青藏高原草地主要单子叶植物的叶表面特征
2016-11-29胡选萍吉成均安丽华
胡选萍,吉成均,安丽华
1 陕西理工大学生物科学与工程学院,汉中 723000 2 北京大学城市与环境学院,北京 100871 3 北京大学医药卫生分析中心,北京 100191
青藏高原草地主要单子叶植物的叶表面特征
胡选萍1,吉成均2,*,安丽华3
1 陕西理工大学生物科学与工程学院,汉中 723000 2 北京大学城市与环境学院,北京 100871 3 北京大学医药卫生分析中心,北京 100191
采用光学显微镜对青藏高原草地主要单子叶植物的叶表面特征进行观测,并运用one-way ANOVA、Pearson相关及线性回归分析,研究了气孔数量指标的物种间差异性以及气孔数量特征与海拔、生长季均温及生长季降水之间的关系。结果表明:(1)青藏高原草地主要单子叶植物长期受高原气候环境的筛选,形成了一些特有的叶表面共性特征,(a)叶表面细胞有长细胞与短细胞两种类型。长细胞呈规则长方形,排列紧密,纵向相接成行;短细胞呈长方形、方形、近圆形或马鞍形,随机散生、单生或孪生,短细胞形态与分布方式因植物种类而异。(b)气孔多分布于叶片下表面,属于单面分布型气孔。气孔选择性地分布在下表面,可在不影响CO2同化率的情况下,一定程度上起到限制水分蒸发,避免造成生理干旱的作用。(c)不同物种气孔器形态、保卫细胞及副卫细胞形态表现出较为明显的多态性。保卫细胞近方形、半月形或哑铃形;副卫细胞呈低圆顶形、圆顶形或高圆顶形;气孔器为椭圆形、宽椭圆形或近圆形。(d)气孔器类型均是平列型(paracytic type),由两个副卫细胞与保卫细胞共同构成;副卫细胞与保卫细胞平行,并完全包围保卫细胞。气孔器等间距或不等间距呈直线排列形成“气孔带”。(2)青藏高原草地单子叶植物叶表面的气孔密度(SD)较大,平均为(194.07±4.74) 个/mm2,气孔长度(SL)较小(34.50±0.28) μm,气孔指数(SI)为(18.13±0.31)%,其中SD的变异系数(CV)最大(53.02%),SI的变异系数次之(37.23%),SL的变异系数最小(17.94%)。不同物种间叶表面的SL、SD与SI差异极显著(P<0.01)。(3)青藏高原草地单子叶植物叶表面气孔数量特征与环境生态因子显著相关。海拔与叶表面气孔特征呈显著正相关(P<0.01),生长季均温与SL之间呈弱正相关(P<0.05),与SD、SI之间呈显著负相关(P<0.01),生长季降水与SL之间呈显著负相关(P<0.01)。具体表现为随海拔升高SL、SD与SI增加,随生长季均温降低SL减小、SD与SI显著增大,而随着生长季降水减少SL变大、SD与SI显著降低。(4)海拔、生长季均温与生长季降水对SL、SD与SI的回归方程分别为Y=0.005X1+0.878X2-0.021X3+12.278、Y=0.046X1-11.688X2+0.466X3-46.391与Y=0.003X1-0.363X2+0.009X3+7.394,回归方程统计检验显著(P<0.01);环境生态因子对SD的决定系数最大(R=0.690),SL次之(R=0.557),而对SI的贡献率(R=0.342)相对最小。
青藏高原;草地;单子叶植物;叶表面;生长季均温;生长季降水
青藏高原位于中国西南部,平均海拔4000 m以上,是中国大陆地势最高的一级台阶,具有地形复杂、海拔高、辐射强、气温低、积温少、气压低、风力大、气候频变等高原气候特点[1-2],属于气候变化的敏感区。该区域草地植被覆盖面积非常广,占青藏高原植被总面积的63.9%[3],草地植物能在如此极端的环境中广泛分布与生存繁衍,一定有其特殊的结构特征及生理、生态适应机制[4-8]。草地植物对极端环境的适应方式多种多样,而叶片作为植物的重要器官,对环境生态因子的变化敏感,可塑性强,能够快速地反映环境的变化[9- 10],因此可作为植物生态解剖的主要指标。目前关于低温、干旱、光照、海拔等环境因子对植物叶形态结构特征的影响已有较多研究,但对其在经历青藏高原极端环境筛选后的叶解剖特征报道较少。前人基于青藏高原草地双子叶植物总结出了一些叶解剖特征的共性规律[11- 14],但对该区域草地单子叶植物的相关研究非常有限。虽然在嵩草属植物中有少量报道[15-16],但因材料选取不足以及区域面积的局限,难以归纳出具有普适意义的规律。因此,本研究以青藏高原草地主要单子叶植物为试材,通过对叶表面特征的系统观察,尝试在区域尺度上分析高寒极端环境下植物叶表面细胞及气孔指标的共性特征,探索其对高寒气候胁迫的响应方式与适应性变化规律,为揭示青藏高原草地单子叶植物对高原极端环境的适应机理提供依据。
1 材料与方法
1.1 材料
材料由北京大学城市与环境学院提供,样品于2003—2005年采至青藏高原,采集的叶片在野外立即用福尔马林-醋酸-酒精固定液(Formalin-acetic- alcohol,FAA)溶液固定。研究区域(80.25°—101.03° E,31.06°—37.43° N), 平均海拔 4101 m(2934—4990 m),年平均气温-0.41 ℃(-4.44—6.16 ℃),生长季均温8.05 ℃(3.78—13.38 ℃),年降水361 mm(110—569 mm),生长季降水306 mm(85—485 mm)。研究材料隶属于莎草科(Cyperaceae)与禾本科(Gramineae),分别为嵩草属(Kobresia)、苔草属(Carex)、扁穗草属(Blysmus)、芨芨草属(Achnatherum)、赖草属(Leymus)、洽草属(Koeleria)、早熟禾属(Poa)7个属,包括小嵩草(Kobresiaparva)、藏嵩草(Kobresiatibetica)、甘肃嵩草(Kobresiakansuensis)、矮嵩草(Kobresiahumilis)、大花嵩草(Kobresiamacrantha)、粗壮嵩草(Kobresiarobusta)、高原嵩草(KoleusiapusillaIvan)、线叶嵩草(Kobresiacapillifolia)、葡茎嵩草(Koleusiastolonifera)、藏苔草(Carexthibetica)、无穗柄苔草(Carexivanoviae)、华扁穗草(Blysmussinocompressus)、芨芨草(Achnatherumsplendens)、醉马草(Achnatheruminebrians)、赖草(Leymussecalinus)、洽草(Koeleriacristata)、艾松早熟禾(Poaaitchisonii)17个种。
1.2 方法
1.2.1 光学显微镜观察
采用透明胶带粘取法制备装片,在光学显微镜下观测叶表面特征。首先用10%的铬酸对样品离析12 h,清水冲洗并浸泡。将透明胶带(普通型:宽度13 mm,厚度0.05 mm)拉开8—10 cm,胶面朝上平放在实验台面上;然后将样品从清水中取出,用吸水纸迅速吸干表面水分;用镊子夹住材料,分清上下表面,将下表面顺长贴于胶带约1/3处,再将胶带从1/2处对折,平整地粘贴于材料的上表面,用镊子柄沿同方向轻刮数下,使胶带与叶片两面充分粘着;从对折处剪断胶带,并缓慢撕开,分清上下表皮胶面,用清水冲洗除去叶肉细胞残留物;最后用吸水纸吸干表面水分,将粘有上下表皮的胶带成对贴于载玻片上,封片后用MoticB5光学显微镜观察,Motic Images Plus 2.0显微成像系统照相和测定。
1.2.2 气孔测量指标
气孔的数量特征主要考察气孔长度(SL)、气孔密度(SD)与气孔指数(SI)3个指标。(1)气孔长度(SL)测定:在显微镜下选取10个视野,每个视野随机选取5个气孔,测量其保卫细胞长度,即为气孔长度(μm)。(2)气孔密度(SD)测定:在显微镜下随机选取10个视野计算气孔数目,移动载玻片在表皮的不同部位进行气孔计数,连续计数10次,将其平均值换算为单位面积的气孔数,即为叶片的气孔密度(个/mm2)。(3)气孔指数(SI)测定:随机观察10个视野,统计单位视野气孔个数(S)和单位视野普通表皮细胞个数(P),计算气孔指数。气孔指数(%)=(S/S+P)×100 %。
1.2.3 气候指标及气候数据来源
对全国670个标准气象台站1970—1999年间每月平均温度和降水数据进行克里格(Kriging)插值分析,该数据来自于世界气候数据网站(http://www.worldclim.org),然后根据样地的经纬度从插值结果中提取样地的每月平均温度和降水数据,以30 a的平均值作为样地的温度和降水数据[17],本文使用生长季均温、生长季降水两个气候指标。
1.2.4 统计分析
对实验数据采用SPSS19.0统计软件进行分析。对于不同物种间气孔数量指标差异采用one-way ANOVA方差分析,气孔数量指标对环境因子的响应采用Pearson相关分析以及线性回归分析。
2 结果与分析
2.1 青藏高原草地主要单子叶植物的叶表面形态特征

图1 青藏高原草地主要单子叶植物叶表皮气孔特征图Fig.1 Stomatal characteristics of epidermis on the main monocotyledonous plants of grassland in the Tibetan Plateau1:小嵩草Kobresia parva(下表皮);2:藏嵩草Kobresia tibetica(下表皮);3:甘肃嵩草Kobresia kansuensis(下表皮);4:矮嵩草Kobresia humilis(下表皮);5:大花嵩草Kobresia macrantha(下表皮);6:粗壮嵩草Kobresia robusta(下表皮);7:高原嵩草Koleusia pusillaIvan(下表皮);8:线叶嵩草Kobresia capillifolia(下表皮);9:葡茎嵩草Koleusia stolonifera(下表皮);10:藏苔草Carex thibetica(下表皮);11:无穗柄苔草Carex ivanoviae(下表皮);12:华扁穗草Blysmus sinocompressus(下表皮);13:芨芨草Achnatherum splendens(下表皮);14:醉马草Achnatherum inebrians(下表皮);15:赖草Leymus secalinus(下表皮);16:洽草Koeleria cristata(下表皮);17:艾松早熟禾Poa aitchisonii(下表皮);18:芨芨草Achnatherum splendens(上表皮);19:醉马草Achnatherum inebrians(上表皮);20:草Leymus secalinus(上表皮);21:艾松早熟禾Poa aitchisonii(上表皮)
青藏高原草地单子叶植物长期受高原气候环境的筛选,形成了一些特有的叶表面共性特征:(1)从叶表面细胞形态方面分析,叶表面细胞普遍存在长细胞与短细胞两种类型。长细胞占多数,呈规则长方形,相互嵌合、排列紧密,相邻细胞纵向相接成行,各行平行排列,细胞垂周壁不同程度地弯曲(图1)。不同物种短细胞形态、丰缺及着生方式差异明显(表1)。具体表现为嵩草类植物与洽草(Koeleriacristata),短细胞数量少,呈短长方形、椭圆形或圆形,零星分散在长细胞之间,形态与长细胞差异不大;而芨芨草(Achnatherumsplendens)、醉马草(Achnatheruminebrians)、赖草(Leymussecalinus)与艾松早熟禾(Poaaitchisonii)短细胞数量多,特化为马鞍形,单独分布或两两孪生,有规律地排列在长细胞两端,细胞壁加厚或不加厚。少数种类如芨芨草(Achnatherumsplendens)部分短细胞特化为圆形及正方形,紧密聚集成行与长细胞平行排列(图2)。(2)从气孔的分布位置分析,青藏高原草地单子叶植物气孔多分布于叶片下表面,属于典型的单面分布型气孔。实验研究的17个代表物种,除芨芨草(Achnatherumsplendens)、醉马草(Achnatheruminebrians)、赖草(Leymussecalinus)与艾松早熟禾(Poaaitchisonii)4个种类在叶片上表面观测到气孔;其余种类仅在叶片下表面有气孔分布(表2)。(3)从气孔形态方面分析,不同物种气孔器形态、保卫细胞及副卫细胞形态表现出较为明显的多态性。保卫细胞呈中部狭窄、两端膨大的哑铃形,或两端与中间宽度相差不大的近平边形,或中间略微偏大的半月形;副卫细胞与保卫细胞平行,呈圆顶形。气孔复体椭圆形、宽椭圆形或近圆形,等间距或不等间距地呈直线排列,与表皮细胞长轴平行,形成明显的“气孔带”。(4)从气孔器类型方面分析,青藏高原草地单子叶植物气孔器均是平列型(paracytic type),由两个副卫细胞与保卫细胞共同构成;副卫细胞与保卫细胞平行,并完全包围保卫细胞。
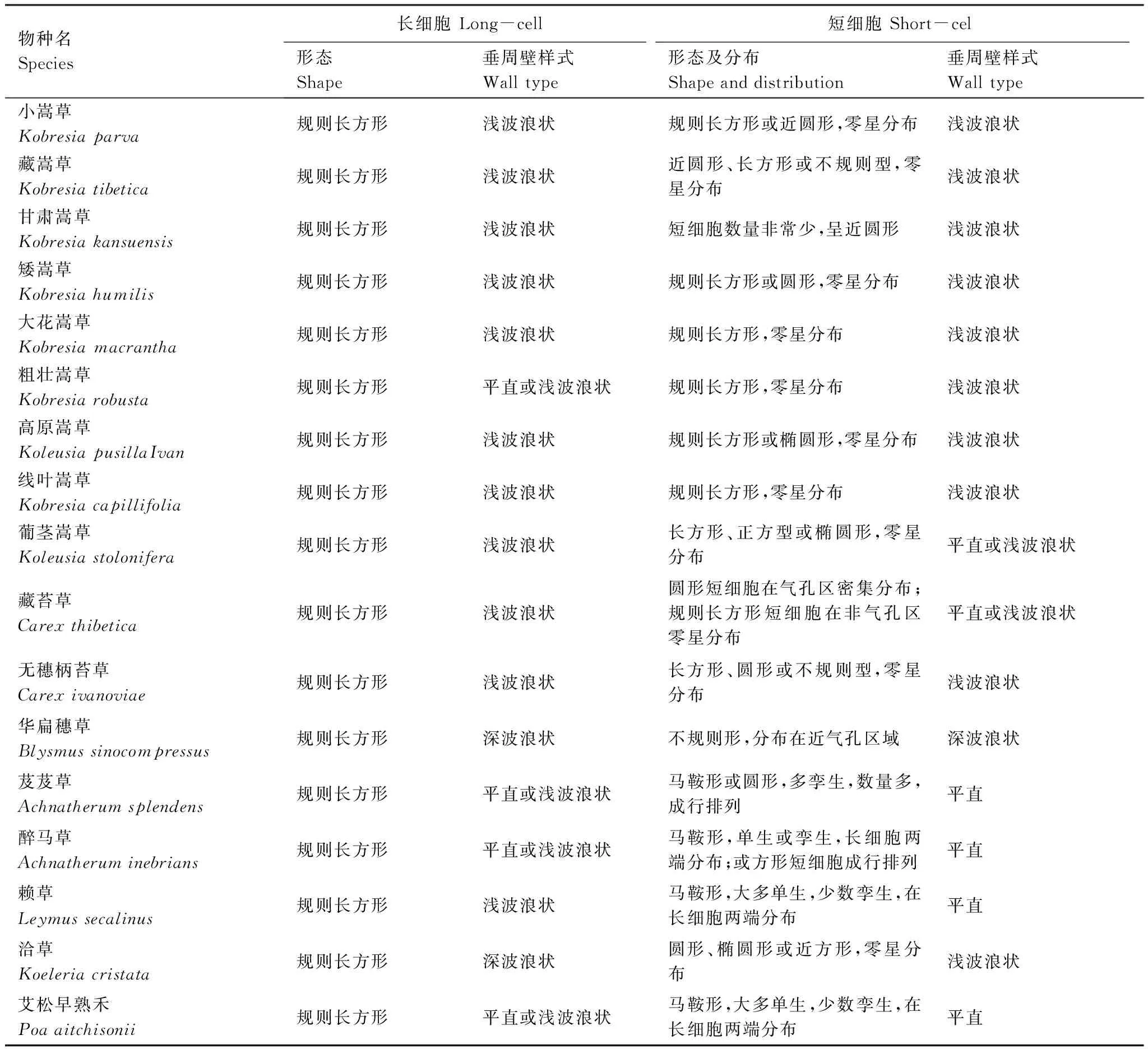
表1 青藏高原草地主要单子叶植物叶表面细胞类型及特征

图2 青藏高原草地主要单子叶植物叶表皮的短细胞Fig.2 Short cells of epidermis on the main monocotyledonous plants of grassland in the Tibetan Plateau1:芨芨草Achnatherum splendens(马鞍形短细胞、成行短细胞);2:醉马草Achnatherum inebrians(马鞍形短细胞);3:赖草Leymus secalinus(马鞍形短细胞);4:艾松早熟禾Poa aitchisonii(马鞍形短细胞)
Table 2 Stomatal distribution and morphological feature of epidermis on the main monocotyledonous plants of grassland in the Tibetan Plateau
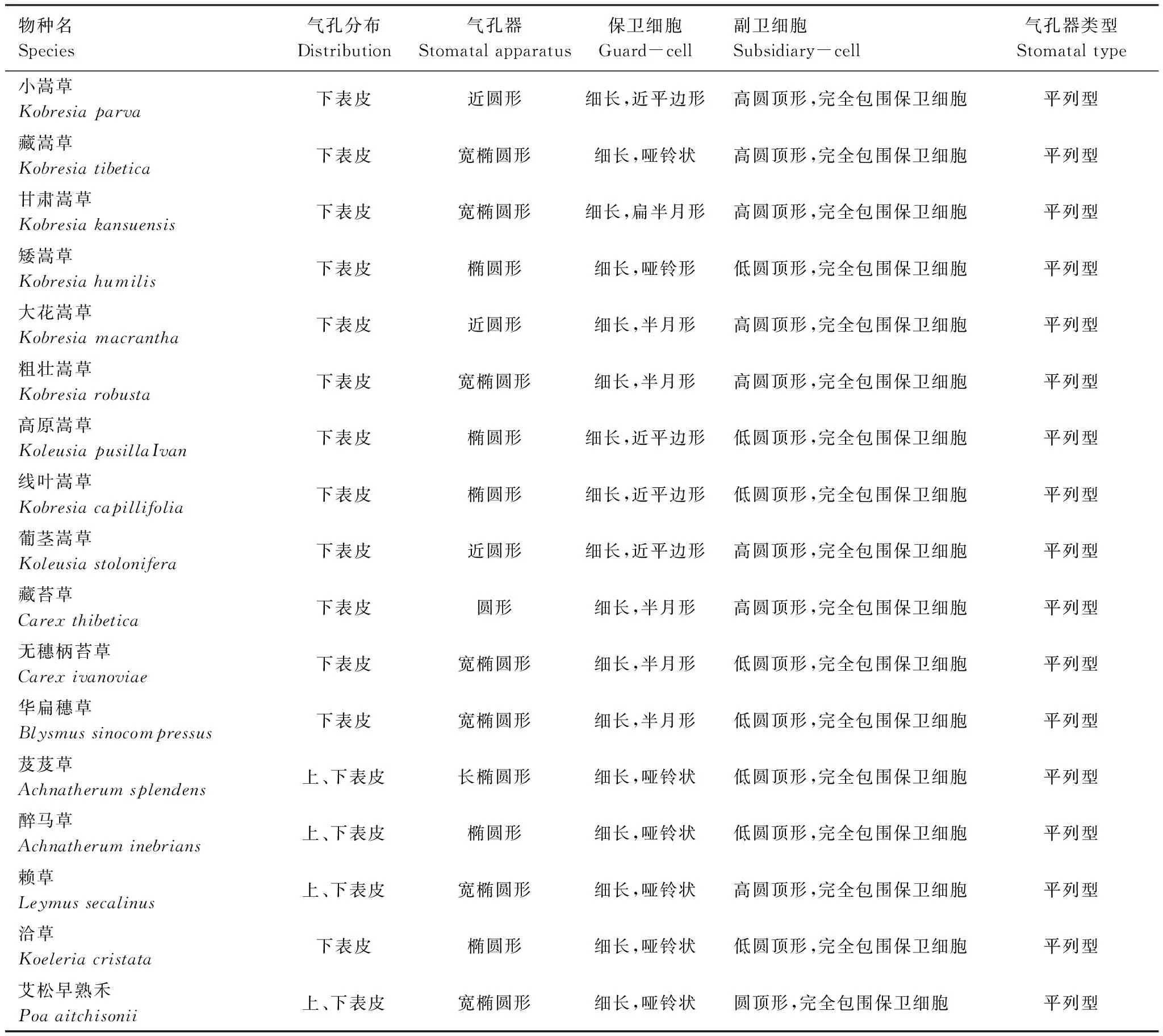
物种名Species气孔分布Distribution气孔器Stomatalapparatus保卫细胞Guard-cell副卫细胞Subsidiary-cell气孔器类型Stomataltype小嵩草Kobresiaparva下表皮近圆形细长,近平边形高圆顶形,完全包围保卫细胞平列型藏嵩草Kobresiatibetica下表皮宽椭圆形细长,哑铃状高圆顶形,完全包围保卫细胞平列型甘肃嵩草Kobresiakansuensis下表皮宽椭圆形细长,扁半月形高圆顶形,完全包围保卫细胞平列型矮嵩草Kobresiahumilis下表皮椭圆形细长,哑铃形低圆顶形,完全包围保卫细胞平列型大花嵩草Kobresiamacrantha下表皮近圆形细长,半月形高圆顶形,完全包围保卫细胞平列型粗壮嵩草Kobresiarobusta下表皮宽椭圆形细长,半月形高圆顶形,完全包围保卫细胞平列型高原嵩草KoleusiapusillaIvan下表皮椭圆形细长,近平边形低圆顶形,完全包围保卫细胞平列型线叶嵩草Kobresiacapillifolia下表皮椭圆形细长,近平边形低圆顶形,完全包围保卫细胞平列型葡茎嵩草Koleusiastolonifera下表皮近圆形细长,近平边形高圆顶形,完全包围保卫细胞平列型藏苔草Carexthibetica下表皮圆形细长,半月形高圆顶形,完全包围保卫细胞平列型无穗柄苔草Carexivanoviae下表皮宽椭圆形细长,半月形低圆顶形,完全包围保卫细胞平列型华扁穗草Blysmussinocompressus下表皮宽椭圆形细长,半月形低圆顶形,完全包围保卫细胞平列型芨芨草Achnatherumsplendens上、下表皮长椭圆形细长,哑铃状低圆顶形,完全包围保卫细胞平列型醉马草Achnatheruminebrians上、下表皮椭圆形细长,哑铃状低圆顶形,完全包围保卫细胞平列型赖草Leymussecalinus上、下表皮宽椭圆形细长,哑铃状高圆顶形,完全包围保卫细胞平列型洽草Koeleriacristata下表皮椭圆形细长,哑铃状低圆顶形,完全包围保卫细胞平列型艾松早熟禾Poaaitchisonii上、下表皮宽椭圆形细长,哑铃状圆顶形,完全包围保卫细胞平列型
2.2 青藏高原草地主要单子叶植物叶表面气孔数量特征分析
上表面气孔数量特征分析结果表明(表3):艾松早熟禾(Poaaitchisonii)的气孔长度最大(46.85±0.86) μm,赖草(Leymussecalinus)次之(45.78±1.06) μm,芨芨草(Achnatherumsplendens)与醉马草(Achnatheruminebrians)气孔较小,保卫细胞纵向长度分别为(29.41±0.518)μm与(29.84±1.57)μm;芨芨草(Achnatherumsplendens)上表面的气孔密度最高(356.57±15.07) 个/mm2,约是其下表面气孔密度的6倍;醉马草(Achnatheruminebrians)上表面气孔密度为(120.08±17.51) 个/mm2,也显著大于其下表面气孔密度(80.21±3.24) 个/mm2;而赖草(Leymussecalinus)与艾松早熟禾(Poaaitchisonii)上表面的气孔密度分别为(75.68±5.52) 个/mm2与(86.49±9.13) 个/mm2,却明显小于下表面的气孔密度(250.88±16.22) 个/mm2与(166.52±7.38) 个/mm2。
下表面气孔数量特征观测结果表明(表4):气孔长度最大的为洽草(Koeleriacristata)(47.50±0.89) μm,最小的为藏苔草(Carexthibetica)(30.48±0.58) μm,平均气孔长度为(34.50±0.28) μm;矮嵩草(Kobresiahumilis)气孔密度最大(299.52±9.51) 个/mm2,无穗柄苔草(Carexivanoviae)的气孔密度最小(50.22±4.72) 个/mm2,平均气孔密度为(194.07±4.74) 个/mm2;气孔指数的极大值与极小值分别为洽草(Koeleriacristata)(26.68±1.61)%与无穗柄苔草(Carexivanoviae)(8.35±0.69)%。就下表面3个气孔数量指标而言,气孔密度的变异系数最大(53.02%),气孔长度的变异系数最小(17.94%)。另外,One-way ANOVA结果表明:不同物种间叶片下表面在SL、SD与SI指标上差异均极显著(P<0.01)。
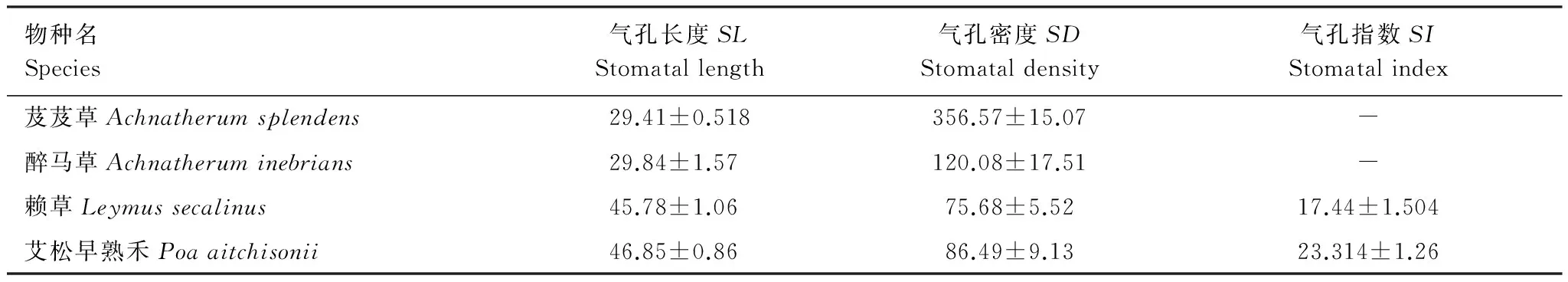
表3 青藏高原草地主要单子叶植物叶片上表面气孔数量特征
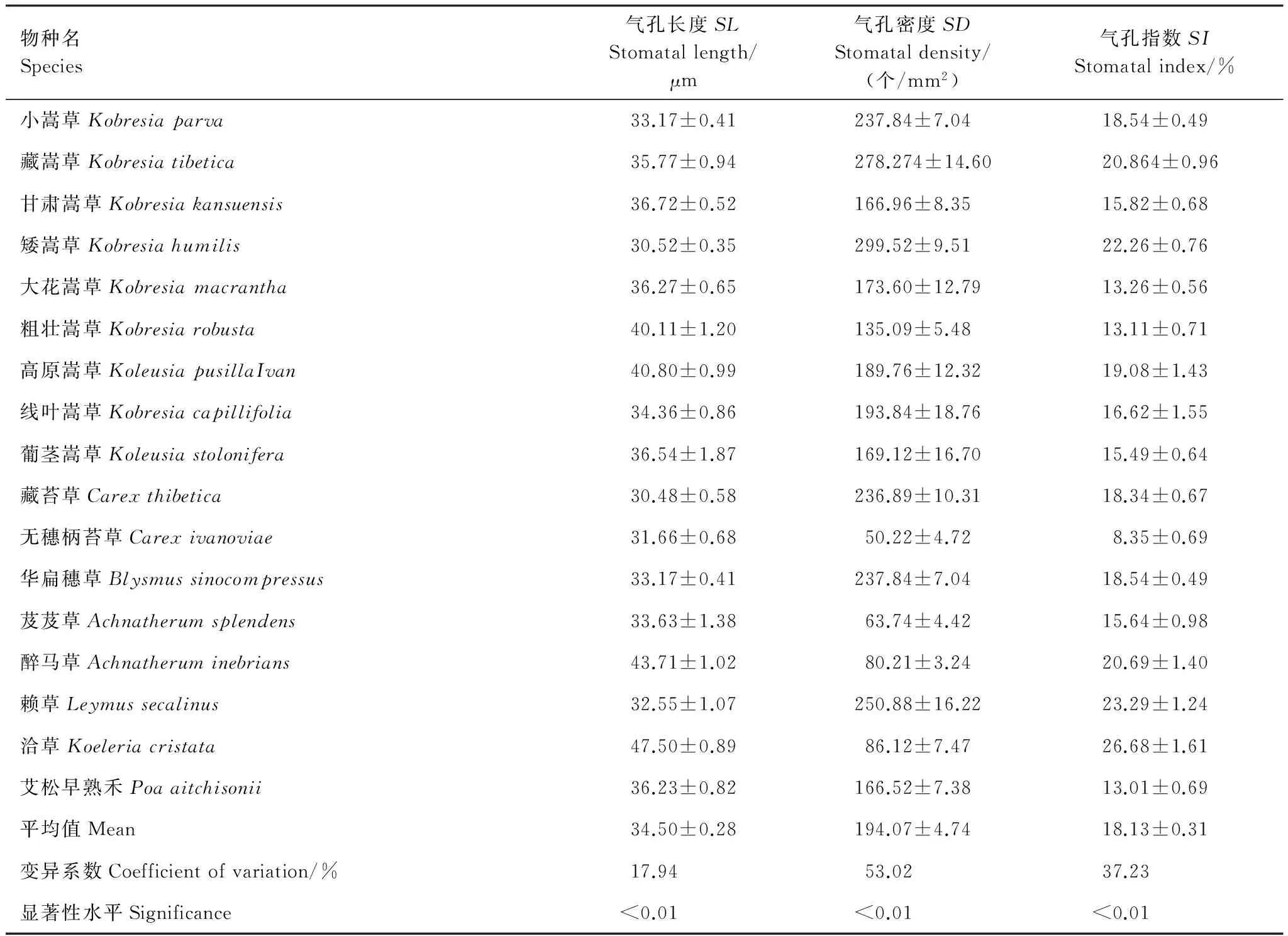
表4 青藏高原草地主要单子叶植物叶片下表面气孔数量特征
2.3 青藏高原草地主要单子叶植物气孔特征与环境之间的关系
2.3.1 气孔特征参数与环境因子的相关分析
Pearson相关分析结果表明:(1)海拔与叶表面气孔特征之间呈正相关关系,相关系数检验极显著(P<0.01),即随着海拔的升高,SL、SD与SI均呈现上升的趋势。(2)生长季均温与SL之间呈弱正相关(P<0.05),与SD、SI之间呈极显著负相关关系(P<0.01),即随着生长季均温的降低,气孔长度变小,而SD与SI呈现增加的趋势。(3)生长季降水与SL之间呈负相关,相关系数检验极显著(P<0.01),而与SD、SI之间呈极显著正相关关系(P<0.01),即随着生长降水的减少,气孔长度一定程度上增大,而SD与SI则呈下降趋势。
表5 青藏高原草地主要单子叶植物气孔数量特征与环境的相关性分析
Table 5 The correlation analysis between stoma quantitative characteristics and environment factors on the main monocotyledonous plants of grassland in the Tibetan Plateau
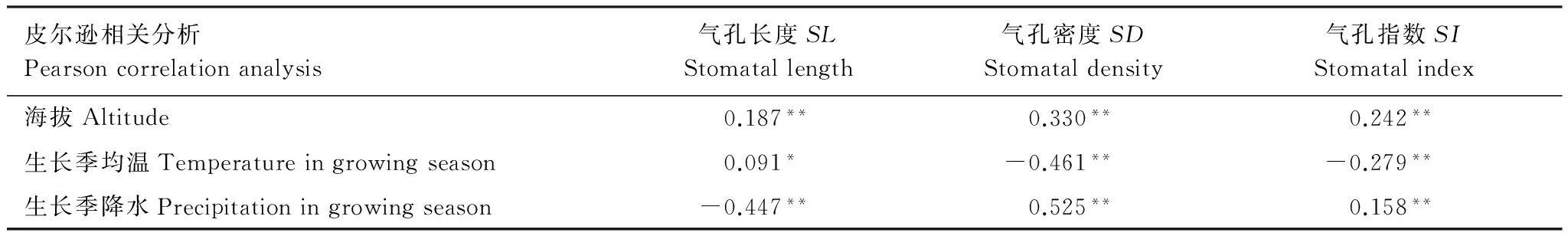
皮尔逊相关分析Pearsoncorrelationanalysis气孔长度SLStomatallength气孔密度SDStomataldensity气孔指数SIStomatalindex海拔Altitude0.187**0.330**0.242**生长季均温Temperatureingrowingseason0.091*-0.461**-0.279**生长季降水Precipitationingrowingseason-0.447**0.525**0.158**
**P<0.01,*P<0.05,无标识表示P>0.05
2.3.2 生态环境因子对气孔特征参数的回归分析
为了分析环境生态因子的综合效应以及各因子的效应大小,以海拔、生长季均温与生长季降水为自变量对气孔数量指标进行线性回归分析(表6)。
表6 环境生态因子对青藏高原草地主要单子叶植物气孔数量特征的回归分析
Table 6 The linear regression analysis of environmental factors and stoma quantitative characteristics on the main monocotyledonous plants of grassland in the Tibetan Plateau
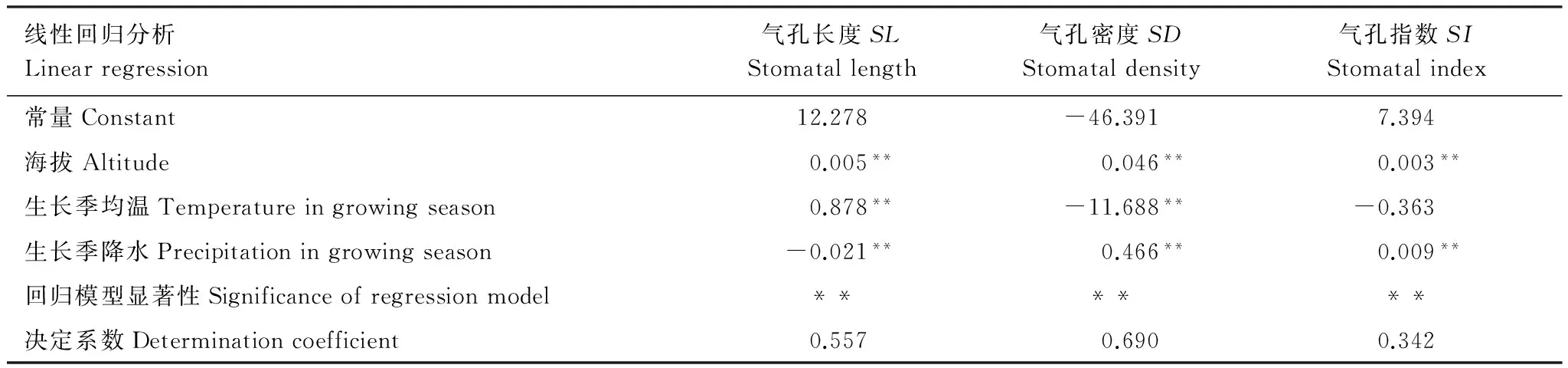
线性回归分析Linearregression气孔长度SLStomatallength气孔密度SDStomataldensity气孔指数SIStomatalindex常量Constant12.278-46.3917.394海拔Altitude0.005**0.046**0.003**生长季均温Temperatureingrowingseason0.878**-11.688**-0.363生长季降水Precipitationingrowingseason-0.021**0.466**0.009**回归模型显著性Significanceofregressionmodel******决定系数Determinationcoefficient0.5570.6900.342
**P<0.01,*P<0.05,无标识表示P>0.05
回归分析表明:海拔、生长季均温与生长季降水对SL的回归方程为Y=0.005X1+0.878X2-0.021X3+12.278,回归方程统计检验显著(P<0.01),3个环境变量的回归系数显著(P<0.01);环境生态因子对SD的回归方程为Y=0.046X1-11.688X2+0.466X3-46.391,回归方程检验显著(P<0.01),各环境变量的回归系数显著(P<0.01);3个环境生态因子对SI的回归方程为Y=0.003X1-0.363X2+0.009X3+7.394,回归方程检验显著(P<0.01),生长季均温回归系数不显著(P>0.05),海拔与生长季降水回归系数极显著(P<0.01)。总体而言,环境因子对SD的决定系数最大(R=0.690),SL次之,而对SI的贡献率相对最小。
3 讨论
青藏高原高达60%的区域被高寒草甸与高寒草原覆盖,草本植物居多数[18],这些植物长期生活在极端胁迫环境中,进化出多种生理生态适应机制。该区域主要草地单子叶植物叶表面的独有特征,印刻着其在经历生理干旱、昼夜温差大的高原气候等逆境筛选后结构饰变的痕迹,是植物对多种生态因子综合响应的结果,体现了植物对高寒独特生境的适应。
3.1 叶表皮细胞的生态适应
青藏高原草地植物对高寒气候环境的生态适应突出体现在叶表面厚度指标方面,具体表现为叶表面细胞及角质层均加厚,且许多植物发育出表皮毛等附属物[11];不同区域横向比较结果表明青藏高原草地双子叶植物上、下表面细胞厚度普遍大于内蒙古草原叶表面厚度[12],厚的表皮细胞具有隔热、保水、抗损伤等功能。本研究对青藏高原主要草地单子叶植物叶表面细胞形态的观察,佐证了叶表面细胞对高寒严酷环境适应的另一种机制。本研究的草地单子叶植物叶表面细胞普遍存在长、短两种类型。长细胞为规则长方形,垂周壁为波纹状,纵向嵌接成行,与叶脉平行紧密排列,为典型的单子叶植物叶表皮组合式样,这种结构有助于增强细胞刚性,是植物抗旱抗寒能力较强的表现[19]。短细胞形态多样,具有明显的类群差异性。尤其是禾本科的短细胞特化为马鞍形,以单生或孪生方式,有规律地固定在长细胞两端,这种结构可能具有“锚定”加固作用,有助于增强长细胞之间的结合力度,增强抗风撕裂能力,使植物在受到大风、冰雹、温度极变、强辐射等不良环境损伤时,能更好地保护其内部结构。这也是青藏高原草地单子叶植物在叶表面解剖层次上对严酷生境的适应。
3.2 气孔分布及形态的生态适应
虽然气孔总面积仅占叶片表面积的5%[20],但气孔的分布与大小会对环境因子感知并趋势应答[21],直接决定着植物的蒸腾与光合作用。有研究表明高山植物与旱生植物类似,气孔多分布在叶片下表面[4,22],有利于减少水分蒸发。青藏高原主要草地单子叶植物气孔分布观察结果表明,大多种类(75%)仅下表面分布气孔,从较大规模尺度上验证这一分布规律。气孔选择性地分布在下表面,可在不影响CO2同化率的情况下,一定程度上起到限制水分蒸发的作用,可避免水分过度蒸发而造成生理干旱。气孔是高等陆生植物在进化中形成的关键结构,该结构使植物体可以适应各种环境的变化[23]。不同于青藏高原草地双子叶植物的肾形保卫细胞以及无规则型气孔器[24],草地单子叶植物保卫细胞除了哑铃形这种主体结构外,还分化出半月形或近平边形的结构变式,反映了草地单子叶植物以气孔形态的丰度来应对环境的多变,从而增加适应环境变化的潜势,可能是植物结构在进化上的一种适应策略。草地单子叶植物气孔器均为平列型(paracytic type),副卫细胞呈圆顶形,完全包围保卫细胞。从整体结构上看,气孔器形态一致,排列整齐,且有副卫细胞在结构与功能上的协助,能够较好地营建稳定的气孔微生态环境,增强CO2同化功能,更有利于光能的有效利用,可快速高效地对开阔生境的环境因子做出响应以避旱,是一种比双子叶植物更加进化、适应性更强的气孔类型。
3.3 气孔数量特征对环境的响应与适应
植物叶形态特征对环境的响应十分敏感。海拔作为重要的环境变量,可以通过氧分压、二氧化碳分压、空气湿度等变量间接地对植物施加影响[4,22],这些因素长期综合作用的结果必然导致植物内部结构发生适应性改变。Woodward[25]对比200年前的草本植物与现在的植物,发现气孔密度和气孔指数与CO2浓度呈负相关关系。随海拔上升CO2分压降低,在低CO2分压下,气孔密度与气孔指数会升高,以利于吸收CO2[26- 27]。青藏高原海拔高、空气稀薄,因此叶片在长期自然选择中形成较高的气孔密度,且随着海拔的升高,SL、SD与SI均呈现上升的趋势,从宏观数量角度解释了海拔与气孔密度之间的协变关系,验证了海拔对叶表面特征的间接效应作用。
由于受西南季风控制,环境相对湿润,但生长季温度较低,昼夜温差大,因此低温是限制青藏高原草地植物生长的重要因子[28]。本研究发现随生长季均温的下降,气孔密度与气孔指数增加,气孔长度变小。气孔数目与密度的增加,可提高叶片与外界环境的气体交换能力[29]。青藏高原草地单子叶植物通过气孔绝对数量与相对数量的同步增加,增强叶片单位面积的CO2摄入量,提高光合速率,保证正常生理功能得以维持;而气孔变小,开闭调节灵活[30],可在一定程度上减少水分蒸发,对高的气孔密度与气孔指数可能造成的“生理干旱”进行生态代偿。这也是植物在数量特征上对高原寒冷逆境条件下长期生存所选择的另一种适应性策略。
已有研究表明水分对叶特征具有可塑性[31],气孔的分布、大小、密度等受环境中水分状况的影响[32]。青藏高原由于低温的影响,植物的生理干旱往往为常态。本研究气孔长度与生长季降水相关系数为-0.447(P<0.01),表明气孔长度和干旱感知间存在明显负相关,反映出气孔大小在干旱条件下起主要作用[33]。随着生长季节降水的减少,水分胁迫成为主导限制因子,植物叶表皮气孔密度与气孔指数降低,虽然减弱了叶片的CO2同化能力,但同时也可降低水分散失。植物通过这种“牺牲”光合“换取”水分优化利用的策略,保证植物正常生命活动进行,是草地单子叶植物对青藏高原极端气候环境长期适应的结果。
植物气孔对特定生态环境的适应机制综合且复杂,青藏高原草地单子叶植物叶表皮结构的特异性,是对高寒特殊综合生态环境长期作用的结果,因此考虑各因子之间的综合效应,建立数学回归模型,深入探讨各生态因子之间的协同效应,从整体上洞悉高寒环境对草地单子叶植物叶表面特征的影响具有重要意义。
[1] 王俊丽. 青藏高原地区植物资源利用与生物技术. 北京: 科学出版社, 2013.
[2] 杨元合, 朴世龙. 青藏高原草地植被覆盖变化及其与气候因子的关系. 植物生态学报, 2006, 30(1): 1- 8.
[3] 中国科学院中国植被图编辑委员会. 中国植被图集. 北京: 科学出版社, 2001.
[4] 周广泰, 刘凤琴, 郭书贤, 吴学明, 刘来正, 袁甲正, 范建平. 青海高山植物解剖特点的研究. 青海师范大学学报: 自然科学版, 1992, (4): 45- 60.
[5] 胡建莹, 郭柯, 董鸣. 高寒草原优势种叶片结构变化与生态因子的关系. 植物生态学报, 2008, 32(2): 370- 378.
[6] Bosabalidis A M, Kofidis G. Comparative effects of drought stress on leaf anatomy of two olive cultivars. Plant Science, 2002, 163(2): 375- 379.
[7] Körner C. Alpine Plant Life: Functional Plant Ecology of High Mountain Ecosystems. 2nd ed. Heidelberg: Springer-Verlag, 2003.
[8] He J S, Wang Z H, Wang X P, Schmid B, Zuo W Y, Zhou M, Zheng C Y, Wang M F, Fang J Y. A test of the generality of leaf trait relationships on the Tibetan Plateau. New Phytologist, 2006, 170(4): 835- 848.
[9] Mott K A, Gibson A C, O′Leary J W. The adaptive significance of amphistomatic leaves. Plant, Cell & Environment, 1982, 5(6): 445- 460.
[10] 李芳兰, 包维楷. 植物叶片形态解剖结构对环境变化的响应与适应. 植物学通报, 2005, 22(S1): 118- 127.
[11] 李全发, 王宝娟, 安丽华, 吉成均. 青藏高原草地植物叶解剖特征. 生态学报, 2013, 33(7): 2062- 2070.
[12] 马建静, 吉成均, 韩梅, 张婷芳, 闫雪东, 胡东, 曾辉, 贺金生. 青藏高原高寒草地和内蒙古高原温带草地主要双子叶植物叶片解剖特征的比较研究. 中国科学: 生命科学, 2012, 42(2): 158- 172.
[14] Chartzoulakis K, Patakas A, Kofidis G, Bosabalidis A, Nastou A. Water stress affects leaf anatomy, gas exchange, water relations and growth of two avocado cultivars. Scientia Horticulturae, 2002, 95(1/2): 39- 50.
[15] 赵庆芳, 崔艳, 马世荣, 李巧峡, 王刚. 青藏高原东部嵩草属植物叶解剖结构的生态适应研究. 广西植物, 2007, 27(6): 821- 825.
[16] 张晓庆, 强科斌, 郭敏, 龙瑞军, 赵连春. 高寒草地四种嵩草属植物叶表皮的微形态. 甘肃农业大学学报, 2006, 41(6): 89- 93.
[17] Hijmans R J, Cameron S E, Parra J L, Jones P G, Jarvis A. Very high resolution interpolated climate surfaces for global land areas. International Journal of Climatology, 2005, 25(15): 1965- 1978.
[18] 杨秀静, 黄玫, 王军邦, 刘洪升. 青藏高原草地地下生物量与环境因子的关系. 生态学报, 2013, 33(7): 2032- 2042.
[19] 强科斌, 郭敏, 张晓庆, 龙瑞军, 赵连春. 圆囊苔草叶片的形态解剖学研究. 草业学报, 2007, 16(2): 76- 83.
[20] Beerling D J, Woodward F I. Changes in land plant function over the Phanerozoic: reconstructions based on the fossil record. Botanical Journal of the Linnean Society, 1997, 124(2): 137- 153.
[21] 王瑞云, 连帅, 刘笑瑜. 气孔对环境因子的感知及趋适应答. 山西农业大学学报: 自然科学版, 2014, 34(6): 481- 487.
[22] 王为义. 高山植物结构特异性的研究. 高原生物学集刊, 1985, (4): 19- 34.
[23] Raven J A. Selection pressures on stomatal evolution. New Phytologist, 2002, 153(3): 371- 386.
[24] 胡选萍, 吉成均, 安丽华. 青藏高原草地双子叶植物叶片的气孔特征研究. 西北植物学报, 2015, 35(7): 1356-1366.
[25] Woodward F I. Stomatal numbers are sensitive to increases in CO2from pre-industrial levels. Nature, 1987, 327(6123): 617- 618.
[26] 马清温, 李凤兰, 李承森. 气孔参数与大气CO2浓度的相关性及其影响因素. 西北植物学报, 2004, 24(11): 2020- 2024.
[27] Wagner F, Below R, Klerk P D, Dilcher D L, Joosten H, Kürschner W M, Visscher H. A natural experiment on plant acclimation: Lifetime stomatal frequency response of an individual tree to annual atmospheric CO2increase. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(21): 11705- 11708.
[28] Ma W H, He J S, Yang Y H, Wang X P, Liang C Z, Anwar M, Zeng H, Fang J Y, Schmid B. Environmental factors covary with plant diversity-productivity relationships among Chinese grassland sites. Global Ecology and Biogeography, 2010, 19(2): 233- 243.
[29] 贺金生, 陈伟烈, 王勋陵. 高山栎叶的形态结构及其与生态环境的关系. 植物生态学报, 1994, 18(3): 219- 227.
[30] 章英才, 闫天珍. 花花柴叶片解剖结构与生态环境关系的研究. 宁夏农学院学报, 2003, 24(1): 31- 33.
[31] Carter J L, White D A. Plasticity in the Huber value contributes to homeostasis in leaf water relations of a mallee Eucalypt with variation to groundwater depth. Tree Physiology, 2009, 29(11): 1407- 1418.
[32] Sam O, Jeréz E, Dell′Amiico J, Ruiz-Sanchez M C. Water stress induced changes in anatomy of tomato leaf epidermes. Biologia Plantarum, 2000, 43(2): 275- 277.
[33] Aasamaa K, Sõber A, Rahi M. Leaf anatomical characteristics associated with shoot hydraulic conductance, stomatal conductance and stomatal sensitivity to changes of leaf water status in temperate deciduous trees. Australian Journal of Plant Physiology, 2001, 28(8): 765- 774.
Leaf epidermis characteristics of the main grassland monocotyledonous plant species on the Tibetan Plateau
HU Xuanping1, JI Chengjun2,*, AN Lihua3
1CollegeofSciencesandEngineering,ShaanxiSci-techUniversity,Hanzhong723000,China2CollegeofUrbanandEnvironmentalSciences,PekingUniversity,Beijing100871,China3MedicalandHealthAnalysisCenter,PekingUniversity,Beijing100191,China
The characteristics of the leaf epidermis of the main monocotyledonous plant species from grasslands on the Tibetan Plateau were investigated using optical microscopy. The differences in stoma quantitative indices among plant species was studied using one-way ANOVA and the relationships between stoma quantitative indices and environmental factors, such as altitude, and average temperature and precipitation in the growing season, were analyzed using the Pearson correlation and linear regression analysis. The results indicated that: (1) The main monocotyledonous plant species on the grassland shared many special leaf epidermis characteristics, due to long-term adaptation to the plateau environment. These characteristics included: (a) Two types of cells on the leaf epidermis: long cells were generally rectangular and closely arranged in rows; and short cells were rectangular, square, suborbiculate, or saddle-shaped, and their distribution was randomly scattered, solitary, or twinned among species. (b) Most stomas were distributed in the lower epidermis and belonged to the single-sided type. This pattern might play an important role not only in maintaining high CO2assimilation rates but also to limit water evaporation and avoid physiological drought. (c) Morphologies of stomatal apparatus, guard cells, and subsidiary cells showed obvious polymorphism. Guard cells were nearly square, half-moon, or dumbbell-shaped. Subsidiary cells were low-dome, dome, or high-dome shaped. The stomatal apparatus appeared in an ellipse, wide-ellipse, or intimate circle. (d)The stomatal apparatus was paracytic, containing two guard and two subsidiary cells, and was further aligned into stomatal bands with equal or unequal intervals. Subsidiary cells were surrounded by and parallel to guard cells. (2) Average stomatal density (SD), length (SL), and index (SI) were (194.07±4.74) units/mm2, (34.50±0.28) μm, and (18.13±0.31)%, respectively. The coefficient of variation (CV) ofSD(53.02%) was largest, followed by those ofSI(37.23%), andSL(17.94%). There were significant differences among species in these three stoma quantitative indices (P< 0.01). (3) Stoma quantitative indices of monocotyledonous plants of grasslands on the Tibetan Plateau were distinctly correlated with environmental factors. Altitude was significantly associated with stomatal characteristics of the leaf epidermis (P< 0.01). Average temperature in the growing season had a weak positive correlation withSL(P< 0.05), and a notable negative correlation withSDandSI(P< 0.01). Precipitation in the growing season was significantly negatively correlated toSI(P< 0.01). Specifically,SL,SD, andSIincreased with increasing altitude;SLdecreased, andSDandSIincreased as average temperature in the growing season decreased;SLincreased, andSDandSIdecreased with reduced precipitation in the growing season. (4) The linear regression equations ofSL,SD, andSIfrom altitude, average temperature, and precipitation in the growing season wereY= 0.005X1+ 0.878X2- 0.021X3+ 12.278;Y= 0.046X1- 11.688X2+ 0.466X3- 46.391; andY= 0.003X1- 0.363X2+ 0.009X3+ 7.394, respectively, which were extremely significant (P< 0.01). The relationship between environmental factors and the leaf epidermis characteristics showed that the coefficient ofSDwas the largest (R= 0.690), followed by those ofSL(R= 0.557), andSI(R= 0.342).
Tibetan Plateau; grassland; monocotyledons plants; leaf epidermis; average temperature in the growing season; precipitation in the growing season
国家自然科学基金项目(31370419)
2015- 03- 30;
日期:2016- 01- 22
10.5846/stxb201503300612
*通讯作者Corresponding author.E-mail: jicj@ pku.edu.cn
胡选萍,吉成均,安丽华.青藏高原草地主要单子叶植物的叶表面特征.生态学报,2016,36(20):6465- 6474.
Hu X P, Ji C J, An L H.Leaf epidermis characteristics of the main grassland monocotyledonous plant species on the Tibetan Plateau.Acta Ecologica Sinica,2016,36(20):6465- 6474.
