土壤灭菌-生物有机肥联用对连作马铃薯及土壤真菌群落结构的影响
2016-11-29张文明张春红邱慧珍李瑞琴沈其荣
刘 星, 张文明, 张春红, 邱慧珍,*, 李瑞琴, 王 蒂, 沈其荣
1 甘肃农业大学资源与环境学院,甘肃省干旱生境作物学重点实验室, 兰州 730070 2 甘肃省农业科学院畜草与绿色农业研究所, 兰州 730070 3 甘肃农业大学农学院, 兰州 730070 4 南京农业大学资源与环境科学学院, 南京 210095
土壤灭菌-生物有机肥联用对连作马铃薯及土壤真菌群落结构的影响
刘 星1, 张文明1, 张春红1, 邱慧珍1,*, 李瑞琴2, 王 蒂3, 沈其荣4
1 甘肃农业大学资源与环境学院,甘肃省干旱生境作物学重点实验室, 兰州 730070 2 甘肃省农业科学院畜草与绿色农业研究所, 兰州 730070 3 甘肃农业大学农学院, 兰州 730070 4 南京农业大学资源与环境科学学院, 南京 210095
甘肃省中部沿黄灌区是全国重要的加工型马铃薯生产基地, 然而因集约化生产带来的连作障碍问题已经严重影响到当地马铃薯种植业的健康发展。结合田间试验和相关的室内分析, 从马铃薯块茎产量和品质、植株生理特征和土壤真菌群落结构等角度, 初步评估土壤灭菌和生物有机肥联用(Ammonia Disinfection plus Bio-organic Fertilizer Regulation, ABR)对马铃薯连作障碍的防控效果。同对照相比, ABR处理的块茎产量和商品薯率分别显著增加约71.1%—152.1%和39.2%—53.3%, 但块茎化学品质变化不大。ABR处理叶绿素含量和根系活力较CK均显著增加, 而叶片和根系丙二醛含量显著下降。PCR-DGGE分析发现, ABR处理显著影响了马铃薯连作土壤的真菌群落结构, 表现为真菌群落的多样性指数较CK相比显著下降。ABR处理还有效抑制了土传病害的滋生, 植株发病率和收获后的病薯率较CK分别显著下降约67.2%—82.2%和69.1%—70.5%。采用Real-time PCR评估连作土壤中3种优势致病真菌的数量变化, 显示ABR处理下立枯丝核菌、茄病镰刀菌和接骨木镰刀菌的数量在生育期内较CK均有不同程度的下降。综合来看, 土壤灭菌和生物有机肥联用技术在防控甘肃省中部沿黄灌区马铃薯连作障碍上具有较大的应用潜力, 而对土传病害的抑制和微生物群落结构的改善是其主要的作用机理。
马铃薯; 连作; 生物有机肥; 土壤灭菌; 土传病害
马铃薯是甘肃省的主导产业, 同时也是促进当地农民增收的主要渠道和重要的粮食来源。根据区域化生产和专业化布局的统一规划, 甘肃中部沿黄灌区被定位为西北地区加工型马铃薯的主要生产基地和种薯繁殖基地。但规模化和集约化的栽培实践以及农业订单为导向的生产模式造成马铃薯多年连作, 导致植株生长发育受阻, 块茎产量和品质下降, 土传病害猖獗等一系列问题, 严重影响企业的种植效益, 危害马铃薯产业的健康发展。因而在探明马铃薯连作障碍机理的基础上, 寻求能够缓解或克服连作障碍的有效措施对于促进该地区马铃薯产业的可持续发展具有重要的理论意义和实践价值。
微生物是土壤生态系统的重要组成部分, 其在结构和功能上具有高度的多样性, 驱动着能量传递、养分循环、矿质化和腐殖化、以及污染物的降解等土壤重要的生化过程。长期连作种植条件下产生的作物生产力下降问题通常与土壤微生物因子的变化息息相关[1- 2]。连作能够引起土壤微生物群落结构的显著变化, 使得土壤从抑病型向导病型的方向转变, 土传病害滋生, 作物长势变差并且大幅度地降低农作物的经济产量, 而这其中大部分是真菌型的土传病害[3- 8]。基于平板培养并结合PCR-DGGE、Real-time PCR和高通量测序等分子生物学方法, 早前的研究结果也显示, 马铃薯连作导致土壤微生物群落结构显著改变, 病原菌过渡成为优势种群,Rhizoctoniasolani和Fusariumsp.等土传病原真菌的数量显著增加, 导致病害大面积发生, 块茎产量降低[9- 15]。在国内外的连作障碍防控研究中, 病原菌的合理有效抑制是首要考虑的科学问题。健康的微生物区系是高产高效土壤的重要特征, 同时对土传病害的抑制具有积极作用, 因此修复和重建连作土壤健康的微生物区系并使之朝着具有自主抑病能力的方向转变同样十分关键[16-19]。土壤灭菌的方法在农业生产中被广泛使用来抑制病原菌, 但这类方法通常未能够照顾到连作土壤微生物区系的修复和重建问题。除存在生态安全风险外, 甲基溴和三氯硝基甲烷等强力型化学灭菌剂的使用也使得土壤中的非靶标微生物类群同样受到破坏性的影响, 微生物群落结构改变, 土壤酶活性显著下降, 这不利于土壤可持续生产力的维持[20- 23]。仅通过播前土壤灭菌尽管能够在短期内抑制或消除大部分的微生物, 但从生态学角度看, 灭菌完成后土壤中残存的病原微生物会在近似于无限养分和低强度竞争的土壤介质中重新生长繁殖, 致病菌数量反弹[24- 28]。因而发展可行的替代方法来抑制土传病害并进行有效地土壤微生物区系调控已成为研究的热点[19]。也有学者从施用生物有机肥的角度, 通过外源微生物和有机碳的输入来进行土壤改良进而克服连作障碍, 但这类实践仍然存在较多的争议且效果并不稳定[19,29]。本课题组前期试验结果也显示, 在长期连作条件下, 单独的生物有机肥施用并不能有效缓解马铃薯连作障碍, 减少块茎产量损失。生物有机肥虽然能够降低病害的发生, 但是对于病害严重的长年连作土壤, 其防治效果仍不能将病原菌控制在不发病或不会引起重大经济损失的阈值范围内[29]。本研究采取连作土壤播前病原菌抑制和播后土壤微生物区系改良并重的策略, 即在马铃薯播前进行土壤灭菌, 而后在马铃薯生长发育过程中将生物有机肥直接兑水浇灌于植株根际, 增加有益菌和拮抗菌向马铃薯根际的输入, 试图通过此方法来达到病原菌的持续性抑制和人工改善连作马铃薯根际微生态环境的目的, 进而缓解或克服马铃薯连作障碍。结合田间试验和相关室内分析, 本研究初步评估土壤灭菌和生物有机肥联用对甘肃省中部沿黄灌区马铃薯连作障碍的防控效果, 特别是该方法对长期连作条件下马铃薯块茎产量和品质, 植株生理生态特征, 土壤真菌群落结构和病原菌数量, 以及植株发病率的影响, 以期探索能够缓解或克服连作障碍的有效措施, 为该地区马铃薯生产的可持续发展提供科学依据。
1 材料与方法
1.1 试验区概况
田间试验设置在地处甘肃省中部沿黄灌区的白银市景泰县, 当地有充足的水源和良好的农业灌溉条件。地理坐标处于103°33′—104°43′ E, 36°43′—37°38′ N之间, 境内平均海拔约1500 m, 属温带大陆干旱气候, 年平均气温为9.1 ℃, 无霜期在141 d左右。年平均降水量为185.6 mm, 年平均蒸发量为1722.8 mm。年平均日照时数2713 h, 全县光热资源丰富,日照百分率62%, 年平均辐射量618.3952kJ/m2, ≥0℃的年活动积温为3614.8 ℃, ≥10℃的年有效积温为3038 ℃, 是我国除青藏高原外光热资源最丰富的地区之一。供试土壤为灰钙土, 质地为砂壤。
1.2 试验设计与方法
田间试验于2011年在景泰县条山农场进行。基于试验结果的重现性考虑, 同时选择连作年限为5a和6a的马铃薯种植地块进行田间试验(分别以CP5和CP6表示)。供试地块在2010年的块茎产量仅有农场平均产量的20%—25%, 属连作障碍重度地块, 土传病害发病严重。灭菌处理前采集供试地块耕层土壤样品, 基础农化性状见表1。田间试验设计为:对照(CK)和土壤灭菌-生物有机肥联用处理(Ammonia Disinfection plus Bio-organic Fertilizer Regulation, ABR)。3次重复, 随机区组排列, 小区面积为54 m2(5.4 m×10 m)。采用统一的马铃薯栽培模式和施肥量, 宽垄双行, 覆膜种植, 播种前一天切种薯, 并用浓度为1.5%的高锰酸钾溶液消毒, 垄宽和行距分别为1.35 m和 0.30 m, 株距为0.17m, 种植密度约为5605株/667m2。联用处理和对照均采用相同的化肥用量, 氮肥为210kg N/hm2, N∶P2O5∶K2O比例为1.4∶1.0∶2.0, 化肥分别用养分含量为15- 15- 15的复合肥和含N 46%的尿素以及含K2O 51%的硫酸钾。播种和施肥过程机械化同步进行, 人工覆膜。化肥在播种时一次性基施, 无追肥, 其余栽培和灌溉以及田间管理措施均按农场统一方法进行。当年5月28日播种, 9月16日收获。供试材料为当地主栽的加工型马铃薯品种“大西洋”, 由条山农场提供。
土壤灭菌在马铃薯播种前一个半月进行, 具体操作如下:将半腐熟玉米秸秆平铺至处理小区, 氨水均匀洒到秸秆表面, 然后快速地将秸秆人工翻埋, 深度为0—20cm, 再用水浇灌使上层土壤达到饱和, 最后使用双层地膜覆盖整个小区, 四周用土压实密闭防止氨挥发和风吹。土壤灭菌持续1个月时间, 而后揭膜晾晒7天, 使氨完全挥发, 最后采集少量灭菌后土壤进行室内发芽试验, 以保证马铃薯正常出苗。市售氨水的用量为130L/667m2,秸秆的用量为3m3/667m2。
在马铃薯出苗后每间隔20 d左右进行生物有机肥的浇灌, 全生育期共浇灌3次。捅破地膜后轻轻扒开马铃薯植株茎基部周围表土, 用兑水后搅拌均匀的生物有机肥悬浊液直接沿植株茎基部浇灌, 浇灌完成后将土壤回填并重新盖上地膜, 膜上覆土并用手压平垄面。生物有机肥的浇灌浓度为2%(w/v), 每株马铃薯单次的浇灌量为0.5 kg。对照小区植株浇灌等量清水。生物有机肥由南京农业大学植物营养系提供, 有机质含量为56.4%, 全氮含量为2.0%, 其中氨基酸态氮占总氮的60%以上, P2O5含量为3.7%, K2O含量为 1.1%, 含根际促生细菌和抗土传病害功能菌数量大于108cfu/g, 拮抗型微生物菌种为Bacillussubtillis和Trichodermasp.。

表1 供试土壤的基础农化性质
表中数据为平均值±标准差
1.3 样品采集与分析
根据生育时期, 分别在马铃薯播前(即土壤灭菌结束后)、苗期、块茎膨大期、淀粉积累期和收获期采用五点取样法采集土样, 采样均在垄上马铃薯行间靠近植株根系处进行, 且避开生物有机肥浇灌时间, 采样深度为0—20 cm。将每个小区的土壤样品混合均匀后, 密封贮存于-80 ℃冰箱中待提取土壤DNA。马铃薯收获时在每个小区随机选择健壮程度和长势一致的无病害植株10株, 使用铁锹在尽量不破坏根系的前提下将植株整株挖出, 用清水将根系缓缓冲洗干净, 调查农艺性状和产量构成要素后, 将植株分根、茎、叶和块茎四部分带回实验室, 105 ℃下杀青30 min, 80 ℃烘至恒重, 称量干物质, 并计算根冠比和收获指数。各个试验小区马铃薯块茎进行实收计产, 并对薯块进行分级, 调查商品薯率、病薯率和畸形薯率。同时在每一个小区内选取大小相近的无病害块茎20个, 带回实验室制备混合鲜样后进行化学品质指标的测定。
连作马铃薯植株的生理特征调查在块茎膨大期和淀粉积累期进行。在每个试验小区选取长势中庸且无明显病症的马铃薯植株5株, 测定其主茎顶枝第3和第4片完全展开叶的叶绿素含量, 而后使用铁锹将植株带土挖出并运回实验室, 剪下叶片和根系部分用于测定相关的生理指标。采用SPAD值来表征叶绿素含量, SPAD 502型叶绿素仪测定, 多次重复并求取平均值; 叶片和根系的丙二醛含量采用硫代巴比妥酸(Thiobarbituric Acid, TBA)显色法测定; 根系活力采用氯化三苯基四氮唑(Triphenyltetrazolium Chloride, TTC)法测定[30]。各试验小区马铃薯植株病害的发生情况采用病薯率和植株发病率共同表示, 病薯率在收获时通过调查薯块分级计算, 植株发病率调查分别在块茎膨大期、淀粉积累期和收获期进行。由于试验区域内马铃薯病害主要为土传病害, 因此在植株发病率调查过程中未详细区分病害种类。
聚合酶链式反应-变性梯度凝胶电泳(PCR-DGGE)技术评估土壤真菌群落结构。采用Power SoilTMDNA Isolation kit(MoBio laboratories, USA)提取土壤微生物总DNA, 称取0.25 g混匀的土壤样品装入提取柱中, 按说明书上的操作步骤提取100 μL土壤DNA, 1%琼脂糖凝胶电泳进行DNA提取效果检测, 提取的微生物DNA总量约为23 Kb。真菌PCR反应采用18S rDNA特异性通用引物GC-Fungi(含GC夹)和NS- 1[31]。PCR反应体系:1 μL的模板, 2 μL dNTPs(2mmol/L), 2.5 μL 10× PCR-buffer, 2.5 μL Mg2+(25mmol/L), 0.3 μL Taq DNA polymerase,引物各0.5 μL, ddH2O为15.7 μL。PCR反应条件:94 ℃预变性5 min, 然后94 ℃变性45 s, 58 ℃退火30 s, 72 ℃延伸45 s, 32个循环, 最后72 ℃延伸5 min, 10 ℃保温。使用1%琼脂糖凝胶电泳进行PCR产物检测, 真菌DNA的PCR产物片段长度在370 bp左右。聚丙烯酰胺凝胶浓度为8%, 变性梯度为25%—40%, PCR产物在D-Code DGGETM系统(Bio-Rad)中进行电泳, 条件为80 V, 恒温60 ℃, 在1× TAE中电泳16 h。电泳结束后银染, 胶片用Win RHIZOTM扫描系统成像。胶图的谱带分析采用凝胶定量软件Quantity One进行。真菌群落的多样性指数的计算基于DGGE条带的位置和条带的强度:H=-∑PilnPi=-∑(ni/N)ln(ni/N),式中ni为DGGE泳道第i条泳带亮度峰值高度,N为泳道中所有泳带亮度峰值高度总和[32]。
采用实时荧光定量PCR(Real-time PCR)的方法评估土壤中3种真菌致病菌的数量动态变化, 分别是立枯丝核菌(Rhizoctoniasolani), 茄病镰刀菌(Fusarinmsolani)和接骨木镰刀菌(Fusariumsambucinum), 标准菌株由甘肃农业大学植保系和甘肃省农科院植保所提供。供试菌株在液体培养基中25 ℃摇动培养3—5 d后, 收集菌丝团, 提取DNA。3种病原菌rDNA-ITS序列PCR扩增的特异性引物和反应体系以及反应条件同早前的文献报道[12-13]。荧光定量PCR采用ABI 7500实时定量PCR仪进行, 扩增反应体系为20 μL:2× SYBR®Premix Ex TaqTM混合液10 μL, 引物各0.4 μL, 50× Rox Reference Dye II 0.4 μL, DNA模板2 μL, 超纯水6.8 μL。扩增的反应条件:95 ℃预变性30 s, 然后95 ℃变性5 s, 60 ℃退火34 s,40个循环。在每一循环的退火阶段收集荧光, 实时检测反应并且记录荧光信号变化, 得出扩增产物熔解曲线。将病原菌特异引物扩增后的PCR产物纯化, 连接至PUC18T载体上, 转化至大肠杆菌中, 挑取转化后平板上的白色单克隆提取质粒DNA, 测序确定插入片段是否正确。在1.0×10-8至1.0×10-3的质粒浓度范围内选择6个模板梯度进行反应, 确定阈值和基线, 绘制标准曲线, 横坐标为病原菌拷贝数的常用对数, 纵坐标为荧光定量PCR测得的Ct值。立枯丝核菌的标准曲线方程为y=-3.2330x+32.984,R2=0.9990; 茄病镰刀菌为y=-3.4925x+36.688,R2=0.9994; 接骨木镰刀菌为y=-3.4901x+34.811,R2=0.9978。通过Ct值, 计算待测样品中病原菌的数量。
1.4 数据处理
田间试验数据计算和图表绘制在Microsoft Excel 2007软件上进行。使用DPS软件进行处理间差异的显著性检验(One-way,P<0.05)。
2 结果与分析
2.1 土壤灭菌-生物有机肥联用对连作马铃薯产量品质和农艺性状的影响
ABR处理块茎产量较CK在CP5和CP6地块分别显著增加约152.11%和71.13%(表2)。处理间在单株结薯数量上并无显著差异, 但在单株产量和单薯重量上差异明显。两个地块上, ABR处理单株产量较CK分别显著增加约70.89%和77.75%, 单薯重量也分别增加约81.49%和108.11%。从产量构成看, 单薯重量大幅增加是ABR处理下连作马铃薯块茎产量增加的直接原因。ABR处理较CK相比株高有显著增加, 两个地块上增幅分别约为10.62%和26.20%。但在植株茎围、分株数和主茎分枝数上, ABR处理和CK并无显著差异。
土壤灭菌和生物有机肥联用显著改善连作马铃薯植株生产力(表3),ABR处理整株生物量较CK在两个地块下分别显著增加约36.99%和45.20%。就植株各器官而言, ABR处理下茎、叶和块茎的生物量较CK在两个供试地块下均有不同程度的显著增加。ABR处理较CK还显著降低植株根冠比, CP5和CP6地块上分别降低约30.36%和36.18%。统计分析表明, 根冠比与块茎产量(R2=-0.5153,P=0.0086,n=12)和单株产量(R2=-0.4129,P=0.0242,n=12)均有着显著或极显著的负相关关系。ABR处理和CK在收获指数上无显著性差异。
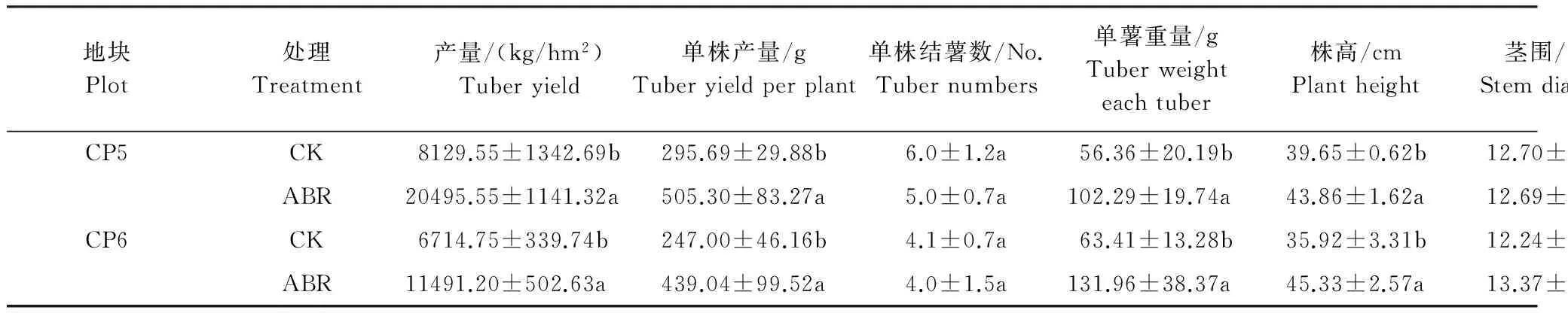
表2 马铃薯块茎产量及其产量构成要素和植株农艺性状的比较
CK: 对照; ABR: 土壤灭菌-生物有机肥联用;表中数据为3次重复的平均值±标准差, 同列的不同小写字母表示相同地块下处理间差异达5%显著水平(P0.05)

表3 马铃薯整株和不同器官生物量的比较
收获后马铃薯块茎品质的分析结果见表4。整体来看, 土壤灭菌和生物有机肥联用对块茎品质影响较小, 反映在对加工型马铃薯最为重要的淀粉和还原糖含量上。两个供试地块上, ABR处理与CK的淀粉和还原糖含量均无显著差异; 在可溶性总糖含量上, ABR处理较CK分别显著下降约10.30%和12.24%。但在还原型维生素C含量上, ABR处理较CK分别显著增加约67.17%和10.95%。ABR处理的可溶性蛋白质和游离氨基酸含量较CK在两个地块下均未显示出一致的变化特征。
2.2 土壤灭菌-生物有机肥联用对连作马铃薯商品薯率和发病情况的影响
土壤灭菌和生物有机肥联用能够显著提高连作马铃薯的商品薯率(表5)。在CP5和CP6地块上, ABR处理商品薯率较CK分别显著增加约39.15%和53.25%; 而病薯率相比于CK则分别显著下降约69.05%和70.52%。另外, 土壤灭菌和生物有机肥联用也大幅降低连作马铃薯植株发病率, 不同生育时期下ABR处理较CK下降约67.23%—76.90%(CP5地块)和74.39%—82.20%(CP6地块)。相关分析结果表明, 块茎产量与病薯率(R2=-0.5999,P=0.0031,n=12)和不同生育时期下植株发病率(R2=-0.5697—0.6044,P=0.0029—0.0045,n=12)之间均有着极显著的负相关关系。

表4 收获后马铃薯块茎化学品质的比较

表5 马铃薯商品薯率、病薯率和植株发病率的比较
2.3 土壤灭菌-生物有机肥联用对连作马铃薯植株生理特征的影响
由图1可知, 土壤灭菌和生物有机肥联用能够显著影响连作马铃薯植株生理特征。在CP5地块上, ABR处理的叶绿素含量较CK在块茎膨大和淀粉积累期分别显著增加约9.36%和7.27%; 在CP6地块上, 两个生育时期也分别显著增加约7.27%和11.17%。同时, 两个地块下, 不同生育时期内ABR处理较CK均显著提高连作马铃薯植株的根系活力。此外, ABR处理下植株叶片和根系的丙二醛含量较CK均显著降低, 其中以根系降幅最大, 约为62.32%—67.53%。
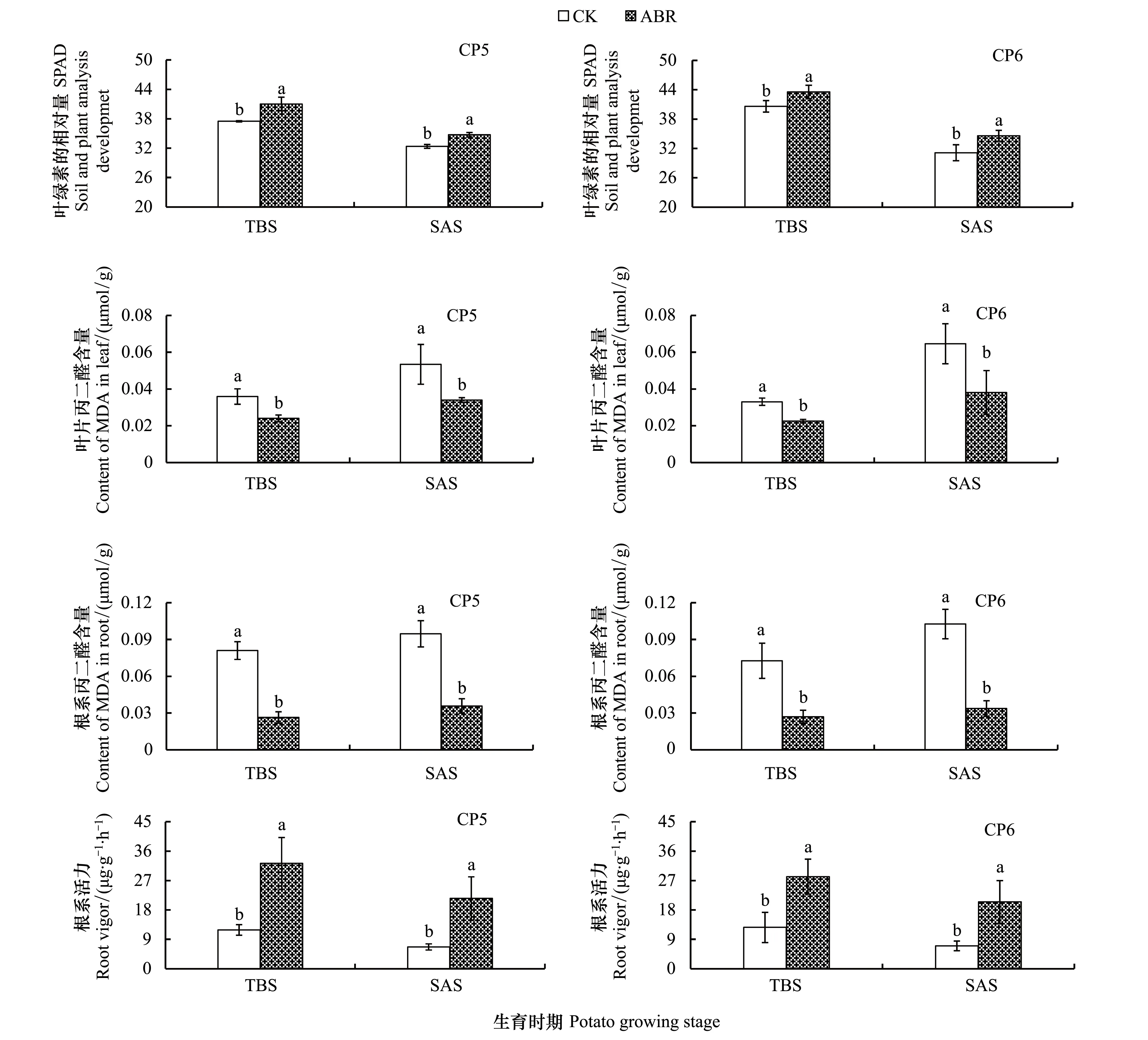
图1 土壤灭菌-生物有机肥联用对连作马铃薯植株生理特征的影响Fig.1 Effects of combination application of soil disinfection and bio-organic fertilizer amendment on physiological characteristics of potato plants in monoculture systemTBS:块茎膨大期 tuber bulking stage;SAS:淀粉积累期 starch accumulation stage;图中数据为平均值±标准差(n=3), 不同小写字母表示相同供试地块下处理间差异达到显著水平(P<0.05)
2.4 土壤灭菌-生物有机肥联用对连作土壤真菌群落结构的影响
应用变性梯度凝胶电泳技术(DGGE)分离真菌18S rDNA片段的PCR产物, 不同DNA片段迁移为若干条带。整体来看, 土壤灭菌和生物有机肥联用处理改变了马铃薯连作土壤的真菌群落结构, 这从DGGE图谱的条带数量和相关条带的明暗程度上均能体现(图2)。进一步通过计算多样性指数来定量化描述连作土壤真菌群落结构变化(图3)。灭菌降低连作土壤真菌群落的多样性, 表现在ABR处理下播前土壤真菌群落的多样性指数较CK在两个供试地块上均显著下降, 这是由于真菌病原菌受到抑制所致。但在马铃薯苗期, CP5地块上ABR处理和CK间多样性指数却并未表现出显著差异, 这可能与土壤灭菌结束后短期内连作土壤残存真菌重新生长繁殖有关, 而在马铃薯播种过程中因耕作所带来的土壤扰动和施肥也有利于这种真菌群落的快速恢复。在CP5地块上, 随着生育进程的推进并伴随着生物有机肥的浇灌, ABR处理的真菌群落多样性指数逐渐下降, 而CK则变化不大, 表现在块茎膨大期和淀粉积累期, ABR处理多样性指数较CK分别显著下降约11.68%和24.68%, 这种处理间差异直至收获期消失。而就CP6地块来看, ARR处理和CK的真菌群落多样性指数变化趋势与CP5地块整体一致, 只是变化程度略有不同。统计分析表明, 在块茎膨大期和淀粉积累期, 连作土壤真菌群落的多样性指数与植株发病率之间有着极显著的正相关关系(R2=0.5385,P<0.0001,n=24)。
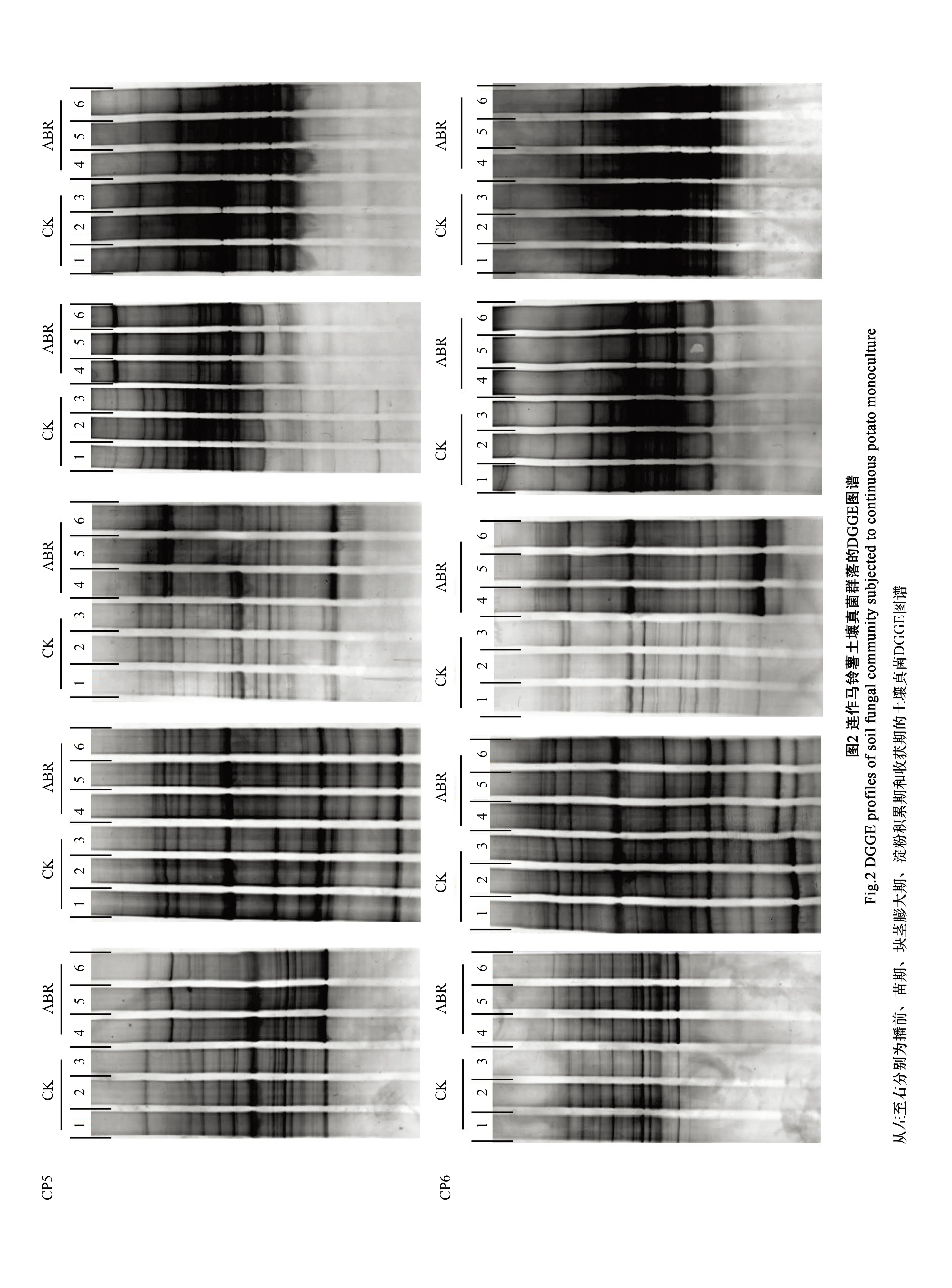

图3 土壤灭菌-生物有机肥联用对马铃薯连作土壤真菌群落多样性的影响Fig.3 Effects of combination application of soil disinfection and bio-organic fertilizer amendment on diversity index of soil fungal community in potato monoculture systemBS:播前 before sowing; SS:苗期 seedling stage;TBS:块茎膨大期 tuber bulking stage;SAS:淀粉积累期 starch accumulation stage;HT:收获期 harvest stage
2.5 土壤灭菌-生物有机肥联用对马铃薯连作土壤致病菌数量的影响

图4 土壤灭菌-生物有机肥联用对马铃薯连作土壤真菌致病菌数量的影响Fig.4 Effects of combination application of soil disinfection and bio-organic fertilizer amendment on the numbers of fungal pathogens in soils in potato monoculture system
马铃薯连作土壤中3种真菌致病菌数量的动态变化见图4。可以看出, 土壤灭菌和生物有机肥联用能够显著抑制土传真菌致病菌数量。在CP5地块上, ABR处理立枯丝核菌的数量在播前、苗期、淀粉积累期和收获期较CK相比显著下降约30.35%—60.40%; 而在块茎膨大期, 尽管也表现为ABR处理低于CK, 但并未达到差异显著水平。在CP6地块上, ABR处理和CK土壤立枯丝核菌数量的变化趋势与CP5地块表现一致。此外, ABR处理较CK也显著降低整个生育期内接骨木镰刀菌和茄病镰刀菌的数量, 且不同供试地块表现基本一致。土壤致病菌数量的显著下降是连作系统下马铃薯植株发病率和病薯率下降的直接原因, 相关分析结果证明, 3种致病菌数量与植株发病率间均有着极显著的正相关关系(R2=0.2000—0.4113,P<0.01,n=36), 且立枯丝核菌(R2=0.4726,P=0.0135,n=12)和接骨木镰刀菌数量(R2=0.3862,P=0.0310,n=12)与病薯率之间也均有着显著的正相关关系。
3 结论与讨论
3.1 土壤灭菌-生物有机肥联用能够有效缓解马铃薯连作障碍
集约化生产实践和订单农业种植模式导致甘肃省中部沿黄灌区出现严重的马铃薯连作障碍问题, 危害马铃薯产业的可持续健康发展。随着马铃薯主粮化战略的实施, 发展高效的马铃薯连作障碍防控技术也愈发紧迫。目前, 马铃薯连作障碍防控研究更多是通过田间试验来筛选或验证对连作障碍具有高抗性的种质资源[33], 但对于以农业订单为导向的加工型马铃薯生产企业而言, 新品种的选用往往存在着极大的市场风险。并且通过基因工程手段来培育新的种质资源或抗连作的马铃薯新品系也进展缓慢。也有研究采用化学调控方法来进行马铃薯连作障碍防控, 其主要机理是改善马铃薯植株对连作胁迫整体的生理抗性, 比如外源水杨酸和黄腐酸等[34- 35], 但这类方法对于生产实践来讲只是治标不治本, 并且以上研究都是在模拟条件下进行的, 未得到田间验证。本研究表明, 在大田条件下, 土壤灭菌和生物有机肥联用能够改善植株生长发育, 显著增加块茎产量, 提高植株生产力, 降低长期连作下马铃薯产量损失。从植株生理生态角度来看, 土壤灭菌和生物有机肥联用处理有效缓解了马铃薯植株所受到的连作胁迫程度, 表现在ABR处理下植株根冠比以及叶片和根系的丙二醛含量较CK均有显著下降。根冠比的调整是高等植物应对外界生物或非生物胁迫的基本策略, 它能反映作物的生长发育状况, 连作条件下土壤理化和生化环境的恶化导致马铃薯植株根冠比显著增加[36-37]。丙二醛是活性氧自由基对细胞质膜系统链式攻击的产物, 其含量下降对连作马铃薯叶片和根系细胞质膜维持正常的结构和功能具有重要的意义[36]。田间试验结果表明, ABR处理叶绿素含量和根系活力较CK均显著增加, 连作马铃薯植株光合生理得到改善, 根系对水分和养分吸收增强, 这是土壤灭菌和生物有机肥联用后连作马铃薯块茎产量大幅增加的生理基础。而土壤环境改善是马铃薯植株连作障碍能够得到缓解的必要条件。
3.2 土壤灭菌-生物有机肥联用影响马铃薯连作土壤真菌群落结构
大量的报道均已指出, 连作障碍问题的实质是土壤障碍问题, 而调控连作土壤微生态环境是解决连作障碍问题的突破口。根据已有的文献资料, 本研究首次报道马铃薯连作土壤微生态环境调控策略并加以田间验证, 即在抑制土传病害致病菌的前提下通过携带有大量益生菌和拮抗菌的商品化生物有机肥应用来逐步改善连作土壤微生物区系。农作物长期连作种植通常导致土壤微生物群落结构发生改变, 各种土传病害滋生, 而其中真菌型土传病害往往居多[8]。有鉴于此, 本研究将连作土壤真菌群落结构变化作为研究重点。PCR-DGGE结果表明, 土壤灭菌和生物有机肥联用能够显著影响马铃薯连作土壤真菌群落结构。在苗期、块茎膨大期和淀粉积累期, ABR处理真菌群落多样性指数较CK显著下降约5%—20%, 并且多样性指数与发病率之间存在着显著或极显著的正相关关系, 这种真菌群落结构的变化是土壤灭菌和生物有机肥浇灌共同作用的结果[29,38-39]。沈宗专等[28]指出, 灭菌处理后土壤微生物活性下降, 不利于土壤生态系统稳定, 易受其它微生物侵染。故在土壤灭菌后, 需及时补施生物有机肥, 增加土壤中有益微生物的数量及比例[27]。Wu等[39]对烟草青枯病的研究表明, 土壤灭菌和生物有机肥施用结合较单独的土壤灭菌处理、土壤灭菌和堆肥结合相比能够给土壤中补充大量的有益微生物, 如Bacillussp.,Paenibacillussp.,Trichodermasp.,Arthrobactersp.和Streptomycessp.等, 土壤微生物群落结构得到明显改善, 而这是植株发病率下降的重要原因。传统的肥料施用方法导致外源有益菌和拮抗菌远离根系, 不能形成在根区范围的有效定植[40-42], 本研究通过将生物有机肥进行多次兑水浇灌, 在生育期内将有益菌和拮抗菌持续性地向马铃薯根际补充, 不仅能够达到抑制病原菌的目的, 还能够改善微生物群落结构, 有助于有益菌和拮抗菌在连作马铃薯根系周围的“生物墙”形成[32], 这也是本研究与已有的相关报道在方法学上的最大不同。
3.3 土壤灭菌-生物有机肥联用降低马铃薯连作土壤致病菌的数量
田间试验结果也表明, 土壤灭菌和生物有机肥联用处理能够显著降低马铃薯连作土壤中土传致病菌的数量。在两个供试地块上, ARB处理土壤中3种致病菌数量较CK在生育期内均有大幅下降, 致病菌数量与植株发病率和病薯率之间均有着显著或极显著的正相关关系。土传致病菌数量的下降减少了植株和薯块被侵染的风险, 这是发病率和病薯率显著降低的直接原因。氨水已被证明是一种良好的化学灭菌剂, 能够杀灭土壤中多种病原微生物, 其机理是氨能够抑制真菌的孢子萌发和菌丝生长[28,38]。氨水灭菌后土壤真菌数量会出现显著下降, 而细菌数量并不会发生明显的变化, 氨水灭菌对细菌的影响要小于真菌[28], 这对于以真菌型土传病害为主的甘肃省中部沿黄灌区马铃薯连作系统而言尤为重要, 能够有效避免对土壤微生物区系的过度扰动。此外, 在本研究的土壤灭菌处理过程中, 半腐熟玉米秸秆的添加结合饱和灌水实际上也诱导了上层土壤强还原环境的形成, 这对于播前土壤中真菌型病原菌的抑制同样具有积极作用[43]。但播前灭菌并不能完全杀灭土壤中所有的致病微生物, 因而在生育期内通过土壤调控形成对病原菌的持续抑制十分重要, 将病原菌的数量控制在不发病或轻度发病的阈值内。在本试验中也可以看出, ABR处理和CK间土壤病原菌数量差异出现播前小于块茎膨大和淀粉积累期的现象, 表明在播前灭菌的基础上通过生物有机肥的浇灌能够形成对病原菌的持续抑制。连作马铃薯生长过程中, 除了生物有机肥携带的拮抗菌直接作用于病原菌外, 土壤微生物区系结构的改变也是真菌型土传病原菌能够被持续抑制, 植株发病率和病薯率下降的重要原因, 这在其它研究中已被充分验证[27,31- 32,44], 但其机理尚需进一步研究。早前关于苹果连作障碍的研究表明, 使用溴甲烷作为化学灭菌剂并结合堆肥改良并不能改善果树生长发育状况和提高果实产量, 推测可能与供试作物差异以及连作障碍程度有关[45]。此外, 堆肥中缺乏有益微生物或拮抗微生物, 土壤灭菌结束后, 单靠有机碳输入来提高土壤生物活性难以达到持续抑制致病菌的目的[19]。
综上所述, 在甘肃中部沿黄灌区, 土壤灭菌和生物有机肥联用能够有效改善长期连作条件下马铃薯植株的生长发育和生理特征, 显著抑制土传病害滋生, 提高块茎产量, 降低集约化生产条件下马铃薯产量损失。其主要机理在于土壤灭菌和生物有机肥联用有效降低了连作土壤中病原菌数量和改善了土壤微生物群落结构。但在马铃薯长期连作条件下, 土壤细菌群落结构对土壤灭菌和生物有机肥联用的响应本研究并未涉猎。因而在下一步研究工作中, 弥补这一短板并结合高通量测序等分子生物学技术能够加深我们对“疾病”土壤微生物区系向“健康”土壤微生物区系的变化路径或演进特征等方面的了解。
[1] Huang L F, Song L X, Xia X J, Mao W H, Shi K, Zhou Y H, Yu J Q. Plant-soil feedbacks and soil sickness: from mechanisms to application in agriculture. Journal of Chemical Ecology, 2013, 39(2): 232- 242.
[2] Fiers M, Edel-HermannV, Chatot C, Hingrat Y L, Alabouvette C, Steinberg C. Potato soil-borne diseases. A review. Agronomy for Sustainable Development, 2012, 32(1): 93- 132.
[3] Yim B, Smalla K, Winkelmann T. Evaluation of apple replant problems based on different soil disinfection treatments-links to soil microbial community structure?. Plant and Soil, 2012, 366(1/2): 617- 631.
[4] Savario C F, Hoy J W. Microbial communities in sugarcane field soils with and without a sugarcane cropping history. Plant and Soil, 2011, 341(1/2): 63- 73.
[5] Li C G, Li X M, Kong W D, Wu Y, Wang J G. Effect of monoculture soybean on soil microbial community in the Northeast China. Plant and Soil, 2010, 330(1/2): 423- 433.
[6] Yao H Y, Jiao X D, Wu F Z. Effects of continuous cucumber cropping and alternative rotations under protected cultivation on soil microbial community diversity. Plant and Soil, 2006, 284(1/2): 195- 203.
[7] Larkin R P. Characterization of soil microbial communities under different potato cropping systems by microbial population dynamics, substrate utilization, and fatty acid profiles. Soil Biology and Biochemistry, 2003, 35(11): 1451- 1466.
[8] Shipton P J. Monoculture and soilborne plant pathogens. Annual Review of Phytopathology, 1977, 15(1): 387- 407.
[9] Lu L H, Yin S X, Liu X, Zhang W M, Gu T Y, Shen Q R, Qiu H Z. Fungal networks in yield-invigorating and -debilitating soils induced by prolonged potato monoculture. Soil Biology and Biochemistry, 2013, 65(10): 186- 194.
[10] Liu X, Zhang J L, Gu T Y, Zhang W M, Shen Q R, Yin S X, Qiu H Z. Microbial community diversities and taxa abundances in soils along a seven-year gradient of potato monoculture using high throughput pyrosequencing approach. PLoS One, 9(1): e86610, doi: 10.1371/journal.pone.0086610.
[11] 孟品品, 刘星, 邱慧珍, 张文明, 张春红, 王蒂, 张俊莲, 沈其荣. 连作马铃薯根际土壤真菌种群结构及其生物效应. 应用生态学报, 2012, 23(11): 3079- 3086.
[12] 李瑞琴, 刘星, 邱慧珍, 张文明, 张春红, 王蒂, 张俊莲, 沈其荣. 发生马铃薯立枯病土壤中立枯丝核菌的荧光定量PCR快速检测. 草业学报, 2013, 22(5): 136- 144.
[13] 李瑞琴, 刘星, 邱慧珍, 张文明, 张春红, 王蒂, 张俊莲, 沈其荣. 连作马铃薯根际干腐病优势病原菌荧光定量PCR快速检测及在根际的动态变化. 草业学报, 2013, 22(6): 239- 248.
[14] 刘星, 邱慧珍, 王蒂, 张俊莲, 沈其荣. 甘肃省中部沿黄灌区轮作和连作马铃薯根际土壤真菌群落的结构性差异评估. 生态学报, 2015, 35(12): 3938- 3948.
[15] 牛秀群, 李金花, 张俊莲, 沈宝云, 柴兆祥, 王蒂. 甘肃省干旱灌区连作马铃薯根际土壤中镰刀菌的变化. 草业学报, 2011, 20(4): 236- 243.
[16] Thirup L, Johansen A, Winding A. Microbial succession in the rhizosphere of live and decomposing barley roots as affected by the antagonistic strainPseudomonasfluorescensDR54-BN14 or the fungicide imazalil. FEMS Microbiology Ecology, 2003, 43(3): 383- 392.
[17] Garbeva P, van Veen J A, van Elsas J D. Assessment of the diversity, and antagonism towardsRhizoctoniasolaniAG3, ofPseudomonasspecies in soil from different agricultural regimes. FEMS Microbiology Ecology, 2004, 47(1): 51- 64.
[18] Pedersen B S, Mills N J. Singlevs. multiple introduction in biological control: the roles of parasitoid efficiency, antagonism and niche overlap. Journal of Applied Ecology, 2004, 41(5): 973 - 984.
[19] 张瑞福, 沈其荣. 抑病型土壤的微生物区系特征及调控. 南京农业大学学报, 2012, 35(5): 125- 132.
[20] Klose S, Acosta-Martínez A, Ajwa H A. Microbial community composition and enzyme activities in a sandy loam soil after fumigation with methyl bromide or alternative biocides. Soil Biology and Biochemistry, 2006, 38(6): 1243- 1254.
[21] Ladd J N, Brisbane P G, Butler J H A, Amato M. Studies on soil disinfection-III: Effects on enzyme activities, bacterial numbers and extractable ninhydrin reactive compounds. Soil Biology and Biochemistry, 1976, 8(4): 255- 260.
[22] Jawson M D, Franzluebbers A J, Galusha D K, Aiken R M. Soil fumigation within monoculture and rotations: Response of corn and mycorrhizae. Agronomy Journal, 1993, 85(6): 1174- 1180.
[23] 王方艳, 王秋霞, 颜冬冬, 毛连纲, 郭美霞, 燕平梅, 曹坳程. 二甲基二硫熏蒸对保护地连作土壤微生物群落的影响. 中国生态农业学报, 2011, 19(4): 890- 896.
[24] Mowlick S, Inoue T, Takehara T, Kaku N, Ueki K, Ueki A. Changes and recovery of soil bacterial communities influenced by biological soil disinfestation as compared with chloropicrin-treatment. AMB Express, 2013, 3(1): 46- 46, doi: 10.1186/2191-0855- 3- 46.
[25] 张树生, 杨兴明, 茆泽圣, 黄启为, 徐阳春, 沈其荣. 连作土壤灭菌对黄瓜(Cucumissativus)生长和土壤微生物区系的影响. 生态学报, 2007, 27(5): 1809- 1817.
[26] Marschner P, Rumberger A. Rapid changes in the rhizosphere bacterial community structure during re-colonization of sterilized soil. Biology and Fertility of Soils, 2004, 40(1): 1- 6.
[27] 刘星, 张书乐, 刘国锋, 邱慧珍, 王蒂, 张俊莲, 沈其荣. 土壤熏蒸-微生物有机肥联用对连作马铃薯生长和土壤生化性质的影响. 草业学报, 2015, 24(3): 122- 133.
[28] 沈宗专, 钟书堂, 赵建树, 张建, 李荣, 阮云泽, 沈其荣. 氨水熏蒸对高发枯萎病蕉园土壤微生物区系及发病率的影响. 生态学报, 2015, 35(9): 2946- 2953.
[29] 王丽丽, 石俊雄, 袁赛飞, 吴凯, 蔡刘体, 刘艳霞, 杨兴明, 冯勇刚, 沈标, 沈其荣. 微生物有机肥结合土壤改良剂防治烟草青枯病. 土壤学报, 2013, 50(1): 150- 156.
[30] 邹琦. 植物生理学实验指导. 北京: 中国农业出版社, 2008: 62- 63, 173- 174.
[31] Luo J, Ran W, Hu J, Yang X M, Xu Y C, Sheng Q R. Application of bio-organic fertilizer significantly affected fungal diversity of soils. Soil Science Society of America Journal, 2010, 74(6): 2039- 2048.
[32] Lang J J, Hu J, Ran W, Xu Y C, Shen Q R. Control of cottonVerticilliumwilt and fungal diversity of rhizosphere soils by bio-organic fertilizer. Biology and Fertility of Soils, 2012, 48(2): 191- 203.
[33] 余斌, 沈宝云, 王文, 邱慧珍, 刘鑫, 李朝周, 张俊莲, 王蒂. 连作障碍对干旱地区不同马铃薯品种的影响. 甘肃农业大学学报, 2012, 47(4): 43- 47.
[34] 回振龙, 王蒂, 李宗国, 李朝周, 李旭鹏, 张俊莲. 外源水杨酸对连作马铃薯生长发育及抗性生理的影响. 干旱地区农业研究, 2014, 32(4): 1- 8.
[35] 回振龙, 李朝周, 史文煊, 张俊莲, 王蒂. 黄腐酸改善连作马铃薯生长发育及抗性生理的研究. 草业学报, 2013, 22(4): 130- 136.
[36] 沈宝云, 刘星, 王蒂, 孟品品, 张俊莲, 邱慧珍. 甘肃省中部沿黄灌区连作对马铃薯植株生理生态特性的影响. 中国生态农业学报, 2013, 21(6): 689- 699.
[37] 刘星, 张书乐, 刘国锋, 邱慧珍, 王蒂, 张俊莲, 沈其荣. 连作对甘肃省中部沿黄灌区马铃薯干物质积累和分配的影响. 作物学报, 2014, 40(7): 1274- 1285.
[38] Sun L, Song S, Fu L, Deng X H, Wang D S, Liang X L, Li R, Shen Q R. Exploring a soil fumigation strategy based on ammonium bicarbonate to controlFusariumwilts of cucurbits. Crop Protection, 2015, 70(4): 53- 60.
[39] Wu K, Yuan S F, Wang L L, Shi J X, Zhao J, Shen B, Shen Q R. Effects of bio-organic fertilizer plus soil amendment on the control of tobacco bacterial wilt and composition of soil bacterial communities. Biology and Fertility of Soils, 2014, 50(6): 961- 971.
[40] Weller D M. Biological control of soilborne plant pathogens in the rhizosphere with bacteria. Annual Review of Phytopathology, 1988, 26(1): 379- 407.
[41] Cotxarrera L, Trillas-Gay M I, Steinberg C, Alabouvette C. Use of sewage sludge compost andTrichodermaasperellumisolates to suppressFusariumwilt of tomato. Soil Biology and Biochemistry, 2002, 34(4): 467- 476.
[42] Hoitink H A J, Boehm M J. Biocontrol within the context of soil microbial communities: a substrate-dependent phenomenon. Annual Review of Phytopathology, 1999, 37(1): 427- 446.
[43] 蔡祖聪, 张金波, 黄新琦, 朱同彬, 温腾. 强还原土壤灭菌防控作物土传病的应用研究. 土壤学报, 2015, 52(3): 469- 476.
[44] Qiu M H, Zhang R F, Xue C, Zhang S S, Li S Q, Zhang N, Shen Q R. Application of bio-organic fertilizer can controlFusariumwilt of cucumber plants by regulating microbial community of rhizosphere soil. Biology and Fertility of Soils, 2012, 48(7): 807- 816.
[45] Yao S R, Merwin I A, Abawi G S, Thies J E. Soil fumigation and compost amendment alter soil microbial community composition but do not improve tree growth or yield in an apple replant site. Soil Biology and Biochemistry, 2006, 38(3): 587- 599.
Combination of the application of soil disinfection and bio-organic fertilizer amendment and its effects on yield and quality of tubers, physiological characteristics of plants, and the soil fungal community in a potato monoculture system
LIU Xing1, ZHANG Wenming1, ZHANG Chunhong1, QIU Huizhen1,*, LI Ruiqin2, WANG Di3, SHEN Qirong4
1CollegeofResourcesandEnvironmentalSciences/GansuProvincialKeyLabofAridlandCropScience,GansuAgriculturalUniversity,Lanzhou730070,China2AnimalHusbandryandPastureandGreenAgricultureInstitutes,GansuAcademyofAgriculturalSciences,Lanzhou730070,China3CollegeofAgronomy,GansuAgriculturalUniversity,Lanzhou730070,China4CollegeofResourcesandEnvironmentalSciences,NanjingAgriculturalUniversity,Nanjing210095,China
The irrigated areas along the Yellow River in central Gansu Province form one of the main potato growing regions in China. However, continuous monoculture practices, which are required for intensive production in order to maximize profits, have already impaired the development of the potato industry in the region. This is reflected in severe production losses in terms of tuber yield and quality, in the poor growth and development of potato plants, and in rapidly increasing problems related to fungal soil-borne diseases. In this study, we combined the application of soil disinfection and bio-organic fertilizer amendment to recover potato plant productivity in a continuously monoculture system. Additionally, efforts were made to improve the micro-environment of the potato rhizosphere by inhibiting soil-borne pathogens via soil disinfection prior to sowing the potatoes and then directly irrigating plants with bio-organic fertilizer mixed with water injected into potato rhizosphere after potato emergence. The commercial bio-organic fertilizer used contained a large amount of plant growth-promoting rhizobacteria as well as antagonistic microorganisms active against known soil-borne fungal pathogens. Irrigation with bio-organic fertilizer was performed three times at 20 day intervals during the entire growing period of the potato plants. Field experiments were conducted in two plots that had previously displayed severe continuous monoculture-related problems, one of which had been continuously planted with potato crops for over five years and the other for over six years. The goal was to evaluate the effects of a combined application of soil disinfection and bio-organic fertilizer amendment (ABR treatment) on the management of problems related to continuous potato monoculture. The field experiment included a control (CK) and an ABR treatment with three replicates of both. Specifically, the study examined tuber yield and quality, physiological characteristics of potato plants, and the structure of the soil fungal community in a long-duration monoculture system with and without soil treatment. Compared with CK, the ABR treatment significantly increased tuber yield and the ratio of marketable tubers by 71.1% to 152.1% and 39.2% to 53.3%, respectively. No distinct differences were observed between the chemical qualities of potato tubers produced by ABR or CK treatments. In terms of the physiological characteristics of potato plants, the ABR treatment significantly increased the chlorophyll content of leaves and the root vigor as compared to CK, but decreased the MDA content both in leaves and in roots, indicating that the ABR treatment could improve growth and development of potato plants in a continuous monoculture system. Based on Polymerase Chain Reaction-Denaturing Gradient Gel Electrophoresis (PCR-DGGE), the ABR treatment significantly affected the structure of soil fungal community, since fungal diversity index was significantly lower in ABR than in CK. Additionally, the ABR treatment effectively suppressed soil-borne diseases, with plants exhibiting a lower incidence of disease and a lower ratio of diseased tubers from 67.2% to 82.2% and 69.1% to 70.5%, respectively, when compared with CK. Real-time PCR assessment confirmed that the abundance of several pathogenic soil fungi (Rhizoctoniasolani,Fusarinmsolani, andFusariumsambucinum) in the ABR treatment was significantly lower than that in CK during the potato growth stage. In the present study, the highly significant linear correlation were revealed between tuber yield and plant disease incidence, fungal diversity index, and the abundance of soil-borne pathogens, respectively. The combined application of soil disinfection and bio-organic fertilizer amendment is a potential approach to managing problems related to continuous potato monoculture in the irrigated areas of the Yellow River floodplain in central Gansu Province since it suppresses soil-borne diseases and improves the structure of the soil microbial community.
potato; monoculture; bio-organic fertilizer; soil disinfection; soil-borne disease
公益性行业(农业)科研专项(201103004);国家科技支撑计划(2012BAD06B03);国家马铃薯产业技术体系(CARS- 10-P18);甘肃省科技重大专项(1102NKDA025)
2015- 04- 11;
日期:2016- 01- 22
10.5846/stxb201504110737
*通讯作者Corresponding author.E-mail: hzqiu@gsau.edu.cn
刘星, 张文明, 张春红, 邱慧珍, 李瑞琴, 王蒂, 沈其荣.土壤灭菌-生物有机肥联用对连作马铃薯及土壤真菌群落结构的影响.生态学报,2016,36(20):6365- 6378.
Liu X, Zhang W M, Zhang C H, Qiu H Z, Li R Q, Wang D, Shen Q R.Combination of the application of soil disinfection and bio-organic fertilizer amendment and its effects on yield and quality of tubers, physiological characteristics of plants, and the soil fungal community in a potato monoculture system.Acta Ecologica Sinica,2016,36(20):6365- 6378.
