UPA和MMP-9在子宫内膜癌组织中的表达情况及临床意义
2016-11-29郑彦强时志民孙秀敏刘石萍杨俊英
庞 岚,郑彦强,时志民,孙秀敏,刘石萍,杨俊英,张 婕
(1.河北省邯郸市妇幼保健院,河北 邯郸 056000;2.河北工程大学,河北 邯郸 056000;3.河北省邯郸市中心医院,河北 邯郸 056001;4.五矿邯邢矿业有限公司职工总医院,河北 邯郸 056000;5.河北省成安县人民医院,河北 成安 056000)
UPA和MMP-9在子宫内膜癌组织中的表达情况及临床意义
庞 岚1,郑彦强1,时志民2,孙秀敏1,刘石萍3,杨俊英4,张 婕5
(1.河北省邯郸市妇幼保健院,河北 邯郸 056000;2.河北工程大学,河北 邯郸 056000;3.河北省邯郸市中心医院,河北 邯郸 056001;4.五矿邯邢矿业有限公司职工总医院,河北 邯郸 056000;5.河北省成安县人民医院,河北 成安 056000)
目的 观察子宫内膜癌组织中尿激酶型纤溶酶原激活剂(UPA)和金属蛋白酶-9(MMP-9)的表达情况及与病理学指标的关系,探讨UPA和MMP-9表达水平的相关性。方法 收集子宫内膜癌组织68例和正常子宫内膜组织32例,采用微波EliVisionTM免疫组织化学方法观察UPA和MMP-9在子宫内膜癌组织和正常子宫内膜组织中的表达水平,Spearman相关分析法分析二者有无相关性,分析二者表达与子宫内膜癌临床病理指标之间的关系。结果 子宫内膜癌中UPA和MMP-9表达定位于细胞浆;UPA和MMP-9在子宫内膜癌组织的阳性表达率明显高于正常子宫内膜组织(P<0.05)。Spearman相关分析检测UPA和MMP-9表达水平存在正相关性(r=0.261,P=0.000);UPA和MMP-9高表达均与组织学分级、cTNM分期、淋巴结转移有关(P均<0.05)。结论 UPA和MMP-9的表达在子宫内膜癌的发生、发展和淋巴结转移中发挥重要作用,提示临床检测二者有可能为评估子宫内膜癌病变程度提供参考。
子宫内膜癌组织;UPA蛋白;MMP-9蛋白;EliVisionTM免疫组化
女性生殖系统的恶性肿瘤包括宫颈癌、卵巢癌和子宫内膜癌,其中子宫内膜癌发病率占到女性恶性肿瘤的第二位,且发病率呈逐年上升趋势[1]。子宫内膜癌的浸润转移是其预后较差的主要原因,在肿瘤浸润转移过程中有多种因子共同参与,尿激酶型纤溶酶原激活剂(UPA)和金属蛋白酶-9(MMP-9)通过降解细胞外基质(ECM)和促进血管生成等作用,在肿瘤浸润转移中发挥作用。本研究采用免疫组织化学SP法检测了子宫内膜癌组织中UPA和MMP-9的表达情况,探讨二者在子宫内膜癌的发生、发展的作用,现将结果报道如下。
1 临床资料
1.1 一般资料 选取2011年1月—2014年12月邯郸市妇幼保健院和邯郸市中心医院收集的68例子宫内膜鳞癌组织蜡块为实验组,年龄56~71岁,中位年龄62.9岁;绝经年龄47~62岁,中位年龄55岁。根据国际妇产科联盟(FIGO,2000)病理分期标准:Ⅰ期22例,Ⅱ期17例,Ⅲ期20例,Ⅳ期9例;组织学分级:高分化(G1)38例,中分化(G2)22例,低分化(G3)8例;病理类型:子宫内膜样腺癌52例,腺鳞癌2例,透明细胞癌7例,浆液性乳头状腺癌7例;肌层浸润深度:肌层浸润深度≥1/2 28例,1/2 以内及无肌层浸润40例;淋巴结转移:术后证实有淋巴结转移33例,无淋巴结转移35例。另选癌旁正常子宫内膜癌组织标本32例作为对照组。
1.2 试剂与方法 S-P试剂盒、DAB显色液及兔抗人UPA单克隆抗体、兔抗人MMP-9多克隆抗体。采用微波EliVisionTM免疫组织化学方法,先行抗原修复,抗体为兔抗人UPA、兔抗人MMP-9(1∶100),取已知切片作为阳性对照,以PBS缓冲液代替一抗作为阴性对照,DAB显色,苏木素复染,镜下观察UPA和MMP-9在子宫内膜癌组织和正常子宫内膜组织中的表达水平。Spearman相关分析法分析UPA和MMP-9有无相关性,并分析二者表达与子宫内膜癌临床病理指标之间的关系。
1.3 结果判断标准 以在阳性细胞内出现棕黄色颗粒为阳性,UPA阳性表达定位于细胞浆,MMP-9阳性表达定位于细胞膜和细胞浆。每张切片均随机观察5个高倍视野(×400),阳性细胞数<5%为(-),5%~25%为(+),26%~50%为(),>50%为()。+~为阳性表达。
1.4 统计学方法 数据采用SPSS 19.0软件进行统计学处理,计数资料采用2检验,相关性分析用Spearman等级相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 UPA和MMP-9在正常子宫内膜组织和子宫内膜癌组织中的表达 UPA蛋白在正常子宫内膜组织中表达率为15.63%(5/32),在子宫内膜癌组织中表达率为70.59%(48/68),二者比较差异有统计学意义(P<0.05);MMP-9蛋白在正常子宫内膜组织中表达率为25.00%(8/32),在子宫内膜癌癌中的表达率为80.88%(55/68),二者比较差异有统计学意义(P<0.05)。
2.2 UPA和MMP-9在子宫内膜癌组织中的表达与临床病理参数的关系 UPA和MMP-9阳性表达与组织学分级、cTNM分期、淋巴结转移均有关(P均<0.05)。见表1。
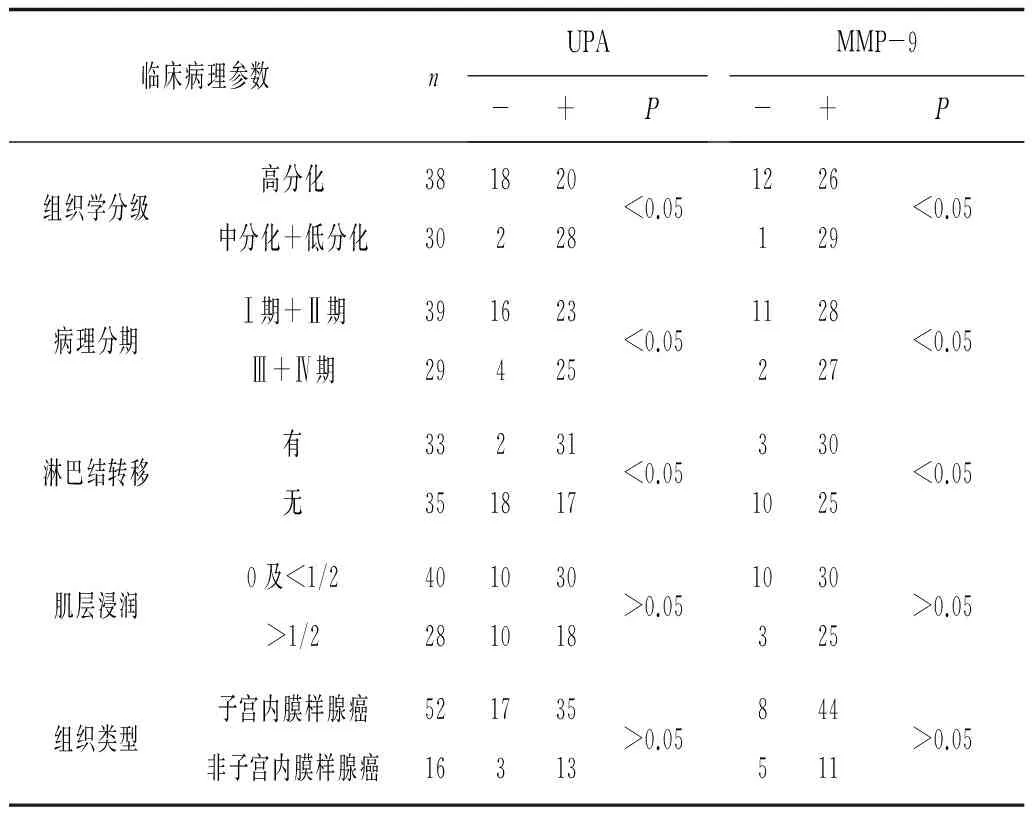
表1 UPA和MMP-9在子宫内膜癌组织中的表达与临床病理参数的关系 例
2.3 UPA和MMP-9二者表达的相关性分析 UPA和MMP-9在子宫内膜癌中的表达呈明显正相关(r=0.261,P<0.05)。见表2。

表2 UPA和MMP-9在子宫内膜癌组织中表达的相关性分析 例
3 讨 论
UPA是一种丝氨酸蛋白水解酶,具有激活纤溶酶原(PLG)作用,在组织改建、细胞迁移、肿瘤侵袭转移及肿瘤血管形成等病理、生理过程中发挥重要作用[2]。肿瘤发生侵袭性成长基本需要几步来完成,首先要对ECM进行黏附,接着对ECM进行降解,最后肿瘤细胞通过ECM后迁徙到新的部位[3]。其中降解ECM是关键,多种蛋白酶能降解ECM,UPA是重要的ECM降解蛋白酶,除了可以直接降解ECM外,作为激活物还可以通过激活纤溶酶原转化成纤溶酶;还可以激活金属蛋白酶,刺激血管生成。UPA具有的生物学作用最终目的是降解ECM成分。研究也证实,在乳腺癌、胃癌、大肠癌、非小细胞肺癌等恶性肿瘤组织中UPA呈现高表达,UPA参与肿瘤的发生、发展的同时也参与了这些肿瘤的浸润、转移[4-7]。本研究也证实,UPA在子宫内膜癌组织中呈高表达,提示其在子宫内膜癌组织中有促癌作用;且UPA在子宫内膜癌中的表达与cTNM分期及淋巴结转移相关,在分化程度较差、cTNM分期晚、淋巴结转移的病例中UPA呈明显高表达,其水平高低预示着子宫内膜癌的恶性程度,原因为UPA与其生物学功能密切相关,通过降解肿瘤组织的ECM和促进血管生成等作用实现其促癌功能。故检测UPA在子宫内膜癌组织中的水平,可以正确认识和判断子宫内膜癌的进展情况,对临床工作具有一定实用价值。
金属蛋白酶家族(MMPs)包括26个成员,金属蛋白酶在破坏肿瘤细胞侵袭的组织学屏障中扮演主要角色,其中MMP-9是MMPs家族中最重要的一员,由巨噬细胞、纤维母细胞、内皮上皮细胞分泌产生,其作用为通过降解、破坏ECM中Ⅳ、Ⅴ、Ⅸ、Ⅺ型胶原,破坏ECM和基底膜的结构,使肿瘤细胞可以沿着受损的基底膜向周围组织浸润[8-10];还可以降低肿瘤细胞之间的黏附性,使肿瘤细胞容易脱离原发灶,提高肿瘤细胞的浸润和游走能力,最终达到恶性肿瘤浸润及转移的目的[11-12]。同时MMP-9在降解ECM过程中释放促血管生成因子,提高血管内皮生长因子(VEGF)水平,促进血管生成,血管生成是肿瘤生长、浸润和转移的基本条件,在为其提供途径同时也为肿瘤提供养分等新陈代谢。本研究结果发现其表达与子宫内膜癌发生关系密切,且与cTNM分期、淋巴结转移密切相关,提示MMP-9在子宫内膜癌的淋巴转移途径中产生了重要作用,其高表达直接证明预后差,值得临床医生关注。
相关研究显示,在某些肿瘤组织中UPA和MMP-9相互作用,共同降解肿瘤组织的ECM,UPA激活纤溶酶原转化为纤溶酶,MMP-9重要的功能是被激活后形成胶原酶,二者在肿瘤组织中相互配合,这种配合称为基因协同作用假说[13-15]。基因协同作用假说认为在肿瘤形成、发展和转移过程中至少存在2个基因的异常激活。本研究结果显示,在子宫内膜癌组织中UPA和MMP-9呈显著正相关,说明在子宫内膜癌中MMP-9与UPA呈现高度的一致性,在肿瘤发生、发展和转移过程中起到协同作用,共同参与降解ECM。对两者的检测有助于不良预后(侵袭和转移)的早发现。
综上所述,UPA和MMP-9的表达在子宫内膜癌的发生、发展和淋巴结转移中发挥重要作用,提示临床检测二者有可能为评估子宫内膜癌病变程度提供参考,为今后对抗子宫内膜癌治疗及预防转移及复发提供了一个新思路。
[1] 蔡东阁,苏文秀,赵晓桂,等.子宫内膜癌组织中GDF-15、P-MTOR蛋白的表达及相关性[J].现代肿瘤医学,2016,24(7):1110-1114
[2] 邹存华,王宏,宋冬冬,等.P38MAPK信号通路与uPA在卵巢癌细胞及组织中表达的相关性[J].中国癌症杂志,2015,25(8):572-578
[3] 尚润泽,戴斌,王德盛.uPA/uPAR系统在肿瘤中作用的研究进展[J].世界华人消化杂志,2014,22(9):1235-1240
[4] 董欢,林燕苹,应学翔,等.乳腺癌组织中uPA和PAI-1的表达及其临床意义[J].癌症,2013,33(4):361-367
[5] 卢庆乐,田玫玲,赵贞香.VEGF与UPA系统在胃癌病情发展的相关性研究[J].国际检验医学杂志,2013,34(17):2261-2262
[6] 东星,王晶,于波.P-P38和UPA蛋白在大肠癌中的表达及临床意义[J].现代肿瘤医学,2014,22(10):2374-2377
[7] 钟安朴,许维毅,曹勇.补肾化瘀解毒方对中晚期非小细胞肺癌化疗患者uPA及PAI-1的影响[J].中华中医药杂志,2016,31(1):316-318
[8] 沙春艳.老年宫颈鳞癌组织中COX-2和MMP-9的表达变化及意义[J].中国老年学杂志,2016,36(2):638-639
[9] 郝艳艳.MMP-9在肺癌患者血清及胸水中的表达[J].现代中西医结合杂志,2010,19(6):673-674
[11] 曹婧.食管鳞癌组织中MMP-2和MMP-9的表达及临床意义[J].肿瘤基础与临床,2016,29(1):23-25
[12] 张敏,宋殿荣,曹保利,等.SDF-1、CXCR4、MMP-9及VEGF在子宫内膜异位症组织中的表达及意义[J].现代中西医结合杂志,2016,25(11):1147-1520
[13] 寇有为,邵华,王强.mmp-9、UPA及CD34与胃癌侵袭和转移及其相关性[J].现代肿瘤医学,2011,19(8):1601-1605
[14] 李诗杰,胡军红,谢永铮,等.MMP-9和UPA联合检测对胰腺癌预后的价值[J].国际肿瘤学杂志,2015,42(3):177-181
[15] 刘刚,关英华,任小强,等.输尿管癌中MMP-9、UPA的表达及与预后的关系[J].临床与实验病理学杂志,2012,28(10):1086-1090
时志民,E-mail:shizhimin1980@163.com
河北省邯郸市科技计划重点项目(1523108076-18)
10.3969/j.issn.1008-8849.2016.32.014
R737.33
B
1008-8849(2016)32-3577-03
2016-05-10
