葛根素上调miR-155-3p降低内脏脂肪素诱导人脐静脉内皮细胞损伤
2016-11-29周凤华黄志勇张蕾孙学刚贾钰华
周凤华,黄志勇,张蕾,孙学刚,贾钰华
(1. 南方医科大学中医药学院,广州 510515;2. 南方医科大学第三附属医院眼耳鼻咽喉科,广州 510630)
葛根素上调miR-155-3p降低内脏脂肪素诱导人脐静脉内皮细胞损伤
周凤华1,黄志勇2,张蕾1,孙学刚1,贾钰华1
(1. 南方医科大学中医药学院,广州 510515;2. 南方医科大学第三附属医院眼耳鼻咽喉科,广州 510630)
目的 研究葛根素对内脏脂肪素(visfatin)诱导人脐静脉内皮细胞(HUVEC)炎症因子及miR-155-3p表达的影响。方法 采用visfatin干预HUVEC建立细胞损伤模型,不同浓度(0.5,1.0,2.0 g/L葛根素分别干预细胞24 h,采用MTT法检测细胞增殖情况,流式细胞术检测细胞凋亡情况,ELISA法检测细胞内CRP和NF-κB的水平,RT-PCR法检测细胞内miR-155-3p水平,western blotting测髓样分化因子(myeloid differentiation factor 88, MyD88)蛋白水平。结果 Visfatin能显著抑制HUVEC增殖,并且诱导其凋亡,与对照组相比差异有显著性(P<0.01),葛根素中、高浓度组可明显抑制visfatin对HUVEC细胞损伤作用;此外,葛根素中、高浓度组能显著降低细胞上清CRP 和NF-κB水平,增加细胞内miR-155-3p基因表达,与模型组相比差异有显著性(P<0.01)。增加miR-155-3p水平可显著降低下游MyD88蛋白表达,抑制HUVEC分泌CRP 与NF-κB,与模型组相比差异有显著性(P<0.05)。结论 葛根素能显著减轻visfatin诱导HUVEC炎症损伤效应,其机制可能与葛根素上调miR-155-3p水平抑制靶基因MyD88蛋白表达,从而降低细胞内CRP与NF-κB水平有关。
人脐静脉内皮细胞;内脏脂肪素;葛根素;miR-155-3p
动脉粥样硬化(atherosclerosis, AS)是众多心脑血管疾病的共同病理基础,已成为严重危害人类健康的头号杀手[1],AS的发病机制一直是心血管疾病研究的热点。内皮是所有心血管危险因素的共同靶点,血管内皮功能损伤是AS发生的始动环节,在可见的AS斑块出现前很长时间即已存在[2]。研究表明,炎症、氧化应激、血流剪切力的变化等均可直接损伤内皮细胞,导致其通透性增高,血小板和单核细胞等黏附增加,从而诱导AS的发生[3,4]。因此,维持血管内皮功能的正常是AS防治的根本。
我们前期研究发现,内脏脂肪素(visfatin)在ApoE-/-小鼠血清及斑块中表达显著增高[5],可诱导人脐静脉内皮细胞(HUVEC)损伤,可能与上调IL-6、TNF-α水平,激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路有关[6,7],提示visfatin在AS的起始环节即发挥作用。研究表明,miR-155可直接靶向一氧化氮合酶,从而在血管内皮细胞中发挥重要作用[8],但visfatin是否能通过调控miR-155水平影响内皮细胞功能尚未见报道。本研究在前期工作基础上主要探讨葛根素对visfatin诱导HUVEC细胞的干预作用机制,以期进一步揭示visfatin诱导内皮损伤的分子机制及中药的防治功效。
1 材料与方法
1.1 材料
1.1.1 细胞及药物
第二代HUVEC细胞(批号ZQ00446,上海中乔新舟科技公司);葛根素(批号110752-201313,广州市药检所)母液浓度为0.5 g/mL先用适量二甲基亚砜(DMSO)溶解后,再用PBS稀释。重组人visfatin(批号YJ130-09,美国Peprotech公司)用PBS溶解稀释成100 mg/L的母液,-20℃保存。
1.1.2 仪器
TSl00-F型Eclipse Ti荧光倒置显微镜(日本Nikon公司),ECHO-PLUS型全自动生化仪(意大利爱康公司),MK3型酶标定量测定仪、反转录仪及荧光定量PCR系统(德国Thermo公司),流式细胞仪(美国Beckman Coulter公司),Image Station 2000MM多功能成像系统(美国Kodak公司)。
1.1.3 试剂
DMEM/F12培养基、胎牛血清(批号03/14、F7676,美国Gibco公司),MTT干粉(批号200-664-3,美国Sigma公司),AnnexinV-FITC细胞凋亡检测试剂盒(批号40302ES20,南京凯基生物公司),miR-155-3p mimic(批号miR10004658-1-2,广州锐博生物公司),CRP与NF-κB ELISA试剂盒(批号ab99995,ab176647,美国Abcam公司),RNAiso Plus、Prime ScriptTMRT Reagent Kit、SYBR Premix Ex TaqTM(批号9109、RR037A、RR420A,日本Takara公司),兔抗髓样分化因子、兔抗GAPDH(批号3699、5174S,美国CST公司)。
1.2 方法
1.2.1 细胞分组
对数生长期细胞分别以0,25,50,100,200 μg/L visfatin干预24 h,再取100 μg/L visfatin分别干预0,3,6,12,24 h,检测细胞增殖及凋亡情况;药物干预分组:对照组,模型组(visfatin 100 μg/L 干预24 h),葛根素低、中、高浓度组,葛根素干预浓度依次为:0.5,1.0,2.0 g/L,共同孵育24 h。
1.2.2 MTT测细胞增殖
HUVEC以5×104/孔密度接种于96孔板,处理后加入MTT溶液(浓度为5g/L)20 μL/孔,于37℃孵育4 h。吸去孔里的培养基,加入DMSO溶液150 μL/孔,震荡10 min充分溶解结晶,酶标仪测A值(波长490 nm)。
1.2.3 流式细胞术测细胞凋亡
细胞干预后离心收集,用PBS洗3次,每次5 min,加入100 μL 1× binding buffer重悬细胞,再加入5 μL annexin V-FITC和5 μL PI 染色液,轻轻混匀,室温避光反应10 min。然后加入400 μL 1× binding buffer,混匀,样品立即上流式细胞仪检测(激发波长488 nm,发射波长530 nm),计算细胞凋亡指数。
1.2.4 ELISA测CRP与NF-κB水平
将细胞制成悬液按照1×105/孔的浓度接种于96孔培养板,分为空白对照组,模型组,葛根素低、中、高浓度组,每组设5个复孔,各组分别培养24 h后,留取细胞上清液,离心10 min后,依次加入稀释好的标准品与待测样品各50 μL于反应孔,立即加入50 μL生物素标记抗体。轻轻混匀,37℃孵育1 h。甩去板内液体,洗涤3次,每孔再加入80 μL亲和链酶素-HRP,混匀,并于37℃孵育0.5 h,再洗涤3次。每孔加入底物A、B各50 μL,轻轻混匀,37℃避光孵育10 min。迅速加入50 μL终止液,立即在450 nm波长处测定各孔的A值并计算CRP与NF-κB的浓度。
1.2.5 RT-PCR测miR-155-3p水平
提取细胞总RNA,琼脂糖凝胶电泳检测总RNA质量及纯度,紫外分光法测定吸光度(A)260/280。cDNA合成:总反应体系20 μL组成为14 μL模板RNA,2 μL enzyme mix,5× RT缓冲液4 μL,42℃反应60 min,95℃反应5 min,将合成好的cDNA保存于-20℃备用。定量PCR:总反应体系20 μL由2× PCR反应混合物10 μL、cDNA 1 μL、miR-155-3p引物0.5 μL、20× SYBR 1 μL与H2O 7.5 μL组成。95℃反应10 min,再转向(95℃ 10 s、60℃ 1 min)共40个循环。miR-155-3p与内参U6的相对表达量用2-△△CT表示,实验重复3次。
1.2.6 Western blotting测MyD88蛋白
细胞分组处理后提取总蛋白,BCA法进行蛋白定量,然后进行SDS-PAGE电泳,蛋白上样量为每孔35 μg,积层胶和分离胶浓度分别为5%和12%,电泳全程1.5 h,再进行半干转膜70 min,5%脱脂牛奶室温封闭1 h,一抗4℃孵育过夜(1∶2000),二抗37℃孵育2 h(1∶5000),ECL法显色成像,Image Tool 3.0分析图像光密度值(IA),GAPDH为内参照。
1.2.7 统计分析

2 结果
2.1 Visfatin致HUVEC损伤
25、50 μg/L visfatin对HUVEC增殖未见明显抑制作用,而100、200 μg/L 能显著抑制HUVEC增殖(P<0.01,见表1);100 μg/L visfatin干预细胞3、6 h对增殖无明显影响,干预12、24 h可见增殖抑制明显,尤其是24 h作用最显著(P<0.01,见表2)。100 μg/L visfatin干预24 h时,细胞凋亡最显著(P<0.01)。
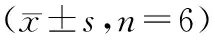
表1 不同浓度visfatin对HUVEC增殖及凋亡的
注:与对照组相比,*P<0.05,**P<0.01(表2同)。
Note. Compared with the control group,*P<0.05,**P<0.01.(Tab.2 is the same).

表2 Visfatin干预不同时间对HUVEC增殖及
2.2 葛根素对HUVEC内CRP、NF-κB及miR-155-3p水平的影响
与模型组相比,葛根素中、高浓度组细胞增殖抑制明显减轻(P<0.01),凋亡指数明显降低(P<0.01,见表3)。模型组细胞上清中CRP与NF-κB明显升高,而葛根素中、高浓度均能显著降低CRP与NF-κB水平(P<0.01)。模型组miR-155-3p水平较对照组明显降低,葛根素中浓度干预后miR-155-3p升高,差异有显著性(P<0.05),高浓度组差异有显著性(P<0.01)。与模型组相比,葛根素低浓度组HUVEC增殖与凋亡,以及CRP、NF-κB、miR-155-3p水平,差异无显著性(P>0.05)。
2.3 激活miR-155-3p对HUVEC的影响
与模型组相比,葛根素组与miR-155 mimic组细胞增殖抑制显著减轻(P<0.01),凋亡指数降低(P<0.01),组间未见差异(P>0.05,见表4)。与空白组相比,模型组CRP、NF-κB与MyD88蛋白水平均显著增加,差异均有显著性(P<0.01)。miR-155-3p mimic可显著降低细胞内CRP、NF-κB与MyD88蛋白表达,与模型组相比差异有显著性(P<0.05,图1)。
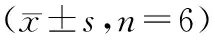
表3 葛根素对HUVEC细胞增殖、凋亡及CRP、NF-κB、miR-155水平的影响
注:与模型组相比,*P<0.05,**P<0.01。
Note. Compared with the model group,*P<0.05,**P<0.01.

表4 激活miR-155对HUVEC的影响
注:a葛根素浓度为1.0 g/L,bmiRNA-155-3p mimic浓度为50 nmol/L,均干预24 h,与模型组相比,*P<0.05,**P<0.01。
Note. Puerarina: 1.0 g/L for 24 h, miR-155;b( miRNA-155-3p mimic): 50 nM for 24 h.Compared with the model group,*P<0.05,**P<0.01.
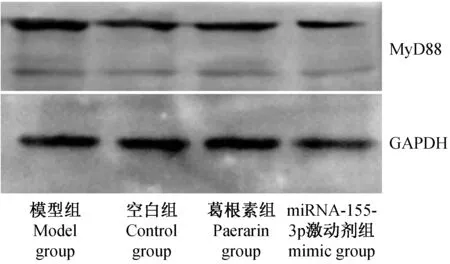
图1 各组MyD88蛋白水平Fig.1 MyD88 protein levels in different groups
3 讨论
内皮细胞是血管内膜屏障,易受到各种心血管危险因素的刺激而发生功能和结构异常,其功能障碍是AS发生发展的起始环节。一旦内皮细胞功能失衡,大量的脂质和单核细胞就会侵入到内皮,导致炎症和脂纹的形成[9,10]。因此,维持血管内皮细胞功能平衡是AS一级预防工作的重要举措。
Visfatin主要由内脏的白色脂肪组织分泌,冠心病患者血清中visfatin水平显著升高,且伴有CRP及肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)的升高[11]。前期发现,visfatin在ApoE-/-小鼠血清及斑块中的表达均明显升高,升高的visfatin可诱导巨噬细胞表面清道夫受体活化,加速对胆固醇及氧化低密度脂蛋白的吞噬,导致泡沫细胞形成[5]。此外,visfatin可明显诱导HUVEC细胞增殖抑制,上调细胞上清中TNF-α及白介素-6(IL-6)水平,诱导细胞炎症损伤,其机制与visfatin激活MAPK家族中的ERK1/2、JNK与p38等信号蛋白有关[6,7]。本实验中我们也发现,visfatin与HUVEC共培养后,细胞增殖抑制,凋亡增加,上清中CRP与NF-κB水平明显升高,进一步证实了visfatin具有显著诱导炎症的作用。
CRP是炎症的敏感性指标之一,CRP的升高与AS的发生发展及预后有密切联系。研究发现,CRP可直接导致HUVEC细胞炎症[12]。CRP可介导巨噬细胞摄取LDL,促进泡沫细胞形成。此外, CRP能促进局部免疫调节障碍,诱导斑块进展及破裂[13]。本实验发现,visfatin能显著上调HUVEC上清中CRP水平,促进细胞炎症损伤,葛根素中、高浓度可明显抑制其分泌,拮抗visfatin的增殖抑制与诱导凋亡作用。
众所周知,NF-κB参与炎症、免疫、氧化应激反应的全过程,是重要的核转录因子。NF-κB可被众多危险因素活化,一旦NF-κB被激活可调控血管细胞黏附分子、细胞间黏附分子、E选择素等生成增多;同时,NF-κB可抑制细胞凋亡,导致血管平滑肌细胞反应性增生及纤维化,进而促进AS斑块形成[14]。MyD88是Toll样受体信号通路中的一个关键接头分子,可与NF-κB特异性结合激活下游炎症相关基因表达,从而激发一系列级联式炎症反应,进一步促进AS进展,因而MyD88/NF-κB也被认为是抗AS的重要环节。本实验也发现,给予HUVEC外源性visfatin刺激后,细胞内MyD88蛋白表达显著增加,上清中的NF-κB水平升高,提示visfatin诱导HUVEC损伤可能与激活MyD88/NF-κB炎症通路有关,葛根素可显著降低细胞MyD88与NF-κB水平,可能是其抗炎作用的部分机制。
微小RNA(microRNA, miRNA)在调节AS病变进程相关的血管壁炎性反应、免疫细胞分化和胆固醇代谢等方面均发挥了重要作用[15]。miR-155-3p是一个典型的多功能miRNA,已被证实在免疫反应、炎症、肿瘤发生等过程中均发挥了重要作用。miR-155-3p在巨噬细胞泡沫化过程中表达上调,可下调清道夫受体表达抑制泡沫细胞形成[16]。TNF-α可显著上调HUVEC内miR-155-3p水平,这可能是机体内在有效的负反馈调节机制,通过抑制MyD88/NF-κB通路降低内皮炎症,从而减轻AS损伤[17]。可以确定的是,miR-155-3p在AS中具有明显的阶段特异性作用,早期可靶向调节集落刺激因子-1受体表达,从而抑制巨噬细胞增殖;进展期可通过下调Bcl-6表达抑制AS斑块进展[18]。本实验中,100 μg/Lvisfatin干预HUVEC 24 h能显著降低细胞内miR-155-3p表达,而葛根素可有效逆转这种下调作用。增加细胞miR-155-3p水平能显著抑制靶基因MyD88蛋白表达,降低NF-κB与CRP水平,从而减轻visfatin对HUVEC的损伤作用。葛根素对HUVEC的保护作用部分是通过上调miR-155-3p水平实现的。
[1] 中华人民共和国卫生部. 2014中国卫生统计年鉴[M],北京:中国协和医科大学出版社, 2015, 324.
[2] Lu J, Xiang G, Liu M, et al. Irisin protects against endothelial injury and ameliorates atherosclerosis in apolipoprotein E-Null diabetic mice [J]. Atherosclerosis, 2015, 243(2): 438-448.
[3] Shalini V, Pushpan CK, GS, et al. Tricin, flavonoid from Njavara reduces inflammatory responses in hPBMCs by modulating the p38MAPK and PI3K/Akt pathways and prevents inflammation associated endothelial dysfunction in HUVECs [J]. Immunobiology, 2015; pii: S0171-2985(15)30067-X.
[4] Husain K, Hernandez W, Ansari RA, et al. Inflammation, oxidative stress and renin angiotensin system in atherosclerosis [J]. World J Biol Chem, 2015, 6(3): 209-217.
[5] Zhou FH, Pan YY, Huang ZY, et al. Visfatin induces cholesterol accumulation in macrophages through up-regulation of scavenger receptor-A and CD36 [J]. Cell Stress Chaperones, 2013, 18: 643-652.
[6] 崔小冰,周凤华,万强,等. p38 MAPK通路在内脏脂肪素诱导HUVEC细胞分泌TNF-α的作用及定心方含药血清的影响 [J]. 中国实验方剂学杂志, 2014, 20(7): 135-139.
[7] 万强,周凤华,崔小冰,等. 小檗碱通过JNK通路降低内脏脂肪素诱导人脐静脉内皮细胞分泌IL-6和TNF-α的研究 [J]. 中草药,2015,46(7): 216-220.
[8] Shi L, Fleming I. One miR level of control: microRNA-155 directly regulates endothelial nitric oxide synthase mRNA and protein levels [J]. Hypertension, 2012, 60(6): 1381-1382.
[9] Pedrigi RM, Poulsen CB, Mehta VV, et al. Inducing persistent flow disturbances accelerates atherogenesis and promotes thin cap fibroatheroma development in D374Y-PCSK9 hypercholesterolemic minipigs [J]. Circulation, 2015; 132(11): 1003-1012.
[10] Gu P, Cheng M, Hui X, et al. Elevating circulation chemerin level is associated with endothelial dysfunction and early atherosclerotic changes in essential hypertensive patients [J]. J Hypertens, 2015; 33(8): 1624-1632.
[11] Dahl TB, Yndestad A, Skjelland M, et al. Increased expression of visfatin in macrophages of human unstable carotid and coronary atherosclerosis: possible role in inflammation and plaque destabilization [J]. Circulation, 2007; 115(8):972-980.
[12] Raaz-Schrauder D, Ekici AB, Klinghammer L, et al. The proinflammatory effect of C-reactive protein on human endothelial cells depends on the FcγRIIa genotype [J]. Thromb Res, 2014; 133(3): 426-432.
[13] Singh SK, Suresh MV, Prayther DC, et al. C-reactive protein-bound enzymatically modified low-density lipoprotein does not transform macrophages into foam cells [J]. J Immunol, 2008; 180(6): 4316-422.
[14] Feaver RE, Gelfand BD, Blackman BR. Human haemodynamic frequency harmonics regulate the inflammatory phenotype of vascular endothelial cells [J]. Nat Commun, 2013; 4: 1525.
[15] Kumar S, Kim CW, Simmons RD, et al. Role of flow-sensitive microRNAs in endothelial dysfunction and atherosclerosis: mechanosensitive athero-miRs [J]. Arterioscler Thromb Vasc Biol, 2014; 34(10): 2206-2216.
[16] 尚菲,曾德意,杨慧,等. MicroRNA155通过下调清道夫受体表达抑制巨噬细胞泡沫化形成 [J]. 中山大学学报(医学科学版),2012,33(3): 156-162.
[17] Wu XY, Fan WD, Fang R, Wu GF. Regulation of microRNA-155 in endothelial inflammation by targeting nuclear factor (NF)-κB P65 [J]. J Cell Biochem, 2014; 115(11): 1928-1936.
[18] Wei Y, Zhu M, Corbalán-Campos J, et al. Regulation of Csf1r and Bcl6 in macrophages mediates the stage-specific effects of microRNA-155 on atherosclerosis [J]. Arterioscler Thromb Vasc Biol, 2015; 35(4): 796-803.
Puerarin alleviates HUVEC injury induced by visfatin through up-regulating miR-155-3p
ZHOU Feng-hua1, HUANG Zhi-yong2, ZHANG Lei1, SUN Xue-gang1, JIA Yu-hua1
(1. School of Traditional Chinese Medicine, Southern Medical University, Guangzhou 510515, China;2. ENT Department, the Third Affiliated Hospital of Southern Medical University, Guangzhou 510630)
Object To study the effect of puerarin on the expression of inflammatory factors and miR-155-3p in human umbilical vein endothelial cells (HUVEC) induced by visfatin. Methods The HUVEC cell injury model was established with visfatin. Cell proliferation was measured by MTT assay. Cell apoptosis was detected by flow cytometry. The level of CRP and NF-κB was detected by ELISA, and the expression of miR-155-3p was detected by RT-PCR. The expression of myeloid differentiation factor 88 (MyD88) was identified by western blotting. Results Visfatin induced cell proliferation and inhibited apoptosis in HUVEC, meanwhile the expressions of both CRP and NF-κB were significantly increased, compared with that of the control group (P<0.01). Puerarin at moderate and high concentrations obviously reduced the HUVEC injury induced by visfatin, mainly through down-regulating the expression of CRP and NF-κB, as well as up-regulating the level of miR-155-3p in the HUVEC. MiR-155-3p mimic markedly decreased the level of MyD88, CRP and NF-κB in the HUVEC induced by visfatin (P<0.05). Conclusions Pueprarin obviously alleviates HUVEC injury induced by visfatin, probably related to down-regulating the level of MyD88, CRP, NF-κB, and up-regulating the expression of miR-155-3p in HUVEC.
Human umbilical vein endothelial cells, UVEC; Visfatin; Puerarin; miR-155-3p
ZHOU Feng-hua. E-mail: wendyzhou515@126.com
国家自然科学基金(No.81373574、81403339);广东省自然科学基金博士启动项目(No.2014A030310150);广东省中医药管理局科研项目(No.20141186);广东省教育部产学研结合项目(2012B091100157);南方医科大学科研启动计划(No.PY2013N014)。
周凤华(1986-),女,讲师,博士学位,研究方向为缺血性心血管疾病的中医药防治。E-mail: wendyzhou515@126.com
研究报告
Q95-33
A
1005-4847(2016)05-0465-05
10.3969/j.issn.1005-4847.2016.05.005
2016-03-14
