PCR检测实验恒河猴和食蟹猴群体中幽门螺杆菌和“猕猴螺杆菌”的感染
2016-11-29王立鹏李永旺郭连香时长军
王立鹏, 李永旺, 郭连香, 时长军
(苏州西山生物技术有限公司,江苏 215123)
PCR检测实验恒河猴和食蟹猴群体中幽门螺杆菌和“猕猴螺杆菌”的感染
王立鹏, 李永旺, 郭连香, 时长军
(苏州西山生物技术有限公司,江苏 215123)
目的 调查国内实验恒河猴和食蟹猴中幽门螺杆菌和“猕猴螺杆菌”的感染情况。方法 参考文献中的螺杆菌属16S rRNA和幽门螺杆菌16S rRNA的引物序列,和新设计的“猕猴螺杆菌”16S rRNA特异性引物,在人工养殖的45只成年恒河猴和90只成年食蟹猴粪便样本中,通过qPCR或常规PCR检测来初步调查这两种猕猴中两种螺杆菌的感染情况。结果 在恒河猴中幽门螺杆菌和“猕猴螺杆菌”的感染率均为100%,在食蟹猴中幽门螺杆菌和“猕猴螺杆菌”的感染率分别为100%和97.8%。结论 证实我国人工繁育饲养的恒河猴和食蟹猴普遍存在“猕猴螺杆菌”感染。幽门螺杆菌和“猕猴螺杆菌”几乎同时存在于所有人工繁育的实验猴个体中,可能会对这两种猕猴的健康以及相关动物实验结果的准确性存在不利影响。
恒河猴;食蟹猴;幽门螺杆菌; 猕猴螺杆菌;感染;诊断
Warren和Marshall在1983年从胃炎患者胃粘膜活检标本中首次分离出幽门螺杆菌(Helicobacterpylori,HP),此后以该细菌为代表菌建立了螺杆菌属。目前,螺杆菌属已有23个种[1]。幽门螺杆菌,螺旋形弯曲,革兰氏染色阴性,长2~4 μm,直径0.4 μm,菌体一端有4条鞭毛[2]。在人体内,幽门螺杆菌主要定居于胃窦粘膜,会导致胃炎和胃溃疡,WHO已将其定为胃癌的第一类致癌因子[3]。体外研究表明幽门螺杆菌对多种抗生素敏感,但是在体内应用发现感染人群的许多幽门螺杆菌对抗生素具有抗性。为了研究出更有效的根治幽门螺杆菌的药物或疫苗,预防胃癌的发生,需要构建能够感染幽门螺杆菌的动物模型[4]。目前,只有家猫和非人灵长类是幽门螺杆菌的自然宿主动物[5]。
1987~1990年期间的5篇研究报告表明,在恒河猴(rhesus monkey)和南方豚尾猕猴(Southern pig-tailed macaque)中存在幽门螺杆菌的自然感染;而在食蟹猴(cynomolgus monkey)中则既没有发现自然感染,人工感染幽门螺杆菌也无效[2,6-9]。1993年,Takahashi的团队用人源和恒河猴源的幽门螺杆菌人工感染食蟹猴,结果证明食蟹猴可以被人工感染幽门螺杆菌[10,11]。1999年,Reindel等首次发现食蟹猴也存在幽门螺杆菌的自然感染[12]。目前,国内仍未见对猴群中幽门螺杆菌自然感染情况的调查研究。
2001年,Fox等学者从恒河猴结肠组织中分离培养出一种新的螺杆菌,暂时命名为“猕猴螺杆菌”(Helicobactermacacae)。“猕猴螺杆菌”,螺旋形弯曲,革兰氏染色阴性,长2~3 μm,直径0.2 μm,菌体两端各有1条带鞘的鞭毛[13]。该菌长期存在于肠道中,可能与结肠炎的发生有关,引发慢性痢疾、体重下降和脱水等症状[14]。目前,国内尚未有对猴群中该种螺杆菌感染情况的调查研究。
本研究用螺杆菌属16S rRNA特异性引物的普通PCR方法,对我国人工繁育的两种猕猴群中的螺杆菌流行情况进行初步调查。确认螺杆菌在猴群中有感染后,进一步以幽门螺杆菌16S rRNA特异性引物实时荧光定量PCR方法(qPCR)对养殖场恒河猴和食蟹猴的幽门螺杆菌感染进行调查。针对“猕猴螺杆菌”16S rRNA特异性保守区域设计引物,通过PCR方法检测我国猕猴和食蟹猴中是否存在“猕猴螺杆菌”感染。由于“Helicobactermacacae”(“猕猴螺杆菌”)尚未被原核生物命名国际委员会(ICSP)正式采用,因此本文用引号标记以示区别。
1 材料和方法
1.1 猕猴粪便样本
45只2~4岁的雄性恒河猴和90只雌雄各半的4岁左右食蟹猴的新鲜粪便样本分别采集自不同实验猴人工繁育场,样本冷藏空运至本公司,-20℃保存待用。
1.2 粪便样本DNA提取
取恒河猴或食蟹猴的粪便样本200 mg,用粪便基因组DNA提取试剂盒(天根,货号#DP328)提取核酸,操作步骤按照试剂盒说明书进行。最终用100 μL无菌水洗脱,-20℃保存待用。
1.3 幽门螺杆菌阳性对照制备
Helicobacterpylori株(ATCC 43504),用含有血琼脂和7%马血等的弯曲杆菌选择性血琼脂培养基,在37℃微需氧环境下培养。之后用无菌棉棒刮取部分菌落,计数并稀释至109CFU/mL,10倍梯度稀释至100CFU/mL。经PCR测试,103CFU/mL菌液提取的DNA模板可作为PCR反应的阳性对照。
1.4 其他细菌DNA样本
从肺炎克雷伯氏杆菌CVCC3699,大肠埃希氏菌 CMCC44102,嗜肺巴斯德杆菌ATCC35149,假结核耶尔森CMCC53504,乙型溶血性链球菌CMCC32210,肺炎链球菌ATCC49619,多杀巴斯德杆菌CVCC458,金黄色葡萄球菌CMCC26003,鸡白痢沙门氏菌CVCC528,志贺氏菌CMCC51252,小肠结肠耶尔森氏菌GIM1.265及空肠弯曲杆菌ATCC33291中提取基因组DNA,用于3种引物的特异性实验。
1.5 引物及质粒合成
引物和质粒的合成均由苏州金唯智生物技术有限公司合成和构建。螺杆菌属16S rRNA特异性上游引物HSPP767 F: GGCTATGACGGGTATCCG GC,下游引物HSPP767 R:GCCGTGCAGCACCT GTTTTC[15];幽门螺杆菌16S rRNA特异性上游引物HP-P1 F:TTTGTTAGAGAAGATAATGACGGTATCTA AC,下游引物HP-P1R:CATAGGATTTCACACCT GACTGACTATC[4];“猕猴螺杆菌”16S rRNA特异性引物H.M8F:GGGATGCTCTTAGAAATGC,H.M8R:GCTCTTTACGCCCAGTGATT,为本公司设计。HSPP767 F/HSPP767 R、HP-P1F/HP-P1R和H.M8F/H.M8R的靶序列人工合成后分别连接到pUC57载体上,即为pc12、pc16和pc20。
1.6 普通PCR反应
PCR仪为Eppendorf 6321。反应体系包含10 mM Tris-Cl(pH 8.3),50 mM KCl和2 mM MgCl2,4种dNTP各0.2 mM,上下游引物各0.4 μM,1U rTaq DNA聚合酶(Takara,#KA201A),5 μL粪便样本提取的DNA模板,总体积为25 μL。PCR反应条件为95℃预变性5 min,95℃变性30 s,58℃退火30 s,72℃延伸30 s,进行35个循环,之后72℃延伸5 min。2%琼脂糖凝胶电泳,5 V/cm,100 bp DNA marker(天根,#BSA22S1)4 μL,凝胶中掺入0.01% GeneRed(博美达,#41003-0.5 mL)作为荧光染料,由凝胶成像分析仪(上海勤翔,Genosens1560)采集电泳结果。每次实验中,均设置质粒阳性对照和模板空白对照,所有测试组均重复2次。
1.7 实时荧光定量PCR反应
PCR仪为ABI 7500 Real-Time PCR System。反应体系为20 μL,含2× Premix Ex Taq(SYBR)10 μL,ROX(50×)0.4 μL,上下游引物各0.2 μM,补加无菌水至20 μL。反应条件为95℃预变性30 s,95℃变性5 s,60℃退火延伸31 s,采集信号,40个循环;95℃变性15 s,60℃退火延伸1 min,95℃变性15 s,60℃ 15 s绘制溶解曲线。每次实验中,均设置质粒阳性对照和模板空白对照,所有测试组均重复2次。
1.8 扩增产物测序与比对
部分PCR产物送交苏州金唯智生物技术有限公司测序。序列比对分析软件为DNAMAN 6.0。
2 结果
2.1 PCR方法建立
以各自相应的质粒为模板,10-1~10-12做系列梯度稀释,用于3种引物的敏感性实验,结果表明HSPP767和H.M8的普通PCR检测下限为1 132拷贝/5 μL,HP-P1引物的qPCR检测下限为68拷贝/5 μL。3对引物均不会扩增鸡白痢沙门氏菌、志贺氏菌、小肠结肠耶尔森氏菌、大肠埃希氏菌及空肠弯曲杆菌等细菌的核酸,表明3对引物用于粪便提取核酸的PCR特异性好。这一部分的结果未展示。
2.2 猕猴中螺杆菌属细菌检测
以HSPP767引物对恒河猴和食蟹猴的粪便提取DNA样本进行PCR扩增,45份恒河猴粪便样本均为螺杆菌阳性;90份食蟹猴粪便样本中有89份为螺杆菌阳性,仅有1份样本为螺杆菌阴性。阳性样本扩增产物大小与目的扩增片段相同,为767 bp。结果见图1和图2。
2.3 猕猴中幽门螺杆菌的检测
用HP-P1引物对恒河猴和食蟹猴的粪便提取DNA样本进行qPCR检测,135份猕猴的粪便样本检测结果全部为幽门螺杆菌阳性,随机选取3份样本的扩增产物送交测序并与靶序列进行分析比对,确认扩增产物均为幽门螺杆菌。扩增产物见结果图3。
2.4 猕猴中“猕猴螺杆菌”的检测
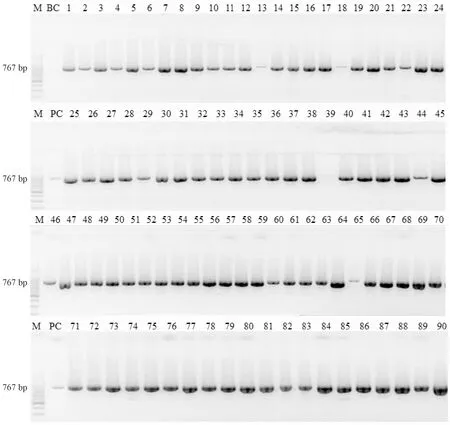
以H.M8引物对恒河猴和食蟹猴的粪便提取DNA样本进行PCR扩增,45份恒河猴粪便样本均为“猕猴螺杆菌”阳性;90份食蟹猴样本中,有88份为“猕猴螺杆菌”阳性,2份阴性。阳性样本扩增产物大小与目的片段相同,为493 bp。随机选取3份扩增产物送交测序,结果表明扩增子与靶序列高度相似,确认为“猕猴螺杆菌”。结果见图4和图5。另外,图4中展示了这对引物以Helicobacterpylori菌株DNA为模板时,扩增结果是阴性的,表明该引物不扩增幽门螺杆菌。以上六项检测结果的汇总见表1。

表1 恒河猴和食蟹猴中螺杆菌感染统计
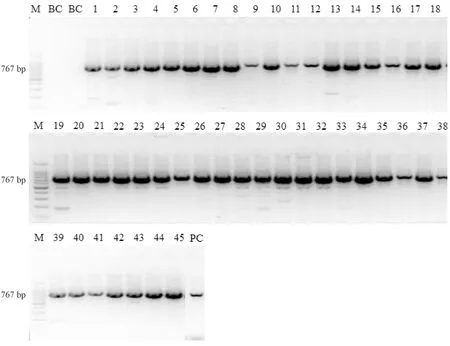
M:100 bp marker ladder;BC:不含核酸模板的空白对照组;PC:阳性质粒对照PC12;泳道1~45:为45份恒河猴粪便提取DNA样本扩增产物图1 恒河猴45份样本中螺杆菌的检测结果M, 100 bp marker ladder; BC, blank control without nucleic acid template; PC, positive control with plasmid PC12; Lane 1-45, 45 DNA samples from feces of rhesus macaques.Fig.1 PCR results of 45 rhesus macaques stool samples with HSPP767 primers for Helicobacter.
M:100 bp marker ladder;BC:不含核酸模板的空白对照组;PC:阳性质粒对照pc12;泳道1~90:90份食蟹猴粪便提取DNA样本图2 食蟹猴90份样本的螺杆菌检测结果M, 100 bp marker ladder; BC, Blank control without nucleic acid template; PC, positive control with plasmid pc12; Lane 1-90, 90 DNA samples from feces of cynomolgus monkeys.Fig.2 PCR results of the HSPP767 primers for Helicobacter in 90 cynomolgus monkeys.

——:完全一致序列;….:空缺序列图3 恒河猴3个样本HP-P1产物测序结果比对“——”: The identical sequence; “….”: Absence of sequence.Fig.3 The alignment results of 3 amplicons of HP-P1F/ HP-P1R in rhesus macaques

M:100 bp marker ladder;BC:不含核酸模板的空白对照组;PC:质粒阳性对照pc20;HP:H. pylori对照;泳道1~45:45份恒河猴粪便提取DNA样本;泳道46~135:90份食蟹猴提取DNA样本图4 恒河猴和食蟹猴样本中“猕猴螺杆菌”PCR产物电泳结果M, 100 bp marker ladder; BC, blank control without nucleic acid template; PC, positive control with pc20; HP, H. pylori DNA; Lane 1-45, 45 DNA samples from feces of rhesus macaques; Lane 46-135, 90 DNA samples from feces of cynomolgus monkeysFig.4 PCR results of the Helicobacter macacae in rhesue and cynomolgus monkeys.

——:完全一致序列;….:空缺序列图5 恒河猴3份样本H.M8扩增产物测序结果比对——: The Identical sequence;….: Absence of sequence.Fig.5 The alignment result of the amplicon of H.M8 primers with 3 rhesue macaques samples.
3 讨论
本研究建立了PCR用粪便样本检测实验猴幽门螺杆菌和“猕猴螺杆菌”的方法,并证实我国人工繁育的恒河猴和食蟹猴中普遍存在这两种螺杆菌感染。
恒河猴和食蟹猴中自然感染幽门螺杆菌后,通常都不会表现出明显的临床症状。内窥镜检常见胃黏膜红斑、表层粘膜增生及单核细胞浸润等炎症反应,但未见萎缩性胃炎或胃癌的发生[2,12]。1988年,Baskerville等在11只恒河猴中以组织学检查和胃黏膜微生物分离培养法确认其中有6只被幽门螺杆菌感染,感染率为54.5%[7];1990年,Arther等以上述相同的方法在34只恒河猴中检测到12只被幽门螺杆菌自然感染,感染率为35.5%[2];1995年,Dubios等用ELISA法检测血清中抗幽门螺杆菌IgG水平,在196只不同年龄段和饲养方式(包括野生)的恒河猴中,发现在1岁恒河猴的幽门螺杆菌感染率已达到50%以上,2~6岁时感染率为80%左右,在7~10岁时感染率最高,可达到90%左右[16];1997年,Laurence等用PCR检测了23只1~3岁中国来源恒河猴的胃部活检组织样本,其中有21只幽门螺杆菌阳性,感染率为91.3%;而同时用培养的方法检出率仅52%[5]。这些结果表明,血清学或PCR方法检测幽门螺杆菌的敏感性远高于组织学检查或微生物培养。本文用16S rRNA特异性引物对45只恒河猴粪便样本的筛查表明,在2~4岁的恒河猴群中,幽门螺杆菌感染率为100%。此结果说明PCR检测粪便样本幽门螺杆菌在实验动物健康监测应用的可行性,并证明我国恒河猴群体中幽门螺杆菌感染的普遍性。
目前,对食蟹猴感染幽门螺杆菌的研究很少[12]。由于恒河猴资源有限,而食蟹猴的人工养殖更普遍,生物医药研究中应用更广泛。早期用内窥镜检、胃黏膜样本组织学检查和微生物培养法进行的调查研究认为食蟹猴既不会自然感染幽门螺杆菌,也对人工感染的人源和恒河猴源的幽门螺杆菌不敏感[2,6]。相反,Takahashi等在1993年成功地用幽门螺杆菌人工感染了食蟹猴[10,11]。Reindel等1999年也报道了与上述相同方法进行的调查,发现食蟹猴可以自然感染幽门螺杆菌,在63只2~4岁的食蟹猴中,幽门螺杆菌阳性感染率达69.8%,病理研究也确认感染造成组织炎症改变[12]。目前,尚未见有用PCR方法对食蟹猴中幽门螺杆菌感染情况的调查。本文首次用16S rRNA特异性引物对90只雌雄各半的4岁食蟹猴的粪便样本进行调查研究,结果表明幽门螺杆菌感染率为100%,比以往国外报道的感染率都高,与本文中恒河猴群中感染率相同,而传统的分离培养或血清学方法检测幽门螺杆菌有低敏感性的局限。
Fox等在2007年从一例患有腺癌的恒河猴回肠内容物中分离出一种螺杆菌新种并命名为“猕猴螺杆菌”。此后,该研究团队对饲养在一起的26只患有回结肠炎恒河猴的回肠内容物进行分离培养,其中有21只恒河猴为螺杆菌阳性;同时对35只没有回结肠炎的恒河猴检测发现也有20只为螺杆菌阳性[13,14]。但是作者仅选择其中少数样本进行16S rRNA分析,因此无法得知该群体中“猕猴螺杆菌”感染的实际数量。至今尚未见有关食蟹猴中“猕猴螺杆菌”感染的相关研究报道。文献中猕猴螺杆菌是通过活组织培养,此培养方法有损动物健康;通过粪便培养分离猕猴螺杆菌难度太大,由于粪便中菌群复杂,且猕猴螺杆菌生长环境、形态特征普遍,进一步分纯进行微生物培养鉴定难度大。因此我们针对“猕猴螺杆菌”的7个细菌株的16S rRNA序列进行比对分析后,设计了特异性引物。实验表明该引物灵敏度高,且特异性好,与包括幽门螺杆菌在内的数种常见肠道菌无交叉。我们用该引物进行的调查结果表明,在45只2~4岁的恒河猴中“猕猴螺杆菌”的感染率为100%;在90只食蟹猴中有88只为“猕猴螺杆菌”阳性,感染率达97.8%,证明了我们建立的检测该菌的PCR方法的可行性和实验猴感染“猕猴螺杆菌”的普遍性。
在本研究中,有1份食蟹猴样本的螺杆菌属特异性引物PCR检测结果为阴性,但幽门螺杆菌特异性引物qPCR检测结果为阳性。由于qPCR比常规PCR灵敏度高20倍以上,因此该例结果的不符合可能是不同方法的敏感性的差异所致。需进一步建立螺杆菌和“猕猴螺杆菌”的qPCR检测方法可提高检测敏感性。
目前的研究表明,只有家猫和非人灵长类是幽门螺杆菌的自然感染动物宿主[5]。非人灵长类与人亲缘关系非常紧密,幽门螺杆菌在非人灵长类中也分布于胃黏膜中,会引发不同程度的持续性胃炎,以及幽门螺杆菌在猴群中广泛存在自然感染的情况,使得非人灵长类成为研究幽门螺杆菌感染人体后的致病机理、药物筛选和疫苗开发的最佳实验动物[5,16]。另一方面,由于幽门螺杆菌感染人群后,会造成胃炎、胃溃疡、十二指肠溃疡甚至胃癌,在实验猴群中广泛存在的幽门螺杆菌污染,可能会对饲养人员和实验人员的身体健康造成威胁,因此应及时发现并清除实验猴中自然感染的幽门螺杆菌[3]。而实验猴感染幽门螺杆菌造成的胃炎以及“猕猴螺杆菌”造成的回结肠炎,可能会对使用这些动物进行的药效学或药物毒理学实验造成干扰[14]。虽然目前国内外尚未有对实验猴中的幽门螺杆菌感染的监测要求,但有必要建立不携带幽门螺杆菌的SPF级实验猴应用于消化道药物临床前研究。
总之,本研究针对螺杆菌属、幽门螺杆菌和“猕猴螺杆菌”的16S rRNA特异性区域建立的PCR方法,检测实验猴粪便样本中这些细菌具有特异、敏感和可行的优势,通过对人工繁育的恒河猴和食蟹猴的螺杆菌感染状况初步调查,表明实验恒河猴和食蟹猴都存在幽门螺杆菌和“猕猴螺杆菌”的复合感染。
[1] 华杰松, 郑鹏远, 张振华, 等. 螺杆菌属细菌的分类和鉴定 [J]. 胃肠病学和肝病杂志, 1999, 8(2): 83-88.
[2] Euler AR, Zurenko GE, Moe JB, et al. Evaluation of two monkey species (MacacamulattaandMacacafascicularis) as possible models for humanHelicobacterpyloridisease [J]. J Clin Microbiol,1990, 28(10): 2285-2290.
[4] Roussel Y, Harris A, Lee MH, et al. Novel methods of quantitative real-time PCR data analysis in a murineHelicobacterpylorivaccine model [J]. Vaccine, 2007, 25: 2919-2929.
[5] Handt LK, Fox JG, Yan LL, et al. Diagnosis ofHelicobacterpyloriinfection in a colony of rhesus monkeys (Macacamulatta) [J]. J Clin Microbiol, 1997, 35(1): 165-168.
[6] Newell DG, Hudson MJ, Baskerville A. Naturally occurring gastritis associated withCampylobacterpyloriinfection in the rhesus monkey [J]. Lancet,1987, 2: 1338.
[7] Newell DG, Hudson MJ, Baskerville A. Isolation of a gastric campylobacter-like organism from the stomach of four rhesus monkeys, and identification asCampylobacterpylori[J]. J Med Microbiol,1988, 27(1): 41-44.
[8] Bronsdon MA, Schoenknecht FD.Campylobacterpyloriisolated from the stomach of the monkey,Macacanemestrina[J]. J Clin Microbiol, 1988, 26(9): 1725-1728.
[9] Reed, KD, and Berridge BR. Campylobacter-like organisms in the gastric mucosa of Rhesus monkeys [J]. Lab Anim Sci, 1988, 38: 329-331.
[10] Takahashi S, Igarashi H, Ishiyama N, et al. Serial change of gastric mucosa after challenging with Helicobacter pylori in the cynomolgus monkey [J]. Zentralbl Bakteriol,1993, 280: 51-57.
[11] Masubuchi N, Takahashi S, Nakano M, et al. Experimental infection of the cynomolgus monkey withHelicobacterpylori[J]. Nippon Rinsho, 1993, 51: 3127-3131.
[12] Reindel JF, Fitzgerald AL, Breider MA, et al. An epizootic of lymphoplasmacytic gastritis attributed toHelicobacterpyloriinfection in cynomolgus monkeys (Macacafascicularis) [J]. Vet Pathol,1999, 36(1): 1-13.
[13] Fox JG, Boutin SR, Handt LK, et al. Isolation and characterization of a novelhelicobacterspecies, "Helicobactermacacae," from rhesus monkeys with and without chronic idiopathic colitis [J]. J Clin Microbiol,2007, 45(12): 4061-4063.
[14] Marini RP, Muthupalani S, Shen Z, et al. Persistent infection of rhesus monkeys with ‘Helicobacter macacae’ and its isolation from an animal with intestinal adenocarcinoma [J]. J Med Microbiol,2010, 59(8): 961-969.
[15] Fatemeh Soghra Abdi, Shahram Jamshidi, Farhad Moosakhani, et al. Detection of Helicobacter spp. DNA in the colonic biopsies of stray dogs: molecular and histopathological investigations [J]. Diagn Pathol,2014, 9: 50.
[16] Dubois A, Fiala N, Weichbrod RH, et al. Seroepizootiology ofHelicobacterpylorigastric infection in nonhuman primates housed in social environments [J]. J Clin Microbiol,1995, 33(6): 1492-1495.
PCR test ofHelicobacterpyloriand “Helicobactermacacae” infections in rhesus and cynomolgus monkey breading colonies
WANG Li-peng, LI Yong-wang, GUO Lian-xiang, SHI Chang-jun
(Suzhou Xishan Biotechnology Inc., Suzhou Jiangsu 215123, China)
Objective To investigate the status ofHelicobacterpyloriand “Helicobactermacacae” infection in rhesus and cynomolgus monkeys in China. Methods With the use of 16S rRNA specific primers for Helicobacter spp andHelicobacterpylori(HP) from published literatures, and new 16S rRNA specific primers designed for “Helicobactermacacae” (HM), we investigated the infection status of these two Helicobacter spps in both of 45 rhesus and 90 cynomolgus monkeys by qPCR or conventional PCR on stool samples. Results All three primer sets for 16S rRNA exhibited excellently sensitivity and specificity. Both the infection rates of HP and HM were 100% among 45 young adult rhesus monkeys. The infection rate of HP and HM in 90 young adult cynomolgus monkeys were 100% and 97.8%, respectively. ConclusionsHelicobacterpyloriand “Helicobactermacacae” are present in almost every artificially bred adult rhesus and cynomolgus individuals which may adversely affect the health of laboratory monkeys and the accuracy of related animal experiments.
Rhesus monkey; Cynomolgus monkey;Helicobacterpylori; “Helicobactermacacae”; Infection; Diagnosis
王立鹏(1989-),男,硕士。Email:wlpburry@126.com。
时长军(1953-),男,博士。Email:changjun.shi@vrl.net。
R-33
A
1671-7856(2016)10-0061-08
10.3969.j.issn.1671-7856. 2016.10.012
2016-05-09
