谷氨酰胺联合脐血间充质干细胞移植在大鼠肠缺血再灌注损伤中的作用
2016-11-29王炳杰胡延伟赵叶芳张仕东
王炳杰,胡延伟,赵叶芳,张仕东
(河北医科大学附属邢台市人民医院 肛肠外科1, 普外科2、4,妇产科3,邢台 054001)
谷氨酰胺联合脐血间充质干细胞移植在大鼠肠缺血再灌注损伤中的作用
王炳杰1,胡延伟2,赵叶芳3,张仕东4
(河北医科大学附属邢台市人民医院 肛肠外科1, 普外科2、4,妇产科3,邢台 054001)
目的 探讨谷氨酰胺联合脐血间充质干细胞(MSCs)移植在大鼠肠缺血再灌注损伤中作用。方法 体外复苏并培养脐血间充质干细胞移植前备用,观察CM-DiI荧光标记后脐血间充质干细胞的去向。80只SD大鼠随机分为正常对照组,缺血再灌注损伤组,谷氨酰胺组,MSCs移植组及联合组每组各15只。对照组采用生理盐水灌肠,损伤组采用TNB (S乙醇稀释)灌肠,在TNBS建模后1 h,谷氨酰胺组于尾静脉输入谷氨酰胺0.45 g/kg、MSCs移植组于尾静脉输入1 × 1010/L脐血间充质干细胞悬液,联合组尾静脉输入谷氨酰胺0 .45 g/kg + 脐血间充质干细胞悬液1 × 1010/L。通过ELISA法检测各组大鼠血清中肠脂肪酸结合蛋白(IFABP)、白介素-6(IL-6)、超氧化物歧化酶(SOD)的含量;各组于再灌注1 h、3 h后检测肠组织含水率;通过RT-PCR、Western blot观察大鼠肠黏膜上皮细胞caspase-3、NF-kB、Bcl-2在谷氨酰胺联合MSCs移植后的mRNA和蛋白的表达情况。结果 通过荧光示踪法观察到移植的MSCs细胞分布于肠粘膜淋巴组织内和腺上皮细胞间,表明MSCs可能参与了肠缺血再灌注损伤的修复过程。各组大鼠血清中SOD、IFABP、IL-6的含量变化比较,损伤组血清中IFABP、IL-6的含量较对照组显著增加,而谷氨酰胺组,MSCs移植组及联合组与之比较,则显著减少,联合组减少更为明显,损伤组血清中SOD的含量较对照组显著减少,而谷氨酰胺组,MSCs移植组及联合组与之比较,则显著增高,联合组增高更为明显(P<0.05)。再灌注1 h和3 h,损伤组肠组织含水率均明显高于对照组;与损伤组相比,谷氨酰胺组、MSCs移植组及联合组肠组织含水率值均显著降低,联合组降低更为明显,而谷氨酰胺组、MSCs移植组差异无统计学意义(P>0.05)。与对照组比较,损伤组肠黏膜上皮细胞caspase-3、NF-kB的mRNA和蛋白表达明显上调,Bcl-2的mRNA和蛋白表达明显下调(P<0.05),而谷氨酰胺组、MSCs移植组及联合组与之比较,caspase-3、NF-kB的mRNA和蛋白表达明显下调,Bcl-2的mRNA和蛋白表达明显上调(P<0.05),谷氨酰胺组及MSCs移植组之间无统计学差异(P>0.05),但两组与联合组比较,差异明显(P<0.05)。结论 谷氨酰胺组及MSCs移植后,明显减轻了大鼠肠缺血再灌注损伤程度,其可能通过抑制caspase-3、NF-kB表达和促进Bcl-2表达减轻肠黏膜缺血再灌注损伤。
脐血间充质干细胞;谷氨酰胺;移植;大鼠;肠道损伤
缺血再灌注损伤(ischemia-reperfusion injury, IR)是多种原因诱发的器官缺血时引起原有结构破坏,当恢复血液供应时细胞和组织结构遭到损伤并出现功能障碍,使损伤加重的现象[1,2]。小肠是IR最常累及的器官,在临床上是无法避免的病理生理过程,肠系膜动脉取栓术后、溶栓术后、出血性休克、小肠移植术后常会继发性发生,有很高的死亡率,且预后很差[3]。肠IR与其他器官的IR损伤不同,其不仅有氧自由基的生成、免疫细胞应答、炎症因子释放的过程[4],还有缺血缺氧所致的内皮细胞和上皮细胞屏障功能受破坏,进而引起细菌移位,导致全身性的免疫应答和多器官功能障碍[5,6]。
谷氨酰胺(glutamine, Gln)对肠上皮细胞正常作用的发挥起重要作用,是抗氧化防御系统中重要物质谷胱甘肽和核苷酸等合成的前体,在抗氧化应激中对机体起到保护作用[7]。既往研究表明,Gln能够减轻IR损伤,起到保护性作用[8]。
IR损伤目前还没有确切的治疗手段,国际研究热点集中在干细胞移植治疗[9]。干细胞有脐血和骨髓两种来源[10],因自体移植需抽取自体骨髓来进行分离以及培养周期较长,并且得到的数目较少,活性不高,定向迁移以及促进再生的能力均下降,且病人及家属较难接受,所以临床实施有一定的困难[11]。脐血间充质干细胞(human umbilical cord blood mesenchymal stem cells, HUMSCs)从脐血中分离得到,相比于祖细胞更加原始,增殖分化能力更强,无论是在体内还是体外均能多方向分化[12],是目前在脑损伤、肠IR损伤等多种疾病在内的治疗中常用的理想细胞[13-14]。HUMSCs免疫原性极低,一般情况下不会引起免疫反应或者是移植物抗宿主病,因此受到临床工作者的青睐,有望成为理想的取材细胞。本研究联合应用Gln和HUMSCs,观察其对IR的影响。
1 材料和方法
1.1 材料
本实验于2013年3月~2015年10月在河北医科大学动物实验中心完成,实验动物使用许可证号:【SYXK(冀)2011-0005】。80只SD大鼠,体质量220~250 g,由河北医科大学动物实验中心提供,实验动物生产许可证号:【SCXK(冀)2011-0004】。实验中对动物的处置符合动物伦理学要求。CM-DiI(美国Invitrogen公司);谷氨酰胺粉末,纯度99%(美国 Sigma 公司);细胞裂解液和BCA法定量试剂(碧云天生物技术公司);PVDF膜(Millipore公司);anti-NF-kB antibody(Santa Cruz公司);anti-β-actin(福州中彬金桥公司);IFABP检测试剂盒(武汉博士德生物有限公司);总RNA提取试剂TRIzol(美国Invitrogen公司);逆转录试剂盒(TaKaRa公司);Soniprep150型超声波发生器(上海宁商超声仪有限公司);酶联免疫试剂盒(上海恒远生化试剂有限公司)。
1.2 方法
1.2.1 体外复苏并培养脐血间充质干细胞:将冻存管从液氮中取出,迅速放入37℃水浴中解冻,注意避免冻存管顶部沾水而受污染。将细胞加入有培养基的离心管中,1 500 r/min 离心5 min,去掉上清液,接种到新的培养基皿中,置入体积分数为0.05 的CO2培养箱内培养。每3 d半量换液1次,7~10 d传代 1 次。继续观察,待贴壁细胞融合完全后对其进行消化并进行传代,将第2代的细胞分别接种到2个6孔板上,调整细胞密度使其满足1×105孔,当再次融合达80%时,向其中添加诱导剂。倒置相差显微镜下观察细胞生长情况。
1.2.2 大鼠建模及其实验分组: 参加实验80只,进入结果分析75只,中途死亡及其脱落5只。将其75只SD大鼠随机分为正常对照组,缺血再灌注损伤组,谷氨酰胺组,MSCs移植组及联合组每组各15只。对照组采用生理盐水灌肠,损伤组采用TNB (S乙醇稀释)灌肠,在TNBS建模后1h,谷氨酰胺组于尾静脉输入谷氨酰胺0.45 g/kg、MSCs移植组于尾静脉输入1×1010/L 脐血间充质干细胞悬液,联合组尾静脉输入谷氨酰胺0 .45 g/kg+脐血间充质干细胞悬液1×1010/L。
1.2.3 脐血间充质干细胞示踪:利用CM-DiI与HUMSCs结合而将其标记,使其在显微镜下观察时能够表现出红色的荧光而进行跟踪。将等量的CM-DiI与DMSO进行混合并充分溶解后制成原液,随后从中抽取2 μL放到干净的Ep管中,添加DPBS液1 mL制成2 μg/mL的工作液。向上述已制备好的HUMSCs中添加PBS进行浓度的调整,使其满足1 mg/mL,并从中抽取50 μL添加到干净的Ep管中,向其中添加等量的上述配好的工作液,放在培养箱中温育5 min,随后将其放在4℃条件下静置15 min,毕后用PBS进行冲洗。将其放在离心机中,调整参数进行离心,2 h后将其取出丢弃上层液体,用枪头对下层留下的沉淀进行反复吹打,随后将其进行接种及培养。并从中取出少量的细胞行细胞爬片,监测细胞的变化,6 h后将其置于荧光显微镜下对CM-DiI标记的HUMSCs的进行观察,对结果进行拍照。4周后将大鼠处死,同时取肠组织立即以OCT包埋,冰冻切片,直接荧光显微镜下观察,记录和分析CM-DiI荧光分布情况。
1.2.4 ELISA法检测IFABP、IL-6、SOD的含量: 将大鼠麻醉后处死,截取肠管约1 000 mg,将肠系膜以及内含物分离,用生理盐水对其进行冲洗,随后放在-80℃条件下进行保存。在4℃条件下将300 mg的肠组织用生理盐水进行冲洗,随后用滤纸将其表面的水分吸干,将9倍于组织块的生理盐水视为匀浆介质。调整Soniprep150超声波发生器的参数为振幅14 μm,时间30 s,使细胞充分破裂。将组织匀浆中的10%放在低温离心机中,调整其参数,进行离心,将上清液取出并保留。采用ELISA方法测定血清中IFABP、IL-6、SOD的含量。
1.2.5 各组于再灌注1 h、3 h后检测肠组织含水率: 将大鼠处死后进行消毒并剖开腹部取回盲瓣以上肠管3 cm,将其内的内容物以及附于表面的肠系膜丢弃,用生理盐水进行反复冲洗。用吸水纸将附于表面的水分吸取干净,随后将其放在电子分析天平上称量其湿重(W),将其放在80℃的恒温干燥箱中进行烘干,对其进行反复称重直至重量不再变化,再次进行称重,得到干重(D),根据公式[(W - D)/W] × 100%,计算含水率。
1.2.6 通过RT-PCRt检测caspase-3、NF-kB、Bcl-2 mRNA的表达:对总RNA进行提取并转录。β-actin 上游引物:5’-GGGAAATCGTGCGTGACAT-3’,下游引物:5’-TCAGGAGGAGCAATGATCT TG-3’;Casepase-3上游引物:5’-AGATACCGGTGGAGG CTGACT-3’,下游引物:5’-TCTTTCGTGAGCATGG ACACA-3’; NF-kB的上游引物:5’-GCATTCTGAC CTTGCCTATC-3’,下游引物:5’-ATCCTTCCCAAA CTCCACC-3’;Bcl-2 上游引物:5’-CGCTGGGAG AACAGGGTA-3′,下游引物:5’-GGGCTGGGAGG AGAAGAT-3′。加入SYBR Green RCR Master Mix 10 μL,上游引物0.4 μL,下游引物0.4 μL,cDNA 1μL,DEPC H2O 8.2 μL,将上述物质进行混合,随后进行离心,行PCR反应。毕后行溶解曲线分析,根据结果来确定该反应是否特异。应用软件分析得到的结果。

图1A:首次换液后可见部分细胞已贴壁;图1B:第3代MSCs细胞; 图1C:第6代MSCs细胞图1 MSCs细胞的形态观察(×100)Fig. 1A. After the first change of medium, some cells were adherent to the glass surface. Fig. 1B: The 3rd generation of MSCs cells; Figure 1C: The 6th generation of MSCs cellsFig.1 Morphological observation of the MSCs
1.2.7 Western blot检测caspase-3、NF-kB、Bcl-2 蛋白的表达:将大鼠麻醉后,迅速取出包含损伤区域在内的肠组织约10 mm,对其中的总蛋白参照说明书进行提取,随后对蛋白样品浓度进行检测。清洗玻璃板,进行灌胶上样,并进行电泳,将蛋白采用印迹法取 50 μg 总蛋白于 10% 聚丙烯酰胺凝胶中电泳。取纤维膜用半干式电印迹将蛋白进行转膜,37℃温育2 h,加入一抗后过夜,次日洗膜后加入HRP标记的二抗,重复进行上述温育及洗膜处理,用显色剂进行显色。重复以上操作步骤3次。用Quantity One 处理系统进行结果的处理。

2 结果
2.1 MSCs细胞的形态观察
刚接种完毕后对细胞形态进行观察发现其形态不一,差异性较大。进行首次换液后将未贴壁的细胞及杂质去除后可见到部分细胞已贴壁,但形态仍不规则(图1A)。4 d后再次换液可见有小的细胞集落形成,7 d后再次观察可见集落明显增大,并且呈方向性排列,10~12 d后细胞融合度良好,可以进行传代。传代后生长速度明显增快,且形态逐渐趋于一致。第3代时细胞胞质色变浅,核较清晰,胞体以纺锤形和梭形为主,周围可见数量不等的突起,突起间相互交织,细胞排列较紊乱,极性不明显(图1B)。至第6代时,细胞的形态比较无明显变化,但胞体变长变大,形态更加均一,呈方向性排列,极性较一致(图1C)。
2.2 CM-Dil标记的HUMSCs形态观察
HUMSCs能否于肠IR损伤中发挥作用的前提是其能否有效的表达于肠组织中,为了对其进行证明,我们用活细胞染色剂CM-DiI对其进行染色。将活细胞染色剂CM-DiI与HUMSCs共同放置6h后利用荧光显微镜进行观察发现,经CM-DiI标记后的HUMSCs细胞均发出红色荧光(图2A)。将CM-DiI标记的HUMSCs细胞经尾静脉移植入肠IR大鼠后,用荧光显微镜在大鼠肠粘膜的淋巴以及上皮细胞的冰冻切片中可以见到大量的HUMSCs分布,且向损伤区迁移(图2B),提示其可能参与肠IR损伤的修复过程。
2.3 ELISA法检测IFABP、IL-6、SOD的含量
对各组中IFABP、IL-6以及SOD含量进行比较发现,损伤组血清中IFABP以及IL-6的含量较对照组明显增加,而谷氨酰胺组、MSCs移植组以及联合组两者的含量则明显减少,且联合组减少更为显著(P<0.05);对各组中SOD含量进行比较发现,损伤组较对照组明显减少,而其他三组较其则显著增高,且联合组增高更显著(P<0.05)。见表1。2.4 再灌注1 h、3 h后肠组织含水率的检测结果
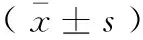
Tab.1 The changes of supernatant IFABP, IL-6, and SOD in the intestinal tissue of various groups

组别Groups人肠脂肪酸结合蛋白(IFABP)(ng/L)白介素-6(IL-6)(ng/L)超氧化物歧化酶(SOD)(ng/L)对照组Control1223.04±76.54a1380.48±131.32a134.09±27.05a损伤组Injury1302.23±136.13b1535.68±104.56b116.88±25.93b谷氨酰胺组Glutamine1033.04±126.24c976.57±114.60c234.66±24.12cMSCs组MSCs1016.17±105.13d957.83±105.06d249.58±23.20d联合组Combination636.78±35.40305.98±29.69420.53±23.20
注:abcdP<0.05。 Note.abcdP<0.05.
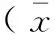
Tab.2 Comparison of the water content in the intestinal tissue of the groups

组别Groups肠组织含水率(%)Watercontentintheintestinaltissue1h3h对照组Control41.52±2.18a45.41±2.24a损伤组Injury84.46±2.66b89.26±2.08b谷氨酰胺组Glutamone64.94±2.11c62.53±2.80cMSCs组MSCs64.68±2.20d62.42±2.67d联合组Combination43.42±2.5645.13±2.23
注:abcdP<0.05。Note.abcdP<0.05。
IR损伤后不同时间点对各组含水率进行比较:损伤组中肠组织的含水率较对照组明显升高,且显著高于其他三组,与联合组相比差异最为显著(均P<0.05);而谷氨酰胺与MSCs组进行比较无意义(P>0.05)。见表2。
2.5 Caspase-3、NF-kB、Bcl-2 mRNA的表达
经PT-PCR对各组mRNA进行测定可知,与对照组相比,损伤组的肠粘膜上皮细胞中caspase-3及NF-kB的mRNA表达量显著上调,而Bcl-2的mRNA的表达量明显下调(P<0.05);而谷氨酰胺、MSCs以及联合组与之相比较,caspase-3、NF-kB明显下调,Bcl-2明显上调,各组间差异有统计学意义 (P<0.05)。如图3。
2.6 Caspase-3、NF-kB、Bcl-2 蛋白的表达
对蛋白的表达情况进行测定发现,损伤组中caspase-3的表达量较对照组显著上调,Bcl-2的表达量明显下调(P<0.05);而谷氨酰胺、MSCs以及联合组与之相比较,caspase-3明显下调,Bcl-2明显上调,差异有统计学意义(P<0.05)(图4)。对各组间总NF-kB进行比较,差异无统计学意义,进一步对各组磷酸化的NF-kB表达水平进行比较,得到与casepase-3一致的结果,即损伤组中磷酸化的NF-kB表达量较对照组显著上调;而谷氨酰胺、MSCs以及联合组与之相比较,磷酸化的NF-kB明显下调,差异有统计学意义(P<0.05)(图5)。

图2A:肠粘膜淋巴组织CM-Dil标记的MSCs;图2B:上皮细胞CM-Dil标记的MSCs图2 CM-DiI标记的MSCs(×200)Fig. 2A: CM-Dil-labeled MSCs in the intestinal lymphoid tissue; Fig. 2B: The epithelial cell CM-Dil-labeled MSCsFig.2 The CM-DiI labeled MSCs

图3 各组Caspase-3、NF-kB、Bcl-2 mRNA表达Fig.3 Expression of caspase-3, NF-kB, and Bcl-2 mRNA in each group

图4 各组caspase-3、NF-kB、Bcl-2 蛋白表达Fig.4 The expression of caspase-3, NF-kB, and Bcl-2 protein in each group

图5 各组NF-kB的表达情况Fig.5 The expression of NF-κB in each group
3 讨论
大量研究表明,肠道可能是对缺血缺氧最敏感的器官之一,在肠绞窄、腹部外伤及肠系膜血管缺血性疾病等情况下,小肠出现不同程度的缺血性损伤,当恢复血流时,其损伤进一步加重[15-18]。因此,研究IR的机制以及如何对其进行预防有重要意义。牛琼等[19]研究表明,在IR中Gln能够保护肠粘膜,但是否和抗氧化应激以及抗炎相关,未见报道。
近年来,人们对肠IR损伤的机制有了更加深入的了解,如氧自由基、促炎细胞介质、黄嘌呤氧化酶的释放等机制均参与肠IR损伤[20]。小肠绒毛中含有大量的活性氧簇相关的酶,当IR时能够激活腺嘌呤-次黄嘌呤途径,增加氧自由基的产生。SOD是氧自由基的去除剂能够反映机体对其的去除能力。而IL-6被认为是IR的主要致病因子。本研究通过对SOD及IL-6进行检测发现,机体损伤后SOD表达减少,而IL-6表达增加,与以往研究一致[21]。IFABP亦是肠IR损伤的指标之一。本研究发现,损伤组IFABP表达量明显增加,与既往[22]的研究结论相同。
细胞凋亡是IR过程中的关键一环。通过对肠组织中凋亡相关蛋白进行检测,能够反映大鼠IR损伤后肠道的变化情况。其通过激活casepase最终诱导凋亡的发生。Bcl-2是抗凋亡因子中的一员[23,24]。而NF-kB能够上体炎症及免疫因子的表达,诱发炎症反应、细胞凋亡,最终导致脏器的损伤[25]。本研究通过对其进行检测发现,IR后casepase以及NF-kB表达增加,而Bcl-2减少。
总之,通过本研究发现,大鼠肠IR损伤后进行谷氨酰胺联合HUMSCs移植,能够改善损伤,对肠道起到保护性作用。其可能的机制是减少casepase-3、NF-kB并促进Bcl-2表达来实现。
[1] Tian S, Guo R, Kong Y, et al. Curcumin protects against intestinal ischemia-reperfusion injury: involvement of the tight junction protein ZO-1 and TNF-a related mechanism [J]. Korean J Pharmacol, 2016, 20(2): 147-152.
[2] 王爱丽, 牛琼, 史宁, 等. 谷氨酰胺对大鼠肠缺血再灌注损伤后闭合蛋白的保护作用 [J]. 中国病理生理杂志, 2015, 31(2): 364-368.
[3] 董建新, 杨牟, 张居文, 等. 线粒体通透性转换孔在缺血后适应减轻兔肠缺血再灌注损伤中的作用 [J]. 中华实验外科杂志, 2015, 32(2): 327-329.
[4] Stringa P, Lausada N, Romanin D, et al. Pretreatment combination reduces remote organ damage secondary to intestinal reperfusion injury in mice: follow-up study [J].Transplant Proc, 2016, 48(1): 210-216.
[5] 喻苗, 金镭, 吕艳锋, 等. 天然虾青素对大鼠肠缺血再灌注损伤的保护作用 [J]. 中国现代普通外科进展, 2015, 18(8): 589-592.
[6] 段常鹏, 解雅英, 于建设. 右美托咪定与异丙酚对大鼠肠缺血再灌注损伤影响的比较 [J]. 中华麻醉学杂志, 2015, 35(7): 837-839.
[7] 马春燕, 王爱丽, 王爱娜, 等. 谷氨酰胺对大鼠肠缺血再灌注损伤后ZO-1的作用及其机制研究 [J]. 中华临床医师杂志(电子版), 2015, 9(9): 1644-1648.
[8] Peng Z, Ban K, Wawrose RA, et al. Protection by enteral glutamine is mediated by intestinal epithelial cell peroxisome proliferator-activated receptor-γ during intestinal ischemia/reperfusion [J]. Shock, 2015, 43(4): 327-333.
[9] Seo JH, Cho SR. Neurorestoration induced by mesenchymal stem cells: potential therapeutic mechanisms for clinical trials [J]. Yonsei Med J, 2012, 53(6): 1059-1067.
[10] 邱振宇, 周盾, 孙洞箫, 等. 脐血间充质干细胞治疗大鼠肾缺血再灌注损伤的效果及机制探讨 [J]. 山东医药, 2012, 52(6): 32-33.
[11] Fang B, Wang H, Sun XJ, et al. Intrathecal transplantation of bone marrow stromal cells attenuates blood-spinal cord barrier disruption induced by spinal cord ischemia-reperfusion injury in rabbits [J]. J Vasc Surg, 2013, 58(4): 1043-1052.
[12] Shao H, Xu Q, Wu Q, et al. Defective CXCR4 expression in aged bone marrow cells impairs vascular regeneration [J]. J Cell Mol Med, 2011, 15(10): 2046-2056.
[13] Shao P, Tang L, Li P, et al. Application of a vasculature model and standardization of the renal hilar approach in laparoscopic partial nephrectomy for precise segmental artery clamping [J]. Eur Urol, 2013, 63(6): 1072-1081.
[14] Luo F, Lv Q, Zhao Y, et al. Quantification and purification of mangiferin from Chinese Mango (Mangifera indica L.) cultivars and its protective effect on human umbilical vein endothelial cells under H2O2-induced stress [J]. Int J Mol Sci, 2012, 13(9): 11260-11274.
[15] 徐超, 孟庆祥, 许可, 等. 右美托咪定联合维生素C对小鼠小肠缺血再灌注损伤的保护 [J]. 徐州医学院学报, 2015, 35(7): 460-463.
[16] 李为明, 徐鹏远, 岑云云, 等. 远隔缺血后适应对大鼠小肠缺血再灌注损伤的保护作用 [J]. 华中科技大学学报(医学版), 2015, 44(5): 549-551.
[17] 王震东. 肠缺血再灌注损伤对Rho激酶影响及法舒地尔保护研究 [J]. 心理医生, 2015, 21(8): 52-53.
[18] Sarsu SB, Ozokutan BH, Tarakcioqlu M, et al. Effects of leptin on intestinal ischemia-reperfusion injury [J]. Indian J Surg, 2015, 77(2): 351-355.
[19] 牛琼, 王爱丽, 王伟, 等. 谷氨酰胺预处理对大鼠肠缺血再灌注损伤的保护作用及其对eNOS-NO通路的影响 [J]. 天津医药, 2015, 43(3): 252-255.
[20] Akinrinmade FJ, Akinrinde AS, Sovemi OO, et al. Antioxidant potential of the methanol extract of Parquetina nigrescens mediates protection against intestinal ischemia-reperfusion injury in rats [J]. J Diet Suppl, 2016, 13(4): 420-432.
[21] Zhao W, Gan X, Su G, et al. The interaction between oxidative stress and mast cell activation plays a role in acute lung injuries induced by intestinal ischemia reperfusion [J]. J Surg Res, 2014, 187(2): 542-552.
[22] 曹志新, 刘斌, 赵德银. 前列腺素E1预处理对大鼠SMA急性缺血再灌注损伤保护的研究 [J]. 安徽医科大学学报, 2015, 50(10): 1409-1412.
[23] Woodruff TM, Wu MC, Morgan M, et al. EPHA4-FC treatment reduces ischemia/reperfusion-induced intestinal injury by inhibiting vascular permeability [J]. Shock, 2016, 45(2): 184-191.
[24] 范玲玲, 侯明星, 陈冬梅, 等. 乌司他丁对肠缺血再灌注损伤大鼠小肠细胞凋亡的影响 [J]. 山东医药, 2015, 55(5): 28-29.
[25] Yuan DD, Chi XJ, Jin Y, et al. Intestinal injury following liver transplantation was mediated by TLR4/NF-kB activation-induced cell apoptosis [J]. Mol Med Rep, 2016, 13(2): 1525-1532.
Effects of glutamine in combination with umbilical cord blood mesenchymal stem cell transplantation on intestinal ischemia reperfusion injury in rats
WANG Bing-jie1, HU Yan-wei2, ZHAO Ye-fang3, ZHANG Shi-dong4
(1.Department of Anorectal Surgery, 2,4. Department of General Surgery,3. Department of Obstetrics and Gynecology, Hebei Medical University Xingtai City People’s Hospital, Xingtai Hebei 054001, China)
Objective To investigate the effect of glutamine in combination with umbilical cord blood mesenchymal stem cells (MSCs) transplantation on intestinal ischemia-reperfusion injury in rats. Methods Umbilical cord blood mesenchymal stem cells were isolated, and were labeled with CM-DiI fluorescent dye. Eighty Sprague-Dawley rats were randomly divided into normal control group, ischemia reperfusion injury group, glutamine group, MSCs transplantation group and combined group with 15 rats in each group. The control group received saline enema. The injury group was treated with TNBS (ethanol dilution) enema. The glutamine group at 1 h after TNBS received intravenous injection of 0.45 g/kg glutamine. The rats of MSCs transplantation group had tail vein injection of 1 ×1010/L umbilical cord blood mesenchymal stem cell suspension, and the combined group received intravenous injection of glutamine 0.45 g/kg and 1×1010/L umbilical cord blood mesenchymal stem cell suspension. ELISA was used to detect the midgut fatty acid binding protein (iFABP), interleukin 6 (IL-6), and superoxide dismutase (SOD) content in the rat serum. The water content of intestinal tissue was detected at 1 h and 3 h after reperfusion in each group. The expressions of NF-kB, Bcl-2 and caspase-3 mRNA and proteins in the rat intestinal epithelial cells after treated with glutamine in combination with MSCs were detected by RT-PCR and Western blot assays. Results The fluorescent tracer method revealed that the transplanted MSCs cells were distributed in the intestinal mucosal lymphoid tissues and glandular epithelial cells, indicating that MSCs might be involved in the repair process of intestinal ischemia-reperfusion injury. The content of serum IFABP and IL-6 in the injured group was significantly higher than that in the control group, while significantly reduced in the glutamine group, MSCs transplantation group and combined group, with the most obvious in the combined group. The content of SOD in the injury group was significantly lower than that in the control group, and significantly increased than that in the glutamine group, MSCs transplantation group, with the most striking in the combined group (P<0.05 for all). The water content of intestinal tissue in the injury group at 1 and 3 hours after reperfusion was significantly higher than that in the control group, significantly lower in the glutamine group, MSCs transplantation group and the combined group, with the most decreased in the combination group, and there was no significant difference between the glutamine group and MSCs transplantation group (P>0.05). Compared with the control group, the caspase-3 and NF-kB mRNA and protein expressions in the intestinal mucosal epithelial cells of the injury group were significantly increased, and the expressions of Bcl-2 mRNA and protein were significantly reduced (P<0.05), the expressions of caspase-3 and NF-kB mRNA and protein were significantly reduced in the glutamine group, MSCs transplantation group and combined group. The expressions of Bcl-2 mRNA and protein were significantly increased (P<0.05), while no significant difference was shown between the glutamine group and MSCs transplantation group (P>0.05), but there was a significant difference between these two groups and the combined group (P<0.05). Conclusions After treated with glutamine and MSCs transplantation, the degree of intestinal ischemia reperfusion injury is obviously reduced in rats. It may be mediated through inhibiting the expression of caspase-3 and NF-kB and promoting the expression of Bcl-2.
Umbilical cord blood mesenchymal stem cells; Glutamine; Transplantation; Rat; Intestinal ischemia reperfusion injury; Rat
王炳杰(1978-),主治医师,研究方向:普外,肛肠。
R-33
A
1671-7856(2016)10-0025-07
10.3969.j.issn.1671-7856. 2016.10.006
2016-06-15
