识图像想原理找联系
2016-11-29陈世华
陈世华
电离平衡图像问题是电解质溶液相关题型中的重点和难点,也是高考命题的热点。突破图像问题要按以下三步走:识图像、想原理、找联系。识图像,是指识别图中坐标的含义,包括原点、起点、拐点、终点的含义,数据与数量级、曲线和平台的含义等。想原理,是指找到电离平衡图像涉及的原理,影响平衡移动的因素。找联系,是指将图像与原理联系起来分析题设问题,做出正确的判断。以下从五种电解质平衡图像进行分析。
一、水的电离平衡
【突破技巧】突破水的电离平衡图像问题要抓住以下几点:(1)水的电离是吸热的,温度升高时,水的电离平衡常数会增大;(2)不论在中性溶液中还是在酸碱溶液中,水电离的c(H+)、c(OH-)是相等的,水的离子积只与温度有关,与溶液酸碱性变化无关;(3)水的离子积和水电离的c(H+)、c(OH-)既有区别,也有联系,在纯水中,水的离子积等于水电离的c(H+)、c(OH-)的乘积,在酸性或碱性溶液中,水的离子积是溶液中c(H+)、c(OH-)的乘积,而水电离的c(H+)、c(OH-)与水电离平衡的移动方向有关。
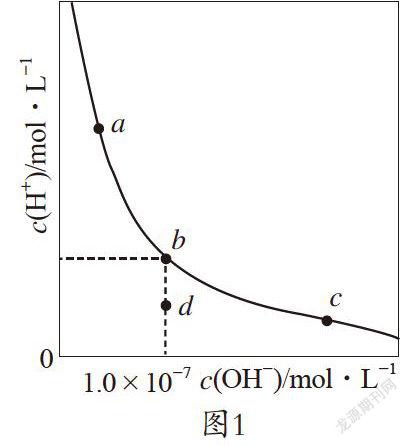
【例1】一定温度下,水溶液中H+和OH-的浓度变化曲线如图1。下列说法正确的是( )
A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为1.0×10-13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
【答案】C

【解析】本题考查水的电离平衡图像与影响水电离平衡移动的因素,涉及温度、浓度对水电离平衡的影响,意在考查识图能力和综合推理能力。水的电离方程式为H2OH++OH-,升高温度,c(H+)和c(OH-)都增大,c点向曲线右上方迁移,A项错误。该图像中b点表示该温度下水的平衡状态,故KW=c(H+)·c(OH-)=1×10-14,B项错误。氯化铁在水中水解生成氢氧化铁,使溶液呈酸性,引起由b向a的变化,C项正确。温度一定,水的离子积不变,在c点溶液呈碱性,加水稀释后溶液的碱性逐渐减弱,c(OH-)减小,c(H+)增大,c点沿曲线向b点迁移,D项错误。
【方法点拨】该图像表示一定温度下溶液中c(H+)、c(OH-)的关系,温度不变,水的离子积不变。a点表示酸性溶液,b点表示中性溶液,c点表示碱性溶液。
二、弱电解质稀释
【突破技巧】从以下几点突破弱电解质稀释图像问题:(1)弱电解质只有部分电离,弱电解质溶液中有大量弱电解质分子存在;(2)稀释过程中,温度不变,则电离常数不变,但是弱电解质浓度越小,其电离度越大,离子浓度越小;(3)大多数弱电解质电离是吸热的(常见弱电解质中,只有HF电离是放热的,分析温度对弱电解质电离的影响时要注意),升高温度时弱电解质电离程度增大,解题时一般不考虑溶液体积的变化,也不考虑弱电解质挥发问题;(4)弱电解质电离程度很小;(5)稀释相同的倍数时,弱电解质越弱,则其离子浓度变化越小(或者说稀释相同的倍数时,强电解质溶液的离子浓度变化较大,而弱电解质溶液中离子浓度变化较小)。
【例2】(2015年全国新课标I卷13题)浓度均为0.10 mol·L-1、体积均为V0的MOH溶液和ROH溶液,分别加水稀释至体积V,pH随lg的变化如图2所示。下列
叙述错误的是( )
A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当lg=2时,若两溶液同时升高温度,则增大
【答案】D
【解析】本题考查强碱、弱碱稀释的图像问题,以及考生的识图能力和数形结合能力。加水稀释之前,MOH溶液的pH=13,说明MOH完全电离,它是强碱,同理,类推ROH是弱碱,A项正确。相同温度下,b点加入水较多,加水越多,ROH溶液越稀,ROH的電离程度越大,B项正确。溶液无限稀释后相当于纯水,呈中性,C项正确。ROH是弱碱,ROH溶液中存在大量ROH分子,升高温度促进ROH电离,溶液中c(R+)增大,而MOH是强碱,升高温度时c(M+)不变,故减小,D项错误。
【思维引申】MOH、ROH溶液经无限稀释后呈中性,但是无论怎么稀释,溶液都不会呈酸性。当弱碱电离出来的离子浓度很小时,水的电离起主要作用。
三、酸碱中和滴定
【突破技巧】 从以下角度突破酸碱中和滴定的图像问题:(1)注意滴定前酸、碱溶液的物质的量浓度、pH、溶液体积等数据;(2)注意水的离子积常数与温度的关系;(3)从酸、碱的电离程度确定电解质的强弱;(4)区别滴定终点和中性点,滴定终点指酸和碱恰好完全反应时对应的点,而中性点指溶液呈中性时对应的点;(5)分析电解质溶液中的离子浓度大小要运用“三守恒”原则,即电荷守恒、物料守恒和质子守恒;(6)联系电离度计算溶液pH,以及根据酸和碱的性质选择指示剂。

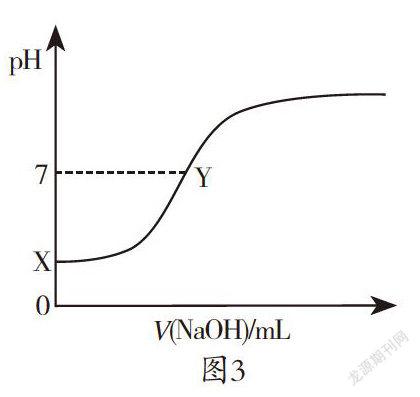
【例3】298 K时,向20mL 0.1 mol·L-1CH3COOH溶液中滴加0.1mol·L-1NaOH溶液,溶液的pH与滴加NaOH溶液的体积V之间关系如图3所示。已知0.1mol·L-1CH3COOH溶液的电离度为1.32%。下列说法正确的是( )
A. 起始醋酸溶液在X点的pH=1
B. 开始至V=40mL过程中,水的电离度逐渐增大
C. 该酸碱中和滴定实验,可选择酚酞作指示剂
D. 滴定过程中都存在
【答案】C
【解析】本题考查电离度与pH、弱酸与强碱反应的图像问题,意在考查综合分析能力和识图能力。 c(H+)=0.1mol·L-1×1.32%=1.32×10-3mol·L-1,pH= 3-lg1.32> 2,A项错误。当醋酸完全中和时,再加入氢氧化钠溶液,水的电离度减小,B项错误。滴定终点时生成醋酸钠,溶液呈弱碱性,故用酚酞作指示剂,C项正确。在醋酸和氢氧化钠的混合液中都存在电荷守恒,c(Na+)+c(H+)=c(OH-) + c(CH3COO-),只在Y点存在物料守恒,c(Na+)=c(CH3COOH)+c(CH3COO-),只有Y点对应的溶液中存在c(OH-)=c(H+)+c(CH3COOH),D项错误。
【易错警示】对于强酸强碱中和滴定,选择甲基橙或酚酞作指示剂;对于强酸弱碱中和滴定选择甲基橙作指示剂;对于强碱弱酸中和滴定,选择酚酞作指示剂。
四、难溶电解质
【突破技巧】难溶电解质图像问题可以从以下角度突破:(1)难溶电解质电离是吸热反应,升高温度,促进难溶电解质溶解;(2)难溶电解质电离平衡移动原理类似化学平衡移动原理,主要受温度、浓度影响;(3)图像中离子浓度与溶度积常数有关;(4)溶度积常数只与温度有关,温度不变,平衡移动不会改变溶度积常数;(5)判断外界条件的改变对离子浓度的影响时,要联系溶度积表达式、溶解平衡式等。
【例4】已知:298 K时,Ksp(MnS)=4.65×10-14,Ksp(MnCO3)=2.24×10-11。298K下,MnS、MnCO3在水中溶解曲线如图4所示。下列说法正确的是( )
A. 图像中a点处溶液c(Mn2+)≈5.0×10-6
B. 其他条件不变,加热含固体的溶液可使e點升到f点
C. 常温下,加水稀释X溶液可使d点到f点
D. 在MnS和MnCO3饱和溶液中加少量MnCl2, 增大
【答案】B
【解析】本题考查难溶电解质溶度积图像及溶解平衡原理的应用。根据硫化锰、碳酸锰的溶度积常数值知,X代表碳酸锰,Y代表硫化锰。图像中a点处溶液中的c(Mn2+)≈2.0×10-7,A项错误。加热含硫化锰固体的溶液,硫化锰溶解度增大、溶度积常数增大,B项正确。加水稀释X溶液,阴、阳离子浓度都会减小,C项错误。在硫化锰、碳酸锰的饱和溶液中加入氯化锰,溶度积不变,阴离子浓度之比值保持不变,D项错误。
【方法点拨】(1)对于极稀溶液,两种稀溶液混合的总体积近似等于两种溶液体积之和;(2)改变温度,一般不考虑稀溶液体积的变化;(3)大多数难溶电解质电离是吸热的,只有少数难溶物溶解时放热,例如氢氧化钙溶于水放热Ca(OH)2(s) Ca2+(aq)+2OH-(aq)△H<0,这就解释了“升高温度,氢氧化钙的溶解度减小”;(4)溶度积只是温度函数,温度不变,溶度积不变,即一种离子浓度增大,另一种离子浓度必减小;(5)两种难溶物转化,平衡常数可由溶度积计算得出,以分别代表相同温度下两种溶度积不同的难溶电解质的溶解曲线,也可以代表一种难溶电解质在两种不同温度下的溶度积曲线。
五、酸式盐和酸与碱反应
【突破技巧】有关化学反应与溶液导电性的图像问题,要抓住化学反应过程与离子浓度之间的关系,分段分析化学反应及溶液中离子浓度的情况。例如,在反应的不同阶段,写出化学方程式和离子方程式,可以看出离子浓度的变化情况,从而判断溶液导电性的变化趋势。
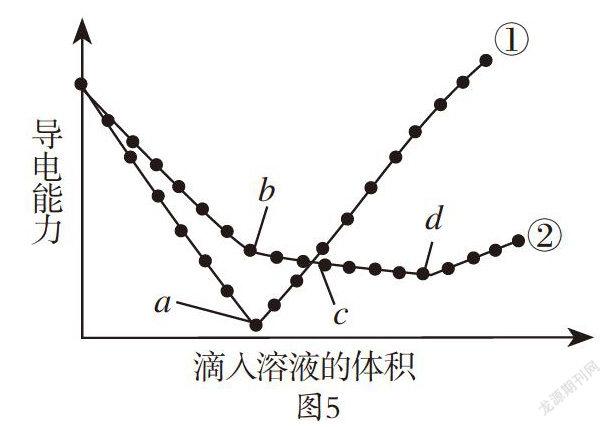
【例5】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图5所示。下列分析不正确的是( )
A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH-
C. c点,两溶液中含有相同量的OH-
D. a、d两点对应的溶液均显中性
【答案】C
【解析】本题考查酸碱溶液混合时对溶液的酸碱性以及导电性的判断。硫酸与氢氧化钡反应的化学方程式为H2SO4+Ba(OH)2=BaSO4↓+2H2O;硫酸氢钠与氢氧化钡反应的化学方程式为Ba(OH)2 + NaHSO4= BaSO4↓+ NaOH + H2O,NaOH + NaHSO4=Na2SO4 + H2O。当硫酸和氢氧化钡恰好完全反应时,离子浓度最小,导电性接近于0,①曲线代表硫酸与氢氧化钡反应,A项正确。b点表示加入硫酸氢钠恰好完成反应第一阶段,溶液中含有氢氧化钠,B项正确。在c点曲线①代表溶液中含有硫酸,曲线②代表溶液中含有氢氧化钠和硫酸钠,因为硫酸根离子浓度相等,②中的钠离子浓度大于①中氢离子浓度,所以溶液中氢氧根离子浓度不相同,C项错误。a点表示钡离子和硫酸根离子完全沉淀,d点溶液中只有硫酸钠溶液,溶液都显中性,D项正确。
【方法点拨】在氢氧化钡溶液中滴加少量硫酸氢钠溶液,离子反应为Ba2++H++SO42-+OH-= BaSO4↓+ H2O;在硫酸氢钠溶液中滴加少量氢氧化钡溶液,离子反应为Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O。
综上所述,分析电解质图像问题时,应该要抓住原理,如电离平衡、盐类水解平衡、难溶电解质溶解平衡等,联系外界条件对离子浓度的影响综合判断。
