盐胁迫下外源Si对甘草种子萌发及幼苗K+、Na+含量的影响
2016-11-28崔佳佳张新慧张恩和
崔佳佳,张新慧,张恩和
(1.甘肃农业大学 农学院,甘肃 兰州 730070; 2.宁夏医科大学 药学院,宁夏 银川 750004; 3.宁夏回药现代化工程技术研究中心,宁夏 银川 750004; 4.宁夏回医药协同创新中心,宁夏 银川 750004;5.宁夏医科大学 回医药现代化省部共建教育部重点实验室,宁夏 银川 750004)
盐胁迫下外源Si对甘草种子萌发及幼苗K+、Na+含量的影响
崔佳佳1,张新慧2,3,4,5,张恩和1
(1.甘肃农业大学 农学院,甘肃 兰州 730070; 2.宁夏医科大学 药学院,宁夏 银川 750004; 3.宁夏回药现代化工程技术研究中心,宁夏 银川 750004; 4.宁夏回医药协同创新中心,宁夏 银川 750004;5.宁夏医科大学 回医药现代化省部共建教育部重点实验室,宁夏 银川 750004)
以乌拉尔甘草(Glycyrrhizauralensis)种子为试验材料,研究在NaCl(100和200 mmol/L)胁迫下,不同浓度Si(0、0.4、0.8、1.2、1.6和 2.0 mmol/L)对种子萌发及幼苗根冠比和K+、Na+含量的影响。结果表明:外源Si对盐胁迫下种子的发芽率、发芽势和发芽指数均具有显著的促进作用,且Si浓度在0.4和2.0 mmol/L下作用最佳;Si可显著增加幼苗的根冠比,幼苗可通过增加K+吸收,减少Na+吸收来维持根系内K+、Na+的平衡。
甘草;盐胁迫;Si;种子发芽;K+、Na+
甘草(Glycyrrhizauralensis)是多年生豆科草本植物,主要以干燥的根及根状茎入药,性平、味甘,具有润肺、清热解毒、调和诸药等功效[1]。甘草地下根和根茎发达,具有较强的抗旱、抗寒、耐盐碱和防风固沙能力[2]。近年来,甘草作为药材、食品和烟草添加剂等被广泛应用,加之野生甘草资源被当地农民过度采挖,使野生甘草资源供不应求[3]。自然条件下甘草种子萌发率较低(低于20%),生长周期较长(长于3年),主要分布于西北、华北、东北和沿海等盐渍化区域。虽然野生甘草具有一定的耐盐性且对盐渍环境有一定的修复作用,但是近年来大量研究发现高盐不利于栽培甘草生长,导致产量和质量急剧下降,无法满足市场需求[4]。因此,如何提高甘草种子抗盐能力、发芽率、产量和质量成为盐碱化地区甘草生产和可持续发展的核心问题。植物对NaCl的盐害非常敏感,植物体内Na+含量过高会导致细胞膜功能发生变化、渗透性增加和K+外渗,使细胞中离子和可溶性物质失去平衡,引起植物营养缺乏,生长异常[5]。Na+和K+存在拮抗关系,Na+抑制植物对K+的吸收,使植物受到Na+毒害的同时面临K+的亏缺,从而抑制植物对水分和养分吸收,不利于植物种子萌发或延迟其发芽[6]。由此可见,盐胁迫下植物对Na+和K+选择性吸收程度可反映其抗盐能力强弱。
Si是植物生长发育的有益元素和环境友好型元素[7]。大量研究表明,Si不仅能促进植物生长发育,还可以降低盐分胁迫对植物体的伤害[8-9],提高作物的抗盐性。在野大豆(Glycinesoja)、麻疯树(Jatrophacuicas)种子萌发过程中[10-11],Si可以降低高浓度盐对种子萌发的抑制,缓解高浓度盐对幼苗生长的胁迫[9]。增施可溶性Si可提高水稻(Sativaoryza),黄瓜(Cucumissativus),甜瓜(Cucumismelo)和玉米(Zeamays)等植物的耐盐性[12-15]。
研究发现Si直接参与甘草种子萌发和幼苗生长的生理生化过程,且较低浓度的外源Si对甘草盐害有一定的缓解作用[16]。因此,为了确定Si促进NaCl胁迫下甘草种子萌发的适宜浓度,试验在前期研究基础上,以发芽的乌拉尔甘草种子为对象,研究不同浓度Si对NaCl胁迫下甘草种子发芽参数和幼苗Na+、K+含量的影响,旨在探讨Si对盐胁迫条件下甘草种子萌发特性及甘草幼苗对Na+、K+吸收的影响,筛选出不同程度盐胁迫下利于甘草种子萌发的最佳Si处理浓度,为科学合理的应用Si缓解甘草盐胁迫、提高其综合效益提供理论依据。
1 材料和方法
1.1 供试材料及试验区概况
乌拉尔甘草种子,由宁夏医科大学药学院张新慧副教授鉴定。种子于2012年在盐池县野生甘草分布区王乐井乡狼洞沟采种基地(N 37°16′,E 106°32′)采收,收获并净种后,将种子装入牛皮纸袋放置冰箱冷藏室4℃贮藏,于2013年8月开始试验。
1.2 种子预处理
甘草种子种皮较厚而抑制发芽,导致甘草种子自然萌发率为10%~20%[17]。为了提高种子萌发率,在播种前通常对甘草种子进行预处理(种皮打磨或酸处理)[18]。选取甘草种子籽粒饱满、大小一致,用85%的浓H2SO4处理45 min(打破因种皮抑制而导致的种子休眠)后,用无菌水冲洗3遍,再用0.1%的H2O2消毒10 min,最后用无菌水冲洗,置于玻璃杯中用无菌水浸泡8 h后待用[18]。
1.3 试验处理盐浓度的确定
前期预试验采用不同浓度NaCl处理甘草种子,通过与对照比较,结合甘草实际的分布区域,试验设置2个NaCl浓度;100 mmol/L(Na1,对植株造成伤害)和200 mmol/L(Na2,植株伤害严重但能存活)2个盐分处理。
1.4 试验方法
试验采用NaCl单盐胁迫,设置2个浓度梯度:Na1=100 mmol/L(轻度胁迫)和Na2=200 mmol/L(重度胁迫)。Si处理通过外源添加K2SiO3,浓度分别为0(Si0)、 0.4(Si1)、0.8(Si2)、1.2(Si3)、1.6(Si4)、2.0 mmol/L(Si5)6个梯度,试验中因加入K2SiO3引入了K+,用KCl来维持K+浓度的一致性,防止由于K+浓度差异导致种子渗透压出现差异,在Cl-浓度较低时,其对植物的营养效应可以忽略[19]。采用培养皿纸上发芽法,用无菌滤纸吸去种子表皮多余水分,均匀摆放在铺有2层无菌滤纸(用K2SiO3和KCl混合溶液浸湿)的培养皿中,每皿81粒,每处理3个重复,称量培养皿重量后置于恒温(25℃)人工气候培养箱中黑暗培养。为避免由于水分蒸发导致的盐分在滤纸表面积累,每天早晚(早上10∶00点,下午16∶00)定量加入无菌水至恒重,以保证各处理中NaCl及Si浓度一致。24 h后开始统计发芽种子数,以胚根露出种子长度的1/2为发芽标志,种子连续5 d不再发芽确定为发芽结束。最后计算、测定指标[17-18]。
(1)种子发芽率(%)=发芽终期全部正常发芽粒数/供试种子数×100%。
(2)发芽势(%)=7 d内发芽种子总数(规定日期内)/供试种子总数×100%。
(3)发芽指数GI=ΣGt/Dt。
式中:Gt为在t日的发芽率,Dt为相应的发芽日数。发芽指数反映种子在整个发芽期的综合活力。
种子发芽结束后测定不同处理下胚根,胚芽和总干重,计算根冠比。Na+和K+含量测定采用火焰光度法[20]。
1.5 数据统计方法
试验数据采用SPSS 11.5软件进行方差分析、相关性分析和显著性检验,方差分析多重比较用Duncan法(P<0.05),各图表中的数据均为3次重复平均值±标准误。
2 结果与分析
2.1 Si对不同浓度NaCl胁迫下甘草种子发芽率、发芽势和发芽指数的影响
试验表明,Si对不同浓度盐胁迫下甘草种子发芽率的效应基本相同。Na1(100 mmol/L)和Na2(200 mmol/L)盐胁迫下,不同浓度的外源Si显著提高甘草种子的发芽率,当外源Si浓度为0.8 mmol/L(Si2)和2.0 mmol/L(Si5)时,促进作用最显著。在Na1胁迫下,Si5(2.0 mmol/L)处理甘草种子发芽率达到100%。在Na2胁迫下,Si2(0.8 mmol/L)和Si5(2.0 mmol/L)处理发芽率均达到100 %(图1)。
Si对不同程度盐胁迫下甘草种子发芽势和发芽指数均有明显的促进作用(图2,3),但作用大小因盐胁迫程度和Si浓度而异。与Si0(0 mmol/L)相比,Na1胁迫下,Si1、Si2、Si4和Si5处理的发芽势和发芽率均显著提高,且在Si浓度为0.8和2.0 mmol/L时促进作用最显著;Na2胁迫下,各浓度Si处理均显著提高其发芽势和发芽指数,其中Si浓度为0.8和2.0 mmol/L时促进作用最明显。
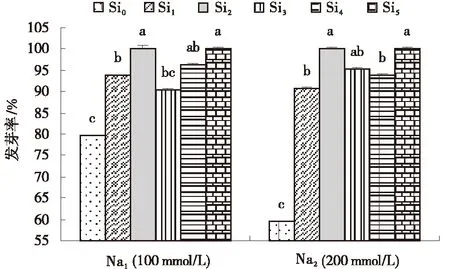
图1 Si对不同浓度NaCl胁迫下甘草种子发芽率Fig.1 Effects of exogenous Si on germination rate of seeds treated with 100 mmol/L and 200 mmol/L NaCl注:不同小写字母表示同一盐浓度下不同Si浓度处理间差异显著(P<0.05),下同

图2 Si对不同浓度NaCl胁迫下甘草种子发芽势Fig.2 Effects of exogenous Si on germination potential of seeds treated with 100 mmol/L and 200 mmol/L NaCl
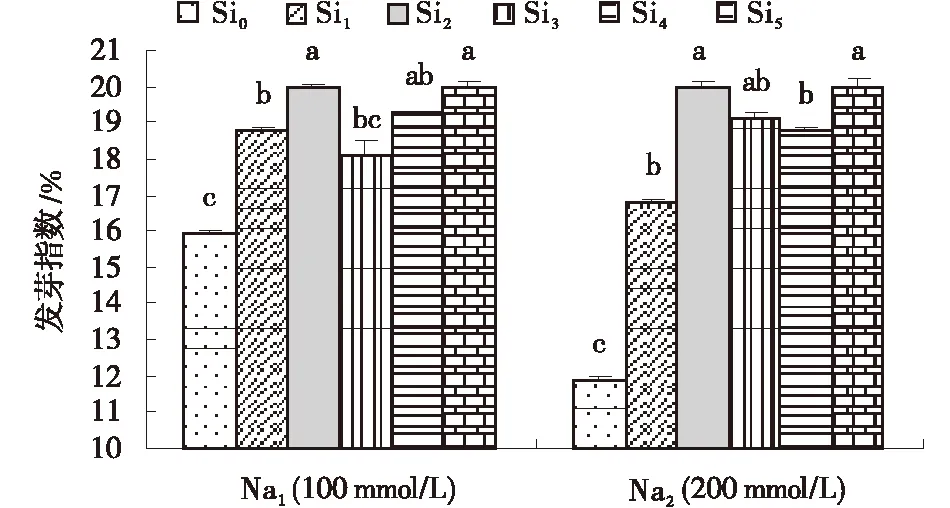
图3 Si对不同浓度NaCl胁迫下甘草种子发芽指数Fig.3 Effects of exogenous Si on germination index of seeds treated with 100 mmol/L and 200 mmol/L NaCl
2.2 Si对不同浓度NaCl胁迫下甘草幼苗根冠比
Na1胁迫下,甘草幼苗根冠比随着Si浓度的增加呈现逐渐上升的趋势,各浓度下甘草幼苗根冠比均显著高于Si0,且Si3、Si4和Si5高于Si2和Si1,差异显著。Si5、Si4和 Si3处理之间、Si2和Si1处理之间无显著差异。Na2胁迫下,Si1、Si2和Si4处理的甘草幼苗根冠比显著高于Si3和Si5处理,各浓度Si处理下根冠比显著高于Si0(图4)。

图4 Si对不同浓度NaCl胁迫下甘草幼苗根冠比Fig.4 Effects of exogenous Si on root-shoot ratio of seedlings treated with 100 mmol/L and 200 mmol/L NaCl
2.3 Si对不同浓度NaCl胁迫下甘草幼苗不同部位K+、Na+的含量
在不同NaCl浓度胁迫下,甘草幼苗芽和根部的K+含量均随着NaCl浓度的增加而降低;在同一NaCl浓度胁迫下,芽和根部的K+含量随着Si浓度的增加均呈现上升趋势。Na1胁迫下,芽中K+含量在Si4和Si5处理下达到最高值,为14.0和14.1 mmol/L;根部K+含量在Si2和Si5处理下达到最高值,分别为18.1和18.2 mmol/L。Na2胁迫下,甘草幼苗中K+含量在Si0理下达到最大,较Si0增加24.1%;甘草根部K+含量在Si4处理下显著高于其他处理,较Si0增加20.7%(图5)。
在2种浓度NaCl胁迫下,甘草幼苗芽和根部的Na+含量均随着NaCl浓度的增加而增加,随着Si处理浓度的增加芽和根部的Na+含量均呈现下降趋势,且甘草芽中的Na+含量明显高于根部。在Na1和Na2胁迫下,甘草幼苗芽中的Na+含量在Si5处理下达到最低值,分别为14.4 和19.2 mg/g;甘草根部Na+含量在Si4处理下最低,分别为0.68和0.81 mg/g(图6)。
2.4 Si对不同浓度NaCl胁迫下甘草幼苗芽和根K+/Na+的影响
随着NaCl浓度的升高,甘草幼苗芽中K+/Na+明显降低,而且,添加Si显著增加了甘草幼苗芽中K+/Na+,且随Si浓度的增加而增加。本试验甘草根部K+/Na+随着NaCl浓度的增加而降低,添加Si显
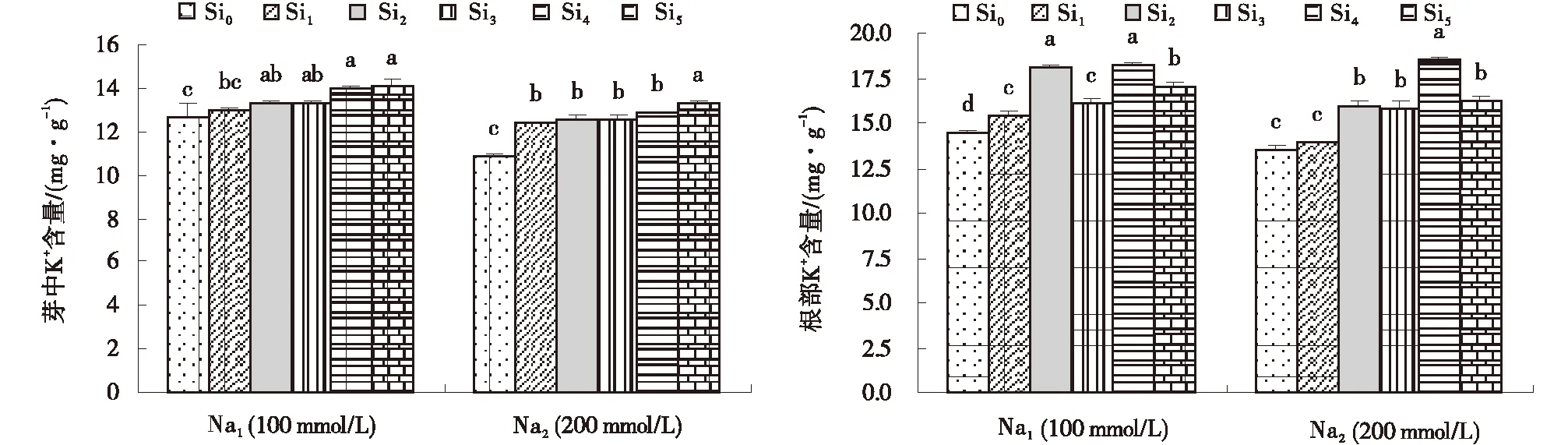
图5 Si对不同浓度NaCl胁迫下甘草幼苗根和芽中K+的含量Fig.5 Effects of exogenous Si on K+ concentrations of root and bud of seedlings treated with 100 mmol/L and 200 mmol/L NaCl
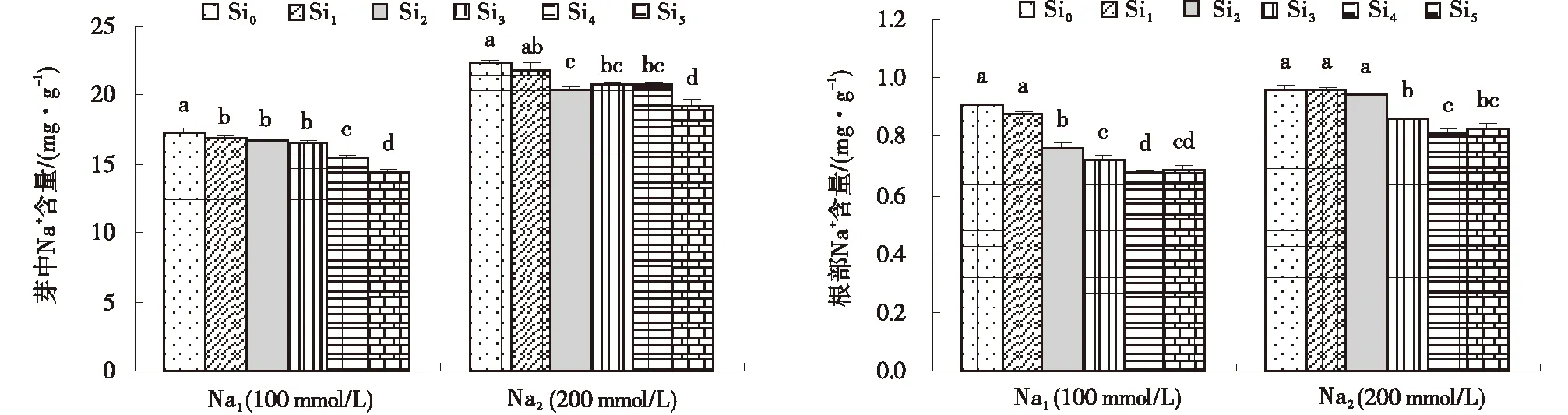
图6 Si对不同浓度NaCl胁迫下甘草幼苗根和芽中Na+的含量Fig.6 Effects of exogenous Si on K+ concentrations of root and bud of seedlings treatedwith 100 mmol/L and 200 mmol/L NaCl
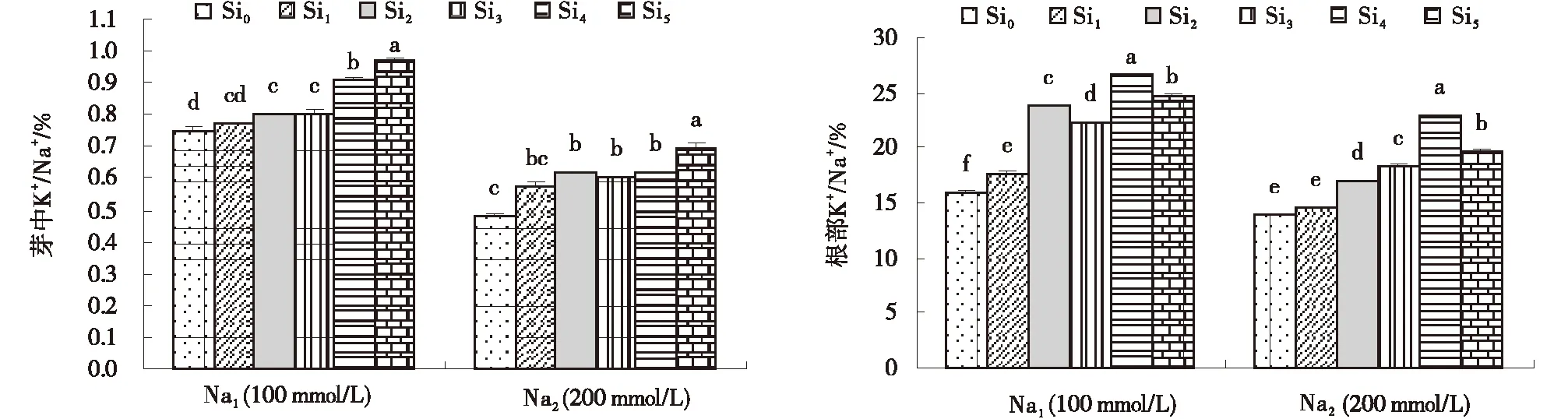
图7 Si对不同浓度NaCl胁迫下甘草幼苗芽和根中K+/Na+变化Fig.7 Effects of exogenous Si on K+/Na+ ratios of root and bud of seedlings treated with 100 mmol/L and 200 mmol/L NaCl
著提高幼苗根中K+/Na+,Si4处理下该效应最显著(图7)。
2.5 Si不同浓度NaCl胁迫下甘草幼苗根冠比与K+、Na+含量及K+/Na+相关性
为了研究不同盐浓度胁迫下K+和Na+对甘草幼苗根冠比的影响,将甘草幼苗芽和根部K+和Na+含量与根冠比进行相关性分析(表1),在甘草种子发芽过程中,根冠比与幼苗K+含量和根K+/Na+、幼苗K+含量与幼苗Na+含量、幼苗芽K+/Na+与根K+/Na+、幼苗芽Na+含量与根K+/Na+、根K+含量与根Na+含量均呈极显著正相关(P<0.01)。幼苗K+含量与根Na+含量、根Na+含量与根K+/Na+呈极显著负相关(P<0.01)。根冠比与幼苗Na+含量和芽K+/Na+、芽K+/Na+和根K+/Na+呈显著正相关(P<0.05)。根冠比与根Na+含量、根K+含量与根K+/Na+呈显著负相关(P<0.05)。

表1 Si对不同浓度NaCl胁迫下甘草幼苗根冠比与K+、Na+含量及K+/Na+相关系数Table 1 The correlation analysis of exogenous Si on K+,Na+ concentrations and K+/Na+ ratios of root and bud of seedlings treated with different concentrations of NaCl
注:**表示P<0.01;*表示P<0.05(n=18,df=15)
3 讨论
植物种子耐盐性是植物耐盐性的基础,Na+和Cl-是造成盐土中离子毒害的主要因素,盐胁迫导致种子吸水速率降低和吸水不足,抑制种子的正常萌发或延迟其发芽,不利于植物在盐碱地上建植。樊学惠等[21]研究表明,NaCl溶液胁迫对小黑麦(Triticosecale)和燕麦(Avenasativa)种子的发芽率、发芽势和发芽指数具有明显的抑制作用。高占军等[22]研究表明,NaCl溶液对白三叶(Trifoliumrepens)种子萌发具有显著的抑制作用,随着NaCl溶液浓度的增加,其发芽率、发芽势和发芽指数均显著降低。崔雪梅等[23]研究表明,盐胁迫可抑制高羊茅和黑麦草两种牧草种子的萌发,但抑制作用与植物自身有很大的关系。大量研究表明,Si可以不同程度的提高盐胁迫下植物种子耐盐性,缓解盐胁迫对种子胚芽和胚根的伤害[24]。
根冠比是反映作物根系与冠层协调生长的重要指标。作物生长前期,适当增加根冠比,有利于幼苗根系从土壤中吸收水分、矿物质等营养物质,更好地度过苗期,为后期作物地上部冠层生长和产量形成创造良好条件。在生产实践中,较高盐浓度不利于作物根系生长,导致作物根冠比降低,影响作物正常生长。研究表明,盐胁迫造成菊芋(Helianthustuberosus)根冠比降低,干物质积累显著减少[25];随着NaCl浓度的增加和培养时间的延长根冠比逐渐下降[26];盐胁迫会使高粱幼苗根冠比降低[27]。Si可以缓解植物受到的生物和非生物胁迫,可以使植物抵抗病害、虫害,提高植物对重金属污染物、干旱、盐碱胁迫等的抗性[28]。朱慧森等[29]研究表明,加入Si可增加盐胁迫下披碱草幼苗的生物量。
K+是植物体内一种具有活化作用的阳离子,K+含量是影响植物耐盐性的关键性因素之一[30-31],盐胁迫下,植物对K+的吸收有利于植物生长发育[32-33]。Na+是植物体内没有活化的阳离子,过多的Na+会造成植物体内相关代谢酶活性降低,甚至产生毒害作用[34],为了降低盐胁迫对植物自身伤害,植物通过降低根部对Na+的吸收和阻止Na+向地上部运输来维持正常生长[35]。因此,Na+、K+代谢对植物适应盐渍环境具有重要意义。在盐胁迫下,植物吸收Na+同时抑制K+吸收,许多盐生植物K+/Na+随盐胁迫强度的增大而减小[36]。较高的K+/Na+是维持植物气孔功能正常运行的重要条件,促进植物生长代谢[37]。王波等[38]研究表明,随着盐碱浓度的升高,植株对Na+的吸收增加,K+的吸收减少,从而使K+/Na+降低。通过加入外源Si可以使植物在盐渍环境下选择性增加对K+的吸收,这种选择性吸收能够为植物生长和代谢提供足量的K+,使得K+含量在较高的盐胁迫下也能保持相对稳定状态[39-40]。
4 结论
(1)加Si处理均显著提高NaCl盐胁迫下(100 mmol/L和200 mmol/L)甘草种子的发芽率、发芽整齐度,并增强种子发芽期间综合活力,为甘草成苗奠定基础。NaCl 100 mmol/L和 200 mmol/L胁迫下,Si 0.8 mmol/L和Si 2.0 mmol/L处理甘草种子,发芽率、发芽势和发芽指数均达到最大值,表明Si对盐胁迫下甘草种子发芽的促进效应存在浓度剂量效应,在Si5(2.0 mmol/L)处理下,能最大限度的发挥缓解作用。
(2)随着NaCl浓度增加,甘草幼苗根冠比明显下降,添加外源Si后能显著增加根冠比,缓解甘草幼苗受到的盐害,从而维持甘草幼苗更好的生长。
(3)高盐处理(200 mmol/L)下甘草幼苗的芽和根部Na+含量均大于低盐处理(100 mmol/L),而K+则相反。甘草幼苗芽中K+和Na+含量均大于根部(芽中Na+含量是根中的17倍)。在相同盐浓度下,随着Si浓度增大,甘草幼苗芽与根部K+含量均表现为升高趋势,而Na+含量均呈现出逐渐降低趋势,K+/Na+也显著增加。Si可以促进植物保钾排钠,从而使得甘草幼苗中的K+和Na+维持在一个平衡状态,较高水平K+含量降低盐害对甘草幼苗造成的伤害。加入Si可以抑制甘草对Na+的吸收,从而缓解甘草所受盐害,有益于甘草幼苗生长发育。由此可见,Si不但促进了甘草种子的发芽过程,而且间接提高甘草幼苗抵御胁迫的能力。
[1] 国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2010:80-81.
[2] 杨江山,张恩和,黄高宝,等.H2O2,NaCl,SA处理对磨砂后甘草种子发芽特性的影响[J].甘肃农业大学学报,2009,44(5):88-91.
[3] 李学斌,陈林,李国旗,等.中国甘草资源的生态分布及其繁殖技术研究[J].生态环境学报,2013,22(4):718-722.
[4] 焦艳红,宋艳茹,高述民.药用甘草组织培养生产黄酮的研究进展[J].植物生理学报,2013,49(1):13-18.
[5] 时丽冉,白丽荣,崔兴国.NaCl胁迫对不同耐盐性小黑麦幼苗Na+、K+、Cl-吸收及分配的影响[J].麦类作物学报,2014,34(4):546-551.
[6] 刘媛,王仕稳,殷俐娜,等.Si提高黄瓜幼苗抗盐能力的生理机制研究[J].西北植物学报,2014,34(5):0988-0944.
[7] 王佳丽,黄贤金,钟太洋,等.盐碱地可持续利用研究综述[J].地理学报,2011,66(5):673-684.
[8] Ando H,Kakuda K,Fuji H,etal.Growth and canopy structure of rice plants grown under field conditions as affected by Si application[J].Soil Science and Plant Nutrition,2002,48:429-432.
[9] Hossain M T,Mori R,Soga K,et al.Growth promotion and an increase in cell wall extensibility by silicon in rice and some other Poaceae seedlings[J].Journal of Plant Research,2002.115:0023-0027.
[10] 王丽燕.Si对NaCl胁迫下野大豆种子萌发的影响[J].大豆科学,2010,29(5):906-908.
[11] 樊哲仁,王晓东,唐琳,等.Si对盐胁迫下麻疯树种子萌发及幼苗生长的影响[J].中国油料作物学报,2010,32(2):217-221.
[12] 黄益宗,张文强,招礼军,等.Si对盐胁迫下水稻根系活力、丙二醛和营养元素含量的影响[J].生态毒理学报,2009,6(4):860-866.
[13] 侯玉慧,韩晓日,杨家佳,等.Si对盐胁迫下黄瓜种子萌发及幼苗生长的影响[J].中国生态农业学报,2007,15(6):206-207.
[14] 王玉萍,王映霞,白向利,等.Si对NaCl胁迫下甜瓜种子萌发及幼苗生长的影响[J].草业学报,2015,24(5):108-116.
[15] Gao X,Zou C,Wang L,etal.Silicon improves water use efficiency in maize plants[J].Journal of Plant Nutrition,2005,27:1457-1470
[16] 张新慧,郎多勇,白长财,等.外源Si对不同程度盐胁迫下甘草种子萌发和幼苗生长发育的影响[J].中草药,2014,7(45):2075-2079.
[17] 王咏星,陈海洋,谢丽琼,等.提高甘草种子的发芽率和出苗率试验[J].种子,2004,10(23):27-29
[18] 陆嘉惠.三种药用甘草耐盐性及耐盐机制研究[D].石河子:石河子大学,2014.
[19] 刘慧霞,申晓蓉,郭正刚.Si对紫花苜蓿种子萌发及幼苗生长发育的影响[J].草业学报,2011,20(1):155-160.
[20] 南京农业大学.土壤农化分析(第2版)[M].北京:农业出版社,1996:218-219.
[21] 樊学惠.盐分浓度对小黑麦和燕麦出苗率、芽长及根长的影响[J].草原与草坪,2013(3):26-30.
[22] 高占军,张星亮,张颖,等.盐胁迫对白三叶种子萌发及幼苗生理特性的影响[J].草原与草坪,2015(2):73-76.
[23] 崔雪梅,蔡红昌,章爱群.基于灰色方法的盐胁迫对牧草萌发的影响[J].湖北工程学院学报,2013,33(6):64-68.
[24] 吴成龙,刘兆普,徐阳春,等.NaCl胁迫对菊芋幼苗生长及其离子吸收运输的影响[J].西北植物学报,2006,26(11):2289 -2296.
[25] 李先婷,曹靖,魏晓娟,等.NaCl渐进胁迫对啤酒大麦幼苗生长、离子分配和光合特性的影响[J].草业学报,2013,22(6):108-116.
[26] 马金虎,郭数进,王玉国,等.种子引发对盐胁迫下高粱幼苗生物量分配和渗透物质含量的影响[J].生态学杂志,2010,29(10):1950-1956.
[27] 王义超.Si对镉和汞胁迫下大蒜生理生化代谢的影响及机理研究[D].杨凌:西北农林科技大学,2014.
[28] 朱慧森,方志红,杨桂英,等.不同盐碱化草地披碱草生物量形成及根系对K+,Na+的选择性吸收[J].草地学报,2010,18(3):383-387.
[29] Sylvie Renault,Clare Croser,Jennifer A,etal.Effect of NaCl and Na2SO4on red-osier dogwood(CornusstoloniferaMichx) seedlings[J].Plant and Soil,2001,233:261-268.
[30] Zhu J K,Liu J P,Xiong L.Genetic analysis of salt tolerance in Arabidopsis:Evidence for a critical role potassium nutrition[J].The Plant Cell,1998,10:1181-1191.
[31] 王素平,郭世荣,周国贤,等.NaCl胁迫下黄瓜幼苗体内K+,Na+和Cl-分布及吸收特性的研究[J].西北植物学报,2006,26(11):2281-2288.
[32] 沈艳华,徐锡增,方升佐,等.Si对盐胁迫下杨树幼苗生长和膜脂过氧化的影响[J].福建林学院学报,2009,29(1):69-73
[33] 王树凤,胡韵雪,李志兰,等.盐胁迫对弗吉尼亚栎生长及矿质离子吸收、运输和分配的影响[J].生态学报,2010,30(17):4609-4616.
[34] 杨桂英,夏方山,董秋丽,等.NaCl胁迫对碱地风毛菊苗期植株Na+、K+含量的影响[J].草原与草坪,2011(2):11-14.
[35] 刘志华,赵可夫.盐胁迫对獐茅生长及Na+和K+含量的影响[J].植物生理与分子生物学学报,2005,31(3):311-316.
[36] 徐春波,米福贵,王勇.转基因冰草植株耐盐性研究[J].草地学报,2006,14(1):20-23
[37] 王波,宋凤斌.盐碱胁迫对燕麦水势、干物质积累率以及K+、Na+选择性吸收的影响[J].农业系统科学与综合研究,2006,22(2):105-108.
[38] 赵昕,赵敏桂,谭会娟,等.NaCl胁迫对盐芥和拟南芥K+,Na+吸收的影响[J].草业学报,2007,16(4):21-24.
[39] 田晓艳,刘延吉,郭迎春.盐胁迫对NHC牧草Na+,K+,Pro,可溶性糖及可溶性蛋白的影响[J].草业科学,2008,25(10):34-38.
[40] 丁菲,杨帆,张国武,等.NaCl胁迫对构树幼苗叶片水势、光合作用及Na+,K+吸收和分配的影响[J].林业科学研究,2009,22(3):428-433.
Effects of exogenous silicon on seed germination and concentrations of K+and Na+in licorice(Glycyrrhizauralensis) seedlings under salt stress
CUI Jia-jia1,ZHANG Xin-hui2,3,4,5, ZHANG En-he1
(1.CollegeofAgronomy,GansuAgriculturalUniversity,Lanzhou730070,China; 2.CollegeofPharmacy,NingxiaMedicalUniversity,Yinchuan750004,China; 3.NingxiaEngineeringandTechnologyResearchCenterofHuiMedicineModernization,Yinchuan750004,China; 4.NingxiaCollaborativeInnovationCenterofHuiMedicine,Yinchuan750004,China; 5.KeyLaboratoryofHuiMedicineModernization,MinistryofEducation,Yinchuan750004,China)
The effects of exogenous silicon(0,0.4,0.8,1.2,1.6 and 2.0 mmol/L) on seed germination and the concentrations of K+and Na+of licorice(Glycyrrhizauralensis) under salt stress(100 and 200 mmol/L NaCl) were studied.The results showed that the application of silicon increased the germination rate,germination potential,germination index and root-shoot ratio of seedlings under salt stress,and the improving effect was the best while the silicon concentrations were 0.4 and 2.0 mmol/L.Application of silicon could maintain the balance between K+and Na+by improving the absorption of K+and reduced the absorption of Na+under salt stress in licorice seedlings.
licorice;salt stress;silicon;seed germination;K+;Na+
2016-04-07;
2016-04-12
国家自然科学基金(31260304,31460330)资助
崔佳佳(1991-),女,甘肃兰州市人,硕士研究生。
E-mail:573377977@qq.com
S 318
A
1009-5500(2016)05-0001-07
张新慧为通讯作者。
