TSG-6对人病理性瘢痕成纤维细胞增殖与凋亡的影响
2016-11-28张苏文李小静
张苏文,李小静,陈 钊,王 晖
TSG-6对人病理性瘢痕成纤维细胞增殖与凋亡的影响
张苏文,李小静,陈 钊,王 晖
目的 探讨肿瘤坏死因子α刺激基因6(TSG-6)对人病理性瘢痕成纤维细胞增殖与凋亡的影响。方法 取人病理性瘢痕组织共6例,用组织块培养法培养人病理性瘢痕成纤维细胞,体外培养的第3、4代细胞,用浓度为2 μg/ml的重组人TSG-6蛋白处理,在作用48 h后,用免疫组化法检测TSG-6作用前后人病理性瘢痕成纤维细胞增殖细胞核抗原(PCNA)的变化,并计算PCNA阳性细胞率;流式细胞术计算、分析人重组TSG-6蛋白作用前后,人病理性瘢痕成纤维细胞的凋亡率;Western blot法检测细胞凋亡相关蛋白p53、半胱天冬酶3(caspase-3)表达的变化。结果 2 μg/ml TSG-6体外干预人病理性瘢痕成纤维细胞48 h情况下,人病理性瘢痕成纤维细胞PCNA的阳性细胞率显著降低,差异有统计学意义(P<0.05);细胞凋亡率增高,差异有统计学意义(P<0.05);Western blot法检测显示细胞凋亡相关蛋白p53、caspase-3表达明显增多。结论 TSG-6在体外能够抑制人病理性瘢痕成纤维细胞的增殖并促进其凋亡,TSG-6对细胞的抑制作用可能与TSG-6抑制PCNA基因表达有关,TSG-6诱导人病理性瘢痕成纤维细胞凋亡的作用可能与TSG-6促进细胞凋亡相关蛋白p53、caspase-3表达有关。
肿瘤坏死因子α刺激基因6;病理性瘢痕;成纤维细胞;细胞增殖;细胞凋亡
肿瘤坏死因子α刺激基因6(tumor necrosis fac tor alpha stimulated gene-6,TSG-6)是Lee et al[1]发现的一种参与多种炎性反应的抗炎因子。 病理性瘢痕是由皮肤创伤过度愈合而形成,增生的病理性瘢痕组织高于周围正常皮肤,不仅影响美观,而且可出现瘙痒、疼痛等症状,甚至会发生瘢痕挛缩,发生在关节处瘢痕挛缩常造成关节严重的功能障碍,因此皮肤创伤后瘢痕形成的防治是创伤愈合领域的一个重要问题。Tan et al[2]首次证明抗炎因子TSG-6表达的减少可能是导致病理性瘢痕形成的一个重要因素。该研究探讨2 μg/ml TSG-6对人病理性瘢痕成纤维细胞增殖与凋亡的影响。
1 材料与方法
1.1 病例资料 人病理性瘢痕组织标本均来源于安徽医科大学第一附属医院整形外科病房与门诊手术中切除的病理性瘢痕组织,全部征得患者同意并签署知情同意书,组织标本共6例(男2例,女4例),年龄4~27(16.82±1.35)岁,患者均属于首次治疗,未经其他治疗,且病理性瘢痕症状突出,病程6~12个月。
1.2 主要试剂及仪器 TSG-6蛋白购自美国R&D Systems公司;胎牛血清、PBS、DMEM(高糖)培养基均购自美国HyClone公司;增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)单克隆抗体及免疫组化SP试剂盒均购自福州迈新生物技术开发有限公司;BD 556547 AnnexinV-FITC/PI细胞凋亡双染试剂盒、流式细胞仪购自美国BD公司;Western blot试剂盒购自美国Sigma公司;CO2细胞培养箱购自德国Heraeus公司;Western blot检测全套设备购自Bio-Rad公司;超净工作台购自苏州安泰空气技术有限公司;倒置荧光显微镜购自日本Olympus公司。
1.3 方法
1.3.1 病理性瘢痕成纤维细胞原代培养 应用组织块培养法进行病理性瘢痕成纤维细胞的原代培养,用含20%胎牛血清的DMEM培养液,于37 ℃、5% CO2培养箱内常规培养。每3 d更换细胞培养液1次,10~14 d可见组织块周围有成纤维细胞萌出,当成纤维细胞爬满细胞培养瓶底并连接成片(铺满细胞瓶底80%以上),可行传代,待细胞传至第3或4代时,可用于实验。
1.3.2 免疫组化法检测PCNA 取第3代处于对数生长期的人病理性瘢痕成纤维细胞,用0.25%胰酶消化,以 1×105/ml的密度接种于放有盖玻片的6孔培养板中。实验分为空白对照组和浓度为2 μg/ml的 TSG-6干预组。细胞贴壁生长后,弃上清液,分别加入不含TSG-6的完全培养基和TSG-6蛋白终浓度为2 μg/ml的培养基。于37 ℃、5% CO2培养箱内常规培养48 h。再经过固定、烤片处理,采用柠檬酸(0.01 mol/L,pH=6.0)微波法行抗原修复。采用SP法,DAB显色。实验重复3次。
1.3.3 流式细胞仪检测细胞凋亡 取处于对数生长期的第3代人病理性瘢痕成纤维细胞,用0.25%胰酶消化,以 1×105/ml的密度接种于放有盖玻片的6孔培养板中。实验分为空白对照组和2 μg/ml TSG-6干预组。细胞贴壁生长后,弃上清液,分别加入不含TSG-6的完全培养基和TSG-6蛋白终浓度2 μg/ml的培养基。于37 ℃、5% CO2培养箱内常规培养48 h。收集空白对照组和浓度为2 μg/ml TSG-6干预组细胞到试管中,2 000 r/min离心10 min,弃上清液,用冰PBS漂洗2次,后按BD 556547 AnnexinV-FITC/PI细胞凋亡双染试剂盒说明书操作,操作完成后上流式细胞仪检测。
1.3.4 Western blot法检测p53、半胱天冬酶3(caspase3) 取处于对数生长期的第3代人病理性瘢痕成纤维细胞进行实验。实验分为空白对照组和浓度为2 μg/ml TSG-6干预组。将人病理性瘢痕成纤维细胞提取物与上样缓冲液混合后,加热变性,经10%聚丙烯酰胺凝胶电泳分离蛋白。转印至聚偏二氟乙烯(PVDF)膜,在50 mA、4 ℃条件下转移8 h,实验按照Western blot试剂盒说明书操作,将PVDF膜放入另一塑料袋,加含二抗的封闭液,置室温下1 h,振摇洗涤后,加新配置的DAB显色液,条带显色清楚后终止显色并拍照保存。

2 结果
2.1 TSG-6抑制人病理性瘢痕成纤维细胞增殖 免疫组化法结果显示:细胞核内含有棕黄色颗粒者为PCNA阳性表达细胞,见图1,从每张切片中选取5个阳性率较多的视野计数,阳性细胞率(%)=阳性细胞/细胞总数×100%,TSG-6干预组PCNA阳性细胞率(24.7±4.3)较空白组(40.5±5.0)显著降低,差异有统计学意义(n=6,t=5.88,P<0.01)。表明TSG-6在体外能够抑制人病理性瘢痕成纤维细胞的增殖。

图1 PCNA在人病理性瘢痕成纤维细胞中的表达 DAB×400
2.2 TSG-6促进人病理性瘢痕成纤维细胞凋亡 流式细胞仪检测结果显示:对数生长期细胞消化重悬,接种6孔培养板贴壁生长,浓度为0、2 μg/ml的TSG-6处理48 h后,细胞凋亡率分别为0、12.43%, TSG-6干预组细胞凋亡率较空白对照组增高,差异有统计学意义,见图2。Western blot法检测显示,以β-actin作参照,TSG-6干预组p53蛋白相对定量明显高于空白对照组,差异有统计学意义(n=6,t=2.903,P<0.05);同时TSG-6干预组caspase3蛋白相对定量明显高于空白对照组,差异有统计学意义(n=6,t=5.666,P<0.01),见图3、4。
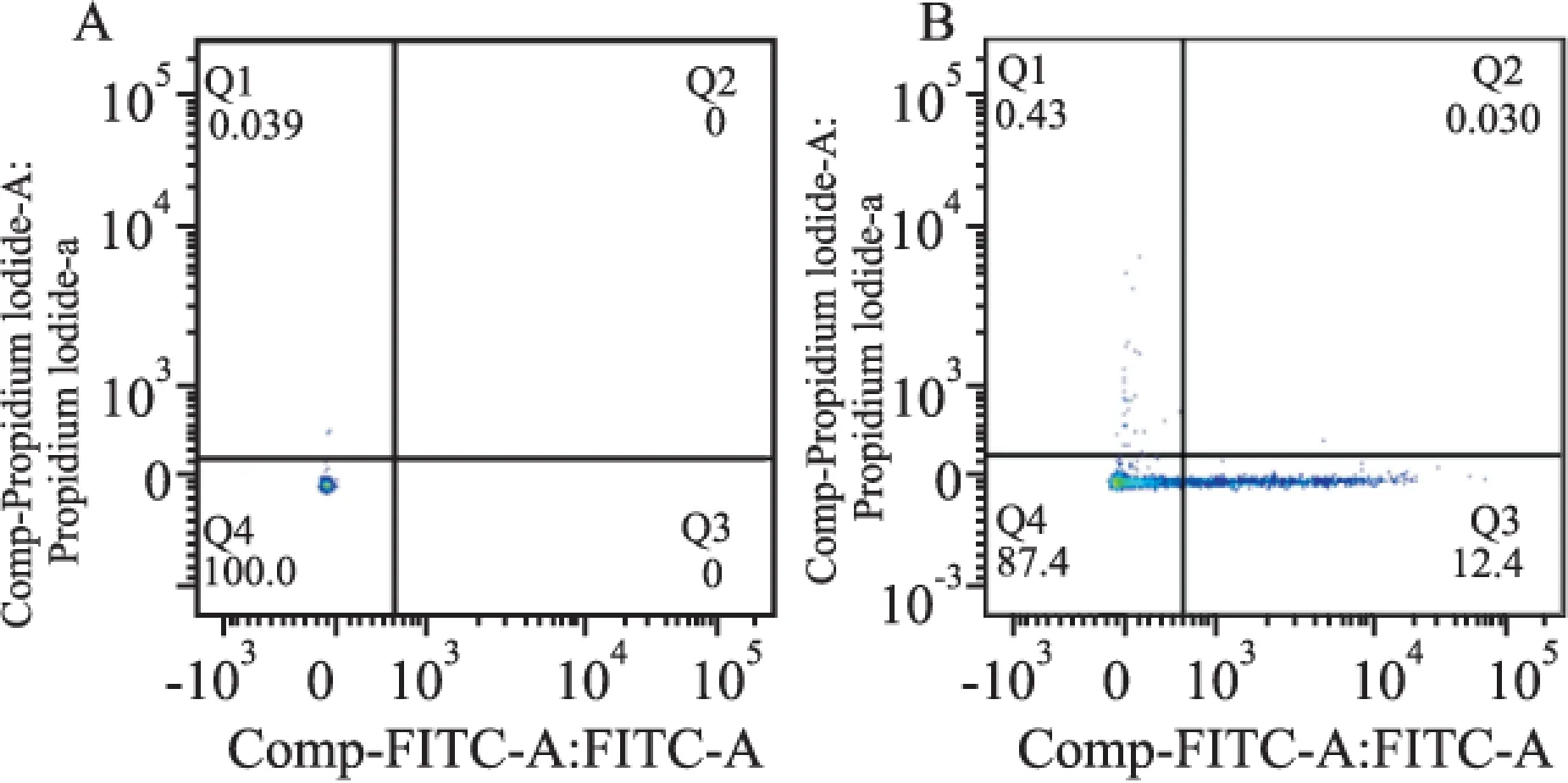
图2 流式细胞仪分析人病理性瘢痕成纤维细胞的凋亡
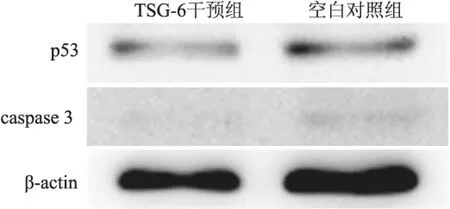
图3 Western blot检测成纤维细胞中p53、caspase3蛋白表达

图4 TSG-6干预组及空白对照组成纤维细胞中p53、caspase3 蛋白相对定量
与空白对照组比较:*P<0.05,**P<0.01
3 讨论
病理性瘢痕一旦产生就无法完全消除,虽然当前病理性瘢痕的治疗方法很多,主要包括外科手术、加压、放射和药物注射治疗[3],但治疗后病理性瘢痕再次复发率高,疗效达不到完全满意。有关病理性瘢痕的防治目前仍然是国际上的医学难题,寻求更为有效、理想的病理性瘢痕治疗方法为临床迫切所需。
在临床治疗病理性瘢痕的过程中发现,组织损伤后形成病理性瘢痕的创面在恢复的过程中往往伴随着感染,在一定程度上提示了病理性瘢痕的形成与炎症反应密切相关[4]。近年,越来越多的学者认为病理性瘢痕的形成是一种纤维化的病理过程,组织损伤后的炎症反应与纤维化病理过程以及其反应程度紧密相关,而炎症反应是组织损伤后纤维化病理变化的部分或主要原因[5-6],有报道[1]称通过某些抗炎作用减少瘢痕形成是一种已被证实的有效的治疗方法。因此,通过抗炎作用以期治疗病理性瘢痕为近年相关领域研究热点之一。
TSG-6基因位于人染色体2q23.3,mRNA全长为1 440 bp,开放阅读框为77~910,主要编码由277个氨基酸残基组成的一种分泌性蛋白质,相对分子质量为31 203×103,第1~19位氨基酸残基为信号肽。TSG-6基因是一个保护性的炎症反应基因,其参与多种炎症反应性疾病,主要发挥抗炎以及细胞外基质重塑等作用[2]。继Tan et al[2]首次证明抗炎因子TSG-6表达的减少可能是导致病理性瘢痕形成的一个重要因素以来,洪学哲 等[7]研究发现TSG-6可能具有抑制病理性瘢痕形成的作用。唐悦玲 等[8]研究TSG-6对病理性瘢痕成纤维细胞凋亡的影响,发现TSG-6对病理性瘢痕有抑制增殖促进凋亡的作用,机制可能与TSG-6调节成纤维细胞内Bcl-2、Bax表达有关。Wang et al[9]通过建立兔耳病理性瘢痕模型,研究证实TSG-6对兔耳病理性瘢痕有显著抑制作用。
病理性瘢痕组织学主要表现为成纤维细胞的过度增殖及细胞外基质的过度聚集[10-11],创伤后的皮肤愈合过程中[12],作为伤口愈合和瘢痕增生的主要效应细胞,成纤维细胞活化增殖合成胶原以及分化异常,可直接导致病理性瘢痕的形成。因此,抑制成纤维细胞的增殖或诱导成纤维细胞凋亡成为治疗病理性瘢痕的关键[13]。本研究显示,TSG-6在体外能够抑制人病理性瘢痕成纤维细胞的增殖,其抑制作用可能与TSG-6通过抑制PCNA基因表达有关。另一方面,流式细胞仪检测分析显示2 μg/ml TSG-6作用于人病理性瘢痕成纤维细胞48 h后,细胞凋亡率明显增高。因此,TSG-6在体外能诱导或促进人病理性瘢痕成纤维细胞凋亡,其作用可能与TSG-6诱导p53、caspase3蛋白表达有关。
综上所述,TSG-6蛋白对体外培养的病理性瘢痕成纤维细胞具有抑制增殖及促进凋亡的作用,这可能与提高细胞凋亡相关蛋白p53及caspase3表达相关。成纤维细胞作为病理性瘢痕主要功能细胞,抑制其增殖、促进其凋亡是瘢痕治疗的重要研究方向,本实验证实TSG-6对人病理性瘢痕成纤维细胞增殖与凋亡具有调控作用,为病理性瘢痕的治疗提供了新的研究方向和一定的实验基础,然而具体作用机制尚不清楚,仍需进一步的研究。
[1] Lee R H, Pulin A A, Seo M J, et al. Intravenous hMSCs improve myocardial infarction in mice because cells embolized in lung are activated to secrete the anti-inflammatory protein TSG-6[J]. Cell Stem Cell, 2009, 5(1):54-63.
[2] Tan K T, McGrouther D A, Day A J, et al. Characterization of hyaluronan and TSG-6 in skin scarring: differential distribution in keloid scars, normal scars and unscarred skin [J]. J Eur Acad Dermatol Venereol, 2011, 25(3):317-27.
[3] 付小兵,程 彪.病理性瘢痕治疗现状与展望[J].中华整形外科杂志, 2006, 22(2):146-9.
[4] Pradhan L, Cai X, Wu S, et al. Gene expression of pro-inflammatory cytokines and neuropeptides in diabetic wound healing [J]. J Surg Rer, 2011, 167(2):336-42.
[5] Mak K, Manji A, Gallant-Behm C, et al. Scarless healing of oral mucosa is characterized by faster resolution of inflammation and control of myofibroblast action compared to skin wounds in the red Duroc pig model [J]. J Dermatol Sci, 2009, 56(3):168-80.
[6] Theoret C. Tissue engineering in wound repair: the three “R”s-repair, replace, regenerate [J]. Vet Surg, 2009, 38(8):905-13.
[7] 洪学哲,李小静,宁金龙.TSG-6在病理性瘢痕的表达及意义[J]. 安徽医科大学学报, 2013, 48(6):685-7.
[8] 唐悦玲,李小静,陈 钊,等.TSG-6对病理性瘢痕成纤维细胞凋亡的影响[J]. 中国美容整形外科杂志, 2014,25(3):157-60.
[9] Wang H, Chen Z, Li X J, et al. Anti-inflammatory cytokine TSG-6 inhibits hypertrophic scar formation in a rabit ear model [J]. Eur J Pharmacol, 2015, 751:42-9.
[10] 段红梅,吴志远,江黎明.皮肤创伤在胚胎内外愈合过程中基因差异表达[J]. 广西医学, 2009, 31(9):1252-3.
[11] Shaker S A, Ayuob N N, Hajrah N H. Cell talk: a phenomenon observed in the keloid scar by immunohistochemieal study[J]. Appl Immunohistochem Mol Morphol, 2011, 19(2):153-9.
[12] 吴志远,罗少军,江黎明.隐丹参酮对兔耳增生性瘢痕组织的影响[J]. 广西医学, 2008, 30(7):1012-3.
[13] Gauglitz G G, Korting H C, Paviciv T, et al. Hypertrophic scarring and keloids: pathomechanisms and current and emerging treatment strategies[J]. Mol Med, 2011, 17(1-2):113-25.
Effects of TSG-6 on the proliferation and apoptosis of human pathological scar fibroblasts
Zhang Suwen,Li Xiaojing,Chen Zhao, et al
(Dept of Plastic Surgery,The First Affiliated Hospital of Anhui Medical University,Hefei 230022)
ObjectiveTo observe the effects of tumor necrosis factor-stimulated gene 6 (TSG-6) on the proliferation and apoptosis of human pathological scar fibroblasts. Methods The samples were harvested from human pathological scar tissue, a total of 6 cases, and then were cultured to pathological scar fibroblasts with adherence method. Cells used in this study were propagated for 3-4 times before use. The pathological scar fibroblasts were cultured with 2 μg/ml of recombinant human TSG-6 protein for 48 h. The effects of TSG-6 on cell proliferation were then assessed by immunohistochemical method at the indicate time. The rate of apoptosis induced by TSG-6 was determined by flow cytometry. Western blot was performed to detect the expression levels of caspase-3 and p53 after TSG-6 was treated. Results After treated with TSG-6 for 48 h,cells expressing proliferating cell nuclear antigen,an indicator of cell proliferation, reduced significantly (P<0.05). On the other hand, the rate of apoptosis of pathological scar fibroblasts induced by TSG-6 with 2 μg/ml was increased (P<0.05). The expression levels of apoptosis related proteins caspase-3 and p53 were significantly increased in TSG-6 treated group. Conclusion TSG-6 may inhibit proliferation and induce apoptosis of human pathological scar fibroblastinvitro. The inhibition of proliferation might be caused by inhibition of PCNA gene expression, and the induction of apoptosis might be associated with promotion expression of caspase-3 and p53.
TSG-6; pathological scar; fibroblasts; cell proliferation; apoptosis
时间:2015-12-30 14:38
http://www.cnki.net/kcms/detail/34.1065.R.20151230.1438.048.html
国家自然科学基金(编号:81272107)
安徽医科大学第一附属医院整形外科,合肥 230022
张苏文,男,硕士研究生;
李小静,女,主任医师,教授,博士生导师,责任作者,E-mail:lixiaojing5@163.com
R 619+.6
A
1000-1492(2016)01-0102-04
2015-09-30接收
