胸苷酸合成酶检测指导肺腺癌患者术后辅助化疗的临床研究
2016-11-25解明然郭明发柳常青孙翔翔徐美青
邓 杰,解明然,郭明发,柳常青,孙翔翔,徐美青
胸苷酸合成酶检测指导肺腺癌患者术后辅助化疗的临床研究
邓 杰,解明然,郭明发,柳常青,孙翔翔,徐美青
目的 评估胸苷酸合成酶(TS)检测指导肺腺癌患者根治术后行奈达铂联合培美曲塞方案化疗的临床意义。方法 回顾性分析166例ⅠB~ⅢA期肺腺癌患者的临床资料。其中研究组94例,经免疫组化检测结果显示全部为TS低表达患者;对照组72例,未行TS检测。两组均予以奈达铂联合培美曲塞方案化疗,比较两组患者的临床病理特征、中位无病生存期、3年无病生存率、3年总生存率以及转移复发情况。结果 两组患者临床病理特征差异无统计学意义。研究组患者的中位无病生存期为43.0个月,1年、2年、3年无病生存率分别为90.4%、76.6%、61.7%,观察组患者中位无病生存期为29.9个月,1、2、3年无病生存率分别为87.5%、66.7%和52.5%,两组无病生存率差异有统计学意义(P=0.035)。研究组患者的3年总生存率优于观察组患者(67.7% vs 56.4%),差异有统计学意义(P<0.05)。研究组中复发转移41例(43.6%),观察组中复发或转移43例(59.7%),差异有统计学意义(P=0.04)。多因素分析结果显示吸烟史、T分期、N分期及病理分期为患者的独立预后因素。结论TS表达状况与肺腺癌患者术后接受奈达铂联合培美曲塞化疗方案有效率有一定相关性,通过免疫组化法对肺腺癌患者术后大体标本行TS检测可筛选培美曲塞化疗的获益人群。
癌;腺癌;非小细胞肺癌;胸苷酸合成酶;培美曲塞;预后
肺癌目前是世界上发病率和死亡率最高的恶性肿瘤[1]。其中腺癌已经超过鳞癌成为目前肺癌最主要的病理类型,可能和目前工业环境、吸烟人群增加有关[2]。手术仍是目前早中期肺腺癌最主要的治疗方式,通过术后辅助化疗可以提高肺腺癌患者的生存率[3]。美国国立综合癌症网络指南指出铂类联合培美曲塞已成为肺腺癌的一线化疗方案,相比传统的铂类联合吉西他滨化疗,其疗效更高,化疗毒副作用更低。培美曲塞是一种干扰细胞内叶酸代谢的抗肿瘤药物,胸苷酸合成酶(thymidylatesynthase,TS)为其主要作用靶点。文献[4]报道培美曲塞的化疗疗效和TS的表达有关,TS可能会成为肺癌患者培美曲塞方案化疗的预后因素。因此理论上检测肺腺癌患者中TS表达情况可能会有助于筛选肺腺癌患者培美曲塞化疗的受益人群。该研究收集接受根治性肺癌切除术且术后病理诊断为肺腺癌的ⅠB~ⅢA期患者166例,所有患者术后予以培美曲塞联合奈达铂方案化疗;其中94例经免疫组化检测为TS低表达患者,72例未行免疫组化检测,比较两组的临床病理特征、预后生存、复发转移情况。
1 材料与方法
1.1 病例资料 回顾性分析2010年6月~2014年6月于安徽医科大学附属省立医院胸外科行肺癌根治术、术后病理确诊为肺腺癌的患者195例,病例纳入标准:① 术后病理证实为肺腺癌,根据UICC分期诊断为ⅠB~ⅢA期;② 手术为R0切除;③ 术后行奈达铂联合培美曲塞方案化疗4疗程;④ 术前未行放化疗治疗;剔除标准:① 非根治性手术;② 术后辅助化疗<4周期;③ 术前或术后口服分子靶向药物治疗;④ 病例资料不完整。基于以上标准,共166例患者纳入本研究,其中男94例,女72例;年龄32~76岁,中位年龄57岁;ⅠB期62例,Ⅱ期61例,ⅢA期43例。研究组经免疫组化检测全部为TS低表达患者(n=94),对照组未行TS检测(n=72)。
1.2 方法
1.2.1 术后辅助化疗方案 患者术后2~4周内,研究组和对照组均采用奈达铂联合培美曲塞方案化疗,培美曲塞500mg/m2静脉滴注第1天,奈达铂75mg/m2治疗第1天,治疗期间补充叶酸和维生素。21d为1周期,共治疗4周期。
1.2.2 免疫组化法检测TS表达 肿瘤石蜡切片脱蜡至水,放入3%双氧水, 室温孵育5~10min以消除内源性过氧化物酶的活性;蒸馏水冲洗,PBS浸泡2次,每次5min(如需抗原修复,可在此步后进行);5%~10% 正常山羊血清(PBS稀释)封闭,室温孵育10min,倾去血清,勿洗。滴加一抗工作液,37 ℃ 孵育1~2h或4 ℃ 过夜;PBS冲洗3次,每次5min;滴加适量生物素标记二抗工作液,37 ℃ 孵育10~30min;PBS冲洗3次,每次5min; 滴加适量的辣根酶或碱性磷酸酶标记的链霉卵白素工作液,37 ℃孵育10~30min;PBS冲洗3次,每次5min;显色剂显色3~15min(DAB或NBT/BCIP);自来水充分冲洗、复染、脱水、透明、封片。试剂购自迈新生物技术开发有限公司。
1.2.3 判定标准 低表达:以片中的非肿瘤细胞作为参照,强度为0,肿瘤细胞核染色强度分为0、1(低)、2(一般)、3(高)。强度0、1、2为低表达;强度为3,染色细胞数≤1也为低表达。强度为3,染色细胞数在2个以上则为高表达。
1.3 观察指标 比较分析研究组与对照组患者的临床病理特征、中位无病生存期、3年无病生存率、3年总生存率及复发转移情况。
1.4 随访情况 患者术后采用门诊复查或电话随访等方式,术后第1年每3个月随访1次,第2年每半年随访1次,从第3年起每1年随访1次,随访截止到2015年9月,获取患者的的相关临床信息和生存情况,包括影像学检查(胸腹部CT、头颅磁共振、骨扫描、PET-CT等)及病理穿刺检查结果等。
1.5 统计学处理 采用SPSS20.0软件进行分析。计数资料的组间比较采用χ2检验,应用Kaplan-Meier法绘制生存曲线,运用Logrank检验进行生存过程的比较;使用Cox比例风险模型考察患者预后影响因素。检验水准α=0.05。
2 结果
2.1TS在肺腺癌中的表达情况以及两组患者临床病理特征的比较 免疫组化结果显示,TS蛋白阳性表达的肺腺癌细胞核内出现棕黄色颗粒(图1)。两组患者在性别、年龄、吸烟、肿瘤分化程度、原发灶分期(T分期)、淋巴结分期(N分期)、病理分期上比较差异无统计学意义(表1)。
2.2 两组患者的随访、预后及生存情况 166例患者中,随访150例(90.4%),中位随访时间为34个月。全组患者的中位无病生存期为37.5个月,1、2、3年无病生存率分别为92.2%、67.5%、50.3%。研究组患者的中位无病生存期为43.0个月,1、2、3年无病生存率分别为90.4%、76、6%、61.7%。对照组患者的中位无病生存期为29.9个月,1、2、3年无病生存率分别为87.5%、66.7%、52.5%。研究组患者无病生存率优于对照组患者,差异有统计学意义(P=0.035)。见图2。
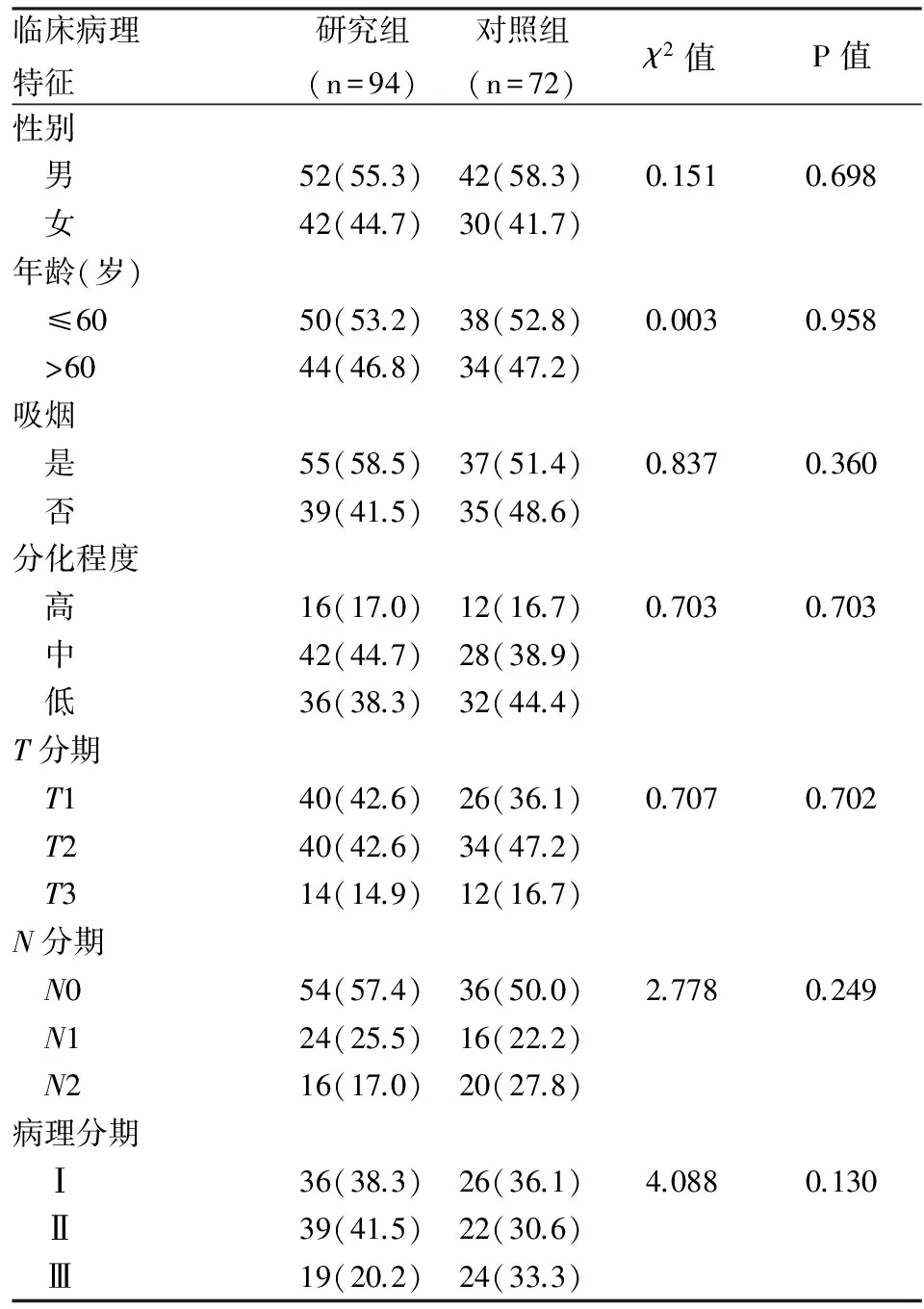
表1 患者的临床病理特征比较[n(%)]
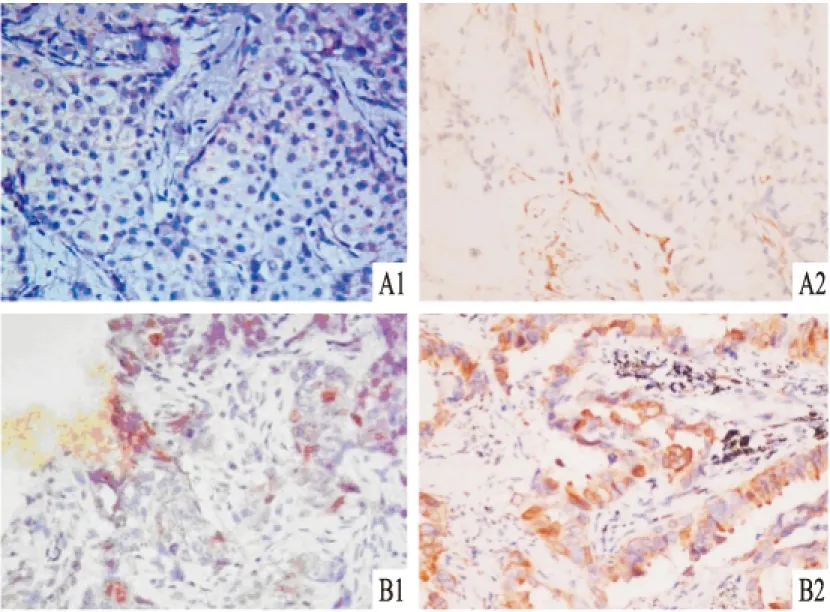
图1 免疫组化法DAB染色检测TS在腺癌组织中的表达情况
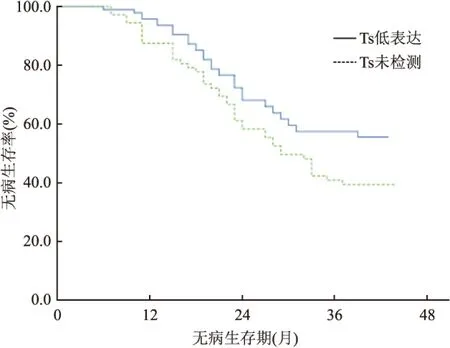
图2 TS低表达组与TS未检测组患者的无病生存曲线比较
2.3 随访情况 在随访过程中,166例患者局部复发或远处转移84例(50.6%),其中死亡23例。研究组94例患者中局部复发或远处转移41例(43.6%),其中死亡12例。对照组患者中局部复发或远处转移43例(59.7%),其中死亡11例。两组患者比较差异有统计学意义(P=0.04)。
2.4 影响铂类联合培美曲塞化疗的肺腺癌患者预后的多因素分析 吸烟、T分期、淋巴结转移情况及病理分期为肺腺癌患者的独立预后因素(P<0.05)。见表2。
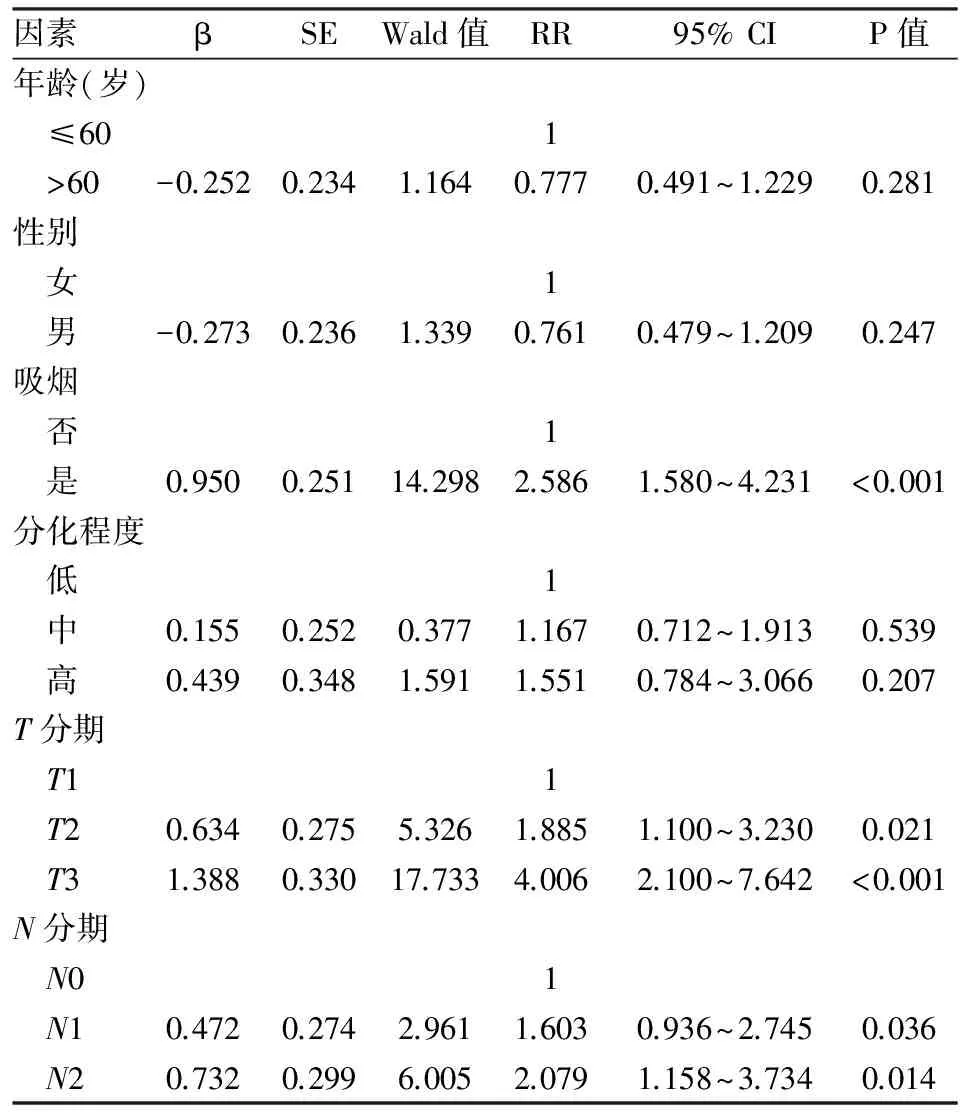
表2 166例肺腺癌患者预后影响因素的Cox比例风险模型分析
3 讨论
培美曲塞是一种新型抗叶酸代谢药物,能够干扰叶酸代谢及DNA合成来抑制肿瘤生长[5]。培美曲塞作用的靶点之一就是TS,TS是胸苷酸合成的限速酶,而胸苷酸是胸腺嘧啶合成所必须的原料,培美曲塞对胸苷酸合成酶的抑制,导致DNA合成所需要的胸腺嘧啶减少,使得细胞增殖减少,所以培美曲塞能够作用于增殖程度明显的肿瘤细胞来达到抑制肿瘤生长的目的[6]。文献[7]报道,采用含培美曲塞方案化疗的患者,TS低表达的非小细胞肺癌患者其生存率高于TS高表达者,提示TS低表达可能是培美曲塞治疗肺癌患者的生存预测因素。本研究显示ⅠB~ⅢA期肺腺根治术后患者采用奈达铂联合培美曲塞方案化疗,研究组较对照组有更高的无病生存率,进一步论证了TS低表达可能是肺腺癌患者行培美曲塞方案化疗的预后影响因素。
研究[8]显示,在肺腺癌、鳞癌、小细胞肺癌、大细胞肺癌及腺鳞癌的几种病理类型中,TS基因在腺癌组织中表达水平低于其他病理类型肺癌,这就提示培美曲塞用于肺腺癌患者可能有更高的敏感性。Nakagawaetal[9]回顾性分析了104例I期肺腺癌根治术后行培美曲塞联合铂类方案化疗的患者,TS低表达患者的5年生存率为86.1%,而TS高表达患者为72.0%,两者比较差异有统计学意义(P=0.048)。Wangetal[10]进行的一项Meta分析显示,526例Ⅰ ~Ⅳ期非小细胞肺癌患者行铂类联合培美曲塞方案化疗,TS低表达患者的无病生存期及总生存期高于TS高表达患者(P=0.004)。一项前瞻性随机对照研究[11]显示,共315例非鳞非小细胞肺癌患者纳入研究,结果显示,在TS阴性组中培美曲塞联合顺铂疗效优于吉西他滨联合顺铂,而在TS阳性组中则无此现象,说明TS蛋白表达水平是培美曲塞方案化疗潜在的疗效预测指标。本研究结果显示,TS未检测组患者1、2、3年无病生存率分别为87.5%、66.7%、52.5%,TS低表达组患者1、2、3年无病生存率分别为90.4%、76.6%、61.7%,两组比较差异有统计学意义。导致该结果出现的原因可能在于,未检测组患者中可能有部分TS高表达患者,通过行TS检测,可以减少盲目化疗患者。多因素分析结果显示,吸烟是肺腺癌患者的独立预后因素。Ceppietal[12]发现吸烟患者中TS表达水平更高,特别是在肺腺癌患者中表现明显,这从侧面反映TS可能是肺腺癌患者的一个预后监测指标。
培美曲塞用于非小细胞肺癌一线和二线治疗取得了很好的疗效,也有报道培美曲塞用于进展期非小细胞肺癌的三线甚至四线治疗也取得了满意效果,同时显示化疗疗效和TS表达有明显的相关性[13]。通过TS检测,筛选出TS低表达患者用培美曲塞方案化疗,可以提高肺腺癌患者的生存期,但仍有相当一部分患者发生局部或者远处转移甚至死亡,可能有以下几点原因:① 部分患者出现了培美曲塞耐药,文献[14]报道 ,体外培养的培美曲塞耐药细胞株中,TS表达水平会上调;② 检测方法差异导致TS表达高低检测不准确。免疫组化法是在蛋白质水平上来检测TS表达,以肿瘤细胞核染色强度和染色细胞数的多少来判定TS表达高低,因缺乏统一的评分标准,这可能会导致TS判定结果有差异,一些TS高表达患者检测成TS低表达患者而使用了培美曲塞方案化疗,导致化疗不敏感。有研究者[15]在基因水平上行TS检测,即RT-PCR(reversetranscriptasePCR)方法,发现RT-PCR检测优于免疫组化,TS基因检测可能会筛选更多的培美曲塞化疗获益人群,研究[10]表明,免疫组化检测方法在预测培美曲塞对TS表达水平敏感性方面优于RT-PCR。两者之间的差异需要更多的临床证据支持,同时TS检测也需要更敏感的免疫组化检测系统及更为规范的评分标准。
综上所述,吸烟、T分期、N分期、病理分期是ⅠB~ⅢA期肺腺癌患者的独立预后因素。TS低表达患者用培美曲塞方案化疗可以获得更好的预后生存,通过免疫组化法检测肺腺癌患者的TS表达水平,可以筛选肺腺癌患者培美曲塞方案化疗的获益人群。但本研究为单中心回顾性分析,存在一定的病例选择性偏倚。同时本研究采用免疫组化法检测TS蛋白表达,可能存在一定的检验误差,对照组未行TS检测,也是本研究的不足之处,因此本研究结果有待更为规范及精确的前瞻性随机对照研究验证。
[1]SiegelRL,MillerKD,JemalA.Cancerstatistics, 2015[J].CACancerJClin, 2015, 65(1):5-29.
[2] 邹小农.中国肺癌流行病学[J]. 中华肿瘤防治杂志, 2007, 14(12): 881-3.
[3] 裴宝祥, 孙冰生, 张 钰,等. 集落刺激因子1在肺腺癌组织中的表达及其对预后的影响[J].中华肿瘤杂志, 2015, 37(2):113-8.
[4]NicolsonMC,FennellDA,FerryD,etal.Thymidylatesynthaseexpressionandoutcomeofpatientsreceivingpemetrexedforadvancednonsquamousnon-small-celllungcancerinaprospectiveblindedassessmentphaseⅡclinicaltrial[J].JThoracOncol, 2013, 8(7):930-9.
[5]ChattopahyayS,MoranRG,GoldmanID.Pemetrexed:biochemicalandcellularpharmacology,mechanisms,andclinicalapplications[J].MolCancerTher, 2007, 6(2):404-17.
[6]JonesRJ,TwelvesCJ.Pemetrexed:amultitargetedantifolate(ALIMTA,LY-231514)[J].ExpertRevAnticancerTher, 2002, 2(1):13-22.
[7]RighiL,PapottiMG,CeppiP,etal.Thymidylatesynthasebutnotexcisionrepaircross-complementationgroup1tumorexpressionpredictsoutcomeinpatientswithmalignantpleuralmesotheliomatreatedwithpemetrexed-basedchemotherapy[J].JClinOncol,2010, 28(9):1534-9.
[8]TanakaF,WadaH,FukuiY,etal.Thymidylatesynthase(TS)geneexpressioninprimarylungcancerpatients:alarge-scalestudyinJapanesepopulation[J].AnnOncol,2011, 22(8):1791-7.
[9]NakagawaT,TanakaF,OtakeY,etal.Prognosticvalueofthymidylatesynthaseexpressioninpatientswithp-stageⅠadenocarcinomaofthelung[J].LungCancer, 2002, 35(2):165-70.
[10]WangL,WangR,PanY,etal.Thepemetrexed-containingtreatmentsinthenon-smallcelllungcanceris-/lowthymidylatesynthaseexpressionbetterthan+/highthymidylatesynthaseexpression:ameta-analysis[J].BMCcancer,2014,14:205.
[11]SunJM,AhnJS,JungSH,etal.Pemetrexedpluscisplatinversusgemcitabinepluscisplatinaccordingtothymidylatesynthaseexpressioninnonsquamousnon-small-celllungcancer:abiomarker-stratifiedrandomizedphaseⅡtrial[J].JClinOncol,2015,33(22):2450-6.
[12]CeppiP,RapaI,RighiL,etal.ExpressionandpharmacologicalinhibitionofthymidylatesynthaseandSrckinaseinnonsmallcelllungcancer[J].IntJCancer,2012,130(8):1777-86.
[13]ChangMH,AhnJS,LeeJ,etal.Theefficacyofpemetrexedasathird-orfourth-linetherapyandthesignificanceofthymidylatesynthaseexpressioninpatientswithadvancednon-smallcelllungcancer[J].LungCancer, 2010, 69(3):323-9.
[14]WangDS,PatelA,ShuklaS,etal.IcotinibantagonizesABCG2-mediatedmultidrugresistance,butnotthepemetrexedresistancemediatedbythymidylatesynthaseandABCG2[J].Oncotarget,2014, 5(12): 4529-42.
[15]ShintaniY,OhtaM,HirabayashiH,etal.ThymidylatesynthaseanddihydropyrimidinedehydrogenasemRNAlevelsintumortissuesandtheefficacyof5-fluorouracilinpatientswithnon-small-celllungcancer[J].LungCancer, 2004, 45(2):189-96.
Clinical study on thymidylate synthase test for guiding postoperative adjuvant chemotherapy in patients with lung adenocarcinoma
DengJie,XieMingran,GuoMingfa,etal
(Dept of Thoracic Surgery, The Affiliated Provincial Hospital of Anhui Medical University,Hefei 230001)
Objective To evaluate the clinical significance of thymidylate synthase (TS) test for guiding combined chemotherapy with Nedaplatin and Pemetrexed after radical operation for lung adenocarcinoma.Methods A retrospective review was conducted on clinical data from 166 patients with lung adenocarcinoma from stage ⅠB~ⅢA. A total of 94 patients were assigned to the study group, and immunohistochemical tests showed that they were all patients with low expression of TS. On the other hand, 72 patients who didn′t undergo TS test were assigned to the control group. Both groups received combined chemotherapy with Nedaplatin and Pemetrexed. Clinicopathologic features, median disease-free survival time(mDFS), 3 years disease-free survival(DFS), 3-year survival as well as metastasis and recurrence situations were compared between the two groups.Results No statistical difference in clinicopathologic features was found between the two groups. The median disease-free survival time, 1-year, 2-year and 3-year DFS in the study group were respectively 43.0 months, 90.4%, 76.6% and 61.7%, and the indicators above in the control group were respectively 29.9 months, 87.5%, 66.7% and 52.5%. The statistical difference was significant(P=0.035). Three-year survival of the study group was higher than that of the control group(67.7%vs56.4%), with a significant difference(P<0.05). A total of 41 cases(43.6%) of metastasis or recurrence were found in the study group, while 43 cases(59.7%) were found in the control group,and the statistical difference was significant(P=0.04). Multi-factor analysis showed that a history of smoking,T-staging, N-staging and pathological staging were independent prognostic factors for these patients.Conclusion There is a correlation between the expression status of TS and the efficacy of postoperative chemotherapy with Nedaplatin and Pemetrexed in patients with lung adenocarcinoma. A TS test on the postoperative gross specimen for patients with lung adenocarcinoma through immunohistochemical method can screen out those patients who benefited from Pemetrexed chemotherapy.
carcinoma; adenocarcinoma; NSCLC;thymidylate synthase;pemetrexed;prognosis
http://www.cnki.net/kcms/detail/34.1065.R.20160810.1104.025.html
2016-06-23接收
卫生部肿瘤个体化治疗分子诊断技术临床应用研究课题(编号:W2012FZ115)
安徽医科大学附属省立医院胸外科,合肥 230001
邓 杰,男,硕士研究生;
徐美青,男,教授,硕士生导师,责任作者,E-mail:xmqahslyy@163.com
R73
A
10.19405/j.cnki.issn1000-1492.2016.10.025
