Shp2表达沉默对ATPR诱导K562细胞分化作用的影响
2016-11-25王静静葛金芳陈飞虎
丁 然,王静静,葛金芳,陈飞虎
Shp2表达沉默对ATPR诱导K562细胞分化作用的影响
丁 然,王静静,葛金芳,陈飞虎
目的 研究4-氨基-2-三氟甲基苯基维甲酸酯(ATPR)在诱导慢性粒细胞白血病K562细胞分化过程中蛋白酪氨酸磷酸酶(Shp2)的作用。方法 ATPR作用K562细胞,CCK-8法检测细胞生长抑制率;Q-PCR和Western blot法检测Shp2表达;合成特异性荧光短链Shp2 siRNA链,抑制Shp2表达后,观察ATPR对K562细胞增殖和形态学影响。流式细胞术测定周期动力学和特异性分化指标CD235a表达,利用Western blot和Q-PCR法检测维甲酸受体RARs 蛋白和mRNA的表达。结果 ATPR(10-5mol/L)作用于K562细胞72 h时能最显著地抑制增殖,且Shp2的表达明显下降。靶向沉默K562 细胞中Shp2基因的最佳序列为PTPN-Homo-438,siRNA 与 Lipo 的最佳浓度比例为1 ∶0.05。与 ATPR单独用药组比较,siRNA-Shp2+ATPR组的K562细胞增殖活性升高,G0/G1期细胞所占比例降低,S期增多,CD235a的表达下降,形态学较空白组变化不大。Shp2转染沉默后用药组维甲酸受体RARs表达与单独用药组比较有差异。结论 Shp2沉默后,ATPR诱导K562细胞分化作用减弱,提示ATPR诱导K562细胞分化过程中,Shp2可能发挥着作用。
4-氨基-2-三氟甲基苯基维甲酸酯;蛋白酪氨酸磷酸酶;K562细胞;诱导分化;维甲酸受体
全反式维甲酸(all trans retinoic acid,ATRA)作为分化诱导剂的代表已广泛应用于临床上治疗急性早幼粒细胞性白血病[1]。但长期使用ATRA会导致多种不良反应,制约了其在临床上广泛应用[2]。课题组前期研究[3]对ATRA的碳链末端进行结构改造,经过药效学筛选,显示4-氨基-2-三氟甲基苯基维甲酸酯(4-amino-2-trifluoromethyl-phenyl retinate,ATPR)具有较强的活性,并且可诱导多种肿瘤细胞分化成熟,有望成为一种新型的诱导分化剂。蛋白酪氨酸磷酸酶(Shp2)是PTPs胞内非受体型( non-receptor PTPs,NRPTPs)的一员,由ptpn11基因编码。Shp2不仅通过调节包括RAS在内的多条信号通路,而且还与细胞存活、迁移、凋亡、分化等密切相关[4]。同时,编码基因ptpn11的突变在多种疾病如努南综合征、LEOPARD综合征[5]、部分白血病[6-7]等多种肿瘤中发挥着重要作用。在血液系统中,造血祖细胞对造血生长因子的刺激可以通过Shp2突变体而变得敏感[8],并且Shp2对造血细胞的发育也十分重要[9]。Shp2被认为是治疗肿瘤的靶点。该研究以K562细胞为研究对象,通过小分子干扰RNA(siRNA)技术,建立Shp2表达沉默模型,探究ATPR在诱导K562细胞分化过程中Shp2所起的作用。
1 材料与方法
1.1 材料 ATPR(安徽医科大学药学院);ATRA( 美国Sigma公司);RPMI-1640培养液(上海碧云天公司);胎牛血清(杭州四季青公司);瑞氏-吉姆萨染液(生产批号:20150717,南京建成生物科技研究所);CCK-8(批号:BB150091)、细胞周期检测试剂盒(批号:88150071)(上海贝博生物公司);TRIzol(美国Ambion公司);Lipofectamine 2000、Shp2引物及RARs引物(美国Invitrogen公司);逆转录试剂盒和Q-PCR试剂盒(美国Vazyme公司);siRNA(苏州吉玛基因股份有限公司);抗β-actin、抗Shp2、抗RARα、抗RARβ抗体(美国Immunoway公司);抗RARγ抗体(美国Santa公司)。
1.2 细胞培养 K562细胞由安徽医科大学药学院李晓峰馈赠,使用含10%胎牛血清(FBS)的RPMI-1640培养液进行培养,在37 ℃、5% CO2培养箱中生长,取对数期生长的细胞进行试验。
1.3 ATPR对K562细胞增殖及Shp2表达的影响
1.3.1 CCK-8法测定ATPR对K562细胞生长增殖的影响 将K562细胞接种至96孔培养板中,浓度为5×104/ml,体积为100 μl。实验分组为:空白组、溶剂对照组(含0.02%无水乙醇)、ATRA组(10-5mol/L)、ATPR组(10-4~10-9mol/L),每孔的终体积为200 μl,分别在24、48、72 h时加入10 μl CCK-8,继续培养4 h,测定吸光度(absorbance,A)值。
1.3.2 Q-PCR法检测K562细胞中Shp2 mRNA表达 将K562细胞接种至细胞培养瓶中,浓度为1×105/ml,实验分组为:空白组(RPMI-1640培养液)、溶剂对照组(0.02%无水乙醇)、ATRA组(10-5mol/L)及ATPR组(10-5mol/L)。72 h后,抽提细胞RNA并逆转录为cDNA,根据abmEVAGreen 2×PCR MasterMix 实验方法,以β-actin为内参,上机进行检测。
1.3.3 Western blot法检测K562细胞中Shp2蛋白表达 实验按1.3.2分组处理72 h后,提取总蛋白,使用BCA法测定蛋白浓度,根据蛋白浓度决定上样量,依次进行电泳、转膜、封闭,Shp2小鼠抗兔单克隆抗体(1 ∶1 000)4 ℃孵育过夜,辣根酶标记的山羊抗兔二抗(1 ∶5 000)室温下孵育2 h。洗涤、显影,根据蛋白条带测定光密度值,表示Shp2蛋白的表达强度。
1.4 制备并筛选沉默K562细胞内Shp2的siRNA最佳序列
1.4.1 siRNA序列设计与制备 在NCBI数据库中查找Shp2 mRNA全序列,从Shp2编码区中寻找符合设计原则的靶序列,从而合成Shp2-siRNA序列。Shp2-siRNA 3条序列为:PTPN-Homo-438上游引物:5′-GUUGACAAGAGGAGUUGUTT-3′,下游引物:5′-AUCAACUCCUCUUGUCAACTT-3′;PTPN-Homo-948上游引物:5′-GACAGAUCUUGUGGAACAUTT-3′,下游引物:5′-AUGUUCCACAAGAUCUGUCTT-3′;PTPN-Homo-1493上游引物:5′-CUGAUGAGUAUGCUCUAAATT-3′,下游引物:5′-UUUAGAGCAUACUCAUCAGTT-3′。
1.4.2 siRNA转染及分组 转染前,收集细胞,每孔接种5×105个细胞于6孔板中。实验分为:空白组、每条siRNA与Lipo按照1 ∶0.08、1 ∶0.06、1 ∶0.05、1 ∶0.04各分4组,配制不同比例siRNA-Lipo混合物。将siRNA-Lipo混合液加到培养瓶中,再加4 ml Opti-MEM培养基,摇匀,继续培养。
1.4.3 荧光强度观察转染效率 转染后,培养6 h后,利用激发波长为480 nm、发射波长为520 nm的蓝激发光,采用荧光倒置显微镜观察K562细胞质中绿色荧光强度。
1.4.4 Western blot法检测沉默后Shp2的蛋白表达 提取转染后各组K562细胞的总蛋白,根据蛋白浓度决定上样量,依次进行电泳、转膜、封闭,孵育Shp2一抗(1 ∶1 000)4 ℃孵育过夜后,其后操作同1.3.3。
1.5 Shp2转染沉默后ATPR对K562细胞诱导分化的影响
1.5.1 CCK-8法检测转染后细胞增殖状况 实验分组:空白组(RPMI-1640培养液)、ATRA组(10-5mol/L)、ATPR组(10-5mol/L)、Shp2沉默不加药组(siRNA-Lipo)、siRNA-Lipo+ATRA组以及siRNA-Lipo+ATPR组。实验方法同1.3.1。
1.5.2 细胞形态学观察 将K562细胞接种于6孔板中,细胞浓度为1×105/ml,实验分组同1.5.1。药物处理72 h后,收集细胞,PBS洗涤2~3次,用PBS重悬、混匀,滴加在载玻片上,自然风干,依次滴加瑞氏-吉姆萨染液A液和B液,流水冲洗、干燥,观察并拍摄(×400)油镜下的细胞。
1.5.3 细胞周期和DNA倍体分析 将K562细胞接种于6孔板中,细胞浓度为1×105/ml,实验分组同1.5.1。药物处理72 h后,收集细胞,洗涤,加入75%冰乙醇2 ml,-20 ℃固定1 h或4 ℃过夜(起固定作用)。用200~500 μl冷PBS重悬细胞,加入Rnase A溶液20 μl,37 ℃水浴30 min,然后加入400 μl PI染液,轻轻混匀后避光4 ℃孵育30 min~1 h,使用BD FACSVerseTM流式细胞仪检测结果。
1.5.4 细胞表面分化抗原检测 将K562细胞接种于6孔板中,细胞浓度为1×105/ml,实验分组同1.5.1。72 h后收集细胞,用PBS调整各组细胞密度为1×106个/ml,加入CD235a-PE单克隆抗体,充分涡旋后,避光4 ℃孵育20 min,使用流式细胞仪检测结果。
1.5.5 Q-PCR法检测K562细胞中RARs mRNA表达 将K562细胞接种于细胞培养瓶中,细胞浓度为4×105/ml,实验分组同1.5.1,72 h后,按TRIzol说明书提取K562细胞的RNA,逆转录获得cDNA,根据Q-PCR试剂盒说明书按比例进行上样,以β-actin为内参,上机进行检测。引物序列见表1。
1.5.6 Western blot法检测RARα、RARγ蛋白的表达 将K562细胞接种于细胞培养瓶中,细胞浓度为4×105/ml,实验分组同1.5.1,提取各处理组K562细胞的总蛋白,并进行定量。根据蛋白浓度决定上样量,依次进行电泳、转膜、封闭,并孵育相应一抗,4 ℃过夜。随后操作同1.3.3。


表1 Q-PCR引物序列
2 结果
2.1 ATPR对K562细胞增殖及Shp2表达的影响
2.1.1 ATPR对K562细胞增殖的影响 溶剂对照组的A490值与空白组比较差异无统计学意义,说明无水乙醇(0.02%)作为药物溶剂对细胞活性无影响。显微镜下观察加药后各组细胞显示,ATPR(10-4mol/L)作用于K562细胞时细胞形态发生皱缩,细胞出现大面积凋亡;其他各组ATPR作用24 h时对K562细胞增殖无影响,作用48、72 h后,细胞发生不同程度的抑制增殖作用。10-5mol/L ATPR作用72 h时K562细胞增殖抑制最明显(P<0.01)。见表2。
2.1.2 ATPR作用于K562细胞72 h后Shp2 mRNA表达变化 K562细胞在ATPR(10-5mol/L)作用72 h后,与溶剂对照组比较,其 Shp2 mRNA的表达明显下降(F=87.23,P<0.01)。见图1。
2.1.3 ATPR作用于K562细胞72 h后Shp2蛋白表达变化 Western blot结果显示,与溶剂对照组比较,ATPR(10-5mol/L)作用72 h后K562细胞中Shp2蛋白表达降低(F=75.36,P<0.01)。见图2。

图1 ATPR对K562细胞中Shp2 mRNA的表达影响
A:空白组;B:溶剂对照组;C:ATRA(10-5mol/L)组;D:ATPR(10-5mol/L)组;与溶剂对照组比较:**P<0.01

图2 ATPR对K562细胞中Shp2蛋白的表达影响
A:空白组;B:溶剂对照组;C:ATRA(10-5mol/L)组;D:ATPR(10-5mol/L)组;与溶剂对照组比较:*P<0.05,**P<0.01
2.2 筛选Shp2 siRNA与Lipofectamine 2000最佳浓度和比例
2.2.1 荧光法测定各条Shp2-siRNA 转染效率 本与溶剂对照组比较:*P<0.05,**P<0.01

表2 ATPR对K562细胞增殖的影响

图3 siRNA/Lipo 2000不同比例浓度对siRNA-FAM进入细胞的影响 ×40
A:PTPN-Homo-438;B:PTPN-Homo-948;C:PTPN-Homo-1493;D:空白组;1:siRNA ∶Lipo=1 ∶0.08;2:siRNA ∶Lipo=1 ∶0.06;3:siRNA ∶Lipo=1 ∶0.05;4:siRNA ∶Lipo=1 ∶0.04
研究中设计合成的siRNA其3′端为FAM荧光标记。空白组(siRNA/Lipo 2000比例为0 μl ∶0 μl)几乎无荧光表达,当siRNA/Lipo 2000为其他比例时荧光倒置显微镜下均能观察到不同程度荧光。通过比较各组荧光程度显示PTPN-Homo-438组和PTPN-Homo-1493组荧光表达较多。见图3。
2.2.2 各条siRNA序列转染对K562细胞中Shp2蛋白表达的影响 结果显示:K562细胞经转染后,与空白组比较,Shp2的蛋白质表达下降,与其他各组比较,PTPN-Homo-438组下降明显,PTPN-Homo-438/Lipo 2000比值为1 ∶0.05时,Shp2蛋白表达低于其他各组,差异有统计学意义(P<0.01),见图4。
2.3 Shp2基因转染沉默后ATPR对K562细胞分化的影响
2.3.1 转染沉默Shp2基因后ATPR对K562细胞增殖的影响 转染24 h后,各组细胞生长无明显变化,48 h时ATPR组与空白组比较细胞增殖降低(P<0.01),siRNA-Shp2+ATPR组细胞生长较ATPR组增加,72 h后ATPR组与空白组比较细胞增殖明显降低(P<0.01),siRNA-Shp2+ATPR组细胞生长比ATPR组显著增多(P<0.01),而siRNA-Shp2+

图4 不同siRNA序列转染对siRNA-Shp2蛋白表达的影响
A:PTPN-Homo-438;B:PTPN-Homo-948;C:PTPN-Homo-1493;D:空白组;1:siRNA ∶Lipo=1 ∶0.08;2:siRNA ∶Lipo=1 ∶0.06;3:siRNA ∶Lipo=1 ∶0.05;4:siRNA ∶Lipo=1 ∶0.04;与空白组比较:**P<0.01
ATPR组与siRNA-Lipo组之间差异无统计学意义。见图5。
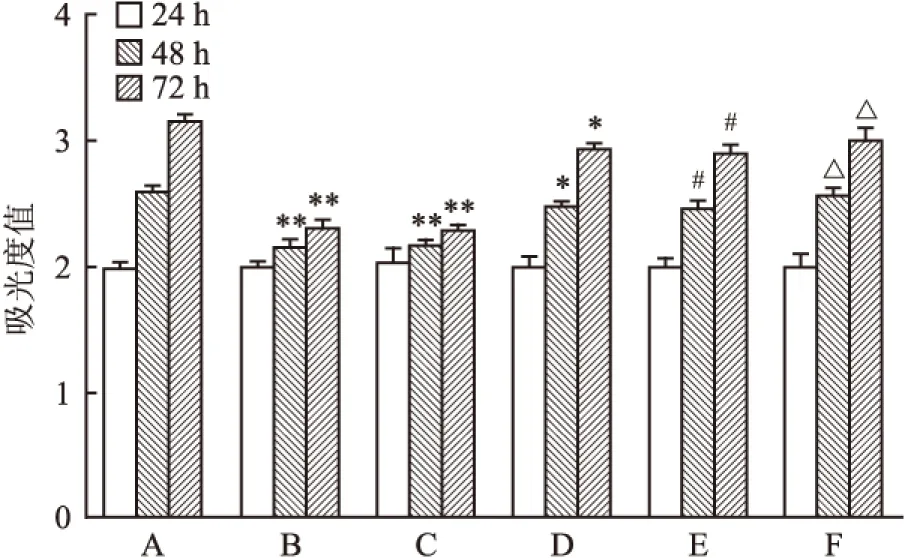
图5 转染沉默Shp2基因后加ATPR对细胞增殖的影响
A:空白组;B:ATRA(10-5mol/L)组;C:ATPR(10-5mol/L)组;D:siRNA-Lipo组;E:siRNA-Lipo+ATRA组;F:siRNA-Lipo+ATPR组;与空白组比较:*P<0.05,**P<0.01;与ATRA组比较:#P<0.05;与ATPR组比较:△P<0.05
2.3.2 Shp2基因转染沉默后ATPR对细胞形态学影响 ATPR(10-5mol/L)对K562细胞作用72 h后形态学变化见图6。结果显示:空白组出现细胞呈圆形、体积较大、核/质比例大、核圆形等特点。用药组的细胞出现细胞和细胞核体积缩小、核质比例缩小、核偏于一侧等细胞分化程度成熟的形态学状态。然而siRNA-Shp2+ATPR组染色后倒置显微镜所呈现的细胞状态跟空白组较为相似,并没有出现明显的细胞开始分化所表现出的现象。

图6 ATPR作用72 h后K562细胞的形态学变化 ×400
A:空白组;B:ATRA(10-5mol/L)组;C:ATPR(10-5mol/L)组;D:siRNA-Lipo组;E:siRNA-Lipo+ATRA组;F:siRNA-Lipo+ATPR组
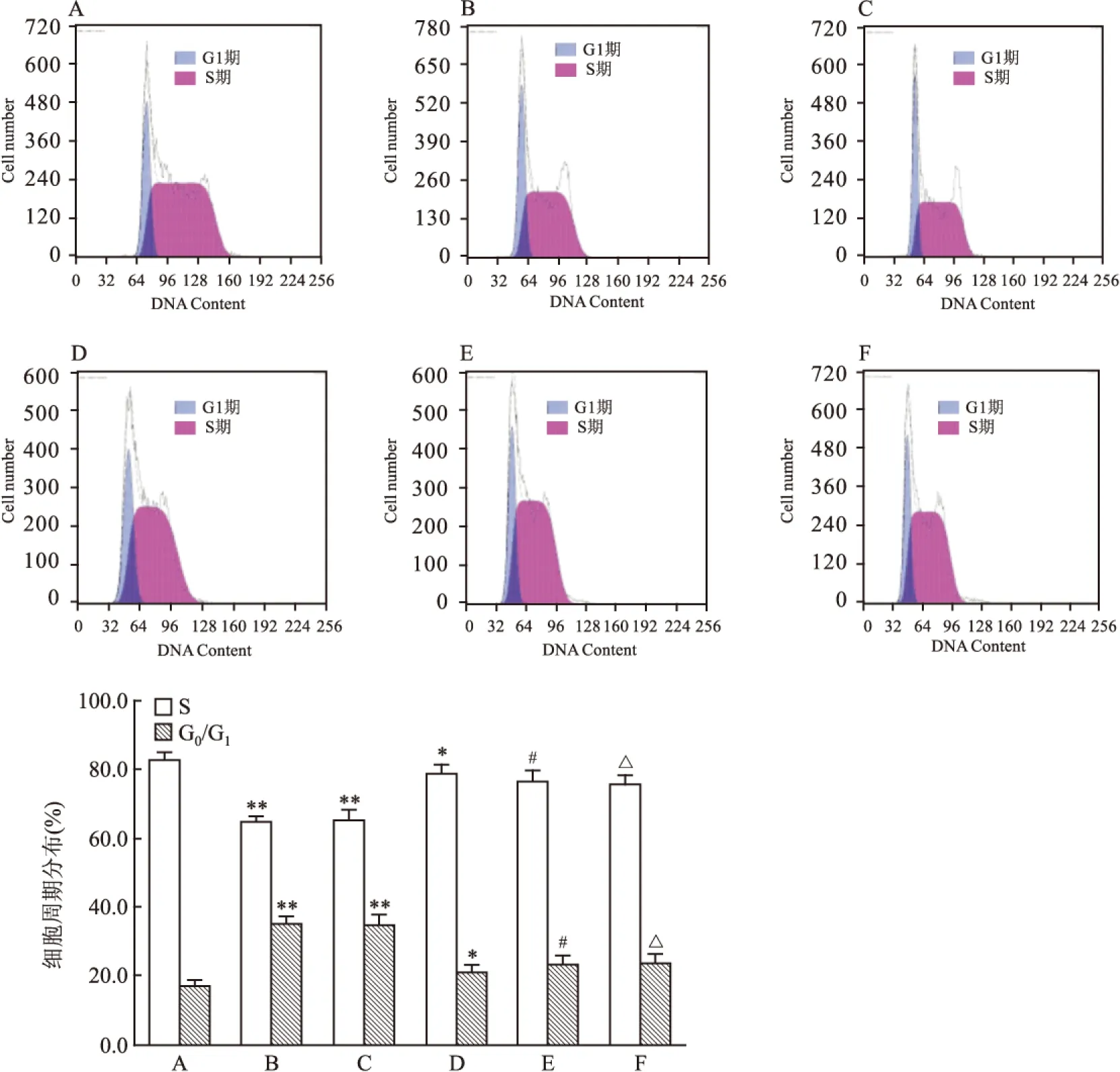
2.3.3 Shp2基因转染沉默后K562细胞周期及DNA倍体分析 细胞周期分析结果显示,ATRA(10-5mol/L)和ATPR(10-5mol/L)组作用于K562细胞72 h后,与空白组比较,S期细胞所占百分比明显下降,G0/G1期细胞百分比上升。当Shp2基因转染沉默后,siRNA-Shp2+ATPR组与siRNA-Lipo组比较差异无统计学意义(F=183.559,P>0.05),siRNA-Shp2+ATPR组与ATPR组比较差异有统计学意义(F=42.397,P<0.05)。 见图7。
2.3.4 Shp2基因转染沉默后细胞表面分化抗原CD235a表达改变 CD235a抗原为血型糖蛋白A(glycophorin A)抗原,是红系特异抗原。ATPR处理K562细胞72 h后,与空白组比较,结果显示CD235a表达上升(P<0.01)。当Shp2基因转染沉默后,siRNA-Lipo+ATPR组与ATPR组比较,CD235a 表达变化明显,差异有统计学意义(F=342.071,P<0.01)。见图8。
2.3.5 Shp2基因转染沉默后K562细胞中RARs mRNA的表达变化 当K562细胞经过ATPR(10-5mol/L)作用72 h后,与空白组比较,RARα的mRNA表达下降,而RARγ的mRNA表达上升。当Shp2基因转染沉默后,siRNA-Lipo+ATPR组细胞的RARα和RARγ mRNA表达与siRNA-Lipo之间差异无统计学意义(FRARα=2.908、FRARγ=0.727,P>0.05),而siRNA-Lipo+ATPR组与ATPR组比较,其RARα和RARγ组的mRNA表达差异有统计学意义(FRARα=17.355、FRARγ=44.145,P<0.01)。见图9。
2.3.6 Shp2基因转染沉默后K562细胞中RARα、RARγ蛋白的表达变化 与空白组比较,ATPR(10-5mol/L)组RARα的蛋白表达下降(F=83.183,P<0.05),RARγ的蛋白表达上升(F=124.307,P<0.01)。然而当Shp2基因转染沉默后,siRNA-Lipo+ATPR组细胞RARα和RARγ蛋白表达与siRNA-Lipo之间差异无统计学意义(FRARα=3.012、FRARγ=4.165,P>0.05),而siRNA-Lipo+ATPR组与ATPR组比较,其RARα和RARγ组的蛋白表达差异有统计学意义(FRARα=29.580、FRARγ=40.790,P<0.01)。见图10。
3 讨论
慢性粒细胞性白血病(chronic myelogenous leukemia,CML)是一类影响血液及骨髓的恶性肿瘤,其特点是产生不成熟的白细胞,这些白细胞聚集于骨髓,致使骨髓的造血被抑制;并且能够通过血液在全身扩散。90%以上CML患者有费城染色体(Ph),(t9;22)(q34;q11)染色体易位并形成BCR/ABL融合基因,从而致使疾病产生[10]。研究[11]显示,Shp2参与BCR / ABL 信号通路,与费城染色体阳性白血病的发生密切相关。本研究以K562细胞为研究对象,通过Q-PCR和Western blot法检测证实,当ATPR作用于K562细胞时,其Shp2的表达明显降低,说明K562细胞被ATPR作用过程中,Shp2可能发挥着作用。为了进一步证实Shp2在ATPR诱导K562细胞分化过程中的作用,本研究通过小分子干扰RNA(siRNA)技术建立Shp2表达沉默模型来进行研究。荧光法和Western blot法结果表明:PTPN-Homo-438与Lipo比例为1 ∶0.05时Shp2蛋白表达最低,故选用此条件进行转染。

A:空白组;B:ATRA(10-5mol/L)组;C:ATPR(10-5mol/L)组;D:siRNA-Lipo组;E:siRNA-Lipo+ATRA组;F:siRNA-Lipo+ATPR组;与空白组比较:**P<0.01;与ATRA组比较:#P<0.05;与ATPR组比较:△P<0.05

图8 ATPR对K562细胞表面分化抗原CD235a表达的影响
A:空白组;B:ATRA(10-5mol/L)组;C:ATPR(10-5mol/L)组;D:siRNA-Lipo组;E:siRNA-Lipo+ATRA组;F:siRNA-Lipo+ATPR组;与空白组比较:**P<0.01;与ATRA组比较:##P<0.01;与ATPR组比较:△△P<0.01
课题组前期研究[12]证实ATPR对K562细胞具有诱导分化作用,然而当Shp2被转染沉默后,CCK-8检测结果表明:靶向沉默Shp2基因6 h后加入ATPR,用药72 h后,siRNA-Shp2+ATPR组与ATPR组相比细胞生长显著增多,表明ATPR作用后,siRNA-Shp2+ATPR组细胞增殖明显高于ATPR组。形态学变化可作为细胞分化程度的重要指标[13], 并且能够反映出诱导分化剂的诱导分化能力。瑞氏染色后结果显示K562细胞被ATPR作用72 h后,细胞形态学趋向于分化成熟方向, 然而siRNA-Shp2+ATRA组和siRNA-Shp2+ATPR组形态学变化没有ATPR组明显,当Shp2被转染沉默后,ATPR诱导K562细胞分化的形态学变化减弱。

图9 ATPR作用72 h后K562细胞RARs mRNA表达量的变化
A:空白组;B:ATRA(10-5mol/L)组;C:ATPR(10-5mol/L)组;D:siRNA-Lipo组;E:siRNA-Lipo+ATRA组;F:siRNA-Lipo+ATPR组;与空白组比较:*P<0.05,**P<0.01;与ATRA组比较:##P<0.01;与ATPR组比较:△△P<0.01
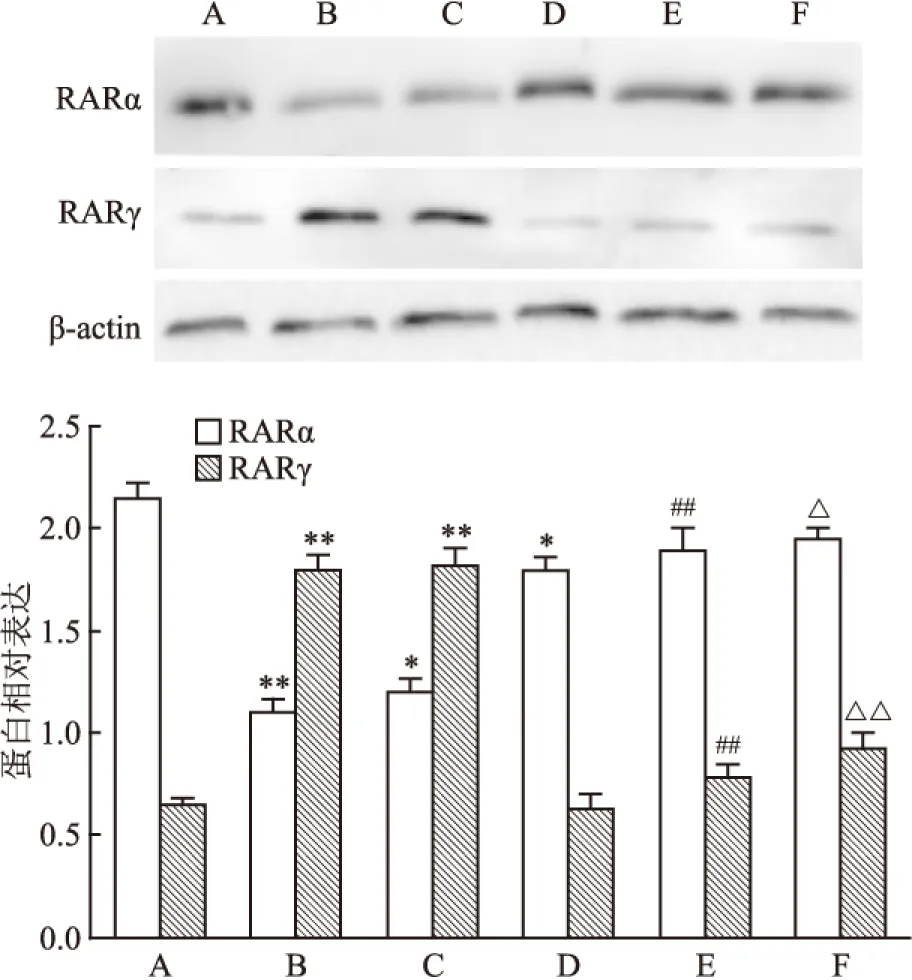
图10 ATPR作用72 h后K562细胞RARs蛋白表达量的变化
A:空白组;B:ATRA(10-5mol/L)组;C:ATPR(10-5mol/L)组;D:siRNA-Lipo组;E:siRNA-Lipo+ATRA组;F:siRNA-Lipo+ATPR组;与空白组比较:*P<0.05,**P<0.01;与ATRA组比较:##P<0.01;与ATPR组比较:△P<0.05,△△P<0.01
细胞S期比例高是恶性肿瘤细胞的周期分布特点之一,分化后细胞G0/G1期比例升高[14]。根据细胞周期结果显示:ATPR作用72 h后,K562细胞中G0/G1期比例升高,S期细胞比例降低。当Shp2基因被沉默后,siRNA-Shp2+ATPR组细胞周期变化与ATPR组比较有明显差异,说明Shp2对ATPR作用K562细胞有影响。CD235a抗原为血型糖蛋白A抗原,是红系特异抗原,可作为ATPR诱导K562细胞分化的重要标志[15],流式结果显示,ATPR处理K562细胞72 h后,与空白组比较,CD235a表达上升,证实K562细胞可被ATPR诱导向红系分化。当Shp2基因转染沉默后,siRNA-Shp2+ATPR组的CD235a 表达变化相较于ATPR组明显降低,说明当Shp2被转染沉默后,ATPR诱导K562细胞分化作用降低。
研究[16]显示,维甲酸类药物是通过与细胞内的维甲酸受体结合,调节体内生理过程。RARs在不同的细胞中的分布有差异,因此 ATPR 在各种细胞中刺激的RARs亚型也不一样。前期实验[12]结果显示,当ATPR诱导K562细胞分化过程中,RARɑ表达下降,RARγ表达上升,RARβ表达没有明确变化。根据Western blot和Q-PCR结果显示:当转染沉默Shp2后,siRNA-Shp2+ATPR组的RARα和RARγ的表达变化与siRNA-SHP2组比较差异无统计学意义,而siRNA-Shp2+ATPR组与ATPR组比较,RARα和RARγ的表达变化明显,提示K562细胞在被ATPR通过RARs作用的过程中,Shp2可能参与着作用。
综上所述,PTPN-Homo-438可有效沉默Shp2基因的表达; ATPR可显著抑制K562细胞增殖并致使其分化程度上升;然而当Shp2被转染沉默后,ATPR对K562细胞抗增殖和诱导分化作用明显降低甚至消失,提示Shp2可能是介导抗白血病作用的主要环节。
[1] Brown G, Hughes P. Retinoid differentiation therapy for common types of acute myeloid leukemia[J].Leuk Res Treatment, 2012, 2012: 939021.
[2] Sanz M A,Montesinos P. How we prevent and treat differentiation syndrome in patients with acute promyelocytic leukemia[J]. Blood,2014,123(18):2777-82.
[3] 沈 娟, 陈飞虎, 石静波, 等. 维甲酸衍生物的合成及其抗肿瘤活性研究[J].中国新药杂志, 2009, 18(11): 86-9.
[4] Qiu W,Wang X,Romanov V, et al.Structural insights into Noonan/LEOPARD syndrome-related mutants of protein-tyrosine phosphatase SHP2(PTPN11)[J].BMC Structural Biology,2014,14:10.
[5] Digilio M C,Conti E,Sarkozy A,et al.Grouping of multiple lentigines/LEOPARD and Noonan syndromes on the PTPN11 gene[J].Am J Hum Genet,2002,71(2):389-94.
[6] Nabinger S C,Chan R J.Shp2 function in hematopoietic stem cell biology and leukemogenesis[J].Curr Opin Hematol,2012,19(4):273-9.
[7] Chen L,Chen W,Mysliwski M,et al.Mutated Ptpn11 alters leukemic stem cell frequency and reduces the sensitivity of acute myeloid leukemia cells to Mcl1 inhibition[J].Leukemia,2015,29(6):1290-300.
[8] Loh M L, Vattikuti S, Schubbert S,et al.Mutations in PTPN11 implicate the SHP2 phosphatase in leukemogenesis[J].Blood,2004,103(6):2325-31.
[9] Broxmeyer H E,Etienne-Jnlan M,Gotoh A,et al.Hematopoietic colony formation from human growth factor-dependent TF1 cells and human cord blood myeloid progenitor cells depends on SHP2 phosphatase function[J].Stem Cells Dev,2013,22(6):998-1006.
[10]Sun W T,Xiang W,Ng B L,et al.Inhibition of isoprenylcysteine carboxylmethyltransferase augments BCR-ABL1 tyrosine kinase inhibition induced apoptosis in chronic myeloid leukaemia[J].Exp Hematol,2016 ,44(3):189-93.e2.
[11]Chen J,Yu W M.Daino H,et al.SHP2 phosphatase is required for hematopoietic cell transformation by Bcr-Abl[J].Blood,2007,109(2):778-85.
[12]阮晶晶, 陈飞虎, 徐 佼, 等. 4-氨基-2-三氟甲基苯基维甲酸酯对K562细胞分化和细胞周期的影响[J].中国药理学通报, 2009, 25(9): 1238-43.
[13]吴 菲, 陈飞虎, 洪凡青, 等. ATPR对ECA-109、PANC-1、Hela细胞增殖及分化的影响[J].中国癌症杂志, 2012, 22(4): 257-63.
[14]Bastie J N, Balitrand N,Guillemot I, et al.Cooperative action of 1a,25-dihydroxyvitamin D3 and retinoic acid in NB4 acute promyelocytic leukemia cell differentiation is transcriptionally controlled[J]. Exp Cell Res, 2005, 310(2): 319-30.
[15]陈 晶, 李 欢, 安 娜, 等. TBLR1-RARɑ融合基因对K562细胞向红系分化的影响[J].中国实验血液学杂志,2015,23(6):1702-8.
[16]Dawson H D,Collins G,Pyle R, et al. The Retinoic Acid Receptor-alpha mediates human T-cell activation and Th2 cytokine and chemokine production[J]. BMC Immunol, 2008,9:16.
Effect of Shp2 gene silencing on the 4-amino-2-trifluoromethyl-phenyl retinate inducing differentiation of K562 cells
Ding Ran,Wang Jingjing,Ge Jinfang,et al
(SchoolofPharmacy,AnhuiMedicalUniversity,Hefei230032)
Objective To investigate the effect of protein tyrosine phosphatase Shp2 on 4-amino-2-trifluoromethyl-phenyl retinate (ATPR) induced differentiation of K562 cells. Methods K562 cells were cultured and treated with ATPR at different concentrations. The proliferation of K562 cells was evaluated using CCK-8.The mRNA and protein expressions of Shp2 were detected by Q-PCR and Western blot .Lipofectamine 2000 transfection reagent was used to transfect the small interfering RNA (siRNA) in K562 cells.Using CCK-8 assay to detect the proliferation of K562 cells. Morphologic changes were observedviaWright-Giemsa staining. Using FCS to observe the expression of an exclusive cell surface antigen CD235a and the distribution of cell cycle on K562 cells.The mRNA and protein expressions of retinoic acid receptors (RARα and RARγ) were detected by Q-PCR and Western blot, respectively. Results The best inhibitory effect reached the peak at 72 h. The expressions of Shp2 remarkably decreased. Detected through fluorescence microscope and Western blot, the PTPN-Homo-438 and the concentration ratio of the siRNA and Lipo was 1 ∶0.05. The gene silencing efficacy was the best. Compared with the ATPR group, the proliferation of K562 cells were not inhibited by treatment with ATPR (10-5mol/L) .The percentage of cells in G0/G1 phase was decreased while S-phase cells were increased, and the expression level of the maturation specific cell surface marker CD235a decreased in K562 cells. Q-PCR and Western blot results showed that RARα mRNA and protein expressions of siRNA+ATPR group were significantly increased than ATPR group. RARγ mRNA and protein expressions of siRNA+ATPR group were decreased than ATPR group. Conclusion The effect of ATPR induced differentiation of K562 cells might be involved with the Shp2 gene.
4-amino-2-trifluoromethyl-phenyl retinate; Shp2; K562 cells; inducing differentiation; retinoic acid receptor
时间:2016-8-10 11:04:48
http://www.cnki.net/kcms/detail/34.1065.R.20160810.1104.003.html
2016-06-12接收
国家科技部“重大新药创新”科技重大专项(编号:2011ZX09401-021)
安徽医科大学药学院,合肥 230032
丁 然,男,硕士研究生;
陈飞虎,男,教授,博士生导师,责任作者,E-mail:cfhchina@sohu.com
R 593.22;R 392.3;R 392.5;R 967;R 979.5
A
1000-1492(2016)10-1403-08
10.19405/j.cnki.issn1000-1492.2016.10.003
