灯盏花乙素对肝星状细胞及TGF-β1/Smad信号通路的作用评价
2016-11-25闫瑢玓方慧迟莉
闫瑢玓 方慧 迟莉
灯盏花乙素对肝星状细胞及TGF-β1/Smad信号通路的作用评价
闫瑢玓 方慧 迟莉
目的 观察灯盏花乙素(scutellarin)对肝星状细胞(hepatic stellate cell,HSC)及转化生长因子β1(TGF-β1)/Smad信号通路的影响,探讨scutellarin抗肝纤维化的机制。方法 建立TGF-β1诱导的HSC LX-2模型,CCK-8法检测scutellarin对细胞增殖的作用,化学发光法检测scutellarin对Caspase3/7活性的影响,酶联免疫吸附测定(enzyme linked immunosorbent assay, ELISA)法检测细胞上清液Ⅰ型前胶原的含量,ELISA法检测细胞Smad2和Smad3磷酸化水平。结果
灯盏花乙素; 肝星状细胞; TGF-β1/Smad信号通路
肝纤维化是指在各种致病因子作用下,肝星形细胞(hepatic Stellate cell,HSC)被活化并增殖,分泌出大量的胶原纤维,过度沉积于肝脏的病理过程,它不是一个独立的疾病,而是许多慢性肝脏疾病的共同阶段。肝纤维化属于可逆的阶段,肝纤维化阶段的治疗非常重要[1]。灯盏花乙素(scutellarin,scu)又名野黄芩苷,是从灯盏花中提取的一种黄酮类成分,具有广泛的生物学活性。近年来发现灯盏花乙素对多种器官纤维化[2-3]有治疗作用,可以减轻CCl4和猪血清诱导的肝纤维化大鼠模型的纤维化程度[4-5],但其抗肝纤维化的作用机制研究较少。转化生长因子β1 (transforming growth factor-β1,TGF-β1)是促进HSC增殖和胶原纤维分泌作用最强的细胞因子之一[6]。本研究拟在人肝星形细胞系LX-2细胞上观察灯盏花乙素对肝星形细胞生物学活性及TGF-β1信号通路的影响,初步探讨灯盏花乙素治疗肝纤维化的作用机制。
1 材料和方法
1.1 药品、试剂和器材
灯盏花乙素,成都贝斯特试剂有限公司,纯度≥98%,批号:150615;LX-2细胞,Scott L. Friedman教授赠送[7];胎牛血清(fetal bovin serum, FBS),GIBCO公司,批号:1616496;DMEM高糖培养基,Hyclone,批号:NAC1363;Cell Counting Kit-8 (CCK-8)试剂盒,日本同仁化学研究所,批号: GX612;Caspase-Glo®3/7检测试剂盒,普洛麦格(北京)生物技术有限公司,批号:0000116968;转化生长因子β1,Peprotech Inc,批号:100-21;Procollagen Type I C-peptide(PIP)EIA试剂盒,Takara Bio Inc,批号:AK1801;PathScan®Phospho-Smad2 (Ser465/467)Sandwich ELISA Kit,Cell Signaling Technology,Inc,批号:0015;PathScan®Phospho-Smad3(Ser423/425)Sandwich ELISA Kit,Cell Signaling Technology,Inc,批号:0028。
十万分之一电子天平,OHAUS,型号:AP2500;酶标仪,美国BIO-RAD公司,型号:MODEL 6800;倒置荧光显微镜,西安测维光电技术有限公司,型号: LWD300-38LT1;Ensipire®多功能酶标仪, PerkinElmer,型号:2300;二氧化碳培养箱,赛默飞世尔科技(中国)有限公司,型号:371。
1.2 CCK-8法检测灯盏花乙素对LX-2细胞增殖的影响[8]
分别在正常状态和TGF-β1刺激下观察灯盏花乙素对LX-2细胞增殖的影响。将LX-2细胞消化成单细胞悬液,按1×104个/孔接种于96孔板中,培养24小时后,加入灯盏花乙素,TGF-β1刺激的组别同时加入2 pg/L的TGF-β1,培养24小时,加入CCK-8 20 μL,培养0.5小时,采用酶标仪在450 nm波长处测定其光吸收值。
1.3 化学发光法检测灯盏花乙素对LX-2细胞Caspase3/7活力的影响
将LX-2细胞消化成单细胞悬液,按1×104个/孔接种于96孔板中,接种于96孔板中,培养24小时后,加入灯盏花乙素,再分别培养10小时和22小时,加入检测试剂,每孔100 μL,继续培养2小时,用化学发光仪检测其化学发光值。
1.4 ELISA法检测灯盏花乙素对LX-2细胞Ⅰ型前胶原分泌的影响[9]
将LX-2细胞消化成单细胞悬液,按1×104个/孔接种于96孔板中,培养24小时,加入2 pg/L的TGF-β1和灯盏花乙素,再培养48小时,采用ELISA法检测上清中Pro-collagenⅠ的影响。
1.5 ELISA法检测灯盏花乙素对LX-2细胞TGF-β1信号通路Smad2、Smad3磷酸化水平的影响
将1.5×105个LX-2细胞接种于12孔板中,培养24小时后,换为无血清培养基,培养24小时,加入灯盏花乙素培养2小时,加入2 ng/mL TGF-β1, 30分钟后,将上清吸出,用PBS冲洗细胞1次,加入细胞裂解液,在冰上孵育5分钟,将细胞刮下来,超声2次,3000 rpm,离心10分钟,将上清取出,每孔加100 μL稀释后的细胞裂解液到酶标板中,之后按试剂盒说明书进行操作。
1.6 统计学处理
实验数据采用SPSS 14.0进行数据分析,计量资料以均数±标准差(±s)表示,对各组数据先进行方差齐性检验。如方差齐,用GraphPad Prism软件进行单因素方差分析,Dunnet-t检验;如果方差不齐,进行对数转化后,再进行方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 灯盏花乙素对LX-2细胞增殖的影响
1、10、100 μmol/L 3个浓度的灯盏花乙素作用24小时对正常LX-2细胞活力无明显影响;2 pg/L TGF-β1作用24小时可明显诱导HSC的增殖,10 μmol/L和100 μmol/L灯盏花乙素对TGF-β1诱导的LX-2细胞增殖有抑制作用,提示灯盏花素有抑制TGF-β1诱导的HSC增殖的作用。见表1。
2.2 灯盏花乙素对LX-2细胞Caspase3/7活力的影响
灯盏花乙素作用12小时和24小时,只有100 μmol/L的灯盏乙素能提高LX-2细胞的Caspase3/7活力,表明只有高浓度的灯盏花素可在一定程度上诱导HSC的凋亡,灯盏花乙素对HSC增殖的抑制作用并非全部通过诱导凋亡而实现。见表1。
表1 灯盏花乙素对LX-2细胞增殖、Caspase3/7水平的影响(n=3,±s)
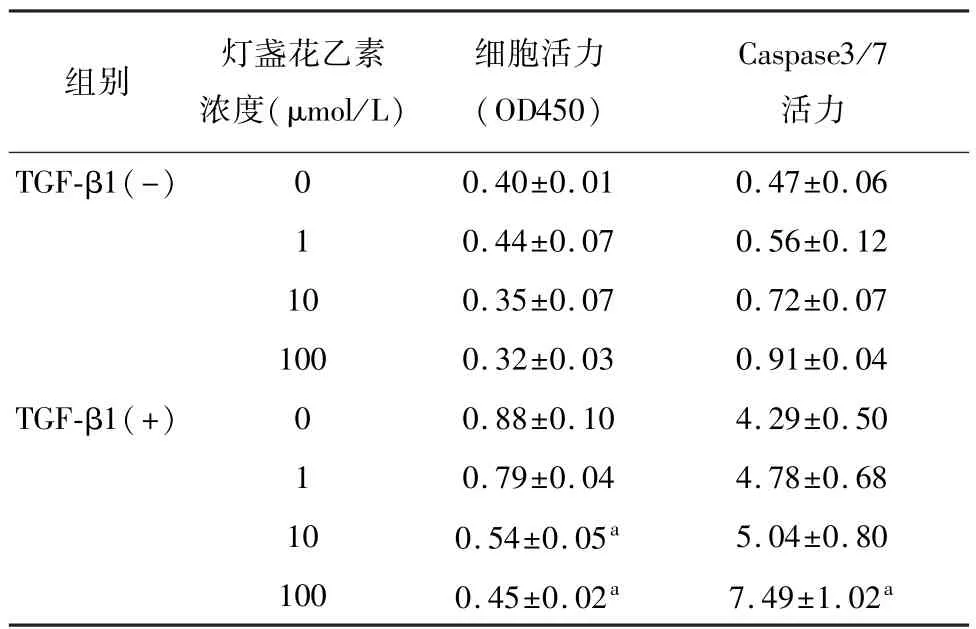
表1 灯盏花乙素对LX-2细胞增殖、Caspase3/7水平的影响(n=3,±s)
注:与0 μmol/L比较,aP<0.05。
Caspase3/7活力TGF-β1(-)组别灯盏花乙素浓度(μmol/L)细胞活力(OD450) 0.40±0.010.47±0.06 1 0.44±0.070.56±0.12 100.35±0.070.72±0.07 1000.32±0.030.91±0.04 TGF-β1(+)00.88±0.104.29±0.50 1 0.79±0.044.78±0.68 100.54±0.05a5.04±0.80 1000.45±0.02a7.49±1.02 0 a
2.3 灯盏花乙素对LX-2细胞Ⅰ型前胶原分泌的影响
灯盏花乙素对正常HSC分泌Ⅰ型前胶原没有影响;TGF-β1刺激LX-2细胞后,细胞分泌Ⅰ型前胶原显著增多,1、10、100 μmol/L 3个浓度的灯盏花乙素都抑制了Ⅰ型前胶原的分泌,提示灯盏花乙素具有抑制星形细胞分泌胶原的能力。见表2。
表2 灯盏花乙素对LX-2细胞上清Pro-collagen TypeⅠC-peptide的影响(n=3,±s)
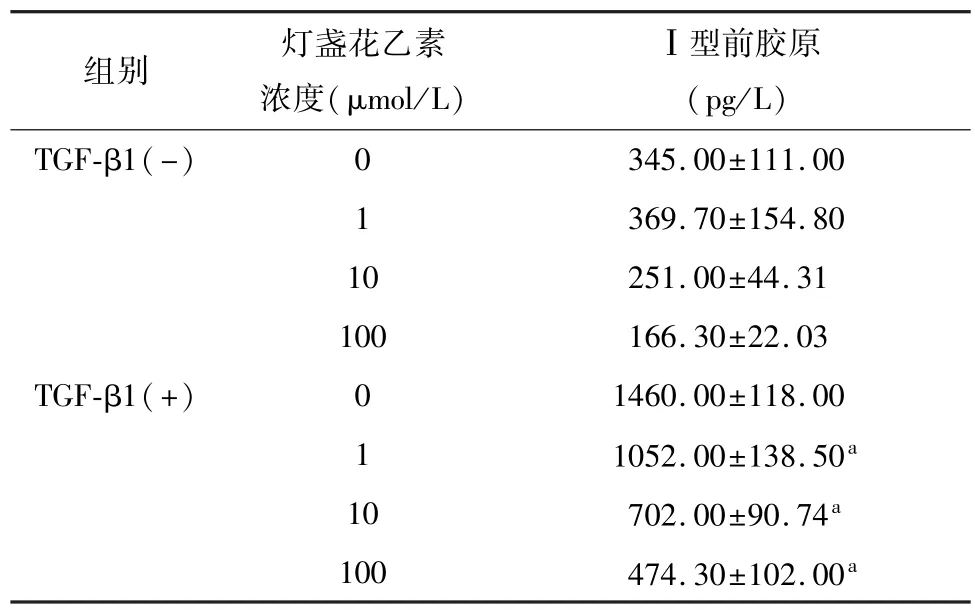
表2 灯盏花乙素对LX-2细胞上清Pro-collagen TypeⅠC-peptide的影响(n=3,±s)
注:与0 μmol/L比较,aP<0.05。
组别灯盏花乙素浓度(μmol/L)Ⅰ型前胶原(pg/L) TGF-β1(-)345.00±111.00 1 369.70±154.80 10251.00±44.31 100166.30±22.03 TGF-β1(+)01460.00±118.00 1 1052.00±138.50a10702.00±90.74a100474.30±102.00 0 a
2.4 灯盏花乙素对LX-2细胞TGF-β1下游信号通路分子p-Smad2和p-Smad3水平的影响
TGF-β1刺激LX-2细胞后,TGF-β1信号通路Smad2和Smad3磷酸化水平显著提高,灯盏花乙素10和100 μmol/L不同程度上抑制了2个分子磷酸化的程度,提示灯盏花乙素可以抑制TGF-β1信号通路相关分子,灯盏花乙素对星形细胞增殖和胶原分泌的抑制作用可能是通过抑制TGF-β1信号通路而实现的。见表3。
表3 灯盏花乙素对TGF-β1诱导的LX-2细胞p-Smad2、p-Smad3的影响(n=3,±s)
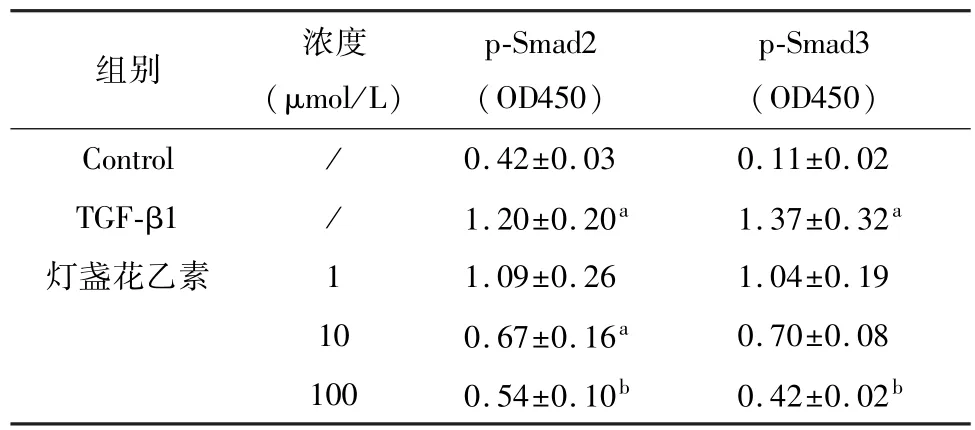
表3 灯盏花乙素对TGF-β1诱导的LX-2细胞p-Smad2、p-Smad3的影响(n=3,±s)
注:与Control比较,aP<0.05;与TGF-β1比较,bP<0.05。
组别浓度(μmol/L) p-Smad2 (OD450) p-Smad3 (OD450) Control/0.42±0.030.11±0.02 TGF-β1/1.20±0.20a1.37±0.32a灯盏花乙素11.09±0.261.04±0.19 100.67±0.16a0.70±0.08 1000.54±0.10b0.42±0.02b
3 讨论
灯盏花又名灯盏细辛,为云南地方性中草药,具有散寒解表、活血舒筋、止痛消积等功效,以灯盏花乙素为主要成分的灯盏花注射液在临床治疗脑血管疾病取得了很好的效果[10-12]。近年来发现灯盏花乙素在抗器官纤维化方面有一定作用。灯盏花乙素抗心肌间质纤维化的机制之一是能够抑制TGF-β1信号通路[13],笔者推测灯盏花乙素可能也是通过作用于TGF-β1信号通路而发挥抗肝纤维化作用。
肝脏TGF-β1由肝细胞、Kupffer细胞和内皮细胞分泌[14-15],被认为是在肝纤维化过程中发挥关键作用的细胞因子[16-17],它不但能促使肝星形细胞转化为成纤维细胞,而且是促进成纤维细胞分泌胶原纤维作用最强的细胞因子[18],能刺激细胞外基质的合成并抑制基质的降解[19]。正常情况下,TGF-β1是失活的状态,一旦激活,TGF-β1就会和细胞膜表面的TGF-β受体结合,形成二聚体,转入膜内,引起Smads家族转导子主要是Smad2和Smad3的磷酸化,之后和Smad4结合,转入细胞核,调节靶基因的表达[20-21]。Smads被认为是TGF-β1介导胶原合成、促进纤维化的关键通路。
笔者检测了灯盏花乙素对肝星形细胞的作用及对TGF-β/Smad信号通路相关因子的影响。实验结果表明灯盏花乙素能抑制肝星状细胞的增殖,降低细胞活力,抑制Smad 2和Smad3的磷酸化,从而抑制TGF-β/Smad信号通路,这可能是灯盏花乙素抗肝纤维化的作用机制之一。
总之,灯盏花乙素能抑制TGF-β1诱导的肝星形细胞增殖,呈剂量依赖性的抑制Smad2/3磷酸化,从而逆转肝纤维化的进程。笔者的研究探讨了灯盏花乙素抗肝纤维化可能的作用机制。
[1] Christian Trautwein,Scott L.Friedman,Detlef Schuppan,et al. Hepatic fibrosis:Concept to treatment.Journal ofhepatology[J]. 2015,62(1 Suppl):15-24.
[2] 吴先闯,杜钢军.灯盏花素抗纤维化和抗肿瘤作用研究[D].开封:河南大学,2010.
[3] 林明华,孟庆媛,郭梦凡.灯盏花素干预大鼠肝星状细胞Caspase-3、NF-κB表达的研究[J].黑龙江医药科学,2012, 35(5):46-48.
[4] 王银辉,耿玲,李辉.灯盏乙素抗大鼠肝纤维化作用的研究[J].中国中药杂志,2015,40(10):1999-2003.
[5] 孟庆媛,苏亚楠,郭梦凡,等.灯盏花素对肝纤维化模型大鼠MMP-13及TIMP-1表达的研究[J].黑龙江医药科学, 2013,36(3):96-97.
[6] Cornel Balta,Hildegard Herman a,Oana Maria Boldura,et al. Chrysin attenuates liver fibrosis and hepatic stellate cell activation through TGF-β/Smad signaling pathway[J].Chemico-Biological Interactions,2015,240:94-101.
[7] Xu L,Hui AY,Albanis E,et al.Human hepatic stellate cell lines,LX-1 and LX-2:new tools for analysis of hepaticfibrosis [J].Gut,2005,54(1):142-151.
[8] Hideaki Shimada,Nicholas R.Staten,Lakshman E.Rajagopalan,et al.TGF-β1 mediated activation of Rho kinase induces TGF-β2 and endothelin-1 expression in human hepatic stellate cells[J]. Journal of Hepatology,2011,54(3):521-528.
[9] Marco Trappoliere,Alessandra Caligiuri1,Monika Schmid,et al.Silybin,a component of sylimarin,exerts anti-inflammatory and anti-fibrogenic effects on human hepatic stellate cells[J]. Journal of Hepatology,2009,50(6):1102-1111.
[10] 侯凌波,乔利军,郭建文.灯盏细辛注射液对血瘀型急性脑梗死患者血清VEGF、MMP-9、EPCs水平的影响[J].中成药, 2015,37(11):2373-2378.
[11] 周峰.灯盏花素注射液治疗急性脑梗死30例[J].河南中医,2015,35(9):2095-2096.
[12] 黄振坚,何世安,雷斌.急性脑梗死灯盏花、芎嗪注射液联合血塞通治疗的临床分析[J].中药材,2014,37(6): 1110-1113.
[13] PAN E,ZHAO W,ZHANG X,et al.Scutellarin alleviates interstitial fibrosis and cardiac dysfunction of infarct rats by inhibiting TGFbeta1 expression and activation of p38-MAPK and ERK1/2[J].Br J Pharmacol,2011,162(3):688-700.
[14] Virginia Hernandez-Gea,Scott L.Friedman.Pathogenesis of Liver Fibrosis[J].Annual Review of Pathology:Mechanisms of Disease,2011,(6):425-456.
[15] Zhiwen Fan,Chenzhi Hao,Min Li,et al.MKL1 is an epigenetic modulator of TGF-β inducedfibrogenesis[J].Biochimica et Biophysica Acta,2015,1849(9):1219-1228.
[16] Ming-Yi Xu,Jun-Jie Hu,Jie Shen,et al.Stat3 signaling activation crosslinkingofTGF-β1inhepaticstellatecell exacerbates liver injury andfibrosis[J].Biochimica et Biophysica Acta,2014,1842(11):2237-2245.
[17] Ling Fang,Cheng Huang,Xiaoming Meng,et al.TGF-β1 elevated TRPM7 channel regulates collagen expression in hepatic stellate cells via TGF-β1/Smad pathway[J].Toxicology and Applied Pharmacology,2014,280(2):335-344.
[18] Jin Won Yang,Tran Thi Hien,Sung Chul Lim,et al.Pin1 induction in the fibrotic liver and its roles in TGF-β1 expression and Smad2/3 phosphorylation[J].Journal of Hepatology,2014, 60(6):1235-1241.
[18] Y.Jiang,C.Wang,Y.Y.Li,et al.Mistletoe alkaloid fractions alleviates carbontetrachloride-inducedliverfibrosisthrough inhibition of hepatic stellate cell activation via TGF-β/Smad interference[J].J Ethnopharmacol,2014,158Pt A:230-238.
[20] Lingyuan Xu,Ni Zheng,Qiaoling He,et al.Puerarin,isolated from Pueraria lobata(Willd.),protects against hepatotoxicity via specific inhibition of the TGF-β1/Smad signaling pathway, thereby leading to anti-fibrotic effect[J].Phytomedicine,2013, 20(13):1172-1179.
[21] J.H.Lee,E.J.Jang,H.L.Seo,et al.Sauchinone attenuates liverfibrosis and hepatic stellate cell activation through TGF-β/ Smad signaling pathway[J].Chem Biol Interact,2014,224C: 58-67.
Effect of scutellarin on TGF-β1/Smad signaling pathway in hepatic stellate cell
YAN Rong-di,FANG Hui,CHI Li.Department of Occupational Disease,the Second Affiliated Hospital of Shandong University of Chinese Medicine,Jinan 250001,China
CHI Li,E-mail:13911824903@163.com
Objective To observe the effect of scutellarin on signaling pathway in hepatic stellate cells(HSC)and transforming growth factor beta 1(TGF-beta 1),to explore the mechanisms of antihepatic fibrosis.Methods Experiments were conducted by human HSC cells line.Transforming growth factor-β1(TGF-β1)was used to induce HSC model.The inhibitory effect of scutellarin on LX-2 cells was observed.Chemiluminescence measurement was used to measure the activity of caspase3/7 in LX-2 cells. ELISA was used to detect the content of pro-collagenⅠin LX-2 supernatant.The expressions of Phospho-
Scutellarin; Hepatic stellate cell; TGF-β1/Smad signaling pathway
R285
A
10.3969/j.issn.1674-1749.2016.11.008
2016-01-21)
(本文编辑:韩虹娟)
2015年首都中医药研究专项(15ZM08)
250001 济南,山东中医药大学第二附属医院职业病科(闫瑢玓);首都医科大学中医药学院中医基础学系[方慧(本科生)、迟莉]
闫瑢玓(1978-),女,硕士,主治医师。研究方向:职业性疾病和中毒性疾病的诊治。E-mail: kellycat813@163.com
迟莉(1980-),女,博士,讲师。研究方向:肝脏疾病的文献和实验研究。E-mail:13911824903@ 163.com
scutellarin能抑制HSC增殖,增强细胞Caspase3/7活力,抑制Ⅰ型前胶原分泌,降低LX-2细胞Smad2和Smad3磷酸化水平。结论 抑制TGF-β1/Smad信号通路可能是scutellarin抗肝纤维化的作用机制。
Smad2 and Phospho-Smad3 were measured by ELISA.Results Scutellarin could Inhibit LX-2 cells proliferation,pro-collagen,Ⅰsecretion,and phosphorylation of Smad2,Smad3 expressions.Scutellarin could improve the activities of caspase3/7.Conclusion The mechanism of scutellarin to anti hepatic fibrosis may be the inhibition of TGF-beta 1/Smad signaling pathway
