水飞蓟种子中黄酮类化合物提取条件优化及抗氧化性测定
2016-11-24刘卉杨国伟
刘卉,杨国伟
(北京电子科技职业学院,北京 100176)
水飞蓟种子中黄酮类化合物提取条件优化及抗氧化性测定
刘卉,杨国伟
(北京电子科技职业学院,北京 100176)
【目的】 研究了水飞蓟种子黄酮类化合物的提取工艺及其黄酮类化合物的抗氧化特性.【方法】 采用超声波辅助乙醇法提取黄酮类化合物,在单因素试验的基础上,设计了以乙醇体积分数、提取时间、提取温度、料液比为四因素三水平的正交试验.【结果】 影响水飞蓟总黄酮提取率的主次顺序是:乙醇体积分数>提取时间>提取温度>料液比;即乙醇体积分数75%,提取时间60 min,提取温度70 ℃,料液比1∶60(g∶mL).黄酮抗氧化试验结果显示水飞蓟黄酮对羟基自由基表现出较好的清除效果.【结论】 水飞蓟黄酮是一种极具开发潜力的天然抗氧化剂,可作为黄酮提取的优良原料.
水飞蓟种子;黄酮类化合物;提取;抗氧化性
水飞蓟(Silybummarianum(L.)Gaertn) ,别名乳蓟(Milkthisthe) ,为菊科水飞蓟属一、二年生草本植物, 原产于南欧及北非[1-2].水飞蓟果实及种子中富含黄酮类化合物,其总提取物即水飞蓟素或西利马林(silymarin) 是药用有效成分,为天然黄酮木脂素类化合物,淡黄色至棕黄色粉末[3].水飞蓟素主要由水飞蓟亭、水飞蓟宁、水飞蓟宾A、水飞蓟宾B、异水飞蓟宾A和异水飞蓟宾B 6种黄酮木脂素和一种黄酮类成分花旗松素组成(化学结构式见图1) ,是水飞蓟及其提取物的有效成分.
临床上,水飞蓟素主要用于治疗急慢性肝炎、脂肪肝及肝硬化等[4-5].然而越来越多的研究表明,水飞蓟素中其他成分也具有较强的抗炎、抗病毒及抗肿瘤等药理活性[6-7].因此研究水飞蓟素中黄酮类成分的提取工艺对全面提升水飞蓟的应用价值具有重要的意义.
黄酮类化合物的提取及性能研究受到了国内外学者的广泛关注,目前,通常用的提取方法有溶剂浸提法,包括水提法[8-10]、碱液提取法[11-13]、有机溶剂提取法[14-15];微波辅助提取法[16-18],超声波提取法[19-22],超临界流体萃取[23-25],酶提取法[26-27]等.相较于其他提取方法传统的水提法成本低、安全,适合工业化大生产,但用水提取时,提取液中杂质较多(如无机盐、蛋白质、糖等) ,给进一步分离带来许多麻烦,而且总黄酮的得率较低;因此,目前已经很少单一使用该方法.有机溶剂提取效率较高,浸液杂质较少,但溶剂用量大,费时较长,操作麻烦;在有机溶剂提取法中最常使用的溶剂是乙醇,即醇提法.在提取过程中,乙醇的体积分数对总黄酮的提取有较大影响,一般认为乙醇的体积分数增高有利于总黄酮的提取.超声波提取是近年来应用于植物天然功能性成分提取分离方面的一种较成熟的先进技术.利用超声波产生的强烈振动、高加速度、空化效应、热效应、搅拌等作用,可以加速植物有效成分进入溶剂,从而提高提取率,缩短时间,节约溶剂,且避免了高温对所提成分的破坏.超声提取法经济实用、方便快捷,可在植物天然功能性成分的提取领域推广使用.目前对水飞蓟中黄酮类物质的有效提取方法的研究还鲜有报道.鉴于此,本试验以水飞蓟种子为原料,综合黄酮类物质提取方法的优势,以乙醇为提取剂,以超声波为辅助研究了以乙醇体积分数、料液比、温度、时间为因素,通过单因素试验、正交试验,确定最佳提取工艺;并通过提取液对DPPH的清除试验研究了水飞蓟中黄酮类化合物的抗氧化性能,为水飞蓟的进一步利用提供试验基础和科学依据.
1 材料与方法
1.1 材料与仪器
1.1.1 材料试剂 水飞蓟种子,购于药店.酪氨酸酶(上海宝曼生物科技有限公司)、甲醇(北京化工厂,分析纯)、无水乙醇(北京化工厂,分析纯)、浓盐酸(上海化学试剂总厂)、石油醚(北京化工厂,分析纯)、DPPH(1,1-diphenyl-2-picryhydrazyl)、磷酸盐缓冲液(pH=6.6)、氢氧化钠(天津市华东试剂厂)、亚硝酸钠(北京化工厂,分析纯)、硝酸铝(天津市华东试剂厂,分析纯)、L-酪氨酸(北京市东环联合化工厂,分析纯).PBS:按药典配置成pH 6.85的缓冲液;酪氨酸酶:用PBS配制成200 U/mL的溶液;L-酪氨酸:用PBS配制成1.5 mmol/L的溶液.
1.1.2 主要仪器设备 紫外分光光度计(上海美谱达有限公司);电子分析天平(奥豪斯仪器(上海)有限公司制造);真空干燥箱(上海福玛实验设备有限公司);水浴锅(常州诺基仪器有限公司);旋转蒸发仪(埃朗科技国际贸易(上海)有限公司);离心机(金南仪器制造有限公司);超声波细胞粉碎机(宁波新芝生物科技有限公司).
1.2 试验方法
1.2.1 水飞蓟提取液的制备及黄酮量测定 水飞蓟种子经干燥,粉碎过筛(40目),加石油醚浸泡脱脂3次,每次6 h.脱脂完毕后,将水飞蓟粉末中的石油醚去除,备用.
1.2.2 标准曲线的制备 精密称取120 ℃干燥至恒质量的芦丁对照品10.0 mg,用60%乙醇溶解,再用水定容到50 mL,得到0.2 mg/mL芦丁对照品溶液.精密吸取芦丁对照品溶液0.0、0.5、 1.0、1.5、2.0、 2.5、 3.0 mL,分别置于25 mL容量瓶中,加蒸馏水至6 mL,加入5%亚硝酸钠溶液1.0 mL,摇匀后放置6 min,加10%硝酸铝溶液1.0 mL,摇匀,放置6 min,加10%氢氧化钠溶液10.0 mL,加水至刻度,摇匀,放置15 min.以第一份作空白,在250 nm处测定各溶液吸光度,以吸光度为纵坐标,质量浓度为横坐标制作工作曲线.质量浓度为0.666 7,1.333 3,2.000 0,2.667,3.000,3.333 3,4.000 0 mg/L时,吸光度值分别为:0.137、0.222、0.350、0.470、 0.658、0.722,可知在0~4.000 0 mg/L,呈良好的线性关系:方程为A= 0.185 1C-0.003 3R2=0.992 07.

1:花旗松素;2:水飞蓟亭;3:水飞蓟宁;4:水飞蓟宾A;5:水飞蓟宾B;6:异水飞蓟宾A; 7:异水飞蓟宾B.图1 水飞蓟中黄酮的化学结构Fig.1 Chemical structures of of flavonoids from Silybum marianum
1.2.3 黄酮含量的测定 精密吸取待测样品溶液0.5 mL,置于25 mL 容量瓶中,加蒸馏水至6 mL,加入5%亚硝酸钠溶液1 mL,摇匀后放置6 min,加10%硝酸铝溶液1 mL,摇匀,放置6 min,加10%氢氧化钠溶液10 mL,加水至刻度,摇匀,放置15 min,试剂为空白参比,在250 nm 处测定各溶液吸光度,计算黄酮类化合物浓度及样品中黄酮的含量.
1.2.4 水飞蓟黄酮类化合物提取的单因素试验 参考各篇文献,采用超声波辅助法提取水飞蓟种子的黄酮类化合物,研究不同乙醇体积分数、料液比、提取温度、超提取时间对其黄酮类化合物提取的影响.
1.2.4.1 乙醇体积分数对总黄酮含量的影响 提取条件的优化单因素试验参考文献方法,设置基础乙醇体积分数65%、温度40 ℃、回流提取时间1 h、料液比为1∶60(g∶mL),在其他条件不变的前提下,设置乙醇体积分数45%、55%、75%、85%;准确称取脱脂水飞蓟粉末1.000 g,超声功率400 W,在波长250 nm,测吸光度值和黄酮类化合物含量,优选最佳参数.
1.2.4.2 料液比对总黄酮含量的影响 准确称取脱脂水飞蓟粉末1.000 g,根据已做单因素提取的最佳条件,设置75%的乙醇体积分数,温度40 ℃,超声功率400 W,回流提取1 h,在其他条件不变的前提下,设置料液比1∶20、1∶40、1∶60、1∶80、1∶100(g∶mL)提取总黄酮,在波长250 nm,测吸光度值和黄酮类化合物含量,优选最佳参数.
1.2.4.3 温度对总黄酮含量的影响 准确称取脱脂水飞蓟粉末1.000 g,根据已做单因素提取的最佳条件,设置75%的乙醇体积分数,料液比为1∶80(g/mL),超声功率400 W,回流1 h,在其他条件不变的前提下,设置温度40、50、60、70、80 ℃提取总黄酮,在波长250 nm,测吸光度值和黄酮类化合物含量,优选最佳参数.
1.2.4.4 提取时间对总黄酮含量的影响 准确称取脱脂水飞蓟粉末1.000 g,根据已做单因素提取的最佳条件,设置75%的乙醇体积分数,料液比1∶80(g∶mL),超声功率400 W,温度70 ℃,在其他条件不变的前提下,设置提取时间分别为20、40、60、80、100 min提取总黄酮,在波长250 nm,测吸光度值和黄酮类化合物含量,优选最佳参数.
1.2.5 水飞蓟黄酮类化合物提取的正交试验 在单因素试验的基础上,采用L9(34)正交试验设计,选择最佳提取条件.
1.2.6 DPPH自由基清除率的测定 精密称取DPPH 8.0 mg,用无水乙醇溶解,并定容至200 mL棕色容量瓶中,得质量浓度为0.004 mg/mL的DPPH溶液,避光保存,备用.
分别取不同质量浓度的各样品溶液(0.24、0.48、0.72、0.96、1.20 mg/mL)1.0 mL,置10 mL离心管中,加入3.0 mL的DPPH溶液,室温避光反应30 min,同时以无水乙醇为空白,于517 nm波长处测定吸光值.按下列公式计算DPPH自由基清除率.
DPPH自由基清除率(%)=A0- (As-Ac) /A0× 100%
式中,A0为1.0 mL蒸馏水+3.0 mL DPPH溶液的吸光度值;As为1.0 mL样品溶液+3.0 mL DPPH溶液的吸光度值;Ac为1.0 mL样品溶液+3.0 mL无水乙醇的吸光度值,试验重复3次,求得清除率的平均值.
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇体积分数对总黄酮含量的影响 由图2可知,乙醇体积分数为75%时,水飞蓟中总黄酮提取量最高.试验选取乙醇体积分数为65%、75%、85% 3个水平做正交试验.
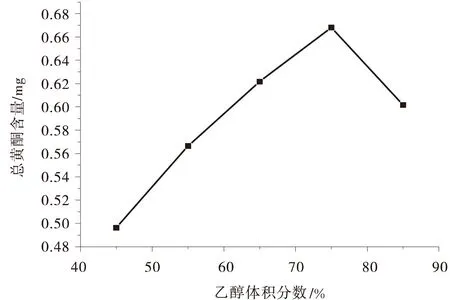
图2 乙醇体积分数对总黄酮含量的影响Fig.2 Effect of ethanol concentration on the content of total flavonoids
2.1.2 料液比对总黄酮含量的影响 由图3可知,随着料液比逐渐增大,黄酮类化合物的含量逐渐增大,当料液比是1∶80时,水飞蓟中总黄酮含量最高.

图3 料液比对总黄酮含量的影响Fig.3 Effect of solid to liquid rate on the content of total flavonoids
试验选取料液比1∶60、1∶80、1∶100 3个水平做正交试验.
2.1.3 温度对总黄酮含量的影响 由图4可知,温度70 ℃时,水飞蓟中总黄酮含量最高,温度再升高时,总黄酮类化合物含量降低.试验选取60、70、80 ℃ 3个水平做正交试验.

图4 温度对黄酮含量的影响Fig.4 Effect of temperature on the content of total flavonoids
2.1.4 提取时间对总黄酮含量的影响 由图5可知,随着提取时间的增加,水飞蓟中总黄酮含量先增大后又减少,由试验结果可知,提取时间为40 min时,水飞蓟中总黄酮含量最高.本试验选取20、40、60 min 3个水平做正交试验.
2.2 正交试验结果与分析
在单因素试验基础上,在超声功率400 W时,设计以乙醇体积分数、料液比、提取温度、提取时间为四因素三水平的正交试验,因素水平见表1.正交试验结果见表2.

表1 正交因素水平表

表2 正交试验结果与分析

图5 提取时间对总黄酮含量的影响Fig.5 Effect of time on the content of total flavonoids
由表6可知,影响水飞蓟中总黄酮提取工艺的主次顺序为乙醇体积分数>提取时间>提取温度>料液比,最佳提取工艺为A2B1C2D3,即乙醇体积分数75%,料液比1∶60(g∶mL),提取温度70 ℃,提取时间60 min,在此组合下,水飞蓟中总黄酮的含量达到1.295 8 mg.
2.3 验证性试验
在优化条件下进行重复性试验,试验结果如表3.水飞蓟种子中总黄酮的平均含量为1.298 6 mg,相对平均偏差为0.339%,相对标准偏差为0.543%,都小于5%,表明试验重现性较好.

表3 重复性试验结果
2.4 DPPH自由基清除率的测定
称取水飞蓟样品1.000 g,在乙醇体积分数75%,提取温度70 ℃,料液比1∶60(g∶mL),提取时间60 min,超声功率400 W,提取样品中的黄酮类化合物.在样品溶液中加入DPPH溶液,保持30 min,在波长517 nm,测定吸光度值,清除率结果见表4.

表4 不同质量浓度提取物的抗氧化性能比较
由试验结果可知,随着样品质量浓度的增大,水飞蓟中黄酮的清除率逐渐升高.
3 结论
以水飞蓟种子为原料,以乙醇为提取剂,结合单因素试验设计与正交试验对水飞蓟中黄酮类物质提取工艺进行了优化,结果表明,影响水飞蓟总黄酮提取效率的主次因素分别为:乙醇体积分数>提取时间>提取温度>料液比,最佳提取工艺为A2B1C2D3,即乙醇体积分数75%,料液比1∶60(g∶mL),提取温度70 ℃,提取时间60 min,水飞蓟中总黄酮的含量达到1.295 8 mg.在此组合下,初步探讨了水飞蓟黄酮提取物的抗氧化效果,结果表明,水飞蓟黄酮提取物对超羟基自由基均有较好的清除能力,在一定浓度范围内其抗氧化性能与黄酮质量浓度呈线性关系.以上结果表明,水飞蓟黄酮是一种很有开发潜力的天然抗氧化剂,可作为黄酮提取的良好原料.
[1] 刘本亮,杨锡.层描法测定益肝灵胶囊中水飞蓟素的会计师[J].中成药,1999,21(4):180-181
[2] 孙淑香,陈志申,马玉萍.水飞蓟素的全成方法研究[J].河南化工,1998(10):13-14
[3] 常国彬,李季平.水飞蓟及其药用有效成分研究[J].辽宁师专学报.2004,6(1):34-35,44
[4] Saller R,Meier R,Brignoli R.The use of silymarin in the treatment of liver diseases[J].Drugs,2001,61(14):2035-2063
[5] 黄大有,赵喦生,吴晶新.利肝隆与益肝灵治疗乙型肝炎的疗效对比[J].北京医学院学报,1978(3):182-184
[6] Ahmed B A,Ahnou N,Barbotte L,et al.Silibinin and related compounds are direct inhibitors of hepatitis C virus RNA-dependent RNA polymerase[J].Gastroenterology,2010,138(3):1112-1122
[7] ShenS L A,Shibano M,Nakagawa G,et al.Cancer preventive agents.7.Antitumor-promoting effects of seven active flavonolignans from milk thistle(Silybum marianum.) on epstein-barr virus activation[J].Pharmaceutical Biology,2007,45(10):735-738
[8] 周萍芳,欧阳克蕙,王文君.苜蓿总黄酮水提工艺的优化[J].广东饲料,2011,20(2):33-35
[9] 宋棋芬,高广春,曹琳茸.南湖菱壳总黄酮的水提醇沉工艺[J].浙江农业科学,2013(8):1029-1031
[10] 金凌洁,陈惠丹,郭碧泽.表面活性剂增效墨旱莲总黄酮水提工艺的研究[J].中国制药装备,2011(6):8-10
[11] 王鸿飞,刘飞,徐超.费菜总黄酮碱法提取工艺及抗氧化活性[J].农业工程学报,2012,28(S1):317-321
[12] 刘金香,王水兴,范青生.碱溶酸沉法提取银杏叶总黄酮[J].安徽农业科学,2008,36(26):11386-11388
[13] 陈继光,米丽雪,上官新晨.青钱柳愈伤组织总黄酮碱溶酸沉提取工艺[J].食品科学,2011,32(16):103-107
[14] 朱英,周旭侃,杜群明.正交试验法优化忍冬叶中总黄酮的提取工艺[J].中国医院药学杂志,2007,27(2):167-170
[15] 杨必成,刘海,杨义芳.油菜花粉中黄酮类化合物的提取与分析[J].中草药,2011,42(12):2451-2455
[16] 付为琳,杨立刚,孙桂菊.微波萃取在菊花黄酮提取工艺中的应用研究[J].食品研究与开发,2008,29(1):1-3
[17] 金时,杨梅,孔羽.木豆叶中黄酮微波提取工艺研究[J].中草药,2011,42(11):2235-2239
[18] 李菁,侯飞燕,李荣东.金银花中总黄酮微波辅助提取工艺优化及其含量动态变化[J].中南药学,2014,12(1):32-36
[19] 宋宏新,邢红香,李楠.超声提取贯叶连翘中总黄酮和金丝桃素的工艺研究[J].陕西科技大学学报,2014,32(1):119-147
[20] 徐秀泉,虞倩,徐颖.赶黄草总黄酮超声提取工艺的响应面法优化及其体外抗氧化活性分析[J].中国实验方剂学杂志,2012,8(18):38-41
[21] 熊蔚蔚,徐铭键,刘健.毛樱桃总黄酮超声提取工艺优选[J].中国实验方剂学杂志,2012,18(15):29-31[22] 赵欣,张进帮,张丽,等.枣叶枣芽中黄酮含量测定及其清除DPPH自由基的作用[J].甘肃农业大学学报,2015,49(4):135-140
[23] 刘璐,付明哲,王侠.植物黄酮类化合物提取及测定方法研究进展[J].动物医学进展,2011,32(6):151-155
[24] 陶清,吕鉴泉.CO2-超临界流体萃取法提取竹叶黄酮的研究[J].湖北师范学院学报:自然科学版,2010,30(1):96-99
[25] 谢建华,单斌,彭云.超临界CO2-流体萃取苦瓜总黄酮工艺及其抗氧化活性[J].生物加工过程,2010,8(1):66-71
[26] 王岩岩,李文娟.纤维素酶提取陈皮黄酮的工艺条件[J].食品与生物技术学报,2008,27(2):71-74
[27] 王文渊,周振华,龙红萍,复合酶法提取苦瓜叶总黄酮的研究[J].中国食品添加剂,2014(1):107-112
(责任编辑 赵晓倩)
Optimization of flavonoids extraction from silybum marianum seeds and its antioxidant characters
LIU Hui,YANG Guo-wei
(College of Beijing Polytechnic,Beijing 100176,China)
【Ojective】 To study an extraction technology of flavonoids fromSilybummarianumseeds,and to determine the antioxidant activity of extration.【Methods】 Ultrasonic-assisted ethanol method was used extraction of flavonoids.according to single-factor experiments,three levels of the factors including material-liquid ratio,extraction temperature,ethanol concentration and extraction time were screened.【Results】 The order of factors affected the content of flavonoids was as ethanol concentration > extraction time> extraction temperature> material-liquid ratio.The optimum extracting process conditions were obtained as ethanol concentration 75%,extraction time 60 min ,temperature 70 ℃,material-liquid ratio 1∶60(g∶mL).Antioxidant tests indicated that the extraction had a better scavenging effects on hydroxyl radicals.【Conclusion】S.marianumseeds can be considered as a good natural antioxidant,and should be superior material for the extraction flavonoids.
Silybummarianumseed;flavonoids;extraction;antioxidant activity
刘卉(1967-),女,副教授,主要研究方向为抗氧化物提取及应用.E-mail:bjliuhui@163.com
朝阳区科委协同创新项目“草本固体饮料及五谷固体饮料产品的研究开发”(XC1425);北京电子科技职业学院重点课题(YZK2014021).
2016-05-13;
2016-09-16
TQ 463+.24
A
1003-4315(2016)05-0148-06
