TM7SF4对人甲状腺乳头状癌细胞IHH-4增殖、凋亡和侵袭的作用研究
2016-11-24周秦毅陈隽冯嘉麟王家东
周秦毅 陈隽 冯嘉麟 王家东
·论著·
TM7SF4对人甲状腺乳头状癌细胞IHH-4增殖、凋亡和侵袭的作用研究
周秦毅 陈隽 冯嘉麟 王家东
目的探讨树突表达特异性7跨膜蛋白(TM7SF4)的低表达对人甲状腺乳头状癌细胞IHH-4增殖、凋亡和侵袭的作用及其相关机制。方法选取甲状腺乳头状癌患者的手术标本(癌组织及癌旁组织)及甲状腺乳头状癌细胞系IHH-4为对象。qRT-PCR法检测病理组织和细胞系IHH-4中TM7SF4的mRNA表达量。分别用MTT法、流式细胞分析和Transwell法检测TM7SF4表达量对IHH-4细胞增殖、凋亡和侵袭的影响。Western印迹检测IHH-4细胞中磷酸化与非磷酸化磷脂酰肌醇3激酶(PI3K)、蛋白激酶B(Akt)、哺乳动物雷帕酶素靶蛋白(mTOR)的表达。结果与癌旁组织相比,甲状腺癌组织中TM7SF4的mRNA表达水平显著升高(t=52.31,P<0.05)。与正常甲状腺细胞系Nthy-ori 3-1相比,IHH-4细胞系中TM7SF4的表达水平也显著上升(t=34.35,P<0.05)。与对照组细胞相比,沉默TM7SF4的表达后,可诱导IHH-4细胞凋亡,而细胞增殖和侵袭能力受到显著抑制(F=8.32,7.55,846.40;P均<0.05)。此外,沉默TM7SF4的表达后可显著降低磷酸化PI3K、磷酸化Akt、磷酸化mTORmRNA及蛋白的表达(F=1 014.88,1 121.29,985.22,720.14,854.63,4 563.12;P均<0.05)。结论低表达的TM7SF4可能通过下调PI3K/Akt/mTOR通路而抑制IHH-4细胞增殖、诱导凋亡并抑制侵袭。
甲状腺乳头状癌;树突表达特异性7跨膜蛋白;细胞增殖;细胞凋亡;细胞侵袭
甲状腺癌是一种起源于甲状腺的常见恶性肿瘤,近年来的发病率呈增加趋势[1]。分化型甲状腺乳头状癌(PTC)是甲状腺癌多种临床分型中最主要的分型,其发病率较高,占所有甲状腺癌的80%左右[2-3]。已有报道表明化学治疗、放射治疗和手术切除是PTC的常规治疗方法,但由于其发病机制复杂,各类治疗效果都不够理想[4-5]。近年来,很多研究致力于PTC的致病基因研究,以期从分子角度找到治疗甲状腺癌的有效手段。
树突表达特异性7跨膜蛋白(Dendrocyte Expressed Seven Transmembrane Protein,DCSTAMP;又名Transmembrane 7 Superfamily Member 4,TM7SF4)是一种由TM7SF4基因编码的主要存在于树突状细胞内的7次跨膜蛋白,参与细胞融合、细胞分化和免疫稳态等生物学过程[6]。前期报道证明TM7SF4在人破骨细胞发生、融合与再吸收和骨Paget病等中发挥关键作用[7-8]。但在甲状腺癌中的报道却很少。目前,已有学者利用生物信息学方法预测到TM7SF4在甲状腺癌组织中的表达会发生异常[9-10]。新近研究中,Lan等[11]利用基因组测序法检测到TM7SF4在PTC组织中的表达量显著增加。但尚未有研究证明TM7SF4与PTC发病机制的关系。本研究利用人PTC细胞系IHH-4,研究了TM7SF4基因在该细胞系中的作用及其可能的机制。
1 材料与方法
1.1 病例样本信息、细胞培养 选取2013年9月至2015年1月在上海交通大学医学院附属仁济医院入院并被诊断为PTC的32对病理及其癌旁组织作为实验材料。PTC病理组织及邻近正常组织置于-80℃中保存备用。PTC细胞株IHH-4及正常细胞株Nthy-ori 3-1(购自中国科学院上海细胞生物研究所)置于含10%胎牛血清的RPMI-1640培养基中,在 37℃,5%CO2的条件下培养。本研究已被上海交通大学医学院附属仁济医院伦理道德委员会批准,所有患者都知情同意。
1.2 材料 RPMI-1640培养基、胎牛血清、抗生素G418、TM7SF4抗体和磷酸化与非磷酸化的磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)/哺乳动物雷帕酶素靶蛋白(mTOR)抗体均购自美国Sigma公司;pcDNA3.1过表达载体和siRNA沉默载体购自生工生物工程(上海)股份有限公司;Lipofectamine 2000、细胞MTT增殖试剂盒、Annexin V-FITC/PI凋亡试剂盒与Transwell小室购自美国Invitrogen公司;qRT-PCR试剂盒和蛋白浓度检测试剂盒购自宝生物工程(大连)有限公司。
1.3 细胞转染 将浓度为5×107/L的IHH-4细胞接种于6孔板中,培养24 h后(细胞贴壁生长),按照Lipofectamine 2000试剂盒的操作步骤进行细胞转染。用10 μl的Lipofectamine 2000包被4 μg质粒(含TM7SF4编码序列的沉默siRNA载体或过表达pcDNA-TM7SF4载体)转入IHH-4细胞。6~8 h后更换新鲜的含抗生素G418的RPMI-1640培养基进行后续培养。转入的空siRNA载体作为对照组。
1.4 MTT法检测细胞增殖 按照MTT试剂盒操作步骤检测TM7SF4基因沉默或过表达对细胞增殖的影响。转入不同类型载体的细胞经过抗生素筛选并继续培养24 h后,将该细胞接种于96孔板上并用新鲜培养基稀释至细胞浓度为2×105个/孔。在不同观察时间点,每孔加入10 μl MTT,将细胞置于含10%胎牛血清的RPMI-1640培养基中继续培养4 d。在波长为450 nm处测定吸光度A值,然后以时间为横坐标,A值为纵坐标绘制细胞生长曲线。
1.5 流式细胞法检测细胞凋亡 用流式细胞法检测TM7SF4基因沉默或过表达对细胞凋亡的影响。将1 ml的IHH-4培养液平铺到24孔板上并调节细胞浓度约至1×105个/孔。用含10%胎牛血清的RPMI-1640培养基培养至对数生长期,然后用胰蛋白酶消化收集贴壁细胞,于12 000 g离心5 min收集细胞体。接着调整细胞浓度为1×109个,使用凋亡试剂盒进行避光染色,染色1 h后在流式细胞仪上进行检测。计算活细胞的早期凋亡率和晚期凋亡率。细胞总凋亡率(%)=早期凋亡率(%)+晚期凋亡率(%)。
1.6 Transwell检测细胞侵袭 用Transwell法检测TM7SF4基因沉默或过表达对细胞侵袭的影响。取对数期的IHH-4细胞用无血清的RPMI-1640培养基稀释制成浓度为1×109/L的单细胞悬液。用100 μl/孔上室凝胶液(融化的Matrigel原液和预冷的RPMI-1640培养基混合液)包被24孔板的Transwell上室,37℃下放置2 h使其凝固。每孔加入200 μl IHH-4单细胞悬液。将500 μl含血清的RPMI-1640培养基加入 Transwell下室,置于含 5% CO2的培养箱中培养。48 h后,取出Transwell小室,去除液体培养基,用PBS缓冲液漂洗后置于4%的甲醛中固定15 min, PBS漂洗 2 min,结晶紫染色 5 min。于400倍显微镜下观察并计数(选取5个视野计算平均值)。
1.7 qRT-PCR检测TM7SF4基因及细胞凋亡信号通路蛋白PI3K、Akt和mTOR mRNA的表达用Trizol法从甲状腺癌组织及IHH-4细胞系中分别提取总RNA,具体操作参照试剂盒说明书。提取的总RNA经过RNse-free Dnase Ⅰ处理后,用紫外分光光度计检测纯度和浓度。用不含核酸降解酶的双蒸水调节RNA浓度为0.5 μg/μl,作为cDNA合成的模板,具体操作参照PrimerScript 1st Strand cDNA Synthesis Kit试剂盒。参考SYBR ExScript RT-qPCR Kit试剂盒操作步骤进行目的基因的扩增,反应体系为20 μl(1 μl cDNA, 10 μl SYBR Premix EX Taq, 1 μl primer, 7 μl ddH2O)。PCR反应程序为:50℃预变性2 min; 95℃变性10 min;退火10 s,60℃延伸1 min,45个循环。2-△△Ct表示mRNA的表达水平。选择GAPDH作为内参(表1)。
1.8 Western印记检测TM7SF4蛋白及细胞凋亡信号通路蛋白PI3K、Akt和mTOR蛋白磷酸化和非磷酸化的表达 收集培养24 h后的IHH-4细胞溶解于RIPA裂解液中,于4℃下以12 000 g离心5 min。收集离心后上清以获得总蛋白,利用二喹啉甲酸(BCA)试剂盒检测总蛋白浓度。将50 μg的总蛋白上样至12%的聚丙烯酰氨凝胶电泳(SDS-PAGE),电泳后将蛋白转移到聚偏氟乙烯膜(PVDF)上,置于含5%牛血清蛋白的TBST缓冲液中室温下封闭1 h。然后加入兔抗人一抗(TM7SF4,磷酸化PI3K,磷酸化Akt,磷酸化mTOR,1∶100)4℃下过夜孵育。加入二抗(1∶1 000)室温下孵育1 h。ECL检测蛋白条带。选择GAPDH作为内参。
1.9 统计学处理 本研究中所有实验均重复3次。正态分布的计量数据采用均数±平均标准误,所有数据均用Graph Prism 5.0软件进行统计分析。两组间差异性统计分析采用独立样本t检验法,多组间比较采用方差分析法。P<0.05为差异有统计学意义。
2 结果
2.1 TM7SF4对IHH-4细胞增殖的影响 与对照组相比,当IHH-4细胞转入pcDNA-TM7SF4载体时,细胞活力(OD值)随培养时间增加而显著升高(F=6.62,P<0.05)。但是当IHH-4细胞转入si-TM7SF4载体时,细胞活力随着培养时间增加而显著下降(F=8.32,P<0.05,图1)。
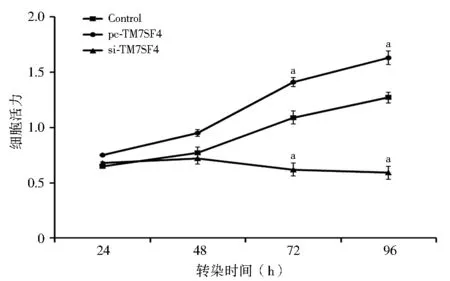
注:Control:转入siRNA空载体的IHH-4细胞;pc-TM7SF4:转入pcDNA-TM7SF4载体的IHH-4细胞;si-TM7SF4:转入siRNA-TM7SF4载体的IHH-4细胞;TM7SF4:树突表达特异性7跨膜蛋白;与对照组相比,aP<0.05图1 TM7SF4对IHH-4细胞增殖能力的影响
2.2 TM7SF4对IHH-4细胞凋亡的影响 与对照组相比,转入pcDNA-TM7SF4的细胞凋亡率没有显著变化(6.20%vs. 4.04%),而转入si-TM7SF4的IHH-4细胞凋亡百分数显著升高(15.5%,F=6.87,P<0.05),而且同时转入沉默和过表达载体后的IHH-4细胞凋亡百分数(5.15%)与对照组相比没有显著差异(图2A,2B)。

表1 qRT-PCR引物序列及产物
注:TM7SF4: 树突表达特异性7跨膜蛋白;PI3K: 磷脂酰肌醇3激酶;Akt:丝/苏氨酸蛋白激酶;mTOR: 哺乳动物雷帕霉素靶蛋白;GAPDH: 磷酸甘油醛脱氢酶
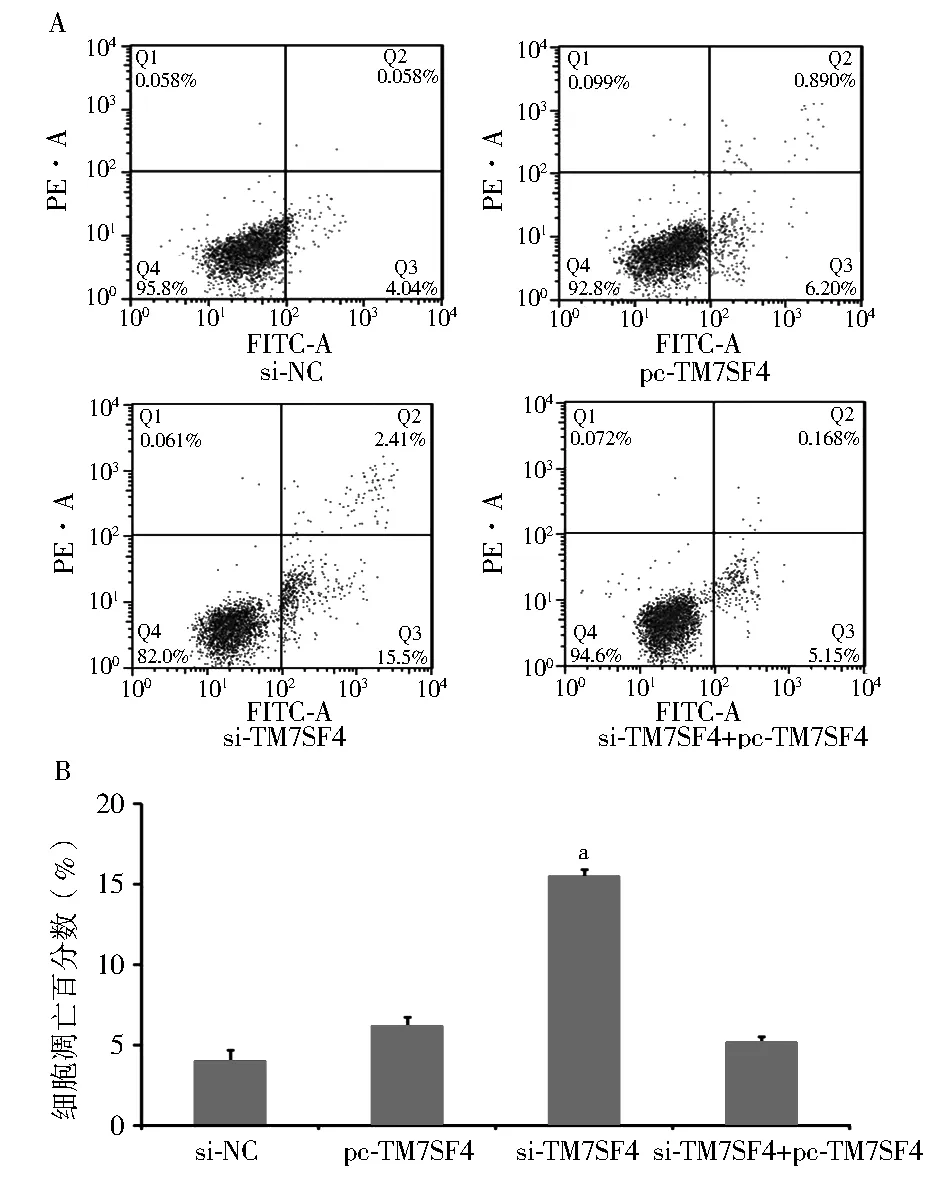
注:A:流式细胞分析法检测各组细胞凋亡结果;si-NC:转入siRNA空载体的IHH-4细胞;pc-TM7SF4:转入pcDNA-TM7SF4载体的IHH-4细胞;si-TM7SF4:转入siRNA-TM7SF4载体的IHH-4细胞;TM7SF4:树突表达特异性7跨膜蛋白;B:各组细胞凋亡的百分数;与对照组相比, aP<0.05图2 TM7SF4对IHH-4细胞凋亡的影响
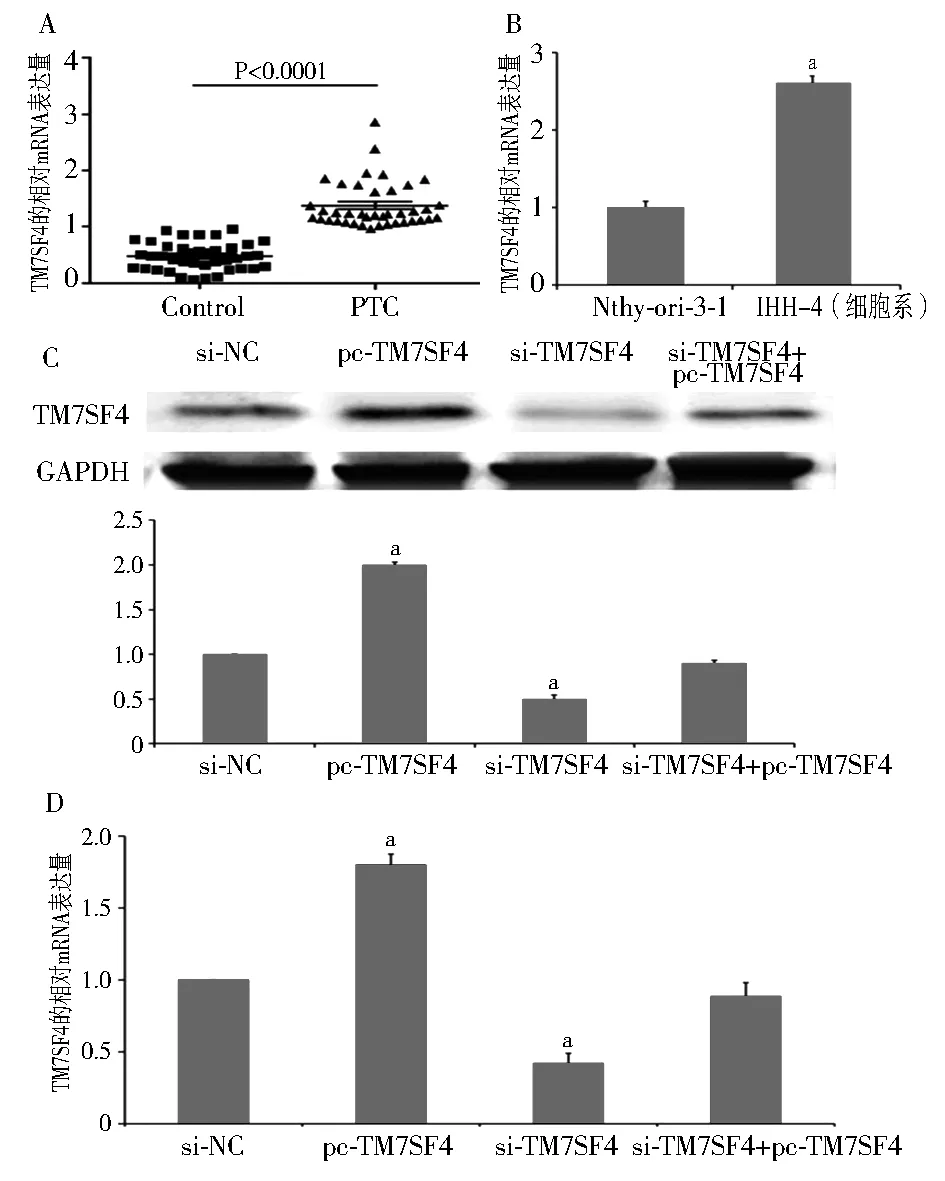
注:A: 与甲状腺癌旁组织相比,TM7SF4在乳头状甲状腺癌组织中的相对mRNA表达水平;B:TM7SF4在甲状腺癌细胞系IHH-4和正常细胞系Nthy-ori-3-1中的相对mRNA水平,与对照组(正常细胞系Nthy-ori-3-1)相比,aP<0.05;C-D:TM7SF4沉默与过表达后在不同组中的mRNA和蛋白水平检测;si-NC:转入siRNA空载体的IHH-4细胞;pc-TM7SF4:转入pcDNA-TM7SF4载体的IHH-4细胞;si-TM7SF4:转入siRNA-TM7SF4载体的IHH-4细胞;PTC:甲状腺乳头状癌;GAPDH:三磷酸甘油醛脱氢酶;与对照组相比,aP<0.05;TM7SF4:树突表达特异性7跨膜蛋白图4 TM7SF4在PTC病理组织及IHH-4细胞系中的表达
2.3 TM7SF4对IHH-4细胞侵袭的影响 与对照组相比,转入pcDNA-TM7SF4的IHH-4细胞侵袭的数目显著增加,而转入siRNA-TM7SF4载体的IHH-4细胞侵袭的数目显著下降(F=846.40,P<0.01)。同时转入沉默和过表达载体的组中,侵袭细胞数目与对照组相比没有显著性差别(图3A,3B,封3)。
2.4 TM7SF4在甲状腺癌组织和细胞系中的表达
qRT-PCR方法检测TM7SF4在PTC组织和癌旁临近正常组织中的表达水平(图4A)。与临近正常组织相比,TM7SF4在癌组织中的表达显著上升(t=52.31,P<0.01)。与正常细胞株Nthy-ori-3-1相比,TM7SF4在IHH-4细胞系中的表达量显著上升(t=34.35,P<0.01),见图4B。分别构建TM7SF4基因沉默和过表达载体并转入IHH-4细胞系中(图4C, 4D)。与对照组相比,转入siRNA-TM7SF4载体的IHH-4细胞中的TM7SF4相对mRNA和蛋白表达量显著下降,而转入pcDNA-TM7SF4的IHH-4细胞中其相对mRNA和蛋白表达量显著升高(F=49.00,42.25,P均<0.05)。当沉默和过表达载体同时转入IHH-4细胞中时,TM7SF4的mRNA和蛋白表达量与对照组相比没有显著性差异。
2.5 TM7SF4基因沉默对细胞凋亡信号通路的影响 与对照组相比,当IHH-4细胞转入pcDNA-TM7SF4过表达载体时,磷酸化的PI3K、Akt和mTOR的相对mRNA和蛋白表达水平均显著升高,但当细胞转入si-TM7SF4载体时,磷酸化的PI3K、Akt、mTOR的相对mRNA和蛋白表达水平均显著下降(F=1 014.88,1 121.29,985.22,720.14,854.63,4 563.12;P均<0.05;图5A, 5B)。同时转入沉默和过表达载体的细胞中,磷酸化的因子水平则与对照组没有显著性差异。
3 讨论
利用生物信息学方法预测TM7SF4在甲状腺癌中发生异常表达[9-10]。但关于TM7SF4对PTC细胞生物学过程的影响及其生物学机制未见报道。只有Nikolova等[10]采用生物信息预测法和RT-PCR法报道了TM7SF4在甲状腺癌发生中高表达,可能是甲状腺癌发生的一个重要靶基因。本研究结果显示,TM7SF4在PTC组织和IHH-4细胞系中表达量显著上升(P<0.05),与前期研究结果一致[10- 11]。表明TM7SF4与PTC的发病存在密切关系。
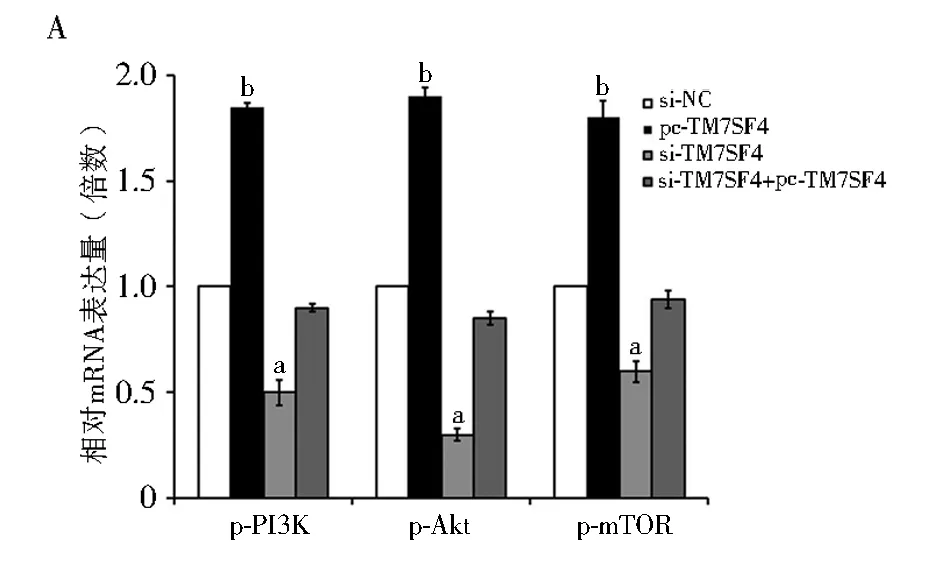
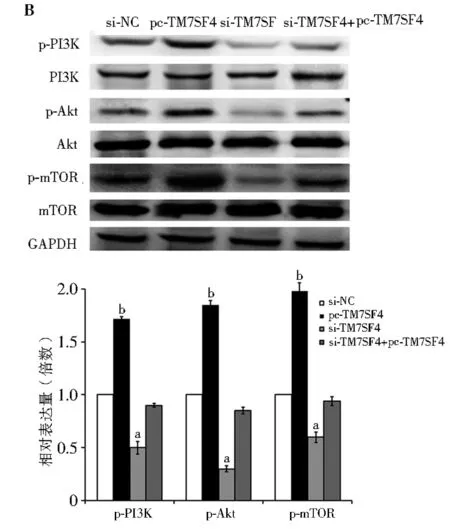
注:PI3K:磷脂酰肌醇3激酶;p-PI3K:磷酸化PI3K;Akt:蛋白激酶B;p-Akt:磷酸化Akt;mTOR:哺乳动物雷帕霉素靶蛋白;p-mTOR:磷酸化mTOR;A: 经过不同TM7SF4表达水平处理后,p-PI3K,p-Akt和p-mTOR的相对mRNA表达水平;与对照组相比,aP<0.05;bP<0.01;B:不同处理组中p-PI3K,p-Akt和p-mTOR的蛋白表达水平;si-NC:转入siRNA空载体的IHH-4细胞;pc-TM7SF4:转入pcDNA-TM7SF4载体的IHH-4细胞;si-TM7SF4:转入siRNA-TM7SF4载体的IHH-4细胞;TM7SF4:树突表达特异性7跨膜蛋白图5 TM7SF4对IHH-4细胞PI3K/Akt/mTOR mRNA及蛋白表达的影响
已有研究证实细胞增殖、凋亡和侵袭与肿瘤的发生、发展和转移密切相关[12-14]。前期研究证明TM7SF4在骨形成或骨炎性反应相关疾病中都呈高表达,但在肿瘤中的作用报道较少[15-16]。在Tu等[17]研究中,TM7SF4高表达通过促进细胞增殖与侵袭,参与前列腺癌的骨转移。Kim等[9]采用基因组测序的方法证明了TM7SF4参与PTC的细胞凋亡、转移和侵袭。本研究结果显示TM7SF4低表达(基因沉默后)可以显著抑制IHH-4细胞增殖和侵袭并诱导细胞凋亡,因此推测低表达的TM7SF4可能在PTC的发生、发展和转移中起抑制作用。
PI3K/Akt/mTOR信号通路参与多种肿瘤的发生和发展[18-20]。PI3K是一种胞内磷脂酰肌醇激酶,而Akt是其下游关键蛋白[21]。PI3K/Akt/mTOR被激活时可以转变为磷酸化的PI3K/Akt/mTOR,Akt能够导致肿瘤的发生、发展和侵袭。mTOR可以直接或间接被磷酸化Akt激活而发生磷酸化,进而促进细胞增殖和凋亡,在肿瘤发生中起促进作用[22]。另一方面,Santarpia等[23]证明在甲状腺癌中,Akt被激活后,可以促进甲状腺癌细胞的增殖和凋亡,进而促进肿瘤的发展。同时,Miyakawa等[24]研究证明,磷酸化Akt在PTC组织中的表达量显著上升,而且100%的PTC中都能检测到高表达水平的磷酸化Akt。与前人研究结果一致,本研究中TM7SF4高表达时,磷酸化PI3K、磷酸化Akt和磷酸化mTOR的水平都显著上升。然而,当TM7SF4基因表达被沉默时,上述3种因子的磷酸化水平则显著下降,表明低表达的TM7SF4参与抑制PI3K/Akt/mTOR信号通路的激活。
本研究表明,TM7SF4低表达可能通过抑制PI3K/Akt/mTOR信号通路的激活进而抑制PTC细胞增殖、诱导凋亡并抑制其侵袭。TM7SF4可能是PTC的一个潜在治疗靶点,但其具体机制及其临床应用潜在能力尚有待进一步研究。
[1] Cho BY, Choi HS, Park YJ, et al. Changes in the clinicopathological characteristics and outcomes of thyroid cancer in Korea over the past four decades[J].Thyroid,2013,23(7):797-804. DOI: 10.1089/thy.2012.0329.
[2] McLeod DS, Cooper DS, Ladenson PW,et al. Prognosis of differentiated thyroid cancer in relation to serum thyrotropin and thyroglobulin antibody status at time of diagnosis[J].Thyroid,2014,24(1):35-42. DOI: 10.1089/thy.2013.0062.
[3] Sacks W, Braunstein GD. Papillary thyroid carcinoma∥Braunstein GD, eds. Thyroid Cancer[M]. Springer, 2012: 133-153.
[4] Wójcicka A, Czetwertyńska M, wierniak M,et al. Variants in the ATM-CHEK2-BRCA1 axis determine genetic predisposition and clinical presentation of papillary thyroid carcinoma[J].Genes Chromosomes Cancer,2014,53(6):516-523. DOI: 10.1002/gcc.22162.
[5] Hay ID, Lee RA, Davidge-Pitts C,et al. Long-term outcome of ultrasound-guided percutaneous ethanol ablation of selected "recurrent" neck nodalmetastases in 25 patients with TNM stages Ⅲ or ⅣA papillary thyroid carcinoma previously treated by surgeryand131I therapy[J].Surgery,2013,154(6):1448-1454; discussion 1454-1455. DOI: 10.1016/j.surg.2013.07.007.
[6] Beauregard M, Gagnon E, Guay-Bélanger S,et al. Identification of rare genetic variants in novel loci associated with Paget′s disease of bone[J].Hum Genet,2014,133(6):755-768.DOI: 10.1007/s00439-013-1409-x.
[7] Chiu YH, Mensah KA, Schwarz EM,et al. Regulation of human osteoclast development by dendritic cell-specific transmembrane protein (DC-STAMP)[J].J Bone Miner Res,2012,27(1):79-92. DOI: 10.1002/jbmr.531.
[8] Zeng Z, Zhang C, Chen J. Lentivirus-mediated RNA interference of DC-STAMP expression inhibits the fusion and resorptive activity of human osteoclasts[J].J Bone Miner Metab,2013,31(4):409-416. DOI: 10.1007/s00774-013-0434-0.
[9] Kim HS, Kim DH, Kim JY, et al. Microarray analysis of papillary thyroid cancers in Korean[J].Korean J Intern Med,2010,25(4):399-407. DOI: 10.3904/kjim.2010.25.4.399.
[10] Nikolova DN, Zembutsu H, Sechanov T,et al. Genome-wide gene expression profiles of thyroid carcinoma: Identification of molecular targets for treatment of thyroid carcinoma[J].Oncol Rep,2008,20(1):105-121.
[11] Lan X, Zhang H, Wang Z, et al. Genome-wide analysis of long noncoding RNA expression profile in papillary thyroid carcinoma[J].Gene,2015,569(1):109-117. DOI: 10.1016/j.gene.2015.05.046.
[12] Hoelting T, Siperstein AE, Clark OH,et al. Epidermal growth factor enhances proliferation, migration, and invasion of follicular and papillary thyroid cancerinvitroandinvivo[J].J Clin Endocrinol Metab,1994,79(2):401-408.
[13] Basolo F, Pollina L, Fontanini G,et al. Apoptosis and proliferation in thyroid carcinoma: correlation with bcl-2 and p53 protein expression[J].Br J Cancer,1997,75(4):537-541.
[14] Rivera M, Ricarte-Filho J, Knauf J, et al. Molecular genotyping of papillary thyroid carcinoma follicular variant according to its histological subtypes (encapsulated vs infiltrative) reveals distinct BRAF and RAS mutation patterns[J].Mod Pathol,2010,23(9):1191-1200. DOI: 10.1038/modpathol.2010.112.
[15] Matsubara R, Kukita T, Ichigi Y,et al. Characterization and identification of subpopulations of mononuclear preosteoclasts induced by TNF-α in combination with TGF-β in rats[J].PLoS One,2012,7(10):e47930. DOI: 10.1371/journal.pone.0047930.
[16] Herbert BA, Valerio MS, Gaestel M, et al. Sexual dimorphism in MAPK-activated protein kinase-2 (MK2) regulation of RANKL-induced osteoclastogenesis in osteoclast progenitor subpopulations[J].PLoS One,2015,10(5):e0125387. DOI: 10.1371/journal.pone.0125387.
[17] Tu SM, Som A, Tu B,et al. Effect of Paget′s disease of bone (osteitis deformans) on the progression of prostate cancer bone metastasis[J].Br J Cancer,2012,107(4):646-651.DOI: 10.1038/bjc.2012.315.
[18] Janku F, Tsimberidou AM, Garrido-Laguna I,et al. PIK3CA mutations in patients with advanced cancers treated with PI3K/AKT/mTOR axis inhibitors[J].Mol Cancer Ther,2011,10(3):558-565. DOI: 10.1158/1535-7163.MCT-10-0994.
[19] Yap TA, Garrett MD, Walton MI,et al. Targeting the PI3K-AKT-mTOR pathway: progress, pitfalls, and promises[J].Curr Opin Pharmacol,2008,8(4):393-412. DOI: 10.1016/j.coph.2008.08.004.
[20] Slomovitz BM, Coleman RL. The PI3K/AKT/mTOR pathway as a therapeutic target in endometrial cancer[J].Clin Cancer Res,2012,18(21):5856-5864. DOI: 10.1158/1078-0432.CCR-12-0662.
[21] Engelman JA. Targeting PI3K signalling in cancer: opportunities, challenges and limitations[J].Nat Rev Cancer,2009,9(8):550-562. DOI: 10.1038/nrc2664.
[22] Wan X, Helman LJ. The biology behind mTOR inhibition in sarcoma[J].Oncologist,2007,12(8):1007-1018.
[23] Santarpia L, El-Naggar AK, Cote GJ,et al. Phosphatidylinositol 3-kinase/akt and ras/raf-mitogen-activated protein kinase pathway mutations in anaplastic thyroid cancer[J].J Clin Endocrinol Metab,2008,93(1):278-284.
[24] Miyakawa M, Tsushima T, Murakami H,et al. Increased expression of phosphorylated p70S6 kinase and Akt in papillary thyroid cancer tissues[J].Endocr J,2003,50(1):77-83.
EffectsofTM7SF4onproliferation,apoptosisandinvasionofhumanpapillarythyroidcancerIHH-4cells
ZhouQinyi,ChenJun,FengJialin,WangJiadong.
DepartmentofHeadandNeckSurgery,RenjiHospital,ShanghaiJiaotongUniversitySchoolofMedicine,Shanghai200001,China
Correspondingauthor:WangJiadong,Email:drjiadongw@aliyun.com
ObjectiveTo investigate the effects and mechanisms of dendrocyte expressed seven transmembrane protein (TM7SF4) on proliferation, apoptosis and invasion of human papillary thyroid cancer (PTC) cell IHH-4.MethodsPTC tumor tissues and the adjacent normal tissues, as well as the human PTC IHH-4 cells were used in this study. TM7SF4 mRNA in tissues and in IHH-4 cells were analyzed using qRT-PCR analysis. The effects of TM7SF4 on proliferation, apoptosis and invasion of IHH-4 cells were analyzed using MTT assay, flow cytometry and Transwell assay, respectively. Furthermore, Western blotting was used to detect the expression of TM7SF4,phosphorylated and non-phosphorylated phosphatidylinositol 3-kinase (PI3K), protein kinase B (Akt), mammalian target of rapamycin (mTOR) protein.ResultsCompared with adjacent normal tissues, TM7SF4 mRNA and protein were significantly increased IHH-4 in PTC tissues (t=52.31,P<0.05). TM7SF4 was also significantly increased in cells compared with that in Nthy-ori 3-1 cells (t=34.35,P<0.05). Consequently, silencing TM7SF4 significantly induced IHH-4 cells apoptosis, inhibited proliferation and suppressed invasion compared with controls (F=8.32, 7.55, 846.40;allP<0.05). Moreover, the mRNA and protein levels of phosphorylated-PI3K, phosphorylated-Akt and phosphorylated-mTOR were significantly decreased by silencing TM7SF4 (F=1 014.88,1 121.29,985.22,720.14,854.63,4 563.12, allP<0.05).ConclusionDown-regulated TM7SF4 may be an inhibitor of PTC development and metastasis through suppressing PI3K/Akt/mTOR pathway.
Papillary thyroid cancer; Dendrocyte expressed seven transmembrane protein; Cell proliferation; Cell apoptosis; Cell invasion
10.3760/cma.j.issn.1673-4157.2016.04.08
200001 上海交通大学医学院附属仁济医院头颈外科
王家东,Email: drjiadongw@aliyun.com
2015-08-29)
