GnRH脉冲治疗对男性HH患者体脂分布和胰岛素抵抗的影响
2016-11-24李晨曦章秋胡红琳代芳邓大同王长江
李晨曦 章秋 胡红琳 代芳 邓大同 王长江
·论著·
GnRH脉冲治疗对男性HH患者体脂分布和胰岛素抵抗的影响
李晨曦 章秋 胡红琳 代芳 邓大同 王长江
目的研究促性腺激素释放激素(GnRH)脉冲治疗对男性低促性腺激素性性腺功能减退症(HH)患者体脂分布和胰岛素抵抗的影响。方法选取2013年2月至2015年1月在安徽医科大学第一附属医院就诊的20例男性HH患者为研究对象,测定GnRH脉冲治疗前、后患者性激素、血脂、空腹血糖、空腹胰岛素(FINS)、性激素结合球蛋白(SHBG)等生化指标,计算稳态模型评估-胰岛素抵抗指数(HOMA-IR),并运用双能X线骨密度仪检测全身、躯干及大腿脂肪量和瘦体重,计算所占各自总质量的百分比。结果经GnRH脉冲治疗6个月后,男性HH患者骨骺闭合人数、卵泡刺激素、黄体生成素、总睾酮、游离睾酮、总瘦体重百分比和躯干瘦体重百分比水平较治疗前增加,FINS、HOMA-IR、总脂肪量百分比和躯干脂肪量百分比水平较治疗前降低(t=-4.169~3.630,P均<0.05)。Pearson相关性分析提示,HOMA-IR与总睾酮(r=-0.676,P=0.032)、游离睾酮(r=-0.731,P=0.016)、躯干瘦体重百分比(r=-0.750,P=0.012)呈负相关,与FINS(r=0.937,P=0.000)、躯干脂肪量百分比(r=0.750,P=0.012)呈正相关。结论GnRH脉冲治疗可减轻男性HH患者的胰岛素抵抗,改变其体脂分布;睾酮水平和躯干瘦体重百分比的升高、FINS水平和躯干脂肪量百分比的降低可能与胰岛素抵抗的改善有关。
性腺功能减退症;促性腺激素释放激素;输注泵;体脂分布;胰岛素抵抗
低促性腺激素性性腺功能减退症(HH)是一种由先天性或获得性因素引起下丘脑或垂体分泌的促性腺激素释放激素(GnRH)或促性腺激素缺乏,进而导致性腺功能减退的遗传异质性疾病[1]。先天性的HH又称为特发性低促性腺激素性性腺功能减退症(IHH)。由于缺乏性激素的作用,男性患者可表现为外生殖器幼稚、胡须或喉结缺如,性功能减退或不育,骨密度降低等[2]。研究表明,HH患者罹患糖尿病、脂代谢紊乱及代谢综合征的风险显著增加[3]。睾酮替代治疗可以选择性减少内脏脂肪聚集,并增加瘦体重(body lean mass),改善HH患者的胰岛素抵抗状况[4]。目前对HH的治疗方案主要有3种,包括睾酮替代、促性腺激素和GnRH脉冲治疗。睾酮替代和促性腺激素治疗的疗效、对代谢指标的影响国内、外报道较多,而GnRH脉冲治疗是否会对HH患者的代谢指标产生影响目前尚无统一定论。因此,本研究旨在探讨GnRH脉冲治疗对男性HH患者体脂分布和胰岛功能的影响。
1 对象与方法
1.1 研究对象 选取2013年2月至2015年1月于安徽医科大学第一附属医院内分泌科住院的男性HH患者20例,平均年龄(22.34±2.56)岁。所有患者均符合2002年美国临床内分泌医师学会诊断标准,未使用或停用促性腺激素和激素制剂6个月以上,并排除甲状腺轴、肾上腺轴和生长激素轴异常,颅脑肿瘤或创伤,糖尿病,家族型高胆固醇血症以及染色体异常疾病家族史。本研究经医院伦理委员会批准,所有受试者均知情同意。
1.2 方法
1.2.1 一般资料收集 对患者进行全面体格检查,测量身高、体重,计算体重指数。所有患者过夜禁食12 h,于清晨空腹采集肘静脉血5 ml,离心后取上清液测定卵泡刺激素(FSH)、黄体生成素(LH)、睾酮、游离睾酮、雌二醇、孕酮、催乳素、总胆固醇、甘油三酯、低密度脂蛋白-胆固醇(LDL-C)、高密度脂蛋白-胆固醇(HDL-C)、空腹血糖、空腹胰岛素(FINS)、性激素结合球蛋白(SHBG)等指标,性激素、FINS和SHBG采用化学发光法测定,血脂采用酶联免疫法测定,血糖采用葡萄糖氧化酶法测定。稳态模型评估-胰岛素抵抗指数(HOMA-IR)=空腹血糖(mmol/L)×FINS(μIU/ml)/22.5。对所有患者均行双腕关节正位X线片以了解骨骺闭合情况。行头颅、垂体MRI以排除其他器质性颅脑疾病,并了解下丘脑、垂体的发育情况。
1.2.2 体脂成分测定 所有患者在安静状态下取平卧位,通过双能X线骨密度仪(Lunar iDXA,ME+200509,GE Healthcare, USA)检测全身、躯干、大腿等部位脂肪量(kg)和瘦体重(kg),并计算总脂肪量百分比(总脂肪量/全身总质量×100%)、总瘦体重百分比(总瘦体重/全身总质量×100%)、躯干脂肪量百分比(躯干脂肪量/躯干总质量×100%)、躯干瘦体重百分比(躯干瘦体重/躯干总质量×100%)、大腿脂肪量百分比(大腿脂肪量/大腿总质量×100%)和大腿瘦体重百分比(大腿瘦体重/大腿总质量×100%)。
1.3 治疗方法 微量脉冲输液泵(型号LF-S-l-1)由上海微创生命医学科技有限公司生产,将600 μg戈那瑞林冻干粉针剂(安徽丰原药业股份有限公司生产,100 μg/瓶)溶于3 ml生理盐水,置于输液泵的储药器内,与埋于腹部皮下的外接输液针管相连。单次脉冲剂量为10 μg,脉冲周期为90 min。6个月后对患者相关生化指标和体脂成分再次进行检测,由专人进行随访信息的记录和管理。
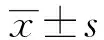
2 结果
2.1 实验室检查 患者平均体重为(73.01±12.92) kg,平均体重指数为(24.82±4.04) kg/m2。经GnRH脉冲治疗6个月后,患者FSH、LH、总睾酮和游离睾酮水平较治疗前增加,FINS、HOMA-IR水平较治疗前降低(P<0.05,表1)。
2.2 影像学检查 20例患者患者尺桡骨远端骨骺线均未完全闭合,骨龄低于实际年龄;头颅、垂体MRI显示,5例患者双侧嗅球缺失、嗅沟低平,考虑Kallman综合征,4例垂体体积小,2例空泡蝶鞍,1例垂体左侧微腺瘤,其余患者未见明显异常。经GnRH脉冲治疗6个月后,患者X线片检查提示,2例患者尺桡骨远端骨骺线完全闭合,6例尺桡骨远端骨骺线基本闭合,骨骺线可见,12例尺桡骨远端骨骺线未完全闭合。头颅、垂体MRI较治疗前无明显改变。
2.3 体脂分布比较 经GnRH脉冲治疗6个月后,患者总脂肪量、大腿脂肪量百分比较治疗前减少,总瘦体重、大腿瘦体重百分比较治疗前增加,但差异无统计学意义(P均>0.05,表2)。总脂肪量百分比和躯干脂肪量百分比较治疗前降低,总瘦体重百分比和躯干瘦体重百分比较治疗前增加(P均<0.05,表2)。
2.4 HOMA-IR及生化指标与体脂百分比的相关分析 取患者治疗前、后HOMA-IR的自然对数之差,以ΔlnIR表示,与治疗前、后生化指标和各部位脂肪量、瘦体重百分比的差值进行Pearson相关分析。结果显示,ΔlnIR与血清总睾酮(r=-0.676,P=0.032)、游离睾酮(r=-0.731,P=0.016)、躯干瘦体重百分比(r=-0.750,P=0.012)呈负相关,与FINS(r=0.937,P=0.000)、躯干脂肪量百分比(r=0.750,P=0.012)呈正相关。
3 讨论
GnRH脉冲治疗可模拟下丘脑生理性GnRH的释放,促进垂体分泌FSH和LH,从而诱导性腺发育和精子生成。孙首悦等[5]和黄炳昆等[6]对接受GnRH脉冲治疗的HH患者进行了长期随访,结果显示患者的FSH、LH、睾酮、睾丸体积、阴茎长度均较治疗前有明显增加,而且GnRH脉冲治疗的生精疗效优于促性腺激素治疗,更加接近生理状态。本研究观察到,在接受GnRH脉冲治疗6个月后,HH患者的FSH、LH、总睾酮和游离睾酮都较前有所增加,与上述研究相一致。研究表明,睾酮的缺乏与胰岛素抵抗密切相关,并可预测2型糖尿病的发生[7]。而与总睾酮相比,游离睾酮与IR的关系更为密切[8]。Naharci等[8]对24例IHH患者进行6个月的睾酮替代治疗,结果显示患者的空腹血糖、FINS、HOMA-IR均较治疗前明显下降。Yialamas等[9]研究发现,停止外源性睾酮替代治疗2周后,即可观察到IHH患者空腹血糖和HOMA-IR显著增加。本研究显示,经过GnRH脉冲治疗后HH患者的FINS和HOMA-IR显著降低,相关性分析提示HH患者的总睾酮和游离睾酮与HOMA-IR存在负相关,证实了睾酮水平的提高与其胰岛素抵抗改善有关。
GnRH脉冲治疗后HOMA-IR的改善还与躯干脂肪量百分比减少和躯干瘦体重百分比增加有关。虽然治疗前、后总脂肪量的变化无统计学意义,但总脂肪量百分比和躯干脂肪量百分比较前都有明显下降,表明GnRH脉冲治疗可通过减少躯干脂肪量、增加躯干瘦体重使HH患者的体脂发生重新分布。杨晓洁等[10]对174名正常体检人群做了体脂分析和血生化检查,发现躯干脂肪含量是胰岛素抵抗的主要影响因素。躯干脂肪尤其是腹内脂肪的脂解速率较其他部位组织更快,肥大脂肪细胞分解产生大量的游离脂肪酸,而高游离脂肪酸血症是肥胖导致胰岛素抵抗的重要因素之一[11]。胰岛素抵抗可引起睾丸间质细胞(Leydig cell)分泌的睾酮水平降低,持续低睾酮水平会加速脂肪组织的堆积,进而加重胰岛素抵抗的严重程度,形成恶性循环。GnRH脉冲治疗通过提高患者体内睾酮水平减少游离脂肪酸的生成,抑制脂肪蓄积,减轻胰岛素抵抗程度。此外,国外动物实验发现,胰岛素抵抗可通过释放炎性因子来抑制家兔下丘脑区GnRH神经元的分泌[12]。这也为GnRH脉冲治疗改善HH患者的胰岛素抵抗提供了新的理论依据。
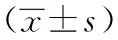
表1 GnRH脉冲治疗前、后患者一般资料比较
注:GnRH:促性腺激素释放激素;BMI:体重指数;FSH:卵泡刺激素;LH:黄体生成素;TT:总睾酮;FT:游离睾酮;E2:雌二醇;P:孕酮;PRL:催乳素;FPG:空腹血糖;FINS:空腹胰岛素;HOMA-IR:稳态模型评估-胰岛素抵抗指数;TC:总胆固醇;TG:甘油三酯;LDL-C:低密度脂蛋白-胆固醇;HDL-C:高密度脂蛋白-胆固醇;SHBG:性激素结合球蛋白
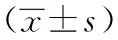
表2 GnRH脉冲治疗前、后患者体脂分布比较
注:GnRH:促性腺激素释放激素;BFM:总脂肪量;BLM:总瘦体重;BFM%:总脂肪量百分比;BLM%:总瘦体重百分比;TrFM%:躯干脂肪量百分比;TrLM%:躯干瘦体重百分比;ThFM%:大腿脂肪量百分比;ThLM%:大腿瘦体重百分比
有研究显示,睾酮水平降低与高胆固醇血症及高甘油三酯血症有密切关系,而补充睾酮可对脂代谢产生有益影响[4, 13]。Aydogdu等[14]将HH患者分为3组,分别进行睾酮酯、睾酮凝胶和绒毛膜促性腺激素治疗,结果只有绒毛膜促性腺激素组观察到了血脂指标的降低,而其他两组的血脂指标都较治疗前有所增加。Sonmez等[3]对208例IHH患者进行为期3周的混合睾酮酯治疗,结果显示患者的总胆固醇水平较前有所下降,而甘油三酯水平却有所增加。本研究未观察到GnRH脉冲治疗后血脂水平的明显改善或恶化,可能与观察样本量较少、饮食和药物的影响有关。而不同剂量、剂型的睾酮也会对血脂代谢产生不同影响,其结果存在争议,有待进一步研究[15]。
本研究存在的不足之处:(1)仅以HOMA-IR代表胰岛功能,未对患者的瘦素、抵抗素、脂联素等反映腹型肥胖、胰岛素抵抗的脂肪因子进行检测。(2)饮食习惯的不同,及部分患者服用抗骨质疏松或调脂药物可造成血脂水平的差异。由于本研究样本量较小,药物种类较多,未能排除这些因素对血脂检测的影响。(3)男性HH的发病率较低,且本研究为回顾性分析,存在一定的失访,故最终纳入的病例数较少,得出的结论还需更大规模的临床研究证实。
综上所述,本研究显示GnRH脉冲治疗可减轻男性HH患者的胰岛素抵抗,改变其体脂分布;睾酮水平和躯干瘦体重百分比的升高、FINS水平和躯干脂肪量百分比的降低可能与胰岛素抵抗的改善有关。因此,GnRH脉冲治疗不仅可以促进男性HH患者的性腺发育,而且可以通过减少躯干脂肪量百分比,增加躯干瘦体重百分比来改善胰岛功能。
[1] 赵芳雅, 陈海冰. 男性低促性腺激素性性腺功能减退症的诊治[J]. 中华内分泌代谢杂志,2013,29(11):998-1001.DOI:10.3760/cma.j.issn.1000-6699.2013.11.021.
[2] 张世林, 王涛, 刘卓, 等. 男性特发性低促性腺激素型性腺功能减退症的诊治分析[J]. 中华泌尿外科杂志,2012,33(3):228-231.DOI:10.3760/cma.j.issn.1000-6702.2012.03.021.
[3] Sonmez A, Haymana C, Bolu E,et al. Metabolic syndrome and the effect of testosterone treatment in young men with congenital hypogonadotropic hypogonadism[J].Eur J Endocrinol,2011,164(5):759-764. DOI:10.1530/EJE-10-0951.
[4] Saad F, Gooren L. The role of testosterone in the metabolic syndrome: a review[J].J Steroid Biochem Mol Biol,2009,114(1-2):40-43.
[5] 孙首悦, 王卫庆, 蒋怡然, 等. 微量泵脉冲输注戈那瑞林治疗特发性低促性腺激素性性腺功能减退症[J]. 中华内分泌代谢杂志,2011,27(8):654-658.DOI:10.3760/cma.j.issn.1000-6699.2011.08.011.
[6] 黄炳昆, 茅江峰, 徐洪丽, 等. GnRH脉冲输注与HCG/HMG联合肌注对男性IHH患者生精治疗效果比较[J].中华医学杂志,2015,95(20):1568-1571. DOI:10.3760/cma.j.issn.0376-2491.2015.20.005.
[7] Rao PM, Kelly DM, Jones TH.Testosterone and insulin resistance in the metabolic syndrome and T2DM in men[J].Nat Rev Endocrinol,2013,9(8):479-493.DOI: 10.1038/nrendo.2013.122.
[8] Naharci MI, Pinar M, Bolu E,et al. Effect of testosterone on insulin sensitivity in men with idiopathic hypogonadotropic hypogonadism[J].Endocr Pract,2007,13(6):629-635.
[9] Yialamas MA, Dwyer AA, Hanley E,et al. Acute sex steroid withdrawal reduces insulin sensitivity in healthy men with idiopathic hypogonadotropic hypogonadism[J].J Clin Endocrinol Metab,2007,92(11):4254-4259.
[10] 杨晓洁, 姚晓红, 严款, 等. 成人体脂分布与胰岛素抵抗、胰岛β细胞功能及代谢紊乱的关系[J]. 中华医学杂志, 2013,93(36):2867-2870. DOI:10.3760/cma.j.issn.0376-2491.2013.36.006.
[11] Oka R, Miura K, Sakurai M,et al. Impacts of visceral adipose tissue and subcutaneous adipose tissue on metabolic risk factorsin middle-aged Japanese[J]. Obesity (Silver Spring),2010,18(1):153-160. DOI: 10.1038/oby.2009.180.
[12] Morelli A, Sarchielli E, Comeglio P,et al. Metabolic syndrome induces inflammation and impairs gonadotropin-releasing hormone neurons in the preoptic area of the hypothalamus in rabbits[J].Mol Cell Endocrinol,2014,382(1):107-119. DOI: 10.1016/j.mce.2013.09.017.
[13] Corona G, Monami M, Rastrelli G,et al. Testosterone and metabolic syndrome: a meta-analysis study[J].J Sex Med,2011,8(1):272-283. DOI:10.1111/j.1743-6109.2010.01991.x.
[14] Aydogdu A, Bolu E, Sonmez A,et al. Effects of three different medications on metabolic parameters and testicular volume in patients with hypogonadotropic hypogonadism: 3-year experience[J].Clin Endocrinol (Oxf),2013,79(2):243-251.DOI: 10.1111/cen.12135.
[15] 关迪. 男性雄激素缺乏症与代谢综合征[J]. 国际生殖健康/计划生育杂志,2011,30(1):21-24.DOI:10.3969/j.issn.1674-1889.2011.01.006.
EffectsofGnRHpumptreatmentonfatdistributionandinsulinresistanceinmenwithHH
LiChenxi,ZhangQiu,HuHonglin,DaiFang,DengDatong,WangChangjiang.
DepartmentofEndocrinology,TheFirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei230032,China
Correspondingauthor:ZhangQiu,Email:aynfmk@163.com
ObjectiveTo investigate the effects of gonadotropin-releasing hormone (GnRH) pump treatment on fat distribution and insulin resistance in men with hypogonadotropic hypogonadism(HH).MethodsA total of 20 male HH patients were enrolled from February 2013 to January 2015 in The First Affiliated Hospital of Anhui Medical University. Serum sex hormones, lipid profile, fasting blood glucose (FBG), fasting insulin (FINS) and sex hormone binding globulin (SHBG) were measured and compared before and after the treatment. Homeostasis model assessment of insulin resistance (HOMA-IR) was calculated. Dual energy X-ray absorptiometry (DEXA) was used to calculate the percentage of fat mass and lean mass in the whole body, trunk and thigh.ResultsAfter 6 months of GnRH pump treatment, the number of closed bone epiphysis, follicle-stimulating hormone, luteinizing hormone, total testosterone, free testosterone, the percentage of body lean mass and trunk lean mass were increased, while FINS, HOMA-IR, the percentage of body fat mass and trunk fat mass were decreased in male patients with HH (t=-4.169-3.630,allP<0.05).Pearsoncorrelation analysis revealed that HOMA-IR was negatively correlated with total testosterone (r=-0.676,P=0.032), free testosterone (r=-0.731,P=0.016) and the percentage of trunk lean mass (r=-0.750,P=0.012), and was positively correlated with FINS (r=0.937,P=0.000) and the percentage of trunk fat mass (r=0.750,P=0.012).ConclusionsGnRH pump treatment can reduce insulin resistance and alter fat distribution in male patients with HH. The increase of testosterone and percentage of trunk lean mass, and the decrease of FINS and percentage of trunk fat mass may lead to the improvement of insulin resistance.
Hypogonadism; Gonadotropin-releasing hormone; Infusion pumps; Fat distribution; Insulin resistance
10.3760/cma.j.issn.1673-4157.2016.04.07
230032 合肥,安徽医科大学第一附属医院内分泌科
章秋,Email:aynfmk@163.com
2015-10-10)
