CaMKIIδ在破骨细胞分化不同阶段表达规律的研究*
2016-11-24陆大壮刘娟娟戚孟春温黎明
陆大壮, 刘娟娟, 戚孟春△, 温黎明, 李 任, 孙 红
(华北理工大学 1口腔医学院口腔颌面外科教研室, 2基础医学院病理教研室, 河北 唐山 063000)
CaMKIIδ在破骨细胞分化不同阶段表达规律的研究*
陆大壮1, 刘娟娟1, 戚孟春1△, 温黎明1, 李 任1, 孙 红2
(华北理工大学1口腔医学院口腔颌面外科教研室,2基础医学院病理教研室, 河北 唐山 063000)
目的: 研究钙离子/钙调蛋白依赖性蛋白激酶II(CaMKII)δ在破骨细胞分化不同阶段的表达规律,以揭示其在破骨细胞分化中的作用。方法: 应用50 μg/L核因子κB受体激活因子配体(RANKL)诱导小鼠RAW264.7细胞向破骨细胞分化;通过抗酒石酸酸性磷酸酶(TRAP)染色及骨磨片吸收陷窝检测评价破骨细胞生成情况;同时于诱导第0、1、3、5 天末通过免疫荧光细胞化学、RT-qPCR和Western blot法检测CaMKIIδ的mRNA及蛋白表达水平。结果: TRAP染色及骨吸收陷窝检测显示于诱导第5 天有多核破骨细胞生成。第0、1、3、5天 CaMKIIδ的mRNA表达水平分别为 1.028±0.041、2.478±0.087、10.524±1.284和42.914±2.667,蛋白相对水平分别为0.762、0.963、1.802和3.136,免疫荧光细胞化学检测显示CaMKIIδ的荧光6强度呈时间依赖性递增。结论: CaMKIIδ的表达随破骨细胞分化逐步增高,提示CaMKIIδ在破骨细胞分化中可能起着关键调控作用。
钙离子/钙调蛋白依赖性蛋白激酶IIδ; 破骨细胞; 核因子κB受体激活因子配体; 抗酒石酸酸性磷酸酶
破骨细胞(osteoclast,OC)是体内唯一具有骨吸收功能的细胞,在骨质疏松、Paget’s 病、多发性骨髓瘤、原发性/转移性骨肿瘤、牙周炎、风湿性关节炎等许多骨过度吸收性疾病中发挥重要作用[1-3]。对上述疾病治疗的一个重要策略是抑制破骨细胞介导的骨吸收;因而破骨细胞分化调控的研究显得尤为重要。已知钙离子/钙调蛋白(Ca2+/calmodulin)信号通路对破骨细胞分化至关重要;而钙离子/钙调蛋白依赖性蛋白激酶II (Ca2+/calmodulin-dependent protein kinase II,CaMKII)是其中的关键信号分子[ 4-6]。CaMKII有α、β、γ和δ 四个异构体[7]。国外学者及我们前期对研究均显示,异构体δ对破骨细胞分化的调控作用可能最为关键[8-9 ],但其在破骨细胞分化中的表达规律及可能的信号调节机制目前尚不清楚。本实验通过检测CaMKIIδ在破骨细胞分化不同阶段mRNA及蛋白的表达水平,以揭示其表达规律,为后期破骨细胞分化信号调控的研究提供实验依据。
材 料 和 方 法
1 实验材料
核因子κB受体激活因子配体(receptor activator of nuclear factor kappa B ligand, RANKL)购自Biovision;小鼠RAW264.7细胞株(北京军事医学科学院);α-MEM培养基、甲苯胺蓝和胎牛血清(中国四季青公司);兔抗鼠CaMKIIδ多克隆抗体(Santa Cruz);抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase, TRAP)染色试剂盒和碘化丙啶(propi-dium iodide,PI)购自Sigma;PCR引物(Invitrogen)。激光聚焦显微镜(Olympus);PCR扩增仪(PERKIN ELMER)。
2 实验方法
2.1 破骨细胞的培养 RAW264.7细胞传代后在含有1×105U/L 青霉素、100 mg/L 链霉素和10%胎牛血清的完全培养基中37 ℃、5% CO2条件下培养,每2 d换液。用终浓度为50 μg/L的RANKL进行诱导,促使细胞向破骨细胞分化;并于诱导前(第0 天)及诱导第1、3、5 天末收获细胞,进行相关检测。
2.2 TRAP染色检测破骨细胞的生成 将RAW264.7细胞按5×103/cm2接种于盖玻片上,制备细胞爬片。待细胞贴壁24 h后用RANKL诱导,于第5 天末收获细胞,2.5%多聚甲醛固定,按试剂盒说明进行染色。
2.3 骨吸收陷窝检测破骨细胞的功能 用新鲜离体制备牙本质磨片,直径约5 mm,厚度0.4 mm,共10片,高温高压灭菌;细胞接种密度为1×107/L。细胞收获后进行扫描电镜观察,500倍下每个磨片上选取6个视野,测量吸收陷窝总数目及总面积,取平均值,作为该磨片的吸收陷窝数目及面积;每组检测5个牙本质磨片。
2.4 免疫荧光化学检测CaMKIIδ的表达 同方法2.2在盖玻片上接种细胞爬片。实验结束后用2.5%多聚甲醛固定,兔抗鼠CaMKIIδ多克隆抗体4 ℃孵育过夜;II 抗为异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的羊抗兔IgG,37 ℃杂交2 h, PI复染细胞核,封片;激光共聚焦显微镜观察。
2.5 RT-qPCR 检测CaMKIIδ的mRNA表达 TRI-zol提取细胞总RNA,逆转录合成cDNA;在Rotor-Gene 3000荧光定量PCR仪上进行变性、退火、延伸,引物见表1。反应条件为95 ℃ 30 s;95 ℃ 15 s,55 ℃ 20 s,72 ℃ 20 s,40个循环。分析软件Rotor-Gene处理后得到数据,计算目的基因mRNA相对表达量,每组设3个复孔,实验重复3次。

表1 RT-qPCR引物序列
F: forward; R: reverse.
2.6 Western blot法检测CaMKIIδ蛋白的表达 提取细胞总蛋白,测定蛋白浓度。加入5×上样缓冲液,煮沸变性,凝胶电泳并转膜,5% BSA室温封闭5 h,兔抗鼠 I 抗4 ℃孵育过夜; II 抗37 ℃孵育2 h,TBST洗3次,ECL显色仪上显色1 min。用ImageJ分析软件检测膜上每个条带的灰度值;每组设3个复孔,实验重复3次。
3 统计学处理
应用SPSS 17.0软件进行数据分析,结果以均数±标准差(mean±SD)表示。多组间比较用单因素方差分析,各组均数间的两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 TRAP染色及骨磨片吸收陷窝检测
细胞经TRAP染色,可见有许多体积较大的多核(≥3个)破骨细胞形成。扫描电镜观察显示,可见在牙本质磨片上形成不同程度的吸收陷窝,边界清晰,呈圆形、椭圆形及不规则形,见图1。上述结果显示,RAW264.7细胞在RANKL诱导下形成了有骨吸收功能的多核破骨细胞。

Figure 1. Detection of osteoclast formation by TRAP staining under light microscope (A), and dentin resorption lacunae by scanning electronic microscopy (B).
图1 TRAP染色检测破骨细胞生成及扫描电镜检测骨吸收陷窝
2 免疫荧光细胞化学检测
在诱导第0、1 天,细胞为单个核细胞,尚无多核破骨细胞形成,CaMKIIδ呈弱阳性表达,荧光较弱;诱导第3、5 天,可观察到多核破骨细胞形成,且细胞数目及体积逐渐增加;CaMKIIδ在第5 天的荧光强度明显强于第3 天,见图2。定量分析表明,CaMKIIδ荧光强度在第0、1、3、5 天分别为4.475±0.274、7.031±0.217、36.750±0.246和51.000±0.255,见图3。该结果提示,CaMKIIδ蛋白的表达量随破骨细胞分化持续增高。

Figure 2. Detection of CaMKIIδ expression during osteoclast differentiation by immunofluorescence cytochemistry (×200).
图2 免疫荧光细胞化学检测CaMKIIδ在破骨细胞分化中的表达
3 RT-qPCR 检测CaMKIIδ的mRNA水平
以第0 天 CaMKIIδ的mRNA相对表达量为参照,第1、3、5 天的mRNA相对表达量呈时间依赖性增高,见图4。
4 Western blot法检测CaMKIIδ的蛋白水平
CaMKIIδ蛋白水平在破骨细胞分化中随时间亦呈递增趋势;其蛋白表达相对水平(与β-actin的比值)在第0、1、3、5 天分别为0.762、0.963、1.802和3.136,见图5。
讨 论
破骨细胞是多核巨细胞,来源于单核/巨噬细胞系前体细胞并通过单核前体细胞融合成多核巨细胞而成熟。骨组织正常的代谢基于破骨细胞与成骨细胞的动态平衡[4],一旦这种平衡被打破,将导致骨质疏松、转移性骨肿瘤、Paget’s病、类风湿性关节炎以及其它骨代谢疾病的发生。研究表明,在RANKL诱导的破骨细胞分化中,NFATc1信号通路对破骨细胞分化及骨吸收功能发挥着极其重要的调控作用[3-5, 10]。
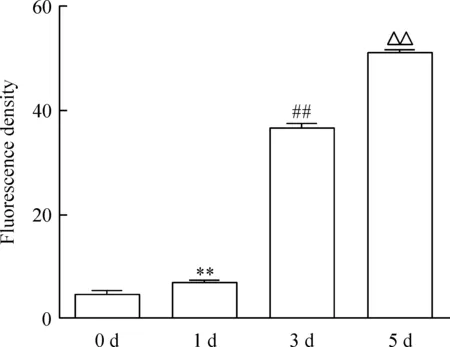
Figure 3. Quantitative analysis of CaMKIIδ expression during osteoclastogenesis by immunofluorescence cytochemistry. Mean±SD.n=3.**P<0.01vs0 d;##P<0.01vs1 d;△△P<0.01vs3 d.
图3 CaMKIIδ在破骨细胞分化中蛋白表达的免疫荧光细胞化学定量分析

Figure 4. Quantitative analysis of the mRNA level of CaMKIIδ at different time points by RT-qPCR. Mean±SD.n=3.**P<0.01vs0 d;##P<0.01vs1 d;△△P<0.01vs3 d.
图4 RT-qPCR定量分析各时点CaMKIIδ的mRNA表达水平
研究发现,在Ca2+信号传递中,CaMKII与Ca2+/calmodulin 结合后,获得2个特性[5]:(1)对calmodulin 的亲和力提高1 000 倍,发生calmodulin 分子捕获;(2) 在calmodulin 解离后,仍保持部分酶活性,在较长时间内调节细胞功能,拥有分子记忆功能。因而,CaMKII对Ca2+信号传递及破骨细胞分化的调控可能极为关键。本课题前期研究发现,Ca2+/calmodulin/NFATc1 是双膦酸盐抑制破骨细胞分化的重要信号通路;唑来膦酸可以时间依赖性抑制破骨细胞内Ca2+振荡,并下调CaMKII mRNA表达及蛋白活性[11]。

Figure 5. Detection of CaMKIIδ protein levels at different time points by Western blot. Mean±SD.n=3.*P<0.05vs0 d;#P<0.05vs1 d;△P<0.05vs3 d.
图5 Western blot法检测CaMKIIδ蛋白的表达
CaMKII有α、β、γ和δ 四个异构体[7], 其在大脑组织中大量表达并发挥重要功能[12-14];而CaMKIIγ和δ也广泛存在于非神经的外围组织中[15]。4个异构体在破骨细胞分化中的表达水平及作用目前还知之甚少。相关研究发现,在破骨细胞分化第0~3 天,CaMKIIβ的mRNA表达较弱,但蛋白无表达;CaMKIIα则几乎不表达,CaMKIIδ、γ均有表达;在多核化阶段(分化第2~3 天),CaMKIIα、β基本不表达;γ虽然表达,但mRNA及蛋白水平均较低且随破骨细胞分化成熟而下降;CaMKIIδ的mRNA 及蛋白表达水平最高,并随破骨细胞分化呈递增趋势[6]。Chang等[8]研究则表明,在破骨细胞分化初期,CaMKIIδ表达上升,其特异性siRNA可显著抑制破骨细胞生成,提示CaMKIIδ在破骨细胞分化中发挥重要作用。Yao等[9]研究也表明,在CaMKII的4个异构体中,只有CaMKIIδ在破骨细胞分化中呈高水平表达,且mRNA的变化和蛋白相一致,因而认为CaMKIIδ在破骨细胞分化中可能起着关键调控作用。而Ang等[16]研究结果显示在RAW264.7细胞和小鼠骨髓单核细胞均没有检测到CaMKIIδ的mRNA。
虽然国内外学者对 CaMKIIδ 在破骨细胞分化中的作用开展了研究,但大多数只局限到破骨细胞分化的某些阶段,因而研究结论或是比较局限,或是相互矛盾[6, 8-9]。而这些问题的解决将更好地弄清楚CaMKIIδ在破骨细胞分化中的调控机制以及有助于发现对骨过度吸收性疾病治疗的有效方法。
由于骨髓单核细胞(bone marrow monocyte,BMM)向破骨细胞分化,大致经历前破骨细胞、单核破骨细胞、多核破骨细胞、成熟破骨细胞4个阶段,分别对应RANKL诱导的第0、1、2~3和5天,因此本实验的观察时点设为0 d、1 d、3 d和5 d。RT-qPCR的检测结果表明,CaMKIIδ的mRNA在破骨细胞形成不同阶段均有表达,且呈持续性高表达;Western blot的检测结果也表明,CaMKIIδ蛋白水平随时间呈递增趋势,统计学分析各组间差异均有统计学显著性。免疫荧光细胞化学检测也表明,CaMKIIδ荧光强度随破骨细胞分化逐渐增强,到第5天达到最高水平。因此推断CaMKIIδ可能在破骨细胞分化及相关信号调控中发挥着重要作用。开展进一步研究,以揭示CaMKIIδ对破骨细胞分化调控的分子机制,将有助于对破骨细胞介导的骨过度吸收性疾病发病机制的了解。
[1] Cho YA, Jue SS, Bae WJ, et al. PIN1 inhibition suppresses osteoclast differentiation and inflammatory responses[J]. J Dent Res, 2015, 94(2):371-380.
[2] Colombo M, Thümmler K, Mirandola L, et al. Notch signaling drives multiple myeloma induced osteoclastogenesis[J]. Oncotarget, 2014, 5(21):10393-10406.
[3] Yavropoulou MP, Yovos JG. Osteoclastogenesis: current knowledge and future perspectives[J]. J Musculoskelet Neuronal Interact, 2008, 8(3):204-216.
[4] Negishi-Koga T, Takayanagi H. Ca2+-NFATc1 signaling is an essential axis of osteoclast differentiation[J]. Immunol Rev, 2009, 231(1):241-256.
[5] Zhang L, McKenna MA, Said-Al-Naief N, et al. Osteoclastogenesis: the role of calcium and calmodulin[J]. Crit Rev Eukaryot Gene Expr, 2005, 15(1):1-13.
[6] Sato K, Suematsu A, Nakashima T, et al. Regulation of osteoclast differentiation and function by the CaMK-CREB pathway[J]. Nat Med, 2006, 12(12):1410-1416.
[7] Colbran RJ. Targeting of calcium/calmodulin-dependent protein kinase II[J]. Biochem J, 2004, 378(Pt 1):1-16.
[8] Chang EJ, Ha J, Huang H, et al. The JNK-dependent CaMK pathway restrains the reversion of committed cells during osteoclast differentiation[J]. J Cell Sci, 2008, 121(Pt 15):2555-2564.
[9] Yao CH, Zhang P, Zhang L. Differential protein and mRNA expression of CaMKs during osteoclastogenesis and its functional implications[J]. Biochem Cell Biol, 2012, 90(4):532-539.
[10]Seales EC, Micoli KJ, McDonald JM. Calmodulin is a critical regulator of osteoclastic differentiatio, function and survival[J]. J Cell Biochem, 2006, 97(1):45-55.
[11]李 鹏, 林珏杉, 张 鹏, 等. 唑来膦酸对破骨细胞分化中钙调蛋白和钙调蛋白依赖性激酶Ⅱ基因表达的影响[J]. 中华口腔医学杂志, 2013, 48(11):694-698.
[12]Erondu NE, Kennedy MB. Regional distribution of type II Ca2+/calmodulin-dependent protein kinase in rat brain[J]. J Neurosci, 1985, 5(12):3270-3277.
[13]Hudmon A, Schulman H. Ca2+/calmodulin-dependent protein kinase II: the role of structure and autoregulation in cellular function[J]. Annu Rev Biochem, 2002, 71:473-510.
[14]Hudmon A, Schulman H. Structure-function of the multifunctional Ca2+/calmodulin-dependent protein kinase II[J]. Biochem J, 2002, 364(Pt 3):593-611.
[15]Caran N, Johnson LD, Jenkins KJ, et al. Cytosolic targeting domains of gamma and delta calmodulin-dependent protein kinase II[J]. J Biol Chem, 2001, 276(45):42514-42519.
[16]Ang ES, Zhang P, Steer JH, et al. Calcium/calmodulin-dependent kinase activity is required for efficient induction of osteoclast differentiation and bone resorption by receptor activator of nuclear factor kappa B ligand (RANKL)[J]. J Cell Physiol, 2007, 212(3):787-795.
(责任编辑: 陈妙玲, 罗 森)
Expression profiles of CaMKIIδ at different stages of osteoclast differentiationLU Da-zhuang1, LIU Juan-juan1, QI Meng-chun1, WEN Li-ming1, LI Ren1, SUN Hong2
AIM: To study the expression profiles and the role of Ca2+/calmodulin-dependent kinase II delta (CaMKIIδ) during osteoclast differentiation. METHODS: Mouse RAW264.7 cells were induced by receptor activator of nuclear factor κB ligand (RANKL) at 50 μg/L for osteoclastogenesis. Tartrate-resistant acid phosphatase (TRAP) staining and bone resorption lacunae examination were performed to verify osteoclast formation. The expression of CaMKIIδ at mRNA and protein levels was also determined by immunofluorescent cytochemistry, RT-qPCR and Western blot at days 0, 1, 3 and 5. RESULTS: TRAP positive multinuclear cells with bone resorption function were formed after 5 d of induction. The mRNA levels of CaMKIIδ detected by RT-qPCR were 1.028±0.041, 2.478±0.087, 10.524±1.284 and 42.914±2.667 at days 0, 1, 3 and 5, respectively, while the protein levels of CaMKIIδ detected by Western blot were 0.762, 0.963, 1.802 and 3.136, respectively. The changes of protein level were also verified by immunofluorescence cytochemistry, in which the fluorescence intensity increased in a time-dependent manner (P<0.05). CONCLUSION: The expression of CaMKIIδ increases with the differentiation of osteoclasts. CaMKIIδ may play a key role in the osteoclastogenesis.
Ca2+/calmodulin-dependent protein kinase II delta; Osteoclasts; Receptor activator of nuclear factor κB ligand; Tartrate-resistant acid phosphatase
1000- 4718(2016)10- 1870- 05
2016- 04- 06
2016- 09- 09
国家自然科学基金资助项目(No. 81270965)
△通讯作者 Tel: 0315-3721508; E-mail: qimengchun@163.com
R363
A
10.3969/j.issn.1000- 4718.2016.10.021
杂志网址: http://www.cjpp.net
(1DepartmentofOralandMaxillofacialSurgery,SchoolofStomatology,2DepartmentofPathology,CollegeofBasicMedicine,NorthChinaUniversityofScienceandTechnology,Tangshan063000,China.E-mail:qimengchun@163.com)
