Toll样受体9配体CpG-ODN鼻内应用对变应性联合气道疾病炎性反应的影响*
2016-11-24李洪涛陈壮桂邹小玲杨海玲张天托
李洪涛, 陈壮桂, 叶 进, 刘 慧, 邹小玲, 杨海玲, 张天托△
(中山大学附属第三医院 1呼吸内科, 中山大学呼吸疾病研究所, 2儿科, 3耳鼻咽喉头颈外科, 广东 广州 510630)
Toll样受体9配体CpG-ODN鼻内应用对变应性联合气道疾病炎性反应的影响*
李洪涛1, 陈壮桂2, 叶 进3, 刘 慧1, 邹小玲1, 杨海玲1, 张天托1△
(中山大学附属第三医院1呼吸内科, 中山大学呼吸疾病研究所,2儿科,3耳鼻咽喉头颈外科, 广东 广州 510630)
目的: 探讨免疫刺激序列CpG寡聚脱氧核苷酸(CpG-ODN)鼻内应用与皮下注射对变应性联合气道疾病(ACAD)模型小鼠下气道炎性反应的影响。方法: 30只清洁级雌性BALB/c鼠随机分为正常对照组(control组)、变应性鼻炎组(AR组)、变应性联合气道疾病组(ACAD组)、变应性联合气道疾病CpG-ODN鼻内滴入组(CpG i.n.组)和变应性联合气道疾病CpG-ODN皮下注射组(CpG i.d.组)。实验组动物依次进行腹腔卵白蛋白(OVA)和氢氧化铝凝胶基础致敏和3次鼻腔激发,此后OVA或生理盐水(NS)雾化气道激发,正常对照组则给予NS。CpG i.n.组和CpG i.d.组分别给予10.0 μg CpG-ODN滴鼻和皮下注射,其它组给予NS滴鼻或皮下注射。观察CpG-ODN干预后对鼻腔及下气道病理变化及评分,并对支气管肺泡灌洗液(BALF)行白细胞分类及嗜酸性粒细胞计数,ELISA法测定BALF和脾脏中细胞因子IL-4、IL-5、IL-13和IFN-γ,以及血清OVA特异性IgE。结果: 炎症细胞浸润评分示ACAD组小鼠肺部的病理改变程度高于control组和AR组(P<0.01);CpG i.n.组炎症评分较ACAD组下降,差异有统计学显著性(P<0.05),而CpG i.d.组炎症评分较ACAD组略有下降,但差异无统计学意义。CpG i.n.组BALF中的白细胞总数、EOS绝对值计数、EOS百分比、BALF和脾脏淋巴细胞上清液中Th2细胞因子较ACAD组降低,差异具有统计学显著性(P<0.01)。CpG i.d.组上述指标略低于ACAD组,但差异无统计学显著性。CpG i.n.组血清的OVA特异性IgE较ACAD组下降,差异有统计学显著性(P<0.05),而CpG i.d.组与ACAD组比较有所下降,但差异无统计学显著性。结论: CpG-ODN可通过抑制变应性鼻炎而抑制变应性联合气道疾病小鼠的下气道炎性反应,鼻内应用可能较皮下注射更有效。
支气管哮喘; 变应性鼻炎; CpG寡脱氧核糖核苷酸
变应性鼻炎(allergic rhinitis, AR)和支气管哮喘(简称哮喘)流行病学密切相关,两者同为Th1/Th2型免疫应答失衡所导致的炎症性疾病。“变应性联合气道疾病(allergic combined airway disease, ACAD)”这一概念形象体现了两者的相关性及一致性[1]。多项研究显示变应性鼻炎是哮喘的高危因素,大多在哮喘前发生,可通过多种途径影响哮喘发生、发展。对于合并变应性鼻炎的哮喘患者,鼻用糖皮质激素(简称激素)不仅可以降低上气道炎症,控制鼻炎症状,同时可提高哮喘控制率并改善哮喘患者生活质量[2]。然而,虽然激素抗炎治疗被认为是目前变应性鼻炎和哮喘最有效的治疗方法,但是仍约有5%~10%呈激素抵抗重型哮喘[3]。而新型免疫佐剂CpG寡脱氧核苷酸(CpG oligodeoxynucleotides,CpG-ODN)能够调节Th1/Th2的比例,使Th0向Th1偏移分化,或逆转已经建立的Th2极化反应向Th1方向转变,这已经成为治疗变应性鼻炎、哮喘等变应性疾病的一种重要途径[4-7]。但这些研究大多单独局限于变应性鼻炎或者哮喘各自专业领域。鉴于变应性鼻炎为哮喘高危因素,我们推测CpG-ODN可能抑制变应性鼻炎发生及转归到哮喘,从而作为变应性联合气道疾病的免疫治疗新选择。为此,拟在本研究中应用BALB/c小鼠复制变应性鼻炎以及变应性联合气道疾病模型,观察CpG-ODN干预变应性鼻炎后对下气道炎性反应的影响,并比较鼻内滴入与皮下注射2种给药方式的效果差异。
材 料 和 方 法
1 试剂
卵白蛋白(ovalbumin, OVA)和RPMI-1640培养基(Sigma);CpG-ODN 包含2个CpG 基序(5’-TCCATGACGTTCCTGACGTT-3’)购自上海生工,并经检测无内毒素脂多糖污染;小鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)中白细胞介素4 (interleukin-4,IL-4)、IL-5、IL-13、干扰素γ(interfe-ron-gamma, IFN-γ)和血清OVA特异性IgE的ELISA试剂盒购于Elabscience。
2 方法
2.1 动物模型的构建及实验分组 清洁级雌性BALB/c小鼠,6~8周龄,体重16~20 g,按随机数字表法分为5组,每组6只,分别为正常对照组(control组)、变应性鼻炎组(AR组)、变应性联合气道疾病组(ACAD组)、变应性联合气道疾病CpG-ODN鼻内滴入组(CpG i.n.组)和变应性联合气道疾病CpG-ODN皮下注射组(CpG i.d.组)。变应性鼻炎和变应性联合气道疾病动物模型参照KleinJan等[8]和我们前期的研究[9]制备,稍加改进。BALB/c小鼠于第1、7天腹腔内注射10 μg OVA/2 mg氢氧化铝凝胶基础致敏,10 d后致敏鼠每鼻孔滴入10 μL OVA(1 g/L)或10 μL 生理盐水(normal saline,NS),每周连续3 d,共激发3周。在最后1次鼻腔激发24 h后,应用NS 5 mL气道雾化吸入0.5 h气道激发共7 d以制备变应性鼻炎模型(AR组)。在上述变应性鼻炎动物模型最后1次鼻腔激发24 h后,将NS替换为2%的OVA溶液(5 mL雾化吸入0.5 h),气道激发共7 d以制备变应性联合气道疾病模型(ACAD组)。CpG i.n.组为10 μL OVA(1 g/L)OVA鼻腔激发1 h后应用10.0 μg CpG-ODN鼻内滴入,每周连续3 d共3周,余同ACAD组;CpG i.d.组为在10 μL OVA(1 g/L)鼻腔滴入并10.0 μg CpG-ODN腹部皮下注射,余同ACAD组;control组在致敏、鼻滴入及激发阶段均应用NS。
2.2 症状观察 每次鼻腔或气道激发后30 min内,摄录机对小鼠行为进行记录,然后对小鼠喷嚏和抓鼻次数进行逐个计数。
2.3 血清OVA特异性IgE的测定 每只小鼠心脏取血约0.7 mL,4 ℃放置过夜,离心15 min,血清移至另一干净Eppendorf管,-80 ℃保存待测。鼠血清标本稀释后,分别用IgE捕获抗体和OVA抗原包被酶标板4 ℃过夜,洗板3次,小牛血清封闭1 h,加入 I 抗室温孵育2 h,洗板3次后加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的抗小鼠IgE II 抗室温孵育1 h,洗板5次,加入底物工作液显色,避光孵育30 min,加入终止液。在450 nm处测吸光度(A)值,根据标准曲线计算待测指标浓度。
2.4 BALF收集及细胞分类计数、细胞因子表达水平的测定 参照我们前期的研究[9-10],每组小鼠最后1次气道激发处死后行气管切开插管右肺行BALF灌洗,分3次缓慢注入PBS 1.5 mL,缓慢灌注,回收BALF。BALF 1 500 r/min离心8 min,Eppendorf管收集上清液-80 ℃保存待测。收集离心后的沉淀细胞,用红细胞裂解液去除红细胞后,细胞沉渣用1 mL PBS液重悬,并用血细胞计数板进行白细胞总数计数,取0.1 mL行嗜酸性粒细胞(eosinophils,EOS)绝对数计数,计算EOS百分比(EOS占细胞总数的百分比)。在高倍镜下分为6处,每处300~400个细胞,绝对数为其比例×细胞总数。所有细胞计数由一人专门完成。BALF中细胞因子浓度的测定按ELISA试剂盒说明书进行,检测标本中IL-4、IL-5、IL-13和IFN-γ的含量。
2.5 小鼠脾脏淋巴细胞培养及细胞因子测定 处死各组小鼠后,取出脾脏放入冷PBS中,将其捻碎并滤过100目无菌钢网,收集脾细胞悬液,洗涤;用完全培养基重悬细胞。加入OVA至终浓度10 mg/L,37 ℃、5% CO2培养箱内孵育过夜后收集悬浮细胞,再用含青霉素G 1×105U/L和链霉素100 mg/L的RPMI-1640完全培养基接种于24孔板培养箱内培养。收集培养上清液,按ELISA试剂盒说明书检测细胞因子IL-4、IL-5和IFN-γ的含量。
2.6 小鼠鼻及肺组织病理学 各组小鼠末次气道激发后处死,打开胸腔,暴露两肺,夹闭左肺门,切取左肺近肺门组织,4%多聚甲醛固定,送病理石蜡包埋切片,厚约5 μm,常规HE 染色。完整切取头部,中性甲醛固定,取鼻部标本石蜡包埋、切片,HE染色。光镜下观察各组小鼠鼻腔和肺组织的病理特点。参照相关文献[11],根据气道周围炎症细胞的浸润情况进行气道炎症评分:正常为0分;少许炎症细胞为1分;1层炎症细胞环绕为2分;2~4层炎症细胞环绕为3分;4层以上炎症细胞环绕为4分。
3 统计学处理
应用STATA 10.0(StataCorp LP)统计软件进行统计分析。实验结果采用均数±标准差(mean±SD)表示。组间比较采用单因素方差分析,组间两两比较采用Bonferroni统计方法。 以P<0.05为差异有统计学意义。
结 果
1 动物的一般情况观察
AR组出现喷嚏、抓鼻次数增多和分泌物增多的表现。ACAD组小鼠激发后除抓鼻和喷嚏次数与control组比较差异有统计学显著性外,尚出现烦躁不安、易激惹、抓耳挠腮、腹部煽动等症状,但无死亡。CpG i.d.组也出现类似表现,但程度较轻。CpG i.n.组抓鼻和喷嚏次数较ACAD组减轻,差异有统计学显著性(P<0.01),见图1。

Figure 1.Intranasal administration of CpG-ODN relieved nasal symptoms. Intranasal CpG-ODN significantly reduced the number of nasal rubbing (A) and sneezing (B) movements, but not in the mice that received intradermal CpG-ODN. AR: allergic rhinitis; ACAD: allergic combined airway disease; CpG i.n.: ACAD treated with CpG-ODN intranasally; CpG i.d.: ACAD treated with CpG-ODN intradermally. Mean±SD.n=6.**P<0.01vscontrol group;##P<0.01vsACAD group.
图1 各组小鼠激发后抓鼻及喷嚏次数
2 鼻黏膜和肺组织的病理学检查
AR组、ACAD组及CpG i.d.组的鼻腔黏膜组织可见炎性细胞浸润、纤毛紊乱、黏膜下小血管扩张,间质水肿。CpG i.n.组上述病理改变较轻。ACAD组肺组织可见支气管和血管周围多量炎性细胞浸润,基底膜轻度增厚。而control组和AR组肺组织支气管及血管周围少见炎症细胞浸润,各级支气管管腔规则。CpG i.n.组和CpG i.d.组病理改变与ACAD组相比减轻。采用炎症细胞浸润情况评分,发现ACAD组小鼠肺部的病理改变程度高于control组和AR组(P<0.01),CpG i.n.组炎症评分比ACAD组下降,差异有统计学显著性(P<0.05),而CpG i.d.组炎症评分与ACAD组比较略有下降,但差异无统计学显著性,见图2。
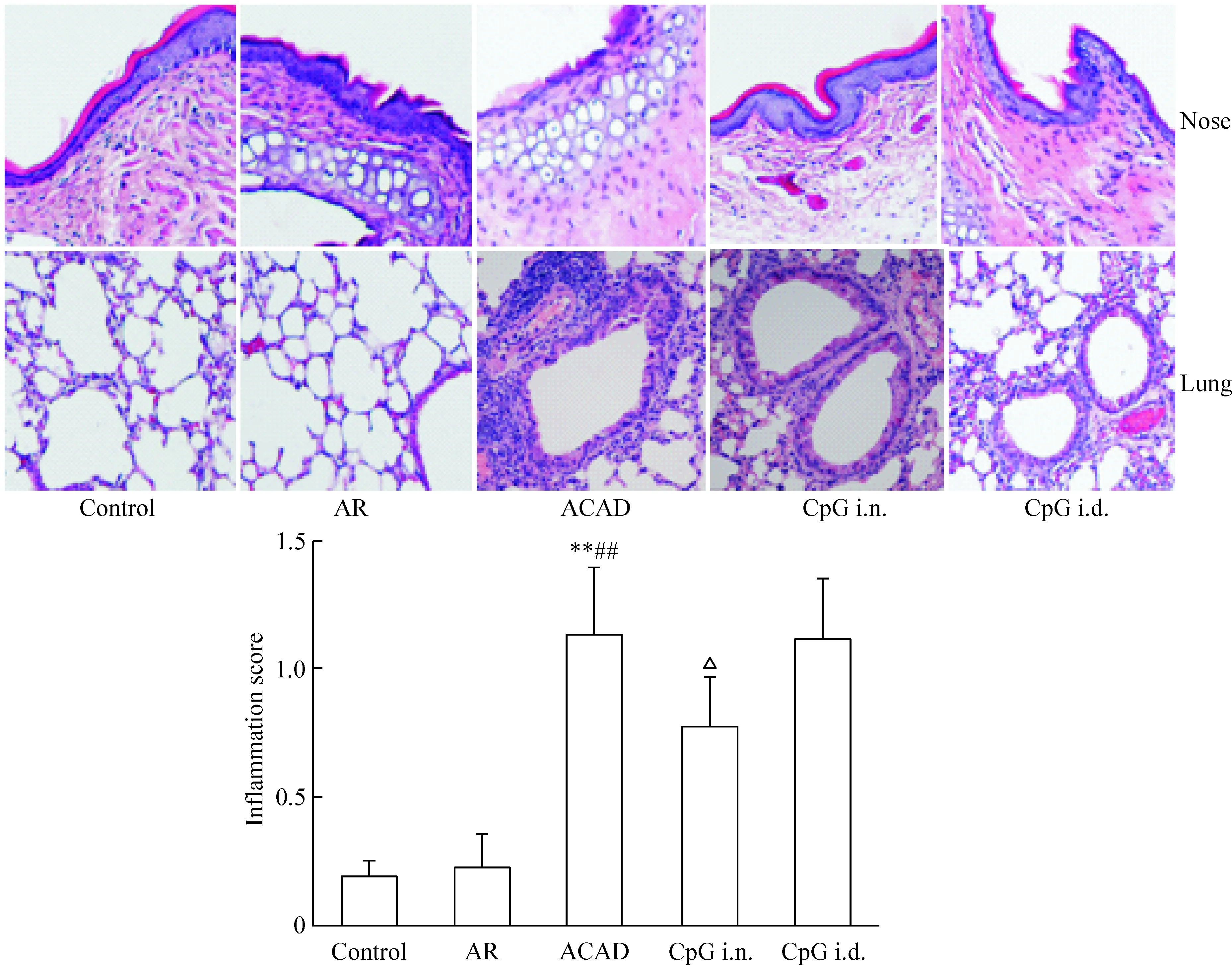
Figure 2.Intranasal administration of CpG-ODN reduced both upper- and lower-airway inflammation (HE staining, ×200). Mean±SD.n=6.**P<0.01vscontrol group;##P<0.01vsAR group;△P<0.05vsACAD group.
图2 小鼠鼻黏膜及肺组织HE染色及气道炎症评分的比较
3 各组小鼠BALF中白细胞总数和分类计数的比较
ACAD组BALF中的白细胞总数、EOS绝对值计数和EOS百分比均高于control组和AR组,差异有统计学显著性(P<0.01)。CpG i.n.组上述指标显著低于ACAD组(P<0.01),白细胞总数仍高于control组和AR组(P<0.01),但EOS绝对值计数与control组和AR组比较差异无统计学显著性。CpG i.d.组白细胞总数及EOS百分比略低于ACAD组,但差异无统计学显著性,EOS绝对值计数较ACAD组降低,差异有统计学显著性(P<0.01),见表1。
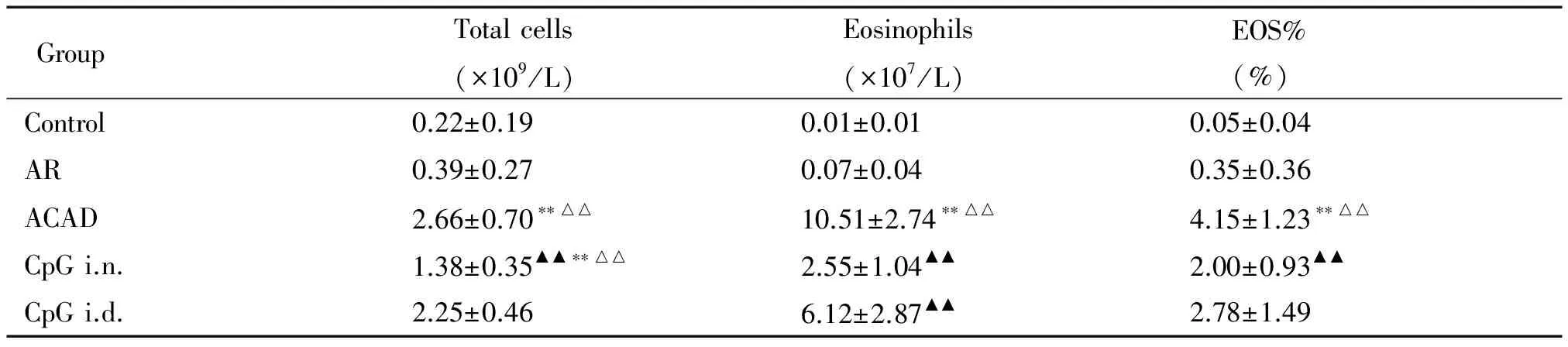
表1 5组小鼠BALF中白细胞总数及EOS绝对值计数的变化
**P<0.01vscontrol group;△△P<0.01vsAR group;▲▲P<0.01vsACAD group.
4 小鼠脾脏淋巴细胞上清液细胞因子含量的比较
将OVA与小鼠脾脏分离的淋巴细胞体外培养后,AR组和ACAD组上清液中的IL-4和IL-5浓度较control组升高,差异有统计学显著性(P<0.05),CpG i.n.组的IL-4和IL-5浓度较AR组和ACAD组下降(P<0.01),而CpG i.d.组的IL-4和IL-5浓度较AR组和ACAD组略有下降,但差异无统计学显著性,见图3。各组均未检出IFN-γ(均低于检测阈值,图未显示)。
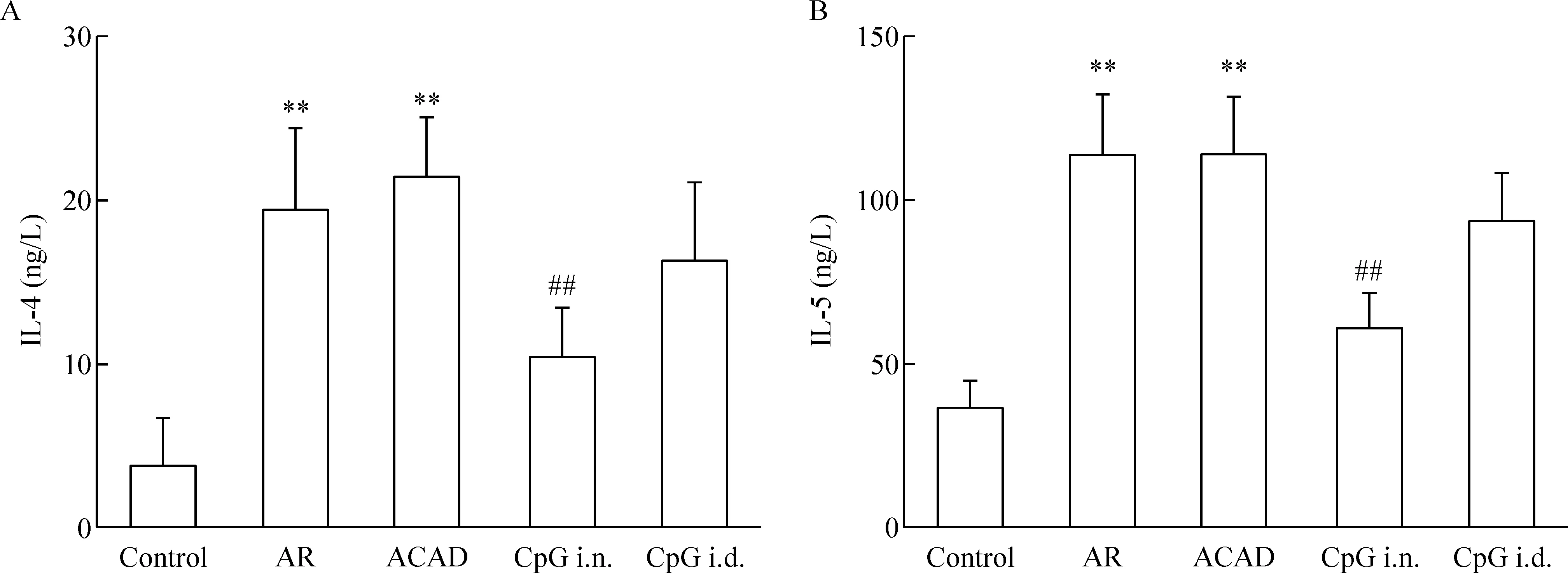
Figure 3.Intranasal CpG-ODN treatment altered Th2-type responses from splenocytes. IL-4 (A) and IL-5 (B) production in culture supernatants of splenocytes were determined by ELISA. Means±SD.n=6.**P<0.01vscontrol group;##P<0.01vsACAD group.
图3 各组小鼠脾脏淋巴细胞上清液IL-4和IL-5的比较
5 各组BALF中Th1/Th2型细胞因子的比较
ACAD组BALF中的IL-4、IL-5和IL-13较control组和AR组升高,差异有统计学显著性(P<0.01)。Control组和AR组的IFN-γ水平低于ACAD组、CpG i.n.组和CpG i.d.组(P<0.01),但ACAD组、CpG i.n.组和CpG i.d.组3组间的差异无统计学显著性。CpG i.n.组BALF中的IL-4、IL-5和IL-13水平较ACAD组降低(P<0.05),但仍高于control组和AR组(P<0.05)。ACAD组的IFN-γ/IL-4较AR组下降,差异有统计学显著性(P<0.01),CpG i.n.组的IFN-γ/IL-4高于ACAD组,差异有统计学显著性(P<0.01)。CpG i.d.组上述指标与ACAD组比较略有下降,但差异无统计学显著性,见图4。
6 各组OVA特异性IgE的比较
AR组和ACAD组外周血的OVA特异性IgE较control组升高,差异有统计学显著性(P<0.01);CpG i.n.组的OVA特异性IgE较AR组和ACAD组降低,差异有统计学显著性(P<0.01),但仍高于control组(P<0.01);CpG i.d.组的OVA特异性IgE与AR组和ACAD组比较有所下降,但差异无统计学显著性,见图4。
讨 论
本研究结果表明CpG-ODN鼻内滴入干预后,下气道炎症细胞浸润情况评分较变应性鼻炎和变应性联合气道疾病明显下降,差异具有统计学显著性,说明病理改变明显减轻;BALF中白细胞总数、EOS绝对值计数、EOS百分比、Th2型细胞因子IL-4、IL-5、IL-13以及脾脏淋巴细胞上清液IL-4、IL-5较变应性联合气道疾病组降低;血清OVA特异性IgE下降。IFN-γ/IL-4较ACAD组升高,表明CpG-ODN主要抑制Th2型细胞因子,从而使Th1/Th2型细胞因子恢复平衡。上述结果表明CpG-ODN可通过抑制变应性鼻炎而抑制变应性联合气道疾病下气道Th2型反应。而CpG-ODN皮下注射干预后上述指标较变应性联合气道疾病有所下降,但差异无统计学显著性,表明鼻内滴入可能较皮下注射更有效。需指出的是,本实验没有比较鼻内应用与皮下注射的剂量及作用时间不同产生的效果,故尚不能确认鼻内(局部)与皮下注射(全身)给药方式的确切差异,有待在今后的研究中进一步证实。
哮喘发病机制的研究仍很有限,故而哮喘的防治仍停留在对症处理阶段,病因治疗难以突破[12]。辅助性T细胞(helper T cell,Th)免疫失衡是变应性鼻炎和哮喘的重要发病机制。通过调节Th1/Th2的平衡,把以Th2为主的免疫应答转变为Th1型是目前治疗哮喘的途径和思路之一。目前临床唯一针对哮喘病因的治疗方法的变应原特异性免疫治疗(specific immunotherapy,SIT)旨在促使Th细胞免疫反应向Th1方向分化,刺激机体产生保护性抗体,但该方法目前仍存在诸多疗效及安全性问题[13]。因此,寻求新的高效、安全的哮喘气道炎症防治途径,一直是该领域的研究课题。CpG-ODN是以CG序列为核心的非甲基化脱氧核苷酸片断,该序列结构广泛存在于细菌及病毒体的DNA中[14]。CpG-ODN可通过与Toll样受体9(Toll-like receptor 9,TLR9),诱导DC分泌细胞因子IL-12及IFN-γ,抑制Th2细胞分泌IL-5等细胞因子,从而抑制以Th2极化为特征的变态反应[4]。CpG-ODN因其较低成本、高效安全稳定、易标准化生产、半衰期长以及可多途径接种等优点可能取代SIT的地位。鼻内CpG-ODN免疫由于是作用于组织局部,不仅能够降低系统免疫带来的风险[4],且避免了全身应用中被降解的可能[15]。为此,本项目中我们采用鼻内应用CpG-ODN作为输送方式,且提示可能较皮下注射更有效,与Suzuki等[6]研究结论一致。其原因可能由于鼻腔局部黏膜免疫系统比较发达,鼻黏膜相关淋巴组织富有多种抗原呈递细胞。鼻黏膜上皮细胞也被证实有TLR9的表达[16],这些使得CpG-ODN鼻腔局部应用会更具有靶向激活作用。Suzuki等[6]研究也表明鼻腔黏膜给予CpG-ODN可降低鼻淋巴细胞及脾细胞中IgE水平及IL-5浓度,抑制嗜酸性细胞增多、缓解鼻腔反应症状,而皮内给药后上述指标无显著改变,提示经鼻腔黏膜给予CpG-ODN对变应性鼻炎具有治疗作用。本研究结果提示CpG-ODN鼻内应用干预变应性鼻炎有利于抑制哮喘炎性反应,而变应性鼻炎为哮喘发病高危因素,说明CpG-ODN可在源头上调控哮喘发生发展的驱动因素,不同于现有治疗仅局限于阻断于免疫反应发生之后引起的一系列症状的下游细胞机制,而没有从根本上阻断免疫反应的发生。本研究为寻找早期、安全、有效的哮喘干预方式提供了实验依据。
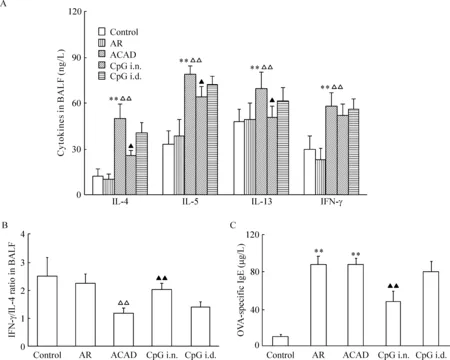
Figure 4.Intranasal CpG-ODN treatment altered BALF Th2-type responses and reduced serum OVA-specific IgE. Th1/Th2-associated cytokines levels (A) and IFN-γ/IL-4 ratio (B) in BALF, and OVA-specific IgE (C) in serum were measured by ELISA. Means±SD.n=6.**P<0.01vscontrol group;△△P<0.01vsAR group;▲P<0.05,▲▲P<0.01vsACAD group.
图4 各组BALF中Th1/Th2型细胞因子表达水平和血清OVA特异性IgE的比较
本研究中我们采用KleinJan等[8]经鼻局部致敏和激发的方法,可较好地保证变应性鼻炎模型局限于鼻炎的表现,研究结果也提示变应性鼻炎组下呼吸道炎性细胞少见、BALF中白细胞总数、嗜酸性粒细胞绝对数与百分比、Th2型细胞因子(IL-4、IL-5、IL-13)等与正常对照组比较差异无统计学显著性,说明该模型仅在鼻腔出现炎性反应。以往研究应用的变应性鼻炎模型多采用大容量鼻腔吸入以激发致敏鼠,可能导致抗原沉积在肺,从而使鼻、肺炎性反应共存[6]。为避免单纯变应性鼻炎模型肺沉积抗原,本研究中应用小剂量10μL OVA或NS重复滴入清醒的致敏鼠。而变应性联合气道疾病组下气道炎性细胞明显增多、BALF中嗜酸性粒细胞及Th2型细胞因子明显升高,提示该模型成功制备。上述动物模型有效地保证了CpG-ODN干预后有关炎性反应指标的检测。然而本研究中没有对CpG-ODN鼻内滴入对影响变应性联合气道疾病下气道炎性反应的免疫调节机制进行进一步探讨,笔者近期曾研究发现布地奈德通过影响TSLP-DC途径而抑制哮喘Th2极化反应[9],鉴于鼻黏膜尚有TSLP表达[17],CpG-ODN尚可通过与TLR9,诱导DC分泌细胞因子Th2型细胞因子[4],我们推测CpG-ODN可能抑制TSLP-DC途径而抑制下气道炎性反应,这将是笔者下一步研究中的重点。
总之,本研究制备了变应性鼻炎、变应性联合气道疾病动物模型,明确了CpG-ODN可通过抑制变应性鼻炎而抑制哮喘下气道炎症反应,鼻内滴入可能较皮下注射更行之有效。这表明CpG-ODN可在源头上调控哮喘发生发展的驱动因素,为寻找早期、安全、有效的哮喘干预方式提供了实验依据。
[1] 武大伟, 王建亭.变应性联合气道疾病[J]. 国际耳鼻咽喉头颈外科杂志, 2014, 38(5): 304-308.
[2] Scichilone N, Arrigo R, Paternò A, et al. The effect of intranasal corticosteroids on asthma control and quality of life in allergic rhinitis with mild asthma[J]. J Asthma, 2011, 48(1):41-47.
[3] Durham A, Adcock IM,Tliba O. Steroid resistance in severeasthma: current mechanisms and future treatment[J]. Curr Pharm Des, 2011, 17(7): 674-684.
[4] 朱冬冬, 朱学伟, 姜晓丹, 等.Toll样受体9配体CpG寡脱氧核苷酸鼻内预免疫对豚鼠鼻变态反应抑制作用的研究[J].中华耳鼻咽喉头颈外科杂志, 2010, 45(6): 471-476.
[5] 方 萍, 吴晓明, 周 筠, 等.CpG-ODNs对慢性哮喘小鼠气道重塑的影响及机制[J].西安交通大学学报:医学版, 2013, 34(1): 58-63.
[6] Suzuki M, Matsumoto T,Ohta N, et al. Intranasal CpG DNA therapy during allergen exposure in allergic rhinitis[J]. Otolaryngol Head Neck Surg, 2007, 136(2): 246-251.
[7] 董 亮, 张 琦, 陈 明, 等. 转录因子T-bet/GATA-3比率评价哮喘患者Th1/Th2失衡及CpG ODN干预机制的研究[J]. 中国病理生理杂志, 2007, 23(9): 1776-1781.
[8] KleinJan A, Willart M, van Nimwegen M, et al. United airways: circulating Th2 effector cells in an allergic rhinitis model are responsible for promoting lower airways inflammation[J]. Clin Exp Allergy, 2010, 40(3): 494-504.
[9] 李洪涛, 张天托, 陈壮桂, 等. 布地奈德对支气管哮喘小鼠树突细胞胸腺基质淋巴生成素受体表达的影响[J].中华结核和呼吸杂志, 2012, 35(7): 497-502.
[10]Chen ZG, Zhang TT, Li HT, et al. Neutralization of TSLP inhibits airway remodeling in a murine model of allergic asthma induced by chronic exposure to house dust mite[J]. PLoS One, 2013, 8(1):e51268.
[11]Nakagami Y, Favoreto S Jr, Zhen G, et al. The epithelial anion transporter pendrin is induced by allergy and rhinovirus infection, regulates airway surface liquid, and increases airway reactivity and inflammation in an asthma model[J]. J Immunol, 2008, 181(3): 2203-2210.
[12]胡 美, 许欣婷, 李红梅, 等. Notch信号通路调控哮喘小鼠气道上皮下纤维化[J]. 中国病理生理杂志, 2016, 32(5): 781-786.
[13]Calderón MA, Casale TB, Togias A, et al. Allergen-specific immunotherapy for respiratory allergies: from meta-analysis to registration and beyond[J]. J Allergy Clin Immunol,2011,127(1):30-38.
[14]丁国富, 李 斌, 吴 翀, 等. CpG ODN核心序列改变对其生物学活性的影响[J].中国病理生理杂志, 2008, 24(10): 2025-2028.
[15]Hanagata N. Structure-dependent immunostimulatory effect of CpG oligodeoxynucleotides and their delivery system[J]. Int J Nanomed, 2012, 7: 2181-2195.
[16]朱学伟, 朱冬冬, 董 震, 等. TLR9在人鼻黏膜上皮细胞中的表达及意义[J]. 临床耳鼻咽喉头颈外科杂志, 2008, 22(8): 356-358.
[17]Kamekura R, Kojima T, Koizumi J, et al. Thymic stromal lymphopoietin enhances tight-junction barrier function of human nasal epithelial cells[J]. Cell Tissue Res, 2009, 338(2): 283-293.
(责任编辑: 卢 萍, 罗 森)
Effect of intranasal treatment with Toll-like receptor 9 ligand CpG oligodeoxynucleotides on airway inflammation in mice with allergic combined airway disease
LI Hong-tao1, CHEN Zhuang-gui2, YE Jin3, LIU Hui1, ZOU Xiao-ling1, YANG Hai-ling1, ZHANG Tian-tuo1
(1DepartmentofPulmonaryDiseases,InstituteofRespiratoryDiseasesofSunYat-senUniversity,2DepartmentofPediatrics,3DepartmentofOtolaryngology-HeadandNeckSurgery,TheThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China.E-mail:zhtituli@163.com)
AIM: To investigate the therapeutic effect of intranasal administration of CpG oligodeoxynucleotides (CpG-ODN), compared with intradermal administration, on lower airway inflammation in ovalbumin (OVA)-induced allergic combined airway disease (ACAD) mouse model. METHODS: Totally 30 female BALB/c mice aged from 6 to 8 weeks were randomly divided into control group, allergic rhinitis model group (AR group), ACAD group, ACAD intranasally treated with CpG-ODN group (CpG i.n. group) and ACAD intradermally treated with CpG-ODN group (CpG i.d. group). The mice were sensitized and challenged with OVA. Treatment with CpG-ODN was also performed during challenge, either intranasally or intradermally. Immunologic variables and nasal symptom were studied. RESULTS: Compared with CpG i.d. group and ACAD group, the percentage of eosinophils from bronchoalveolar lavage fluid (BALF), the levels of Th2 cytokine production in BALF and supernatants of cultured splenic lymphocytes, OVA-specific IgE from blood, peribronchial inflammation score in the lung, and nasal symptoms were significantly reduced in CpG i.n. group. CONCLUSION: Allergic rhinitis treated by CpG-ODN has a significant improvement on lower airway inflammation in ACAD mouse model; and it may be more effective when administrated intranasally than intradermally.
Bronchial asthma; Allergic rhinitis; CpG oligodeoxynucleotides
1000- 4718(2016)10- 1830- 07
2016- 05- 06
2016- 05- 30
国家自然科学基金资助项目(No. 81470220);广东省自然科学基金资助项目(No. S2013010015990)
△通讯作者 Tel: 020-85252241; E-mail: zhtituli@163.com
R363
A
10.3969/j.issn.1000- 4718.2016.10.015
杂志网址: http://www.cjpp.net
