MiRNA-25在非小细胞肺癌吉非替尼耐药细胞中的表达及其作用机制
2016-11-23周建英刘震天陈颖兰
周建英 刘震天 陈颖兰
·基础研究·
MiRNA-25在非小细胞肺癌吉非替尼耐药细胞中的表达及其作用机制
周建英 刘震天 陈颖兰
目的 探讨miRNA-25在非小细胞肺癌(NSCLC)吉非替尼耐药细胞中的表达及其作用机制。方法 采用RT-PCR法检测miRNA-25在NSCLC吉非替尼耐药细胞PC9/G及亲本细胞PC9中的表达;采用体外转染法将miRNA-25模拟物或抑制物分别转染PC9和PC9/G细胞,采用CCK8实验检测转染前后细胞对吉非替尼敏感性的变化;并用Westem blot检测转染前后细胞中Bim的表达变化。采用双荧光素酶报告基因验证miRNA-25是否作用于Bim基因的3'-UTR区预测靶位。结果 miRNA-25在PC9/G细胞中的表达水平是PC9细胞的(7.15±1.26)倍(P<0.01)。PC9细胞转染miRNA-25模拟物后,吉非替尼对PC9细胞增殖的抑制率较转染前明显下降(P<0.01),细胞内Bim表达水平较转染前明显下降(P<0.05)。PC9/G细胞在转染miRNA-25抑制物后,吉非替尼对PC9/G细胞增殖的抑制率与转染前比较明显增加(P<0.01),细胞内Bim表达水平较转染前明显增高(P<0.05)。经双荧光素酶报告基因验证Bim是miRNA-25的靶基因。结论 miRNA-25在NSCLC耐药细胞PC9/G中异常高表达,下调其表达可部分逆转细胞耐药性,miRNA-25可能通过作用于Bim参与NSCLC细胞吉非替尼耐药的发生和发展。
非小细胞肺癌;吉非替尼;耐药;miRNA-25
(ThePracticalJournalofCancer,2016,31:1567~1571)
肺癌是全球发病率和病死率最高的恶性肿瘤之一,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占全部肺癌的80%左右[1]。近年来,以吉非替尼和厄洛替尼为代表的表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs) 逐渐成为治疗NSCLC的重要手段[2-3]。但由于存在原发或获得耐药问题, EGFR-TKIs仅对部分NSCLC患者有效。目前这种耐药机制尚未完全明确[4-5]。
MiRNA是一种广泛存在于各种生物体中的小RNA分子,可在转录后水平负性调控基因的表达。大量的研究证实,miRNA参与了肿瘤的发生发展过程,在肿瘤细胞耐药性形成过程中发挥着重要作用[6-8]。近期研究发现,miRNA-25参与了肿瘤细胞耐药形成[9],但是miRNA-25是否参与了NSCLC细胞EGFR-TKIs耐药的调节,目前尚未见报道。因此,本研究以吉非替尼敏感肺癌细胞株PC9与吉非替尼耐药肺癌细胞株PC9/G为细胞模型,探讨miRNA-25是否参与调节NSCLC吉非替尼耐药及其可能的分子机制,为临床NSCLC EGFR-TKIs耐药的防治提供新的治疗策略。
1 材料与方法
1.1 材料
NSCLC吉非替尼耐药细胞PC9/G及亲本细胞PC9由本实验室保存。吉非替尼为美国阿斯利康公司产品;胎牛血清及RPMI 1640为美国Gibco公司产品;细胞蛋白裂解液为北京碧云天公司产品;兔抗人Bim抗体及β-actin抗体为美国Abcam公司产品;辣根过氧化物酶标记的二抗为北京中杉金桥公司产品;增强化学发光试剂盒为美国Pierce公司产品。转染试剂盒为美国Life公司产品;Prime-scriptTM逆转录试剂盒和miRNA荧光定量PCR试剂盒为日本TaKaRa公司产品;CCK-8试剂盒为南京凯基生物科技公司产品。双荧光素酶报告基因检测试剂盒和pGL载体为美国Promega公司产品。miRNA-25 模拟物(mimics)、抑制物(inhibitor)及相应对照均由上海GenePharma公司合成。
1.2 方法
1.2.1 细胞培养 NSCLC吉非替尼耐药细胞PC9/G及亲本细胞PC9常规培养于含有10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的RPMI 1640培养基中, 37 ℃、5%CO2条件下培养。为维持PC9/G细胞耐药性,向PC9/G细胞培养液中将加入终浓度为2 μmol/L的吉非替尼。
1.2.2 细胞转染 实验设置实验组(miRNA-25 mimics或miRNA-25 inhibitor)、阴性对照组及空白对照组。转染实验时取对数生长期细胞进行细胞转染,miRNA-25 mimics或miRNA-25 inhibitor的转染浓度为10 nM,操作步骤按照Lipofectmine 2000转染说明书进行。
1.2.3 RT-PCR法检测miRNA-25的表达 采用Trizol试剂提取细胞总RNA,测量浓度后采用Prime-scriptTM逆转录试剂盒将其逆转录成cDNA,-80 ℃保存备用。以U6作为内参,采用SYBR Green法检测miRNA-25表达,反应体系为25 μl,反应条件为95 ℃ 10 s,95 ℃8 s,65 ℃10 s,70 ℃10 s,共40个循环。miRNA-25的相对表达量采用2-ΔΔCt法对基因表达量进行相对定量。
1.2.4 CCK8检测转染前后细胞对吉非替尼敏感性变化 参照CCK8试剂盒说明书进行实验。转染24 h后,以5×103个细胞接种到96孔细胞培养板中,接种体积100 μl/孔,并设仅含培养基的空白对照。待细胞贴壁后,分别加入终浓度为0.222、0.667、2、6、18、54 μmol/L及0.0056、0.0167、0.05、0.15、0.45、1.35 μmol/L的吉非替尼,每孔加入100 μl。细胞继续培养48 h后,将CCK8试剂加入培养孔中,37 ℃条件下培养继续孵育2 h,然后在酶标仪上采用450 nm波长测量每孔吸光度(OD)值。绘制细胞生长抑制率曲线,并计算吉非替尼对细胞的半数抑制浓度(IC50)。抑制率计算公式为:生长抑制率=(1-OD用药组/OD对照组)×100%,以最小二乘法进行曲线拟合,得到IC50值,实验重复3次。
1.2.5 Westem blot检测细胞中Bim的含量 转染48 h后,PBS洗涤细胞,采用蛋白裂解液提取细胞总蛋白,用BCA法测定总蛋白含量,将样本按20 μl/孔加入10%聚丙烯酰胺凝胶孔中进行电泳,转膜后采用5%脱脂奶粉封闭2 h,分别加入鼠抗人β-actin抗体及兔抗人Bim抗体,4 ℃孵育过夜。TBST洗3次,每次10 min,分别加入羊抗鼠二抗和羊抗兔二抗,孵育后显影。
1.2.6 双荧光素酶报告基因检测 合成包含有与相应miRNA-25互补结合的靶基因Bim 3'-UTR序列片段和突变的Bim 3'-UTR序列片段,将含突变的Bim 3'-UTR(mutant)的片段和预测miRNA-25结合位点的Bim 3'-UTR克隆到pGL3-Luciferase基因下游的多克隆位点中。将PC9细胞以4×105个/mL接种于6孔细胞培养板中,然后采用Lipofectmine 2000试剂共转染miRNA-25 mimics以及包含Bim 3'-UTR或突变的Bim 3'-UTR的荧光素酶质粒。转染48 h后收集细胞,按照Promega公司双荧光素酶报告基因检测试剂盒说明书进行双荧光素酶活性检测。
1.3 统计学处理
2 结果
2.1 MiRNA-25在NSCLC细胞中的表达
RT-PCR检测结果显示,miRNA-25在吉非替尼耐药细胞PC9/G中高表达,表达水平为(7.15±1.26),与本细胞PC9(表达水平1.0)相比,表达水平增高7.15倍,两者比较差异有统计学意义(P<0.01)。
2.2 转染前后NSCLC细胞对吉非替尼敏感性变化
我们进一步检测miRNA-25是否参与调节NSCLC吉非替尼耐药。在PC9/G细胞中分别转染miRNA-25 inhibitor和对照序列;在PC9细胞中分别转染miRNA-25 mimics和对照序列,采用CCK8实验检测转染前后细胞对吉非替尼敏感性变化。检测结果显示,吉非替尼对PC9细胞的IC50为(0.010±0.004)μmol/L,转染miRNA-25 mimics后吉非替尼对PC9细胞的IC50为(0.042±0.007)μmol/L,差异有统计学意义(P<0.01)(图1A)。吉非替尼对PC9/G细胞的IC50为(8.74±1.65) μmol/L,转染miRNA-25 inhibitor后吉非替尼对PC9/G细胞的IC50为(1.78±0.20)μmol/L,差异有统计学意义(P<0.01)(图1B)。

图1 PC9/G细胞和PC9细胞分别转染miRNA-25 inhibitor和miRNA-25 mimics后吉非替尼对细胞的抑制率变化
2.3 Bim是miRNA-25调节的下游靶基因
利用生物信息学软件预测miRNA-25下游调节靶基因,结果提示Bim可能是miRNA-25下游的靶基因。为了验证miRNA-25与Bim的表达关系,我们采用Western blot技术检测NSCLC细胞中miRNA-25和Bim的表达水平。检测结果显示,与阴性对照组和空白对照组相比,PC9细胞中转染miRNA-25 mimics后,Bim表达水平显著下降(P<0.05)(图2);与阴性对照组和空白对照组相比,PC9/G细胞中转染miRNA-25 inhibitor后,细胞内Bim表达水平明显升高 (P<0.05)。结果表明miRNA-25表达水平与Bim的表达呈负相关。
我们进一步采用双荧光素酶报告基因技术确认Bim是否为miRNA-25靶基因,检测结果提示,表达野生型Bim的3'-UTR序列的细胞中,转染miRNA-25 mimics组与对照组相比荧光素酶活性明显下降(P<0.01);转染突变型Bim的3'-UTR序列的细胞中,转染miRNA-25 mimics组与对照组相比荧光素酶活性无明显差异(P>0.05),以上结果提示,Bim为miRNA-25下游靶基因(图3)。
3 讨论
EGFR-TKI靶向治疗相对于传统化疗具有更大的优势,已成为晚期NSCLC的有效治疗手段。吉非替尼可抑制肿瘤细胞的生长、繁殖及侵袭等,在EGFR-TKI靶向治疗得到广泛应用。近年来,由于吉非替尼原发和获得性耐药导致其临床应用受到很大限制,因此,深入研究NSCLC细胞吉非替尼耐药机制将有助于降低临床上治疗肺癌的难度。目前,越来越多的研究表明,miRNA在肿瘤细胞原发或获得性耐药过程中发挥着重要作用[10]。
miRNA-25属于miRNA 106b~25家族,在食管鳞癌、直肠癌和肝癌等恶性肿瘤中均有高表达[11]。近年研究发现,miRNA-25参与了肿瘤细胞耐药发生过程,如,Wang等[9]研究发现,下调乳腺癌阿霉素耐药细胞中miRNA-25的表达水平可显著降低该细胞对阿霉素的耐药性。目前研究证实miRNA-25在肺癌组织中高表达,且与患者预后显著相关[12],但尚未见有关miRNA-25是否参与肺癌细胞EGFR-TKIs耐药的研究报道。
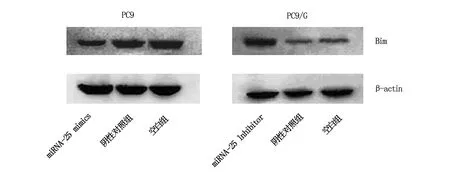
图2 PC9细胞及PC9/G细胞分别转染miRNA-25 mimics和miRNA-25 inhibitor后细胞中Bim的变化
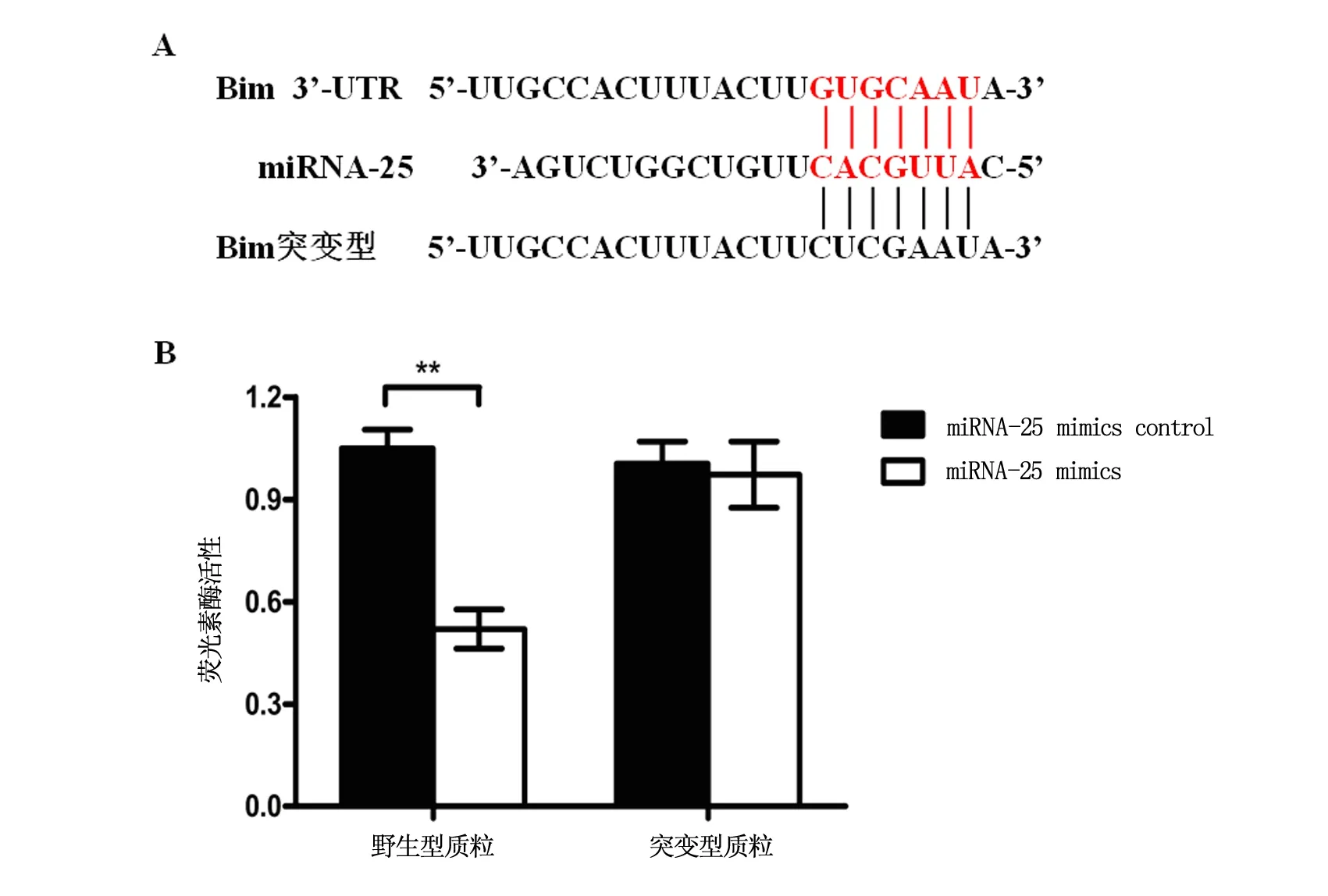
注:A为Bim 3'-UTR荧光素酶质粒构建示意图;B为双荧光素酶报告基因检测结果,**P<0.01。
在本研究中,我们以NSCLC吉非替尼耐药细胞PC9/G及亲本细胞PC9为研究对象,采用RT-PCR技术检测这两种细胞模型中miRNA-25的表达水平,研究发现,miRNA-25在PC9/G细胞中表达显著升高。进一步研究发现下调PC9/G细胞中miRNA-25表达水平可显著逆转其吉非替尼耐药性,而上调亲本细胞PC9中miRNA-25表达水平则可显著促进其对吉非替尼的耐药水平。由此证实,miRNA-25参与了NSCLC细胞吉非替尼耐药形成。
我们采用生物信息学软件预测发现,Bim基因的3'-UTR含有能和miRNA-25成熟序列结合的位点,提示Bim可能是miRNA-25的潜在靶基因之一。Bim是Bcl-2家族中仅含一个BH3结构域的蛋白,具有促凋亡活性,在NSCLC、前列腺癌及乳腺癌等恶性肿瘤细胞中均有表达[13]。最近,Zhang等[14]在人卵巢癌细胞模型中发现Bim介导了miRNA-25对细胞侵袭和凋亡能力的调节。在肺癌研究中,有研究表明Bim的低表达与EGFR-TKIs不良反应存在相关性[13];在肺癌细胞中用沉默Bim的表达可降低吉非替尼诱导突变细胞凋亡的能力[15]。
为了深入研究miRNA-25和Bim基因之间的调控关系,我们采用Western blot技术检测过表达或干扰miRNA-25后Bim基因表达变化,研究结果显示miRNA-25表达水平与Bim的表达呈负相关,过表达miRNA-25后可显著降低Bim基因表达水平。我们进一步采用双荧光素酶报告基因检测系统验证miRNA-25和Bim基因之间的靶向调控关系,研究证实 miRNA-25可以直接调控Bim基因。在后续研究中,我们将进一步研究在肺癌细胞中Bim作为miRNA-25的靶基因是否介导了miRNA-25对肺癌细胞耐药的调节。
综上所述,miRNA-25在肺癌吉非替尼耐药细胞中表达显著升高,下调miRNA-25表达可部分逆转细胞耐药性,这为临床上干预肺癌细胞EGFR-TKI耐药提供了新靶点。
[1] Zhou C.Lung cancer molecular epidemiology in China:recent trends〔J〕.Translational lung cancer research,2014,3(5):270-279.
[2] Wallerek S,Sørensen JB.Biomarkers for efficacy of adjuva-
nt chemotherapy following complete resection in NSCLC stages Ⅰ-ⅢA〔J〕.Eur Respir Rev,2015,24(136):340-355.
[3] 肖琳琳,蔡丽芳,廖圣银,等.EGFR-TKIs维持治疗晚期肺腺癌的临床效果〔J〕.实用癌症杂志,2016,31(1):63-66.
[4] Rothschild SI.Targeted therapies in Non-Small cell lung-
Cancer-Beyond EGFR and ALK〔J〕.Cancers (Basel),2015,7(2):930-949.
[5] 隋东江,王蓉美,李伟生,等.吉非替尼治疗晚期非小细胞肺癌的疗效和毒副作用观察〔J〕.实用癌症杂志,2014,29(11):1486-1488.
[6] Yu DD,Lv MM,Chen WX,et al.Role of miR-155 in drug resistance of breast cancer〔J〕.Tumour Biol,2015,36(3):1395-1401.
[7] Macdonagh L,Gray SG,Finn SP,et al.The emerging role of microRNAs in resistance to lung cancer treatments〔J〕.Cancer Treat Rev,2015,41(2):160-169.
[8] 李智敏,罗喜平,曾俐琴,等.hsa-miRNA27a和hsa-miRNA451通过调控MDR1/P-gp的表达和功能参与卵巢癌和乳腺癌细胞耐药〔J〕.中国癌症杂志,2015,25(3):190-198.
[9] Wang ZY,Wang N,Liu PX,et al.MicroRNA-25 regulates chemoresistance-associated autophagy in breast cancer cells,a process modulated by the natural autophagy inducer isoliquiritigenin〔J〕.Oncotarget,2014,5(16):7013-7026.
[10] Xue J,Niu J,Wu J,et al.MicroRNAs in cancer therapeutic response:Friend and foe〔J〕.World J Clin Oncol,2014,5(4):730-743.
[11] Qu J,Li M,Zhong W,et al.Prognostic role of microRNA-25 in cancers:evidence from a meta-analysis〔J〕.Int J Clin Exp Med,2015,8(8):12921-12927.
[12] 魏益群,李 静,孙 钢,等.MicroRNA-25在非小细胞肺癌患者中的异常表达及其临床意义〔J〕.现代检验医学杂志,2014,29(4):9-12.
[13] Faber AC,Corcoran RB,Ebi H,et al.BIM expression in treatment-naive cancers predicts responsiveness to kinase inhibitors〔J〕.Cancer Discov,2011,1(4):352-365.
[14] Zhang HY,Zuo Z,Lu X,et al.MiR-25 regulates apoptosis by targeting Bim in human ovarian cancer〔J〕.Oncol Rep,2012,27(2):594-598.
[15] Li Z,Zhou S,Zhang L,et al.BIM induction of apoptosis triggered by EGFR-sensitive and resistance cell lines of non-small-cell lung cancer〔J〕.Med Oncol,2011,28(2):572-577.
(编辑:甘 艳)
Expressions of Micro RNA-25 in Gefitinib-resistant Non-small Cell Lung Cancer Cells and Its Mechanism
ZHOUJianying,LIUZhentian,CHENYinglan.
JiangxiCancerHospital,Nanchang,330029
Objective To investigate the expression of microRNA-25 (miRNA-25) in gefitinib-resistant non-small cell lung cancer cells and its mechanism.Methods Real-time PCR (RT-PCR) was used to detect the expression of miRNA-25 in gefitinib-resistant non-small cell lung cancer cells line PC9/G and its parent cells line PC9.miRNA-25 mimics and miRNA-25 inhibitor in vitro were transiently transferred into PC9 and PC9/G cells respectively.The expression level of miRNA-25 was detected by RT-PCR.Cell viability was analyzed by CCK8 assay.Expression of Bim protein was detected by western blot.Bioinformatics software predicted the potential target genes of miRNA-25 and dual luciferase reporter gene was used to analyze the binding between miRNA-25 and 3'-UTR of Bim.Results The expression level of miRNA-25 was up-regulated in PC9/G cells as compared with PC9 cells (P<0.01).Over-expression of miRNA-25 inhibited gefitinib chemosensitivity (P<0.01),and the up-regulation of miRNA-25 led to a significant decrease in the Bim protein levels (P<0.05).Low-expression of miRNA-25 promoted gefitinib chemosensitivity (P<0.01),and the down-regulation of miRNA-25 led to a significant increase in the Bim protein levels (P<0.05).Dual luciferase reporter gene assay indicated that miRNA-25 regulated Bim expression by binding to the 3'-UTR of Bim mRNA.Conclusion The expression of miRNA-25 is up-regulated in PC9/G cells.Down-regulation of the expression of miRNA-25 can partially reverse the gefitinib-resistance.miRNA-25 may play a vital role in drug resistance by targeting Bim.
Non-small cell lung cancer;Gefitinib;Drug resistance;MiRNA-25
江西省卫生厅科技计划资助项目(编号:20131206)
330029 江西省肿瘤医院
刘震天
10.3969/j.issn.1001-5930.2016.10.001
R734.2
A
1001-5930(2016)10-1567-05
2016-04-29
2016-06-22)
