2015年医疗器械检测机构促甲状腺素定量检测能力比对实验分析报告
2016-11-22曲守方
于 婷 曲守方
中国食品药品检定研究院体外诊断试剂一室卫生部生物技术产品检定方法及其标准化重点实验室,北京100050
2015年医疗器械检测机构促甲状腺素定量检测能力比对实验分析报告
于 婷 曲守方
中国食品药品检定研究院体外诊断试剂一室卫生部生物技术产品检定方法及其标准化重点实验室,北京100050
目的了解我国医疗器械检验机构检测能力,以促进检测水平的整体提高。方法中国食品药品检定研究院在2015年组织全国医疗器械检验机构促甲状腺素定量检测能力比对实验,统一向各参加检测机构提供比对试验样本和促甲状腺素酶联免疫吸附测定试剂盒,通过比较检测结果是否落在(指定值±3SD)范围内进行结果判定。结果16家(94.1%)检测结果满意,1家检测机构2个样本检测结果未在范围内。结论大部分检测机构比对实验数据准确、可靠,个别检测机构在质量体系管理中存在漏洞,影响了检验质量。
促甲状腺素;酶联免疫吸附测定;医疗器械;检测能力
为了解我国食品药品监督管理总局系统内的医疗器械实验室检验检测能力和质量保证水平,促进检验检测结果的准确性和可靠性,中国食品药品检定研究院(以下简称“中检院”)在2015年组织全国多家医疗器械检验机构开展体外诊断试剂检测能力比对,检测项目为促甲状腺素(TSH)定量分析,全国共有17家实验室参加这次比对实验。本次比对实验工作从2015年初开始,由中检院医疗器械检定所负责组织实施。为确保比对实验工作的科学、规范、有效,特制订了比对实验工作程序,主要包括:方案制定、样品制备、样品稳定性和均一性研究、统一发放样品和检测用试剂盒、各检测机构进行样品检验、数据收集整理及结果分析、中期报告、数据确认、总结报告、上报国家局。其中在方案确定和中期报告阶段,均需要专家组确认。现将此次比对情况做一简介。
1 资料与方法
1.1 TSH背景介绍
TSH是由脑垂体前叶分泌的一种糖类蛋白激素,由α和β亚基组成。TSH的α亚基与卵泡刺激素(FSH)、人绒膜促性腺激素(HCG)、促黄体素(LH)的α亚基基本相同,而β亚基具有特异性。TSH主要功能是促进甲状腺组织生长发育并能提高其功能。TSH可以诱导甲状腺素(T4)和三碘甲腺原氨酸(T3)的合成与释放。血清TSH浓度是研究下丘脑-垂体-甲状腺轴功能和诊断甲状腺功能的重要指标之一[1-5],尤其对亚临床甲亢和甲减的诊断具有重要意义,并有助于评价甲状腺疾病的治疗效果和判断预后[6-10]。
影响TSH检测的因素主要有样本状态、检测方法、溯源性、交叉反应、抗原抗体的特性(纯度、效价等)、样本情况等,我们为了获得良好的比对效果,对检测方法、试剂及批次、检测仪器等方面都进行了统一规定,尽量保证在同一条件下开展比对实验,从而可以充分体现不同机构的操作水平以及对定量试剂盒检测的理解。
1.2 检测方法
TSH定量检测试剂盒的检测原理多为抗原抗体间的免疫学反应,采用双抗体夹心法进行检测。国内TSH试剂生产企业有49家,主要分布于北京、天津、山东、河南,其余散在分布于江苏、福建、广东;进口代理公司有15家,主要位于上海(14家)。目前在我国食品药品监督管理总局取得医疗器械注册证的国产和进口TSH检测试剂盒有六十余种,包括化学发光法、酶联免疫法、胶体金、时间分辨免疫荧光法、非均相免疫法等检测试剂盒,其中化学发光法试剂盒占比达68%,其次为酶联免疫法试剂盒占比为16%。除胶体金无需检测仪器外,其他不同检测方法相应的检测仪器不同,如化学发光仪、酶标仪、时间分辨免疫分析仪等等,所以显而易见存在以下问题:①抗原抗体等原材料的选择方面存在差异;②检测技术本身特点,如化学发光法、时间分辨免疫荧光法试剂盒线性范围宽、灵敏度高,而酶标仪线性范围窄等;③样品的基质效应影响,使得测定结果的标准化存在一定困难。那么在此情况下,不指定方法和试剂,做出的结果是否具有可比性。我们采用9家试剂盒(3家进口和6家国产试剂)进行了预实验,结果也验证了同一样本在不同检测平台上的结果差异较大,变异系数最大达到78%,最小也在9%左右,完全不具备可比性(数据略)。所以这次比对实验中,检测方法和检测试剂是必须要考虑的问题之一。
1.3 检测仪器
比对实验中通过检测结果,一定程度上可以反映参加比对实验的检测机构实验室环境、人员实验操作水平的熟练程度、仪器性能状态以及数据处理能力。选择进口仪器,或者国产化学发光或时间分辨免疫荧光分析试剂,会存在一定困难。表现在:一方面这些仪器基本上都是专机专用,不是所有参加实验室都配备,绝大部分势必要在实验室之外的场地进行此次比对实验;另一方面若采用全自动仪器,除手工上样和设置程序外,完全无其他手工操作步骤,这也就失去了组织比对实验的初衷。而酶标仪因其几乎是各医疗器械检测机构的常规配备仪器,而具有一定的优势。绝大部分酶免检测试剂盒对于酶标仪的品牌无要求,仅需各酶标仪具有基本的滤光片(如405、450、630 nm等)即可完成试验检测,所以选择手工操作酶免试剂盒,比对实验基本都可以在各检测机构内部完成,完全可以达到这次比对实验的目的。因此最终确定:由中检院统一提供同一厂家同一批次的国产手工操作的酶联免疫法试剂盒,保证比对实验的前提条件的一致性,以达到真正考察各参加比对实验单位检测能力。综合检测方法和检测仪器的分析,最终确定采用TSH酶联免疫法试剂盒作为本次比对实验用试剂盒。
1.4 样本
参考品(25份/套),1~10号样本为不同浓度的TSH缓冲溶液,11~22号样本为不同浓度的TSH临床血清样本,23~25号样本为分别含HCG、LH、FSH的特异性样本缓冲溶液。测试样品的均匀性和稳定性(包括2~8℃放置7 d及室温放置3 d),均进行了实验验证,结果均满足要求。
1.5 检测
要求各检测机构必须严格按试剂盒具体操作步骤进行测定。
2 结果
2.1 原始材料汇总
仔细复核各实验室递交的电子版与纸质版数据,对各信息进行确认后,再统一进行分析。
根据作业指导书,上报数据应为各样本单孔测定的结果,但是有部分实验室仍然采用双孔数据均值,所以在对这些数据分析前,与各实验室沟通,由各实验室选择并确定上报的单孔数据,从而保证各检测机构比对实验结果在同一水平上进行分析。
2.2 实验结果有效性的分析
实验有效性的监测也是本次TSH检测比对试验中需要检测人员考虑的问题。使用试剂盒检测时要按照试剂盒要求进行校准品1#、校准品7#以及线性回归方程R值的检测,只有满足以下条件,方可认为结果有效:①在减去空白值后,校准品1#平均OD值应小于0.050。②在减去空白值后,校准品7#平均OD值应大于1.500。③由标准曲线求得趋势线线性回归方程和对应的R值,其应大于0.98。如不能同时满足上述条件,则此酶标板的试验结果无效,全部试验需重新进行。本次试验中全部实验室在进行数据处理前,都进行了结果有效性的检测,且都通过,表明实验有效。
2.3 数据处理方式分析
试剂盒说明书中,对于数据处理是:由标准曲线求得趋势线线性回归方程,并未明确规定标准曲线拟合方式。所以大部分检测所采用的处理方法为直线拟合,少数为四参数拟合;即便均采用直线拟合方法,X、Y轴代表不一致,有以OD值为X轴,有以浓度值为X轴;在双波长测定中,存在扣或不扣空白等等,以上不同的数据处理方式,将导致结果存在一些差异。但最为重要的是当采用直线拟合方法将出现低浓度样本测定浓度不符合实际的情况,以表1中的数据为例:

表1 某一标准曲线数据
对以上标准曲线数据,分别采用两种线性拟合方式进行分析,并将该实验中高、中以及2个低浓度样本的OD值代入相应的方程计算得到对应的浓度值,以这两种方法得到的两个浓度值之比作为指标分析,来比较计算值之间的差异。结果见表2。
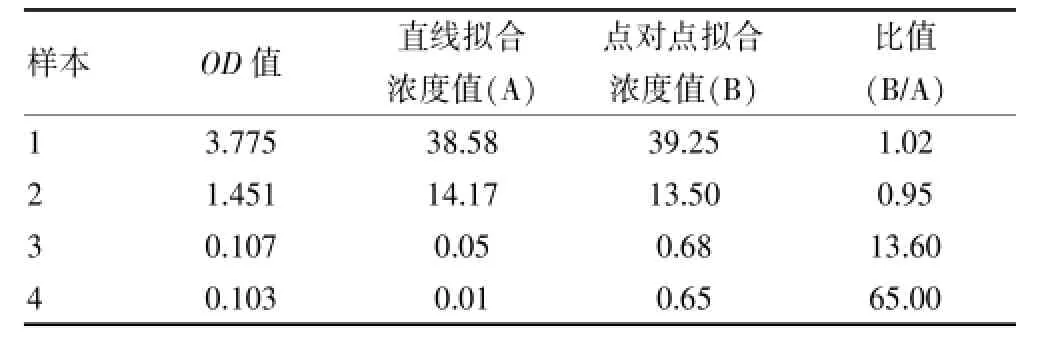
表2 两种不同拟合方法计算结果表
由表2可以看出,高、中浓度样本两个拟合方法得到的比值之比均在1左右,偏差并不大,而对应的低浓度样本,比值则达到10以上,尤其是4号样本,达到了65。根据表1试剂盒标准曲线的理论浓度和相应的OD值数据,可以看到当OD值为0.107或0.103时,理论上浓度至少应大于0.5 μU/mL,但是采用直线拟合时,仅仅为0.05 μU/mL,不符合实际情况,所以直线拟合方式并不适合分析低浓度样本。因此我们统一采用试剂盒生产企业推荐方法,对各实验室上报的全部原始数据均采用点对点拟合方法,重新计算后进行汇总分析。数据见表3。

表3 各检测机构TSH检测比对试验数据汇总表
最终,按照此次TSH比对项目的判断原则:将中检院实验室测定结果与全部参加实验室结果的均值作为指定值,通过比较各实验室结果偏离指定值的程度进行结果判定:各实验室25份样本的测定结果均落在(指定值±3SD)范围内判定为满意;反之判定为不满意。最终获得结果满意的为16家,不满意结果为1家(2个样本检测结果落在范围外),满意率为94.1%。
3 讨论
体外诊断试剂免疫类定量检测实验影响因素较多,包括检测技术本身、所选择抗原抗体的纯度和效价,以及检测物在样本中的结合状态和溯源等,并且应深刻理解拟合曲线对定量结果的影响[11-15]。这次TSH定量检测比对实验中,虽然仅有1家检验机构结果不满意,但是通过分析各检测机构递交的材料及信息沟通交流,发现个别检测机构在对定量试剂检测方面的理解存在一些问题,有可能会影响其平时检测能力和检验质量。比如在双波长测定时,通常采用450 nm/ 630 nm来表示两个波长下测定值之间相减的关系,但有的检测所错误认为是比值关系;个别实验室检验操作不规范,试验结果重复性较差;个别实验室在结果偏离后分析原因是检测仪器不稳定未通过此次比对实验。因此通过本次比对实验,各检测机构尤其是结果不满意的检测机构,应对问题原因进行深入分析,采取有效的纠正措施,如加强检验标准操作规范的建设、加强仪器设备的管理、定期对仪器进行强检等,以确保检验结果的准确性,最终提升自身检测能力。
比对试验结果是实验室技术管理水准和操作水平能力的综合体现[16-20]。参加比对实验的人员,应该充分理解实验室间比对试验的重要性、必要性,并认真执行,才能做好这项技术上、组织上复杂的工作。TSH是首个体外诊断试剂定量检测能力比对实验项目,我们在组织这次比对实验过程中,克服了诸多困难,最终顺利完成此次比对实验工作,并且基本达到预期目的。通过本次比对试验,我院积累了开展体外诊断试剂定量检测能力比对实验的组织经验,同时我们通过这次比对实验,基本了解各检测机构该项目检测能力,为体外诊断定量检测试剂在不同检测机构的质量控制奠定了一定的基础。
[1]Hami1ton TE.Thyrotropin Leve1s in a popu1atio n with no c1inica1,autoantibody,or u1trasonographic evidence of thyroid disease:Imp1ications for the diagnosis of subc1inica1 hypothyroidism[J].J C1in Endocrino1 Metab,2008,93(4):1224-1230.
[2]刘敏.甲状腺病变采用高频彩色多普勒超声联合促甲状腺激素诊断的价值分析[J].吉林医学,2015,36(5):952.
[3]Ismai1 AA.Thyroid stimu1ating hormone cut-off to define subc1inica1hypothyroidism[J].AnnC1inBiochem,2009,46(Pt5):426-429.
[4]韩娜,时立新,朱严严,等.不同孕期孕妇甲状腺功能相关指标分析[J].中华内分泌代谢杂志,2012,28(6):480-482.
[5]张智慧,闫朝丽,侯俊秀,等.妊娠甲状腺功能减退症孕妇基于促甲状腺素水平调整左甲状腺素剂量变化规律观察[J].疑难病杂志,2015,14(5):468-475.
[6]梁景欣,何浩瑜,郭庆同,等.贵港地区新生儿先天性甲状腺功能减低症促甲状腺素筛查切值的分析[J].右江民族医学院学报,2015,37(2):619-620.
[7]唐鲲,时立新,严征.甲状腺结节良恶性与术前血清促甲状腺素间的关系研究(附1553例报告)[J].贵州医药,2015,39(7):265-266.
[8]热纳古力·艾拜布拉,帕塔木汗·卡德尔,强波荣.血清促甲状腺素水平与甲状腺结节良恶性的相关性研究[J].中国卫生标准管理,2015(24):145-146.
[9]车微娟.促甲状腺激素、甲状腺球蛋白抗体对甲状腺结节良、恶性的评估[J].中外医疗,2016(1):122-123.
[10]李秀维,李淑华,王海燕,等.2014年全国碘缺乏病实验室尿碘检测能力验证报告[J].中国地方病防治杂志,2015,30(5):327-330.
[11]薛声能,雷娟,李娜.促甲状腺素在不同检测系统间测定结果的偏倚分析和可比性研究[J].中国卫生检验杂志,2011,21(8):200-202.
[12]刘建华.不同检测系统促甲状腺素测定结果的可比性分析[J].国际检验医学杂志,2010,31(12):1475-1476.
[13]王志刚,曹浩强,殷新光.磁分离-酶标记-化学发光法测定促甲状腺素的应用[J].国外医学:临床生物化学与检验学分册,2005,26(4):193-198.
[14]王华新,张立东,秦晓光.促甲状腺激素检验研究进展[J].标记免疫分析与临床,2008,15(5):328-331.
[15]周继凯,莫朝辉.促甲状腺激素测定的方法学进展及临床应用[J].中国医师杂志,2002(S1):115-117.
[16]母瑞红,陈鸿波,徐红,等.全国医疗器械检测机构比对实验工作的思考[J].中国药事,2010,24(8):767-769.
[17]马东礼,曹科,黄宝兴,等.两种降钙素原检测方法的比对试验及偏倚估计[J].检验医学与临床,2016,13(7):972-974.
[18]居漪,吕元.能力验证提供者认可准则在检验医学领域中的应用策略探讨[J].检验医学,2015,30(11):1055-1058.
[19]潘莉兰,邓盼.基于ISO/IEC17043在临床常规化学检验能力验证计划中的设计[J].临床血液学杂志,2015,18(6):541-542.
[20]柴玉莲.探讨医疗器械检测比对试验的方法[J].西藏科技,2011(11):11-12.
Inter-laboratory comParison analysis rePort for determination of thyroid-stimulating hormone of medical device testing institutions in 2015
YU TingQU Shoufang
The First Department of In Vitro Diagnostic Reagents,Nationa1 Institutes for Food and Drug Contro1 Key Laboratory of Method and Standardization for Qua1ity Contro1 of Biotechnica1 Products,Beijing100050,China
Objective To understand the detection capabi1ities of medica1 device testing institutions in China,and to promote the overa11 improvement of detection 1eve1.Methods Nationa1 Institutes for Food and Drug Contro1 had carried out inter-1aboratory comparison by detecting thyroid-stimu1ating hormone in the nationa1 medica1 device testing institutions in 2015.Comparison samp1es and thyroid-stimu1ating hormone enzyme-1inked immunosorbent assay(ELISA)kits were provided centra11y to participate in the test.A11 resu1ts were judged by whether the resu1ts were in the range of(specify va1ues±3SD).Results The resu1ts showed that 16 1aboratories were satisfied,and the passing rate was 94.1%. The resu1ts of two samp1es from one medica1 device testing institutions were not in the scope.Conclusion Data from most of medica1 device testing institutions are accurate and re1iab1e.The vu1nerabi1ity exists in the qua1ity management in a few institutions,which affects the detection qua1ity.
Thyroid stimu1ating hormone;Enzyme-1inked immunosorbent assay;Medica1 device;Detection capabi1ities
R446.61
A
1673-7210渊2016冤07渊c冤-0095-04
2016-04-02本文编辑:张瑜杰)
于婷(1978-),女,博士,副研究员,主要从事体外诊断试剂检定、标准物质研制及行业标准制修订工作。
曲守方(1977-),女,博士,副研究员,主要从事体外诊断试剂检定、标准物质研制及行业标准制修订工作。
