雷利度胺联合地塞米松抗T淋巴瘤细胞作用的研究
2016-11-22李红玲李明玉张旭霞齐发梅
李红玲 陈 彤 李明玉 张旭霞 齐发梅 王 芳
1.甘肃省人民医院肿瘤内科,甘肃兰州730000;2.甘肃省人民医院检验中心,甘肃兰州730000
雷利度胺联合地塞米松抗T淋巴瘤细胞作用的研究
李红玲1陈 彤1李明玉1张旭霞1齐发梅2王 芳2
1.甘肃省人民医院肿瘤内科,甘肃兰州730000;2.甘肃省人民医院检验中心,甘肃兰州730000
目的探讨雷利度胺联合地塞米松对T淋巴瘤细胞增殖与凋亡的影响。方法预实验后选取雷利度胺(40、80、120、160、200、400、600 mg/L)、地塞米松(50、100、150、200、250 mg/L)及两药联用处理人T淋巴瘤Jurkat细胞24、48、72 h;MTT法测试细胞毒性,流式细胞术检测细胞周期,光镜、荧光显微镜进行形态学观察,Annexin V染色检测凋亡率。结果雷利度胺和地塞米松均以浓度和时间依赖性方式抑制Jurkat细胞生长,诱导Jurkat细胞凋亡。雷利度胺和地塞米松联合处理组的Jurkat细胞增殖受抑率显著高于单用雷利度胺组(P<0.05)和单用地塞米松处理组(P<0.05)。结论雷利度胺和地塞米松联合具有协同抗T细胞淋巴瘤作用,本研究为雷利度胺和地塞米松临床联合应用于T细胞淋巴瘤提供了理论基础。
雷利度胺;地塞米松;T淋巴瘤细胞;增殖;凋亡
淋巴瘤是血液系统恶性肿瘤,分为霍奇金淋巴瘤(HD)和非霍奇金淋巴瘤(NHL)两大类,以NHL更为多见[1],其中NHL占淋巴瘤总数的90%,不同亚类之间恶性程度、疗效、预后有很大差异[2]。常用的治疗方法包括化疗、干细胞移植、靶向治疗等[3],但由于耐药、复发等因素,仍有部分患者不能得到治愈,因此有必要寻找新的治疗手段。
雷利度胺(Lena1idomide)是沙利度胺的类似物,研究证实雷利度胺对部分NHL亚型及其他类型实体瘤有效,如用于T细胞淋巴瘤的治疗[4]。目前雷利度胺在其他类型淋巴瘤中的作用研究仍是热点。在骨髓瘤治疗中雷利度胺临床常用的方案是与地塞米松联合,但在淋巴瘤中二者联合是否有协同作用尚不明确。本研究对雷利度胺联合地塞米松对T细胞淋巴瘤细胞的抗肿瘤作用进行探讨,旨在为雷利度胺用于T细胞淋巴瘤治疗提供一定的理论依据。
1 材料与方法
1.1 实验材料
雷利度胺购自台州市椒江星成医药化工有限公司,用DMSO配制成20 mg/mL的储存液。地塞米松磷酸钠注射液购自辰欣药业股份有限公司,原液浓度5 mg/mL作为储备液。二者均-20℃冻存,临用时稀释至工作浓度。其中,DMSO的使用浓度低于1%。Hoechst33258、Annexin V试剂盒为杭州碧云天公司产品。
1.2 细胞培养、形态学观察
本研究采用的细胞系为人T淋巴瘤细胞株Jurkat,购自中国科学院上海细胞库。用RPMI1640完全培养液,置于37℃、5%CO2、饱和湿度的恒温孵箱中培养。所有细胞系分别以(2~3)×105/mL个细胞的起始浓度接种于含或不含相应药物的新鲜RPMI1640培养液(内含10%小牛血清和1%青、链霉素)中。实验选用对数生长期细胞。药物处理的细胞,经离心、涂片、Wright's染色后在光镜下观察其细胞形态学。
1.3 MTT比色法检测细胞毒作用
在预实验中发现低浓度雷利度胺(1.25、2.5、5、10、20 mg/L)对Jurkat细胞无明显抑制作用,故本研究中选择雷利度胺浓度为40、80、120、160、200、400、600 mg/L。各组均按每孔3×104个细胞数接种96孔板,每组设3复孔。分别于转染后24,48,72 h测定570 nm处吸光度值A570。细胞抑制率=(1-A570处理组/A570未处理组)×100%。地塞米松剂量选择50、100、150、200、250 mg/L,检测方法同上。
1.4 细胞周期检测
收集不同处理后Jurkat细胞,PBS洗涤后,70%乙醇固定,4℃冰箱过夜。检测前PBS冲洗细胞1次,调整样品浓度至1×106/mL,加入碘化丙啶染色液,4℃冰箱中避光染色30 min,流式细胞术分析细胞周期。
1.5 细胞凋亡检测
1.5.1 光镜下检测Jurkat细胞凋亡形态学变化采用瑞氏吉姆萨染色,荧光显微镜检测Jurkat细胞凋亡按Hoechst33258说明书进行荧光染色,荧光显微镜下观察结果。
1.5.2 流式细胞术检测细胞凋亡率分别取对照组及各实验组细胞1×106个,用PBS洗涤2次,加入490 μL结合缓冲液,充分混匀细胞,加入5μL FITC标记AnnexinV和15 μL溶解的碘化丙锭于细胞悬液中,轻轻混匀,将试管置于4℃避光孵育10 min,流式细胞仪检测凋亡细胞比例。
1.6 MTT及Annexin V检测雷利度胺联合地塞米松对Jurkat细胞增殖及凋亡的作用
实验分组:对照组、雷利度胺组(200 mg/L)、地塞米松组(250 mg/L)、雷利度胺(200 mg/L)联合地塞米松组(250 mg/L),以上均为终浓度。调整各组细胞数为5×103个/孔,置37℃、5%CO2培养箱中继续培养48 h,MTT法检测细胞毒作用,Annexin V-FITC/PI检测凋亡率。采用金正均法[5]计算雷利度胺和地塞米松联合应用在促进凋亡方面是否有协同作用;q=Ea+b/(Ea+Eb-Ea×Eb);Ea+b为联合用药组的细胞凋亡率;Ea、Eb分别为应用a药和b单独处理组的细胞凋亡率。q值在0.85~1.15之间为两药联合作用单纯相加,q值<0.85为两药合用有拮抗作用,q值>1.15为两药合用有协同作用。
1.7 统计学方法
采用SPSS 13.0统计学软件进行数据分析,计量资料数据用均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 体外实验检测单用雷利度胺对Jurkat细胞增殖的抑制作用
预实验发现雷利度胺剂量低于40 mg/L时难以检测到显著的细胞抑制作用,低浓度雷利度胺(1.25、2.5、5、10、20 mg/L)的细胞抑制率与对照组比较差异无统计学意义。本研究以40 mg/L为起始剂量,发现剂量增加后雷利度胺细胞抑制率逐渐增加,40、80、120、160、200、400、600 mg/L雷利度胺对Jurkat细胞增殖均有抑制作用,呈时间和剂量依赖性。200 mg/L雷利度胺作用Jurkat细胞24、48、72 h后,细胞增殖抑制率分别为18.2%、27.7%、31.8%。但这种抑制作用总体上较弱,因为雷利度胺剂量即使达到600 mg/L作用72 h,抑制率仅为39.1%,仍未达到IC50。见图1。

图1 MTT法检测雷利度胺对Jurkat细胞增殖能力的影响
2.2 体外实验检测单用地塞米松对Jurkat细胞增殖的抑制作用
预实验结果显示,较低浓度地塞米松对Jurkat细胞增殖的抑制作用微弱,剂量低于50 mg/L时难以检测到显著的细胞抑制作用,故本研究中选择≥50 mg/L的浓度进行后续实验。结果显示,50、100、150、200、250 mg/L地塞米松对Jurkat细胞增殖均有抑制作用,呈时间和剂量依赖性。见图2。

图2 MTT法检测地塞米松对Jurkat细胞增殖能力的影响
2.3 体外实验检测单用雷利度胺对Jurkat细胞周期的影响
用200 mg/L雷利度胺作用Jurkat细胞48 h后,G0/G1、S和G2/M期细胞比例分别为(29.4±2.5)%、(8.42± 1.1)%、(62.2±3.2)%,与对照组[(29.2±1.8)%、(8.12± 0.8)%、(62.7±4.4)%]相比,差异无统计学意义(P>0.05),说明200 mg/L雷利度胺作用48 h对Jurkat细胞周期无显著影响。见图3。
2.4 光镜、Hoechst33258染色检测单用雷利度胺对Jurkat细胞凋亡的影响
2.4.1 光镜检测Jurkat细胞凋亡形态学变化光镜下显示,对照组细胞胞体圆形或近圆形,细胞膜有少量突起,胞膜完整,胞浆丰富,呈蓝色或淡蓝色,细胞核较大,呈圆形或近圆形,细胞核膜完整。与对照组相比,雷利度胺处理组出现细胞变形,胞膜不完整,胞浆丢失,细胞核碎裂等凋亡改变,并出现凋亡小体。见图4。
2.4.2 Hoechst33258染色荧光显微镜检测Jurkat细胞凋亡形态学变化在荧光显微镜下,对照组Jurkat细胞形态完整,染色均匀一致,Hoechst 33258荧光染色检测结果显示,对照组的细胞核大小均一,形态完整,较圆,核内荧光均匀弥散,呈蓝色淡染。雷利度胺处理后,Jurkat细胞呈现典型的凋亡改变,出现部分细胞凋亡变化,细胞核体积缩小,有核碎裂现象,可见染色质高度浓集、核染色质凝聚成明亮的团块状等改变。见图5,封三。
2.5 MTT检测雷利度胺联合地塞米松对Jurkat细胞生长的抑制作用
200 mg/L雷利度胺与250 mg/L地塞米松联合作用24、48、72 h对Jurkat细胞生长抑制率显著高于单用雷利度胺组(P<0.05)和单用地塞米松组(P< 0.05)。见表1。
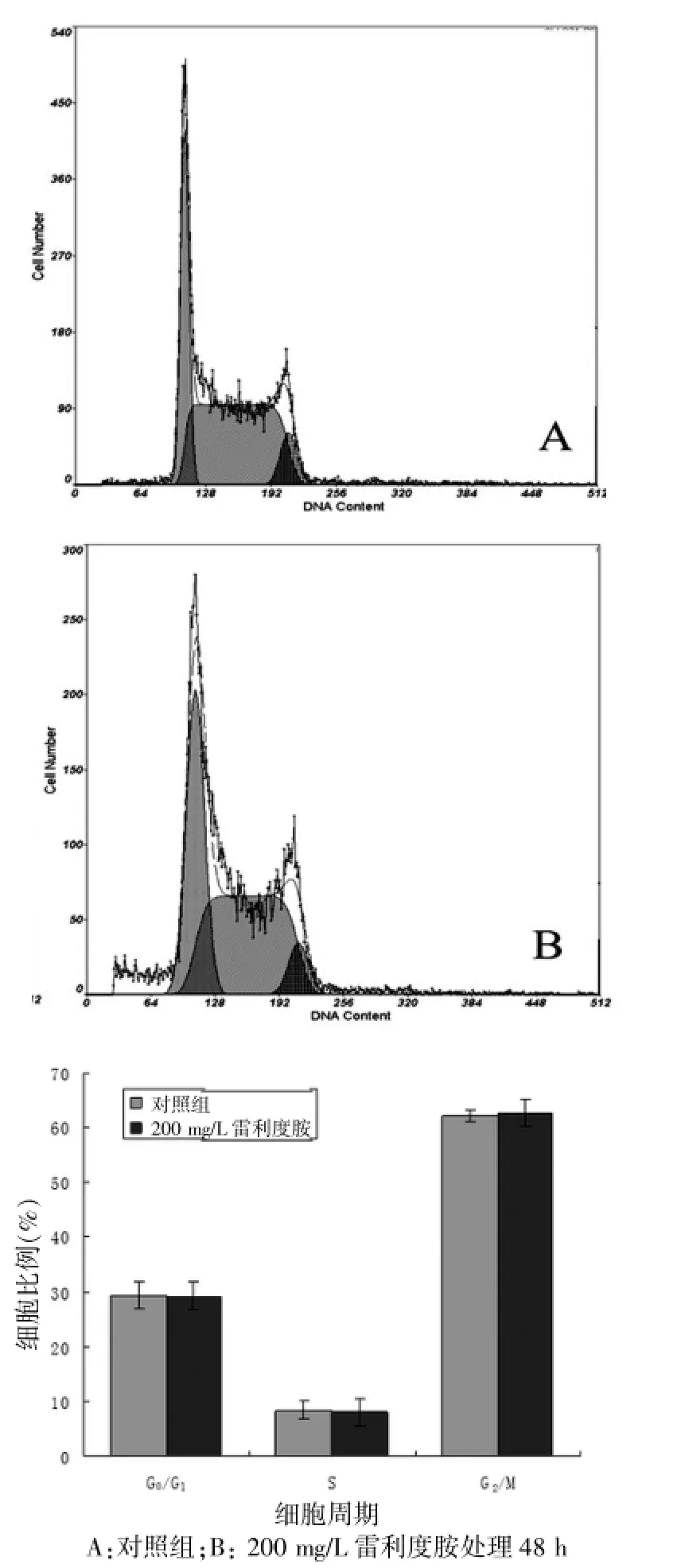
图3 流式细胞术检测单用雷利度胺对Jurkat细胞周期的影响

图4 光镜观察雷利度胺诱导凋亡的形态学改变(100×)
2.6 Annexin V染色检测雷利度胺联合地塞米松对Ju鄄rkat细胞凋亡的诱导作用
流式细胞术检测分析显示,200 mg/L雷利度胺与250 mg/L地塞米松联合作用48 h细胞凋亡率显著高于单用雷利度胺组和单用地塞米松组,差异有统计学意义(P<0.05),见图6。本研究中通过金正均法计算出q=1.21,说明雷利度胺和地塞米松联合应用在促进凋亡方面有协同作用。
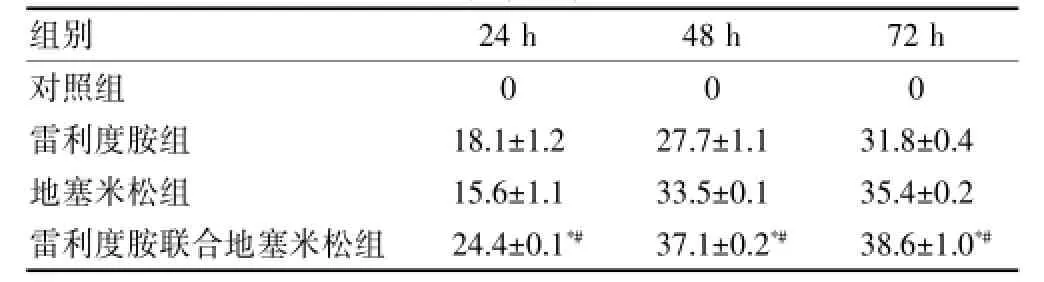
表1 雷利度胺与地塞米松联合应用对Jurkat细胞的增殖抑制作用(%,n=4)

图6 流式细胞术检测雷利度胺联合地塞米松对Jurkat细胞凋亡的影响
3 讨论
雷利度胺是沙利度胺的衍生物,其研发主要是基于减少沙利度胺的不安全性。2000年后,雷利度胺显著的抗肿瘤作用[6]成为研究热点,2006年被相关组织批准用于多发性骨髓瘤的治疗,其治疗方案为雷利度胺与地塞米松联合应用[5]。骨髓增生异常综合征的亚型5q-综合征也是其治疗的适应证之一[7]。
随着对雷利度胺抗肿瘤作用的研究,发现其对某些淋巴瘤如T细胞淋巴瘤也有一定临床效果[8],在滤泡性淋巴瘤、弥漫性大B细胞淋巴瘤患者的临床应用中也有一定的临床反应[9]。但其对T细胞淋巴瘤的作用及与地塞米松的联合作用研究较少,机制仍不明确。本研究选择T细胞淋巴瘤细胞株Jurkat作为研究对象,探讨雷利度胺联合地塞米松对T淋巴瘤细胞增殖与凋亡的影响。雷利度胺、地塞米松及两药联用处理人淋巴瘤Jurkat细胞24、48、72 h,MTT法测试细胞毒性,光镜下及荧光显微镜进行形态学观察。结果提示,雷利度胺以浓度和时间依赖性方式抑制Jurkat细胞生长及诱导细胞凋亡。在荧光显微镜下,雷利度胺处理48 h后,可见核染色质凝聚成明亮的团块状,部分细胞形态不规则,并有核碎裂现象,提示Jurkat细胞呈现典型的凋亡改变。经流式细胞术Annexin V分析显示,雷利度胺对T细胞淋巴瘤也有抗增殖与诱导凋亡作用,与其他肿瘤中的研究结果一致。Mitsiades等[10]研究发现,雷利度胺抗骨髓瘤细胞增殖和诱导凋亡作用与其抑制NF-κb的活性有关。
在预实验中发现,剂量低于40 mg/L时难以检测到雷利度胺显著的细胞抑制作用,增大剂量后,在40~600 mg/L剂量区间,其增殖抑制率和凋亡率均显著低于常用的化疗药物的相应数值,说明与常用化疗药物相比,雷利度胺的抗增殖和诱导凋亡作用较弱,推测其发挥抗肿瘤作用的机制可能更多的与免疫调控、抗血管生成[11]等相关。研究表明,雷利度胺作为一个多效免疫调节剂可杀伤肿瘤细胞,也可增强对肿瘤细胞的免疫应答[12-15]。雷利度胺通过上调CDK抑制剂p21 waf-1引起浓度依赖的细胞周期停滞在G0/G1期,并下调促存活的活性激酶ERK1/2和Akt的活性发挥抗肿瘤作用[16-17]。基于以上分析,认为雷利度胺抗Jurkat细胞增殖和诱导凋亡可能是其抗肿瘤作用机制之一。
地塞米松是一种皮质类固醇药物,常用于肿瘤的化疗,尤其是在多发性骨髓瘤中地塞米松常单独或与其他化疗药物联合应用[18],但雷利度胺与地塞米松联合应用是否也适用于淋巴瘤尚不明确。本研究选择雷利度胺与地塞米松联合应用,观察对淋巴瘤细胞增殖和凋亡的影响,旨在为临床二者的联合应用提供理论基础。
本研究结果发现,雷利度胺和地塞米松联合处理组Jurkat细胞增殖受抑率显著高于单用雷利度胺组(P<0.05)和单用地塞米松处理组(P<0.05)。在凋亡诱导方面,流式细胞术检测分析显示,200 mg/L雷利度胺与250 mg/L地塞米松联合作用48 h细胞凋亡率显著高于单用雷利度胺组和单用地塞米松组,经统计学分析,差异均有显著性(P<0.05)。为了解雷利度和地塞米松联合应用在促进凋亡方面是否有协同作用,通过金正均法计算出q=1.21,提示雷利度胺与地塞米松联合应用具有协同作用。
综上所述,雷利度胺具有抗T细胞淋巴瘤作用,其作用机制可能与其抗淋巴瘤细胞增殖和诱导凋亡有关,雷利度胺和地塞米松联合具有协同作用。本研究为临床雷利度胺和地塞米松联合应用于T细胞淋巴瘤治疗提供了一定理论基础。
[1]Jema1 A,Siege1 R,Ward E,et a1.Cancer statistics 2006[J]. Ca A Cancer Journa1 for C1inicians,2006,56(2):23-47.
[2]Kossakowska AE,Edwards DR,Prusinkiewicz C,et a1.Inter1eukin-6 regu1ation of matrix meta11oproteinase(MMP-2 and MMP-9)and tissue inhibitor of meta11oproteinase(TIMP-1)expression in ma1ignantnon-Hodgkin's 1ymphomas[J].B1ood,1999,94(6):2080-2089.
[3]Van Besien K.Current status of a11ogeneic transp1antation for aggressivenon-Hodgkin 1ymphoma[J].Curr Opin Onco1,2011,23(6):681-691.
[4]Kritharis A,Coy1e M,Sharma J,et a1.Lena1idomide in non-Hodgkin 1ymphoma:bio1ogica1 perspectives and therapeutic opportunities[J].B1ood,2015,125(16):2471-2476.
[5]Weber DM,Chen C,Niesvizky R,et a1.Mu1tip1e Mye1oma(009)Study Investigators Lena1idomide p1us dexamethasone for re1apsed mu1tip1e mye1oma in North America[J]. N Eng1 J Med,2007,357(21):2133-2142.
[6]Davies F,Baz R.Lena1idomide mode of action:1inking bench and c1inica1 findings[J].B1ood Rev,2010,24(Supp1 1):S13-19.
[7]List A,Kurtin S,Roe DJ,et a1.Efficacy of 1ena1idomide in mye1odysp1astic syndromes[J].N Eng1 J Med,2005,352(6):549-557.
[8]Dawar R,Hernandez-I1iza1iturri F.The emerging ro1e of 1ena1idomide in the management of mant1e ce11 1ymphoma(MCL)[J].Best Pract Res C1in Haemato1,2012,25(2):185-190.
[9]Kritharis A,Coy1e M,Sharma J,et a1.Lena1idomide in non-Hodgkin 1ymphoma:bio1ogica1 perspectives and therapeutic opportunities[J].B1ood,2015,125(16):2471-2476.
[10]Mitsiades N,Mitsiades CS,Pou1aki V,et a1.Apoptotic signa1ing induced by immunomodu1atory tha1idomide ana1ogs in human mu1tip1e mye1oma ce11s:therapeutic imp1ications[J].B1ood,2002,99(12):4525-4530.
[11]Gupta D,Treon SP,Shima Y,et a1.Adherence of mu1tip1e mye1oma ce11s to bone marrow stroma1 ce11s upregu-1ates vascu1ar endothe1ia1 growth factor secretion:therapeutic app1ications[J].Leukemia,2001,15(12):1950-1961.
[12]Semeraro M,Vacche11i E,Eggermont A,et a1.Tria1 Watch:Lena1idomide-based immunochemotherapy[J].Oncoimmuno1ogy,2013,2(11):1091-1096.
[13]Vie1 S,Charrier E,Marc,ais A,et a1.Monitoring NK ce11 activity in patients with hemato1ogica1 ma1ignancies[J]. Oncoimmuno1ogy,2013,2(9):e26011.
[14]Teo SK.Properties of tha1idomide and its ana1ogues:imp1ications for anticancer therapy[J].AAPS J,2005,7(1):E14-19.
[15]Gupta D,Treon SP,Shima Y,et a1.Adherence of mu1tip1e mye1oma ce11s to bone marrow stroma1 ce11s upregu-1ates vascu1ar endothe1ia1 growth factor secretion:therapeutic app1ications[J].Leukemia,2001,15(12):1950-1961.
[16]Verhe11e D,Corra1 LG,Wong K,et a1.Lena1idomide and CC-4047 inhibit the pro1iferation of ma1ignant B ce11s whi1e expanding norma1 CD34+progenitor ce11s[J].Cancer Res,2007,67(2):746-755.
[17]Kot1a V,Goe1 S,Nischa1 S,et a1.Mechanism of action of 1ena1idomide in hemato1ogica1 ma1ignancies[J].J Hemato1 Onco1,2008,2(1):1-10.
[18]Cavo M,Tacchetti P,Patriarca F,et a1.Bortezomib with tha1idomide p1us dexamethasone compared with tha1idomide p1us dexamethasone as induction therapy before,and conso1idation therapy after,doub1e auto1ogous stemce11 transp1antation in new1y diagnosed mu1tip1e mye1oma:a randomised phase 3 study[J].Lancet,2010,376(9758):2075-2085.
Combination effects of Lenalidomide and Dexamethasone on inhibition of T lymPhoma cells
LI Hongling1CHEN Tong1LI Mingyu1ZHANG Xuxia1QI Famei2WANG Fang2
1.Department of Onco1ogy,Peop1e's Hospita1 of Gansu Province,Lanzhou730000,China;2.Department of C1inica1 Laboratory,Peop1e's Hospita1 of Gansu Province,Lanzhou730000,China
Objective To study the effect of combination of Lena1idomide and Dexamethasone(DEX)on the T 1ymphoma ce11s growth and apoptosis.Methods After the pre1iminary experiment,Lena1idomide(40,80,120,160,200,400,600 mg/L)and Dexamethasone(50,100,150,200,250 mg/L),and the combination of these two drugs were used to treat Jurkat 1ymphoma ce11s for 24,48 or 72 hours.MTT was used to eva1uate the cytotoxic effects.F1ow cytometry was used to detect ce11 cyc1e.Ce11u1ar morpho1ogic changes of apoptotic ce11 nuc1eus were observed using the Hoechst 33258 staining.The percentage of apoptosis ce11s was detected by f1ow cytometry using Annexin V-FITC/PI Apoptosis assay.Results Both Lena1idomide and Dexamethasone cou1d inhibit the ce11s pro1iferation and induce the apoptosis of Jurkat ce11s in a dose and time dependent manner.There was a significant increase of the ce11 inhibitory rate after exposure to combination of Lena1idomide and Dexamethasone compared to Lena1idomide a1one(P<0.05)or Dexamethasone a1one(P<0.05).Conclusion Combination of Lena1idomide and Dexamethasone has synergistic activity in inhibition of T 1ymphoma ce11s.This study,therefore,provides the framework for c1inica1 eva1uation of Lena1idomide combined with Dexamethasone to improve patients'outcome in T 1ymphoma.
Lena1idomide;Dexamethasone;T 1ymphoma ce11s;Pro1iferation;Apoptosis
R285
A
1673-7210(2016)07(c)-0008-05
2016-04-24本文编辑:程铭)
国家自然科学基金资助项目(30960438;81260 342);甘肃省兰州市科技发展计划项目(2009-1-56)。
李红玲(1969.12-),女,甘肃兰州人,博士,硕士生导师,主任医师,主要从事恶性肿瘤药物治疗研究工作。
