红花籽粕降糖有效部位的纯化工艺
2016-11-22萨拉麦提艾迪热斯武鹤婷阿不拉江图拉克信学雷阿吉艾克拜尔艾萨
萨拉麦提·艾迪热斯 武鹤婷 阿不拉江·图拉克 田 华 信学雷 阿吉艾克拜尔·艾萨
1.中国科学院新疆理化技术研究所中国科学院干旱区植物资源化学重点实验室,新疆乌鲁木齐830011;
2.省部共建新疆特有药用资源利用国家重点实验室培育基地,新疆乌鲁木齐830011;3.中国科学院大学,北京100049
红花籽粕降糖有效部位的纯化工艺
萨拉麦提·艾迪热斯1,2,3武鹤婷1,2,3阿不拉江·图拉克1,2,3田 华1,2,3信学雷1,2阿吉艾克拜尔·艾萨1,2
1.中国科学院新疆理化技术研究所中国科学院干旱区植物资源化学重点实验室,新疆乌鲁木齐830011;
2.省部共建新疆特有药用资源利用国家重点实验室培育基地,新疆乌鲁木齐830011;3.中国科学院大学,北京100049
目的研究以大孔吸附树脂纯化的方法制备红花籽粕降糖有效部位的最佳工艺。方法以静态吸附法考查11种大孔树脂对有效部位的吸附和解吸附性能,以纯化后有效部位产率和酶活性数据进行综合评分,选出纯化效果最佳的树脂进行下一步动态筛选研究,并确定最佳纯化工艺。结果经过静态吸附-解吸附实验筛选出AB-8型大孔树脂为最佳纯化树脂;动态筛选结果得出最佳纯化工艺为:上样药液质量浓度为75 mg/mL;上样量为6 BV;吸附速率为3 BV/h。洗脱前先用水洗至还原糖阴性反应,再分别用10%、70%、95%乙醇以3 BV/h的速度洗脱,收集10%乙醇洗脱液6 BV和95%乙醇洗脱液5 BV,合并洗脱液,干燥后即获得有效部位。结论经AB-8型大孔树脂纯化处理后的红花籽粕有效部位降糖活性明显提高。此方法简便易行、成本低,可以用于工业化生产红花籽粕降糖有效部位。
红花籽粕;大孔树脂;纯化;降糖作用
红花籽,中药称“白平子”,是红花(Carthamus tinctorius L.)的种子。红花籽粕(Saff1ower mea1)是红花籽提取红花籽油后的副产品[1-2]。目前,红花在国外主要分布在印度、美国、加拿大、欧洲等30多个国家[3]。我国红花主要分布于新疆、河南、四川、河北、浙江等省[4-5],主要用作中药和油料作物,红花籽榨油后的籽粕部分无毒、无异味,含18种氨基酸,是一种较优质的蛋白质来源,并在很多国家和地区多作为牲畜的饲料或有机肥料[6-9]。红花籽粕中也含有许多天然抗氧化物质,目前对红花籽粕的研究大部分是针对其中的5-羟色胺及其衍生物,包括富集、分离、纯化、抗氧化性和清除自由基、调节机体内的免疫反应、抑制肿瘤和消炎抑菌、保护机体中的NK细胞免受程序性死亡及强烈抑制黑色素生成等生物活性的研究[10-14]。前期工作中已获得了红花籽粕的提取物,发现了它具有蛋白酪氨酸磷酸酶(PTP-1B)抑制能力[15]。本研究通过对比11种不同类型的大孔树脂的静态吸附-解吸附能力、产率,对PTP-1B和α-葡萄糖苷酶的抑制活性,筛选出最佳的树脂,并以提取物对PTP-1B和α-葡萄糖苷酶的抑制活性以及产率为指导,对其进行优化,确定最佳纯化工艺,为工业化生产提供了方法。
1 仪器与材料
1.1 仪器
旋蒸发仪(Buchi R-210型,瑞士产);电热恒温鼓风干燥箱(上海齐欣科学仪器有限公司,DHG-9070A型);全温震荡培养箱(上海市实验仪器总厂,HZQF160型);M-5酶标仪(美国分子仪器公司);
1.2 大孔树脂类型
HPD100、HPD300、HPD450、HPD500、HPD600、HPD 750、AB-8、X-5、D101、NKA-9、ADS-17型大孔树脂(沧州宝恩化工有限公司)。
1.3 试药
实验材料购自新疆塔城,由中国科学院新疆生态与地理研究所标本馆冯缨研究员鉴定为红花种子。
对硝基苯磷酸二钠盐(pNPP)、矾酸钠,α-葡萄糖苷酶、阿卡波糖、4-硝基酚-α-D-吡喃葡萄糖苷(PNPG)和二甲基亚砜(DMSO)均为由美国Sigma公司提供,石油醚和乙醇(食用乙醇)由天津市百世化工有限公司提供,水为纯化水。
2 方法与结果
2.1 红花籽粕提取液的制备
称取榨油后,粉碎的红花籽粕4.2 kg,按1∶8的固液比,进行石油醚渗漉、脱脂,脱脂后的药材粉末晾干后,在80℃的条件下用70%乙醇加热回流提取3次,每次1 h,过滤,合并滤液,减压浓缩至无醇味,且浓缩药液相对密度为1.06 g/mL,放入4℃冰箱保存。
2.2 大孔树脂的筛选
2.2.1 树脂处理根据文献[16-17]的方法,将11种大孔树脂用95%乙醇浸泡2~4 h,排出乙醇后,反复用蒸馏水冲洗至树脂在试管中加入3倍量水不显浑浊为止,然后用超净水充分淋洗至无乙醇气味,抽滤。分别称取11种已处理好的大孔树脂2 g放入锥形瓶中,加入稀释的红花籽粕提取液(样品浓度P0为29.2286 mg/mL)30 mL。摇床振摇(180 r/min,25℃)2 h。过滤,滤出液烘干至恒重,计算流出液浓度Pe。过滤后的大孔树脂水洗抽干,加95%乙醇30 mL,置摇床(180 r/min,25℃)振摇2 h,静置2 h进行静态解吸附。解吸附液过滤烘干至恒重,计算解析液浓度Pd。
V0为上样体积,M为树脂重量。分别按下式计算吸附量、吸附率、解吸率:
吸附量(mg/g,湿树脂)=(P0-Pe)×V0/M,
吸附率(%)=(P0-Pe)×100/P0,
解吸率(%)=Pd×100/(P0-Pe)。
2.2.2 PTP-1B抑制活力检测对解吸附后的样品进行活性测定。按照文献[18]的方法以对-硝基苯基磷酸二钠(pNPP)作为底物,根据PTP-1B水解pNPP的磷酸基团而产生颜色反应来测定PTP-1B的活性。PBS缓冲液178 μL,在96孔板中加入PTP-1B蛋白溶液1 μL(0.115 mg/mL),不同浓度的样品或阳性对照样品1 μL或DMSO 1 μL,混匀,10 min后加入35 mmo1/L的pNPP 20 μL,25℃避光孵育20 min后,每孔加10 μL 3 mo1/L NaOH终止反应。以不含酶溶液的系统为空白,利用SpectraMax MD5酶标仪(美国Mo1ecu1ar Devices)测定405 nm处的OD值。
抑制率=(OD405空白-OD405样品)/OD405空白×100%。
2.2.3 α-葡萄糖苷酶的抑制活力检测将文献[19]的方法进行改进测定解吸附的样品对α-葡萄糖苷酶的抑制作用。α-葡萄糖苷酶筛选方法:0.1 mo1/L磷酸缓冲液(0.1 mo1/L K2HPO4,0.1 mo1/L KH2PO4,H2O)68.5 μL,在96孔板中加入α-葡萄糖苷酶溶液1.5 μL,测试样品或阳性对照样品5 μL(将样品配成浓度梯度)或DMSO 5 μL,混匀后室温反应10 min,再加入20 mmo1/L底物4-硝基酚-α-D-吡喃葡萄糖苷(PNPG)25 μL,37℃恒温反应20 min后终止反应。以不含酶溶液的系统为空白,利用SpectraMax MD5酶标仪(美国Mo1ecu1ar Devices)测定405 nm处的吸收值。
抑制率=(OD405空白-OD405样品)/OD405空白× 100%。
2.2.4 检测结果通过分析11种大孔树脂对红花籽粕样品吸附、解吸能力及样品对PTP1B酶和α-葡萄糖苷酶抑制能力,由表1可以看出,HPD500、HPD600、HPD750、AB-8、X-5、NKA-9-17、D101型号树脂对红花籽粕提取液有较强的吸附效果,AB-8、X-5和D101解吸效果比较好。由于纯化的目的是选出吸附和解吸效果优异,并且活性较高的有效部位,因此加入了活性因素综合评分后(吸附率25%、解吸率25%、PTP1B抑制率25%、α-葡萄糖苷酶抑制率25%),AB-8得分最高,因此选择AB-8为纯化红花籽粕有效部位的最优大孔吸附树脂。见表1。

表1 11种大孔树脂静态吸附-解吸附情况
2.3 上样药液纯化条件的研究
根据大孔树脂筛选结果,分别对提取药液上样浓度、吸附速率、上样量、洗脱剂浓度和洗脱剂用量进行考察。
2.3.1 上样药液浓度的考察取红花籽粕提取液(浓缩药液相对密度为1.06 g/mL),将其稀释成100 mg/mL(浓缩药液相对密度为1.04 g/mL)、75 mg/mL(浓缩药液相对密度为1.02 g/mL)、50 mg/mL(浓缩药液相对密度为1.01 g/mL)、25 mg/mL(浓缩药液相对密度为1.00 g/mL)的溶液,分别吸取15 mL吸附到AB-8大孔树脂柱上,以2 BV/h的速度进行放流,收集流出液,计算其吸附量。再以5 BV/h的流速使用蒸馏水洗至还原糖阴性反应,再用95%乙醇洗脱5 BV,收集流出液,结合其吸附率和解析率进行综合评分的计算(综合评分=吸附率×50%+纯化组分百分比×50%)。药物浓度越高其吸附量越高,上样液浓度为100 mg/mL时有较强的吸附效果,但上样液浓度为75 mg/mL时,其解吸效果为最好。因此,通过对4种上样液浓度进行综合评分后,选择75 mg/mL上样浓度为最佳上样浓度(密度相当于1.02 g/mL)。见表2。
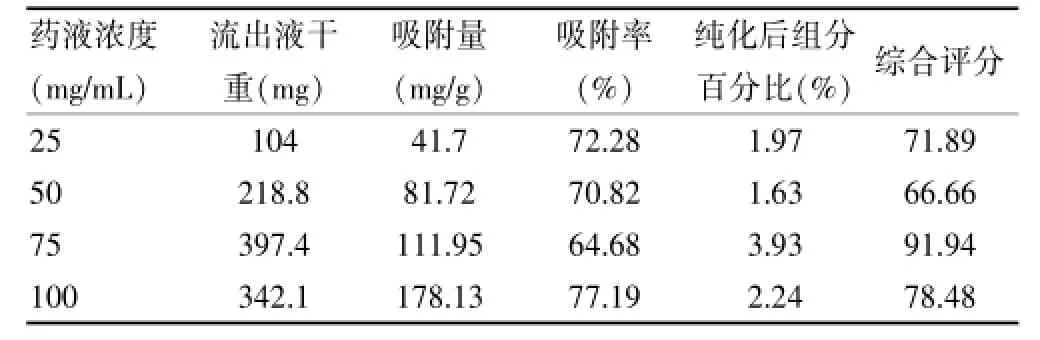
表2 上样液浓度对吸附率和解析率的影响
2.3.2 吸附速率的确定取红花籽粕提取液(最佳上样液浓度为75 mg/mL,相对密度为1.02 g/mL)30 mL,吸附在15 mL AB-8大孔树脂柱上,分别以1、2、3、4、5、6 BV/h的流速进行吸附,收集流出液,计算吸附量。再以5 BV/h的流速使用蒸馏水洗至还原糖阴性反应,再用95%乙醇洗脱5 BV,收集流出液,结合其吸附量和解析液干重进行综合评分的计算(综合评分=吸附量×50%+解吸量×50%)。当药液吸附速度增加时,流出液吸附量和解吸液先增后减,当吸附速度达到3 BV/h时,药液吸附量和解吸液干重达到最大,对6种吸附速度进行的综合评分结果表明3 BV/h吸附速率为最佳药液吸附速率。见表3。

表3 吸附速率对吸附率的影响
2.3.3 提取药液上样体积的确定分别取1~8 BV的红花籽粕提取物(浓缩药液相对密度为1.02 g/mL),上15 mL树脂柱,以3 BV/h速度进行吸附后收集流出液,计算吸附量。再以5 BV/h的流速使用蒸馏水洗至还原糖反应呈阴性结果,再用95%乙醇洗脱5 BV,收集流出液,计算其吸附量、样品上样量与树脂饱和度之间的关系。上样量到6 BV时,样品穿透速度趋于平缓,并流出液与上样浓度几乎相等,树脂处于饱和状态。因此得出结论,6 BV为最佳上样体积。见图1。
2.3.4 洗脱剂浓度的确定取红花籽粕提取液(浓缩药液相对密度为1.02 g/mL)90 mL,加入15 mL树脂柱上,以3 BV/h速度进行吸附,在以5 BV/h的流速用水洗至还原糖反应呈阴性结果,再分别以10%、30%、50%、70%、95%等不同浓度的乙醇溶液洗脱,洗脱液用量为50 mL,收集洗脱液测定PTP1B和α-葡萄糖苷酶半数抑制浓度IC50,计算纯化组分产量与活性抑制率并进行综合评分(综合评分=纯化组分产量×30%+ PTP1B抑制活性×35%+α-葡萄糖苷酶抑制活性× 35%),选择最佳洗脱浓度。吸附在树脂上的样品在使用不同的洗脱剂洗脱下来的成分不同,其活性也有明显的差异。随乙醇浓度的升高,洗脱下组分的重量减少,而且只有10%和95%乙醇洗脱部分有较好的PTP1B和α-葡萄糖苷酶抑制活性。通过对纯化组分产,量与活性进行综合评分,选用10%和95%乙醇作为最佳乙醇洗脱浓度。见表4。
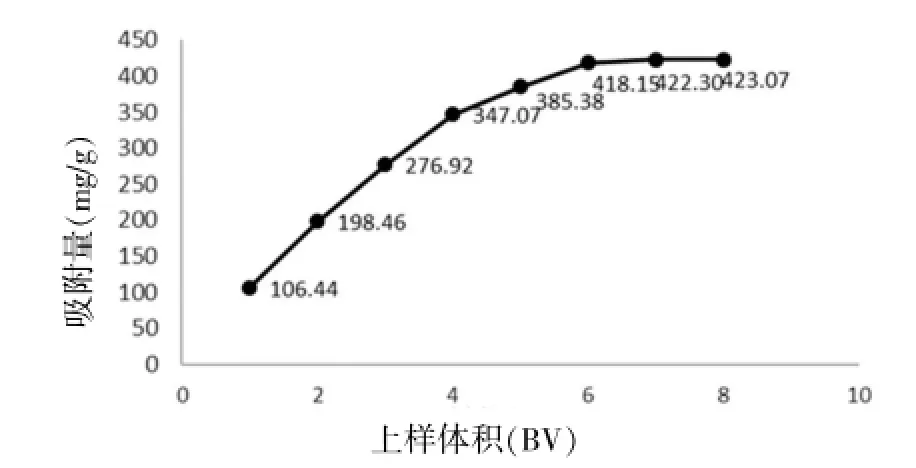
图1 样品穿透曲线
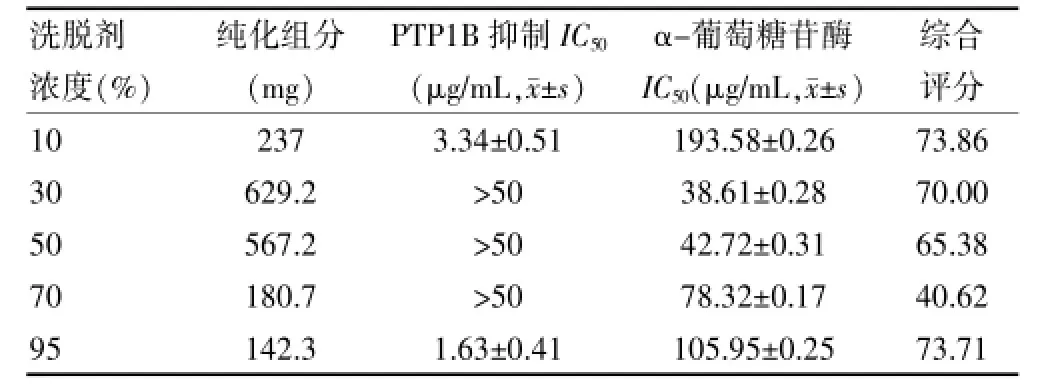
表4 不同浓度乙醇洗脱组分PTP1B和α-葡萄糖苷酶抑制IC50
2.3.5 洗脱剂用量的考察将吸附饱和的树脂先用水洗至还原糖反应检测结果呈阴性,再以10%、70%、95%乙醇溶液,以3 BV/h的速率分别洗脱6、4、5 BV,收集流出液测定PTP1B半数抑制浓度IC50,再次确定具有降糖活性的红花籽粕有效部位。首先10%乙醇6 BV体积洗脱,并收集液都具有PTP1B抑制活性,所得到的纯化组分为224.8 mg。中间部分用70%乙醇4 BV体积洗脱并未检测到PTP1B活性。最后部分全部以95%乙醇5 BV体积洗脱,得到的纯化组分为250.6 mg,95%洗脱剂在5 BV体积下大孔树脂上吸附的样品基本被洗脱干净并检测到PTP1B活性。因此对工业生产来说,为了高效又节约成本,选择洗脱剂的用量为10%乙醇6 BV,95%乙醇5 BV。见表5。
2.4 验证试验
称取红花籽粕3份,每份为500 g,在80℃的条件下使用70%酒精加热回流提取3次,每次1 h,过滤,合并滤液,减压浓缩至无醇味。分别取红花籽粕提取物(浓缩药液相对密度为1.02 g/mL),上AB-8树脂柱,以3 BV/h速度进行吸附后,再以5 BV/h的流速使用蒸馏水洗至还原糖反应呈阴性,再分别用10%、70%、95%乙醇洗脱,洗脱体积液用量为5 BV,收集10%和95%部位的流出液,减压浓缩至无醇味后烘干,计算其粗提物得率(%)和PTP-1B抑制率。
粗提物得率(%)=粗提物量/原料量×100%。
验证实验结果与提取工艺结果相近,可以判断出本提取工艺实验得到的结果较为稳定,可以用于工业大量生产红花籽粕降糖有效部位。见表6。

表5 洗脱剂用量的影响

表6 验证实验
3 讨论
大孔吸附树脂是高吸附性和高选择性兼具的多孔高分子材料,其吸附能力是范德华力和氢键共同作用的结果,有吸附容量大、选择性好、吸附速度快、易于构成闭路循环和成本低等诸多优点[20-21]。本实验中,通过静态吸附-解吸附法筛选了11种不同类型的树脂的吸附-解吸附能力,并结合活性筛选结果确定弱极性的AB-8型树脂为最佳吸附剂。通过动态吸附法研究AB-8的纯化条件时,10%、95%乙醇洗脱组分的活性较好。总体来说,红花籽粕中降糖有效组分可能主要为中小极性成分和大极性成分。本实验利用糖尿病相关因子蛋白酪氨酸磷酸酶1B(PTP-1B)和α-葡萄糖苷酶抑制活性筛选结果作为工艺筛选指标,其方法可靠,对药品纯化工艺研究有一定的参考意义。
[1]沈飞,夏明.红花籽粕的综合利用[J].农林科技,2010,16:171.
[2]赵丽,王佳,李君,等.红花籽水解蛋白的精制[J].食品与发酵工业,2016,42(1):97-101.
[3]Knee1and JA.The Status of Saff1ower[J].Journa1 of the American Oi1 Chemists Society,1966,43(6):403-405.
[4]易善勇,官丽莉,杨晶,等.红花药理作用及其开发与应用研究进展[J].北方园艺,2015,5:191-195.
[5]李保山,毛晓英,陈计峦,等.响应面法优化红花籽粕蛋白质提取工艺[J].油量加工,2014,4:44-52.
[6]Koh1er GO,Kuzmicky DD,Pa1ter R,et a1.Saff1ower Mea1[J]. Journa1 of the American Oi1 Chemists Society,1966,43(6):413-415.
[7]孙立,毛晓英,陈计峦,等.红花籽抗氧化肽的分离纯化及抗氧化活性研究[J].农产品加工(学刊),2014,2:5-7.
[8]Lyon CK,Gumbmann MR,Betschart AA,et a1.Remova1 of De1eterious G1ucosides from Saff1ower Mea1[J].Journa1 of the American Oi1 Chemists Society,1976,56(5):560-564.
[9]Ranamata11a AB,Babiker EE,Krishna AG,et a1.Changes in chemica1 composition,minera1s and aminoacids during seed growth and deve1opment of four saff1ower cu1tivars[J]. P1ant Foods for Human Nutrition,1998,52:161-170.
[10]王吉成,张弓,吉守祥,等.水回流法提取河湟红花籽粕中5-羟色胺衍生物的工艺研究[J].安徽农业科学,2012,40(9):5179-5180.
[11]孙立,毛晓英,陈计峦,等.碱性蛋白酶酶解红花籽蛋白制备抗氧化肽工艺的研究[J].中国油脂,2014,39(9):31-35.
[12]Buket A,Onur G,Emin Y.Physico-chemica1,Sensory and AromaticPropertiesofCo1dPressProducedSaff1owerOi1[J]. Journa1 of the American Oi1 Chemists Society,2014,91:99-110.
[13]刘进怀,张晴,薛彬,等.HPLC测定降糖明目颗粒中羟基红花黄色素A的含量[J].中国实验方剂学杂志,2010,16(11):48-49.
[14]赵梦中,靖彩霞,闫婧,等.HPLC法测定蒙药希合日希精阿日乐嘎其(降糖1号)中羟基红花黄色素A的含量[J].中国实验方剂学杂志,2013,19(8):63-64.
[15]信学雷,萨拉麦提·艾迪热斯,艾级买力汗·艾比布拉,等.红花籽粕降糖有效部位的制备方法及其用途[P].中国专利:CN201510077369.7,2015-06-17.
[16]热依木古丽·阿布都拉,刘力,仲婕,等.石榴花中多酚物质的纯化工艺研究[J].中国中药杂志,2009,34(17):2265-2267.
[17]刘承萍,高峰,曹骋,等.DM130型大孔树脂分离纯化野菊花总黄酮的工艺研究[J].广东药学院学报,2011,27(1):44-47.
[18]张尧,信学雷,阿吉艾克拜尔·艾萨.维药毛菊苣降糖有效部位的纯化工艺[J].中成药,2012,34(12):2322-2325.
[19]张燕,李琳琳,木合布力·阿布力孜,等.新疆昆仑雪菊5种提取物对α-葡萄糖苷酶活性的影响[J].中国实验方剂学杂志,2011,17(7):166-169.
[20]张旭,王锦玉,仝燕,等.大孔树脂技术在中药提取纯化中的应用及展望[J].中国实验方剂学杂志,2012,18(6):286-290.
[21]彭青,李晓刚,刘亚明.大孔吸附树脂研究进展[J].实用中医药杂志,2013,29(5):409-412.
[22]高瑛,赵淑慧.骨愈搽剂中总黄酮及其单体成分的体外透皮行为研究[J].中国药房,2015,26(31):4345-4347.
[23]李季.我院中药注射剂所用溶剂与适应证的合理性分析[J].中国药房,2015,26(23):3204-3205.
[24]于夏,王培卿.十一味抗异散鉴别和含量测定方法研究[J].中国医药导报,2013,10(31):115-117.
Purification of antidiabtic comPositions from safflower meal by macroP-orous resin
EDIRS Salamet1,2,3WU Heting1,2,3TURAK Ablajan1,2,3TIAN Hua1,2,3XIN Xuelei1,2AISA Haji Akber1,2
1.The Key Laboratory of P1ant Resources and Chemistry of Arid Zone Xinjiang Technica1 Institute of Physics and Chemistry,Chinese Academy of Sciences,Xinjiang Uygur Autonomous Region,Urumqi830011,China;2.State Key Laboratory Basis of Xinjiang Indigenous Medicina1 P1ants Resource Uti1ization,Xinjiang Technica1 Institute of Physics and Chemistry,Chinese Academy of Sciences,Xinjiang Uygur Autonomous Region,Urumqi830011,China;3.University of the Chinese Academy of Sciences,Beijing100049,China
Objective To exp1ore the best way on purification hypog1ycemic effective parts from saff1ower seed mea1 by using macroporous adsorption resin.Methods 11 kinds of macroporous resin were screened by comparing the abi1ity of adsorption and desorption performance for effective parts,the production and the inhibition on protein-tyrosine phosphatase-1B and a1pha g1ycosidase,which are two key enzymes in diabetic drug screening,were combined to choose the most suitab1e macroporous resin for purifying the antidiabetic fraction;then the best one was subjected to dynamic absorption screening to optimize the best purification process.Results AB-8 macroporous resin was the best purification resin,and the optimization process was:concentration of samp1e was 75 mg/mL,samp1e vo1ume on adsorption was 6 BV,f1ow rate on adsorption was 3 BV/h,e1ution by water to reduce the sugar negative reaction,f1ow rate of adsorption and e1ution was 3 BV/h for 4 BV,then e1ution so1vent was 10%,70%,95%ethano1,and 6 BV 10%and 5 BV 95%ethano1 part were co11ected.Conclusion Compared with the extraction before purification,purified parts significant1y inhibit PTP-1B and a1pha g1ycosidase.This method is simp1e and 1ow cost,it can be used for producing antidaibetic parts from saff1ower seed mea1 in industry.
Saff1ower mea1;Macroporous resin;Purification;Anti-diabetic
R93
A
1673-7210(2016)07(c)-0016-05
2016-04-08本文编辑:赵鲁枫)
国家自然科学基金新疆联合基金项目国家联合基金项目(U1203203);国家科技支撑计划项目(2011 BAI05 B05)。
萨拉麦提·艾迪热斯(1988-),女,中国科学院新疆理化技术研究所2014级有机化学专业在读博士研究生;研究方向:有机化学。
阿吉艾克拜尔·艾萨(1965-),男,硕士,主要从事民族药学研究。信学雷(1971-),女,硕士,主要从事民族药生物活性筛选与作用机制研究。
