新疆伊犁哈萨克自治州蜱及牛羊蜱传病分子流行病学调查
2016-11-22陈秋语陈荣贵王海军段维春崔建国包拉提乌木尔别克刘小翠郝嘉玮刘光远
陈秋语,罗 金,陈 泽,陈荣贵,王海军,段维春,崔建国,包拉提·乌木尔别克,李 凯,刘小翠,郝嘉玮,刘光远
(1. 中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室 甘肃省动物寄生虫病重点实验室,兰州 730046;2. 伊犁州动物疾病控制与诊断中心,伊犁 835000;3. 新源县畜牧兽医站,新源 835800;4. 巩留县畜牧兽医站,巩留 835400;5. 察布查尔锡伯自治县畜牧兽医站,察布查尔锡伯 835300;6. 昭苏畜牧兽医站,昭苏 835600)
新疆伊犁哈萨克自治州蜱及牛羊蜱传病分子流行病学调查
陈秋语1,罗金1,陈泽1,陈荣贵2,王海军3,段维春4,崔建国5,包拉提·乌木尔别克6,李凯1,刘小翠1,郝嘉玮1,刘光远1
(1. 中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室 甘肃省动物寄生虫病重点实验室,兰州 730046;2. 伊犁州动物疾病控制与诊断中心,伊犁 835000;3. 新源县畜牧兽医站,新源 835800;4. 巩留县畜牧兽医站,巩留 835400;5. 察布查尔锡伯自治县畜牧兽医站,察布查尔锡伯 835300;6. 昭苏畜牧兽医站,昭苏 835600)
为调查新疆伊犁哈萨克自治州境内的蜱及家畜血液样品中潜在蜱传病原的流行情况,采集了新源县、察布查尔锡伯族自治县、巩留县和昭苏县的蜱(600只,150只/县)及血液样品(牛血1200份,150份/县/月;羊血1200份,150份/县/月)。根据形态学标准,共鉴定出边缘革蜱、刻点血蜱、残缘璃眼蜱、亚洲璃眼蜱及嗜群血蜱5个蜱种。运用PCR方法和序列分析,对采集的蜱、羊血和牛血样品进行检测,发现了泰勒虫、巴贝斯虫、牛无浆体、噬吞噬细胞无浆体、边缘无浆体、羊无浆体、螺旋体和立克次体等多种病原。结果表明,伊犁州人和动物蜱传病原在蜱及动物体内大量存在,特别是一些人兽共患病原体的阳性率较高,流行普遍,对人和动物的危害严重。
蜱;蜱传病原体;混合感染;流行病学;牛;羊
蜱属蜱螨亚纲、蜱亚目,是一类重要的体外寄生虫,以吸食脊椎动物的血液为生[1]。蜱在吸血过程中将大量的病原体传入人和动物体内,可引发严重的疾病和人畜共患病[2,3]。蜱是热带和亚热带地区重要的有害生物和多种病原体的传播媒介[4-6]。
蜱和蜱传病原体的分布规律随着地区和时间的变化而改变。迄今为止,已经有许多蜱传疾病在新疆地区被报道,例如梨形虫病、无浆体病、Q热、克里米亚-刚果出血热(新疆出血热)、蜱传脑炎(森林脑炎)、蜱传回归热和莱姆病等[7]。一个蜱种可以携带并传播多种病原体。某些情况下,在相同的自然疫源地可以检测到多个不同的蜱传疾病[8]。如果人和动物被携带多种病原的蜱所叮咬,很有可能引起致病性更加复杂、愈后更加严重的多发性疾病。由于当地社会经济发展和自然环境的改变,新出现的病原体及其协同感染具有的潜在威胁性会逐渐提高,从而影响人类的身体健康和畜牧业的发展。
新疆伊犁哈萨克自治州位于我国西北边境地区,不仅是一个畜牧业发达的地区,还是中国西北部地区的旅游胜地。其东部地区有大量的山脉和丘陵,西部地区为山间平原和河谷。相对较高的湿度和舒适的温度为蜱的发育、繁殖提供了理想的环境,而春季被认为是蜱生长、繁殖的最佳季节,同时也是蜱传疾病传播的高危时期。多年来,该地区虽有蜱传病流行的报道,但均为零星记录,对当地蜱和蜱传病未进行过全面整体的调查。为了更好地了解伊犁地区蜱及蜱传病原的分布规律,评估人(包括牧民、兽医从业者和游客)和动物的已有损失及潜在的危害,本研究选取代表性区域,在蜱和蜱传病主要流行季节对该地区动物群中的蜱类、潜在的病原以及协同感染等情况进行研究,进而评估该地区蜱传疾病可能带来的公共卫生风险。
1 材料和方法
1.1蜱的采集和鉴定采样地区位于北纬40°14′16′′至49°10′45′′,东经80°9′42′′到91°01′45′′之间,包括了新疆伊犁州4个县:新源县、昭苏县、巩留县和察布查尔锡伯族自治县(图1)。在2015年4月、5月期间共采集了600只(150只/县)饥饿成蜱。根据形态学标准,对采集的蜱进行鉴定分类[9]。
1.2血液样品的采集对上述4个县的放牧牛羊进行随机采血(牛1200份,150份/县/月;羊1200份,150份/县/月),保存于EDTA-K2抗凝管中。
1.3DNA的提取蜱样本在500 μL 75%的酒精中涡旋20 s,再置于500 μL的生理盐水中涡旋20 s,洗净后转移至干净的1.5 mL离心管中。将清洗后的样本置于液氮中大约20 s,用一次性组织研磨杵将其研磨成小块,加入180 μL的ATL缓冲液将其重悬。按照QIAamp®DNA Mini Kit(QIAGEN)说明书进行操作。
牛羊血液样品DNA按照DNeasy Blood & Tissue Kit(Qiagen, Hilden,Germany)操作说明进行提取。
1.4PCR扩增及DNA序列分析一步法PCR用于检测立克次氏体[10]、边缘无浆体[11]和羊无浆体[12],套式PCR用于检测巴贝斯虫[13]、泰勒虫[14]、牛无浆体[15]、噬吞噬细胞无浆体[15]和螺旋体[16]。针对不同病原体检测的目标基因、特异性引物和PCR方法详见表1。扩增体系均为50 μL,其中10×PCR buffer(Mg2+Plus)5μL,dNTP(2.5 mmol/L)4 μL,DNA高保真聚合酶(TaKaRa)4.5 μL,模板DNA 2 μL,上、下游引物各1 μL(10 μmol/mL),ddH2O 32.5 μL。将PCR产物送至上海生工生物工程股份有限公司测序。将测序得到的DNA序列进行匹配,并与NCBI数据库中的相关序列进行比较。

表1 标记基因、引物序列、PCR方法及参考文献Table 1 Target genes, primers sequence, PCR methods used for pathogens identifi cation
2 结果
2.1蜱的鉴定根据形态学特征,对采集到的600只蜱进行鉴定,共发现了5个蜱种,分别是边缘革蜱(Dermacentor marginatus,70.00%),刻点血蜱(Haemaphysalis punctata,19.33%)、残缘璃眼蜱(Hyalomma detritum,4.67%)、亚洲璃眼蜱(Hyalomma asiaticum,2.67%)及嗜群血蜱(Haemaphysalis concinna,2.00%)。蜱及宿主的详细信息见表2。

表2 蜱种、采集地区、宿主以及数量Table 2 Tick species, collection regions, host species and numbers
2.2蜱和血液样品中病原体的检测及鉴定通过PCR扩增,并对获得的序列进行测序分析后,发现泰勒虫(Theileria spp.)、巴贝斯虫(Babesia spp.)、螺旋体(Borrelia. spp.)、立克次体(Rickettsia spp.)、牛无浆体(A. bovis)、噬吞噬细胞无形体(A. phagocytophilum)、边缘无浆体(A. marginale)、羊无浆体(A. ovis)等多种病原,阳性率分别为30.67%、21.33%、12.67%、94.00%、10.67%、18.00%、12.67% 和8.00%。在蜱和血液样品检出的病原中,泰勒虫有5种,包括水牛泰勒虫(T. buffeli)、瑟氏泰勒虫(T. sergenti)、环形泰勒虫(T. annulata)、吕氏泰勒虫(T. luwenshuni)和羊泰勒虫(T. ovis);巴贝斯虫有3种,包括莫氏巴贝斯虫(B. motasi)、卵形巴贝斯虫(B. ovata)和羊巴贝斯虫(B. ovis);螺旋体有3种,包括B. afzelii、B. garinii和B. bissettii;立克次体有3种,分别为:R.rickettsii、R.slovaca和R.raoultii。统计分析可知,这些病原体在样品采集地普遍存在。在检测的病原体中,蜱体内的立克次氏体阳性率最高,达94.00%(表3);在血液样品中,无浆体和梨形虫病原阳性率较高,其中羊无浆体的检出率高达54.33%(表4)。
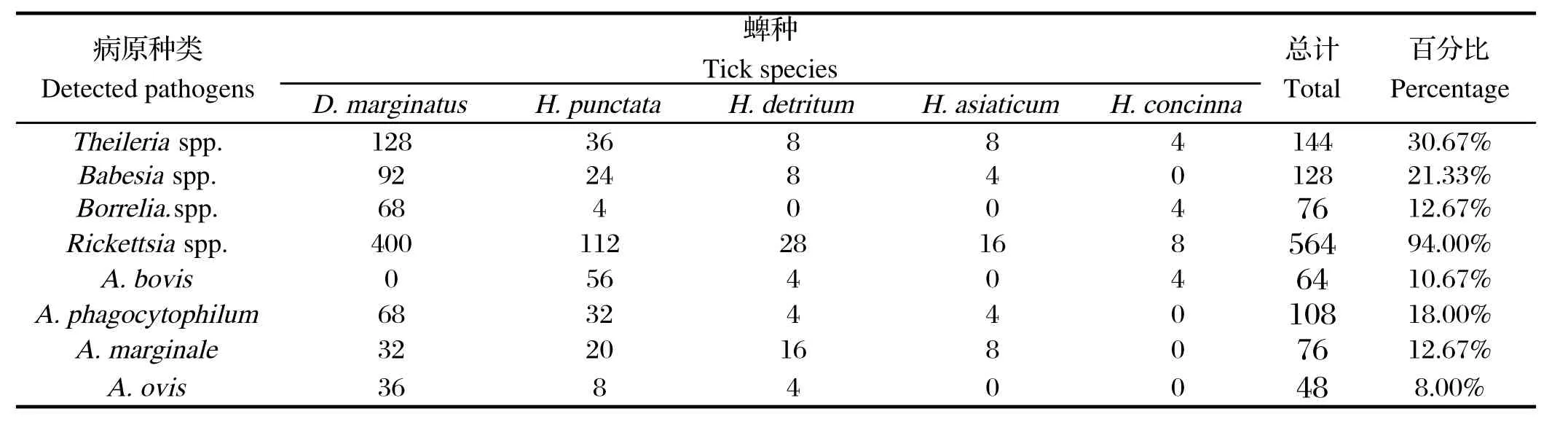
表3 蜱携带病原的检测Table 3 Detected pathogens in ticks

表4 血液样品中病原的检测Table 4 Detected pathogens in blood samples
2.3混合感染情况分析在所有检测的蜱虫中,2.00%蜱体内没有检测出任何病原体,28.67%的蜱体内只感染1种病原体,50.67%的蜱体内同时感染了2种病原体,15.33%的蜱体内同时感染了3种病原体,剩下的3.33%的蜱体内同时感染了4种病原体。通过对血液样品的检测发现,病原体协同感染的比例也较高,只有4.00%的血液样品没有感染任何病原体。在梨形虫阳性血液样品中,有9.33%羊和6.00%牛同时感染了泰勒虫和巴贝斯虫。38.67%羊和30.00%牛同时感染2种无浆体,18.00%羊和12.00%牛的血液样品中检出了3种无浆体,2.67%羊血液样品同时感染了4种无浆体。
3 讨论
研究结果显示,边缘革蜱作为伊犁州当地的优势蜱种,不具有明显的宿主特异性及宿主选择性 ,且革蜱作为各类病原体的储存宿主,是该地区疾病传播的重要来源。在巩留县的蜱虫样品中,仅采集到1只刻点血蜱,说明样品采集期并非其繁殖的最佳季节。然而,在这只刻点血蜱中仍然检测到有梨形虫感染(T. annulata),说明其仍可作为疾病的储存宿主和携带者。
本次检测的饥饿成蜱均在野外草原采集获得,可以保证提取的DNA包含蜱的整个基因组,并且没有宿主基因污染。检测结果表明,除了12只洁净蜱之外,其他蜱虫都至少感染了1种病原,说明蜱虫携带病原体极为普遍,给人和动物传播疫病的风险非常高。血液样品均采自放牧的牛羊体,在蜱中检测出的阳性病原体同时可在次月采集的家畜血液样品中发现,表明家畜感染的病原体很可能是通过蜱类媒介传播给放牧动物。
立克次氏体可以引发人畜共患病,如Q热和蜱传斑疹热,但由于缺乏典型的临床症状,这些疾病常常错过最佳的诊断时机,甚至造成误诊。本次检测结果显示,立克次体的感染率非常高,所携带的病原均为人兽共患病原体,对人畜健康带来极大的威胁。值得一提的是,在所有的血液样品检测中,仅在新源县则克台镇采集的羊血液样品中检出了1例立克次体阳性,且为本实验室第一次在血液样品中检测到立克次体。这一现象可能是由于这类病原体在感染动物后,只能在动物发病的菌血症阶段才能在其血液中检测到病原体,临床检测只能依赖于血清学检查,使用PCR方法在血液中检测到立克次体非常难得和不易。因此建议,在临床大面积调查这类疫病的流行状况时,使用成熟的血清学方法检测较为准确和客观。
莱姆病(Lyme disease)由莱姆病螺旋体(Borrelia burgdorferi sensu lato)所引起,全沟硬蜱是其病原的主要传播媒介。本次研究中没能采集到全沟硬蜱,但在边缘革蜱(D. marginatus)中检测到了B. afzelii、B. garinii和B. bissettii,说明伊犁州可能是莱姆病的自然疫源地,而边缘革蜱可能是莱姆病传播的潜在媒介。
动物及蜱虫体内的蜱传寄生虫病检测表明,该地区的蜱传寄生虫病流行普遍,病原种类较为多样,是危害该地区动物健康和阻碍畜牧业发展的主要因素。在羊的血液样品中,检测出大量的牛无浆体(A. bovis)阳性样品,经反复测序及检测分析确认,这些阳性样品携带的病原确为牛无浆体[17]。这一结果提示,动物无浆体并非传统意义上的“严格宿主专一性”,宿主选择范围较为宽泛,可能具有跨种传播的能力。
新疆伊犁州畜牧业发达,旅游观光为当地的主要支柱产业之一。在本次调查中无论在蜱体还是动物血液样品中均发现大量的蜱传性病原,甚至1只蜱虫携带多种病原,1个动物被几种病原感染的现象相当普遍,表明当地蜱与蜱传病的流行较为严重,家畜和从业人员饱受蜱传疾病肆虐的严峻考验,急需引起当地畜牧部门的高度重视。同时,本次调查中发现了一些重要的蜱传性人兽共患病病原,如:A. phagocytophilum、B. genomosp、B. afzelii、B. bissettii、R.slovaca和R. raoultii等,这些病原的发现不仅对畜牧从业人员及家畜带来极大的危害,而且对当地居民和游客的健康与公共卫生安全带来极大的隐患。蜱和蜱传病是危害当地畜牧业发展和公共卫生安全的头号危害之一,相关从业人员及卫生部门应高度重视蜱和蜱传病的防控工作,居民和游客应采取必要的保护措施,防止蜱类叮咬,控制蜱传病原体的传播,尽量将蜱与蜱传病的危害降到较低。
[1] Nava S, Guglielmone A A, Mangold A J. An overview of systematics and evolution of ticks[J]. Front Biosci, 2009, 14(8): 2857-2877.
[2] Blancou J, Chomel B B, Belotto A, et al. Emerging or re-emerging bacterial zoonoses: factors of emergence, surveillance and control[J]. Vet Res, 2005, 36(3): 507-522.
[3] Cunningham A A. A walk on the wild side—emerging wildlife diseases[J]. Br Med J, 2005, 331(7527): 1214-1215.
[4] Jongejan F, Uilenberg G. The global importance of ticks[J]. Parasitology, 2004, 129(S1): S3-S14.
[5] Hotez P J, Savioli L, Fenwick A. Neglected tropical diseases of the Middle East and North Africa: review of their prevalence, distribution, and opportunities for control[J]. PLoS Negl Trop Dis, 2012, 6(2): e1475.
[6] Jensenius M, Parola P, Raoult D. Threats to international travellers posed by tick-borne diseases[J]. Travel Med Infect Dis, 2006, 4(1): 4-13.
[7] Chen Z, Liu Q, Liu J Q, et al. Tick-borne pathogens and associated co-infections in ticks collected from domestic animals in central China[J]. Parasit Vectors, 2014, 7(1): 237.
[8] Labuda M, Nuttall P A. Tick-borne viruses[J]. Parasitology, 2004, 129 suppl: s221-s245.
[9] 陆宝麟, 吴厚永. 中国重要医学昆虫分类与鉴别[M]. 河南: 河南科学技术出版社, 2003, 1-67.
[10] Regnery R L, Spruill C L, Plikaytis B D. Genotypic identification of rickettsiae and estimation of intraspecies sequence divergence for portions of two rickettsial genes[J]. J Bacteriol, 1991, 173(5): 1576-1589.
[11] Torina A, Agnone A, Blanda V, et al. Development and validation of two PCR tests for the detection of and differentiation between Anaplasma ovis and Anaplasma marginale[J]. Ticks Tick Borne Dis, 2012, 3(5): 283-287.
[12] De la Fuente J, Atkinson M W, Naranjo V, et al. Sequence analysis of the msp4 gene of Anaplasma ovis strains [J]. Vet Microbiol, 2007, 119(2): 375-381.
[13] Da Silveira J A G, Rabelo É M L, Ribeiro M F B. Detection of Theileria and Babesia in brown brocket deer (Mazama gouazoubira) and marsh deer (Blastocerus dichotomus) in the State of Minas Gerais, Brazil[J]. Vet Parasitol, 2011, 177(1): 61-66.
[14] Zahler M, Rinder H, Schein E, et al. Detection of a new pathogenic Babesia microti-like species in dogs[J]. Vet Parasitol, 2000, 89(3): 241-248.
[15] Kawahara M, Rikihisa Y, Lin Q, et al. Novel genetic variants of Anaplasma phagocytophilum, Anaplasma bovis, Anaplasma centrale, and a novel Ehrlichia sp. in wild deer and ticks on two major islands in Japan[J]. Appl Environ Microbiol, 2006, 72(2): 1102-1109.
[16] Yang J, Liu Z, Guan G, et al. Evaluation of molecular methods for detection of Borrelia burgdorferi senso lato in ticks[J]. Diagn Microbiol Infect Dis, 2012, 73(1): 80-83.
[17] Liu Z, Ma M, Wang Z, et al. Molecular survey and genetic identification of Anaplasma species in goats from central and southern China[J]. Appl Environ Microbiol, 2012, 78(2): 464-470.
MOLECULAR EPIDEMIOLOGICAL INVESTIGATION OF TICKS AND TICKBORNE PATHOGENS IN DOMESTIC ANIMALS IN KAZAK AUTONOMOUS PREFECTURE OF ILI, XINJIANG, CHINA
CHEN Qiu-yu1, LUO Jin1, CHEN Ze1, CHEN Rong-gui2, WANG Hai-jun3, DUAN Wei-chun4, CUI Jian-guo5, Bolati Womuerbieke6, LI Kai1, LIU Xiao-cui1, HAO Jia-wei1, LIU Guang-yuan1
(1. Key Laboratory of Veterinary Parasitology of Gansu Province, State Key Laboratory of Veterinary Etiological Biology, Lanzhou Veterinary Research Institute, CAAS, Lanzhou 730046, China; 2. Ili Center of Animal Disease Control and Diagnosis, Ili 835000, China; 3. Xinyuan County Animal Husbandry and Veterinary Station, Xinyuan 835800, China; 4. Gongliu County Animal Husbandry and Veterinary Station, Gongliu 835400, China; 5. Qapqal Xibe Autonomous County Animal Husbandry and Veterinary Station, Qapqal Xibe 835300, China; 6. Zhaosu County Animal Husbandry and Veterinary Station, Zhaosu 835600, China)
Kazak Autonomous Prefecture of Ili, Xinjiang, a border region in Northwest China, famous for its animal husbandry and famed as a romantic holiday resort. For years, there were sporadic research about the tick-borne disease, but systematic epidemiological fi ndings have not report yet. In order to identify the ticks and detect the tick-borne pathogens in ticks and blood samples, samples were collected from steppe and animal body from 4 counties within Ili (Xinyuan County, Qapqal Xibe Autonomous County, Gongliu County and Zhaosu County). A total of 600 ticks were collected in smpling site (each county for 150 pieces), among which fi ve species of Ixodidae were found, including Dermacentor marginatus, Haemaphysalis punctata, Hyalomma detritum, Hyalomma asiaticum and Haemaphysalis concinna. There were also 150 sheep blood samples and 150 cattle blood samples in each sampling site(total of 1200 cattle blood samples, 150/county/month; 1200 sheep blood samples, 150/county/month). Polymerase chain reaction assay (PCR) and sequence analysis were employed to identify the potential pathogens. A total of eight genera pathogens were detected, including Theileria spp., Babesia spp., A. bovis, A. phagocytophilum, A. marginale, A. ovis, Borrelia spp. and Rickettsia spp. The detection results indicated that both human and animal pathogens were abundant in ticks and blood samples in the study areas. Some zoonosis pathogens were prevalent and had an extremely high infection rate. Humans and animals in these regions were at a high risk of exposure to these tick-borne diseases.
Ticks; tick-borne pathogens; co-infection; epidemiology; cattle; sheep
S852.746
A
1674-6422(2016)03-0072-06
2016-03-23
农业科技创新工程(ASTIP)
陈秋语,女,硕士研究生,预防兽医学专业
刘光远,E-mail:liuguangyuan@caas.cn
