ICP-MS及其联用技术在植物重金属分析中的应用研究进展①
2016-11-21邹晓娟尹晓明杨超光
邹晓娟,尹晓明*,李 荣,2,杨超光
(1 南京农业大学资源与环境科学学院,南京 210095;2 江苏省固体有机废弃物资源化利用高技术研究重点实验室,南京 210095)
ICP-MS及其联用技术在植物重金属分析中的应用研究进展①
邹晓娟1,尹晓明1*,李 荣1,2,杨超光1
(1 南京农业大学资源与环境科学学院,南京 210095;2 江苏省固体有机废弃物资源化利用高技术研究重点实验室,南京 210095)
电感耦合等离子体(inductively coupled plasma,ICP)是20世纪80年代发展起来的无机元素分析技术,它具有高分辨率和灵敏度、低检出限、样品耗用少、可同时检测多元素等特点,被广泛地用于无机元素特别是金属元素的分析。ICP与质谱(mass spectrometry, MS)联用极大地促进了无机多元素分析技术的发展。本文综述了ICP-MS及其几种联用技术的原理与性能特点、排除光谱干扰的方法以及在植物重金属分析中的应用实例32篇,以期为植物重金属分析技术的研究提供有益参考。
电感耦合等离子体质谱;联用技术;重金属;植物
随着我国工业化、城镇化的快速发展,工业污水和垃圾、汽车尾气等废弃物排放量不断增加,这些废弃物中含有的 Cd、Cr、Pb、Cu、As 等重金属,通过各种途径迁移、扩散进入土壤,导致土壤重金属元素不同程度的富集,成为土壤退化的重要表现形式[1]。城乡结合部作为城镇化过程的特殊区域,承担着广大城乡居民的食物供给。然而,有不少研究表明这些地区正面临土壤重金属污染的问题,例如南京城乡结合部土壤Cd、Cr和Cu等主要在工厂密集区积累,Pb和Hg可能主要来源于交通运输,Cd、As可能主要来自养殖业废物和生活污水的排放[2]。因此,土壤重金属污染问题已成为影响农产品产地环境和质量安全的突出问题。所以,不仅要对土壤重金属污染进行研究和防控,更为重要的是要对农产品的质量安全进行风险评估。因此,精准、高效的植物重金属含量的检测方法对于监督和加强食品安全具有重要意义。
ICP是一种有效的挥发-原子化-激发-电离器,这种新光源基体效应很小,它所具有的“环状结构”为分析物样品易于导入提供了方便条件[3]。ICP与MS的联用大大地促进了ICP技术的发展,ICP-MS已经成为无机特别是重金属元素及其形态分析的理想技术,是对生物及环境样品进行分析的重要手段。近年来,随着进样系统的多样化、接口性能的不断改进及检测系统的日趋多元化,ICP-MS技术在许多方面都有了飞速的发展。本文就ICP-MS及其几种联用技术的性能、不足之处及排除光谱干扰的方法进行综述,以期为今后深入研究植物重金属元素的分析技术提供参考。
1 电感耦合等离子体质谱(ICP-MS)
1.1 ICP-MS的应用
ICP-MS兴起于20世纪80年代,它是以独特的接口技术将ICP高温(7 000 K )电离特性与四极杆质谱灵敏快速扫描的优点相结合而形成的一种新型的元素分析技术。它主要由样品引入系统、离子源、接口、离子聚焦系统、质量分析系统和检测系统等部分组成。ICP-MS检测最大的优点是灵敏度高、选择性好、具有多元素和同位素的检测能力[3]。由于可以把突变体元素的变化与基因表达和功能联系起来,它又是研究功能基因组学的有力工具,同时由于其独一无二的灵敏度,可用于分析底物专一性和膜转运蛋白调节的特征[4]。把ICP-MS应用于植物重金属元素的分析报道也有不少。
1.2 ICP-MS光谱干扰的排除方法
ICP-MS的局限之处在于质谱干扰和非质谱干扰或称基体效应。常用的克服基体效应的方法主要有:①将样品稀释使基体元素浓度低于500 ~ 1 000 g/ml,以减轻基体干扰程度,但这样会影响检出限;②采用内标法补偿基体效应(比较有效的方法);③校准标准和样品基体相匹配;④采用标准加入法补偿基体效应[3]。
ICP-MS的干扰主要是光谱干扰即来自Ar等离子体的前体物质、样品基质、空气和水以及与分析物具有相同质量/电荷(m/z)的离子。克服光谱干扰的方法有数学校正法[5]、扇形磁场SF-ICP-MS(sector field SF-ICP-MS)[6]、冷等离子体法[7]、碰撞反应池(collision/reaction cell,CRC)[8]、动态反应池(dynamic reaction cell,DRC) 和碰撞-反应接头技术(collisionreaction interface,CRI)[9]。CRI 是把He或H2作为碰撞/反应气体,利用一到两个采样锥把He或H2泵入八级杆质谱的增压室[10],加速了气体与干扰离子的物理碰撞和反应,然后通过聚集透镜系统把干扰离子从等离子体清除[9]。对某些干扰离子可以通过冷ICP-QMS方法排除,冷等离子体方法就是让等离子体在低功率、高Ar气流速、深的采样深度条件下工作[11]。与常规方法相比,冷等离子体降低了Ar的离子化程度、从而降低了元素的检测限,比较适用于Fe、Ca和Cu的测定。一些不能用数学校正法排除干扰的多原子离子可以利用碰撞反应池CRC与冷等离子体方法结合来消除,以提高检测限,降低背景信号[12]。An等[13]通过样品外加3%(v/v)甲醇(10 μg/L As),结合CRC方法,提高了As检测灵敏度约2.5个点。
微波消解ICP-MS由于其分析的高通量性和多元素同时测定能力,近年来被广泛地用于生物样品的测定。然而该技术一个明显的局限是等量异位素或多原子干扰。例如饲料中Cd的两种常见同位素111Cd 和114Cd显著地受到95Mo16O+、94Mo16OH+、94Zr16OH+、98Mo16O+、96Mo18O+、98Ru16O+和97Mo16OH+等氧化物和氢化物的干扰[14],金属氧化物或氢化物干扰的消除可以利用动态反应池DRC方法,它的原理是在离子聚焦透镜与四级杆分析器之间外加一个四级杆以增强反应池气体(如CH4或O2)的压力,通过电荷转移、氧化和碰撞诱导解离,从而抑制干扰离子的形成[15]。Guo等[16]通过矫正DRC动态带通系数(RPq)以及调节O2流速的参数(RPq=0.75、O2=2.0 ml/min),同时用数学矫正法校正了114Sn 对114Cd的干扰,对饲料中糙麦、糙米中111Cd 、114Cd检出限分别达0.8、1.0 ng/g。如前所述,ICP-MS的光谱干扰主要来自等离子体中的Ar产生的各种多原子离子,如40Ar12C、40Ar16O、40Ar35Cl和40Ar40Ar等,它们的质量一般在40 ~ 80 amu,由于这些多原子离子与52Cr、56Fe、75As和80Se等多种同位素的质荷比重叠,因此影响了ICPQMS对Cr、Fe、As和 Se等元素测定的检出限[17]。Pick等[17]用微波消解ICP-DRC-MS 分析了植物和动物饲料中As、Cr、Fe、Ni和Se,选用CH4流速1.1 ~1.6 ml/min、RPq=0.65 ~ 0.8用于Cr、Fe、Ni和Se的测定:O2流速0.6 ml/min、RPq=0.55用于As测定,结果表明几种金属的检测限都在0.03 ~ 0.65 µg/L,低于普通ICP-MS的测定结果。ICP-MS的干扰还与待测样品的成分有关。当待测样品含有较高的Cl时, 它可以与Ar形成与As具有相同质荷比(m/z=75)的40Ar35Cl+而影响ICP-MS对As的测定[18]。对于含碱性元素的样品,Cu的测定容易受到Na+、Mg2+和Ca2+的影响,这可以通过碱性沉淀或离子交换树脂等方法去除干扰[19]。
自2012年以来,全波谱四级杆ICP-MS又有了进一步的发展,出现了ICP与多级质谱串联即ICPMS/MS[20],也称三重四级杆ICP-MS 或ICP-QQQ。ICP-MS/MS与ICP-CRC-QMS的主要区别在于前者使用了八级杆动态反应池CRC,并在CRC之前加了一个四级杆(Q1)做为质谱过滤器,因此只允许有一种质荷比的离子进入池发生反应,反应的产物因信号强弱的差异被另一质谱(Q2)选择性地扫描。一般的ICP-CRC-MS只是起到了动态质谱带通的作用,缺乏一个真正的质谱过滤器,很难抑制所有干扰离子的形成。ICP-MS/MS外加的四级杆质谱(Q1)可以过滤器排除所有与待测离子不同的来自等离子体和基体的离子,从而确保了测定的精准性[21]。
2 ICP-MS联用技术
2.1 高效液相色谱电感耦合等离子体质谱(HPLCICP-MS)
2.1.1 HPLC-ICP-MS 在As、Al、Se等元素分析中的应用 HPLC-ICP-MS技术的运用大大提高了人们对植物金属元素及其大分子的认识。该技术把HPLC简便的操作、强大的分离效果与ICP-MS优良的灵敏度巧妙地结合起来,是目前广泛使用的研究元素化学形态的方法。然而,不同的样品前处理方法、色谱条件对元素测定的结果影响较大。As是环境中最具毒性的元素之一。除了引用水之外,食用大米是人体吸收As的主要途径,长期接触As会导致癌症和其他健康问题。HPLC-ICP-MS用于水稻As测定的样品前处理方法主要有超纯水提取法和酸提取法(如硝酸、三氟已酸)。用水作为提取液最大的好处是不会产生化学物质,特别是不会改变AsIII/AsV比例。但是水提取之后要用高浓度溶液离心过滤,用酸提取大多数糙米提取率很难到达95% 以上,并且酸可能会破坏As的化学形态,即把AsV氧化成毒性更大的AsIII,因此一般认为用酸提取的是无机总As[22]。不同的水稻样品在不同的前处理方法、不同的HPLC条件下(色谱柱类型、流动相的选择等)As的含量差异较大[22-25](表1)。另外,不同植物的样品、不同的前处理方法及液相色谱条件对Se、Cr和Al等含量的影响也较大[23,26-33](表2)。
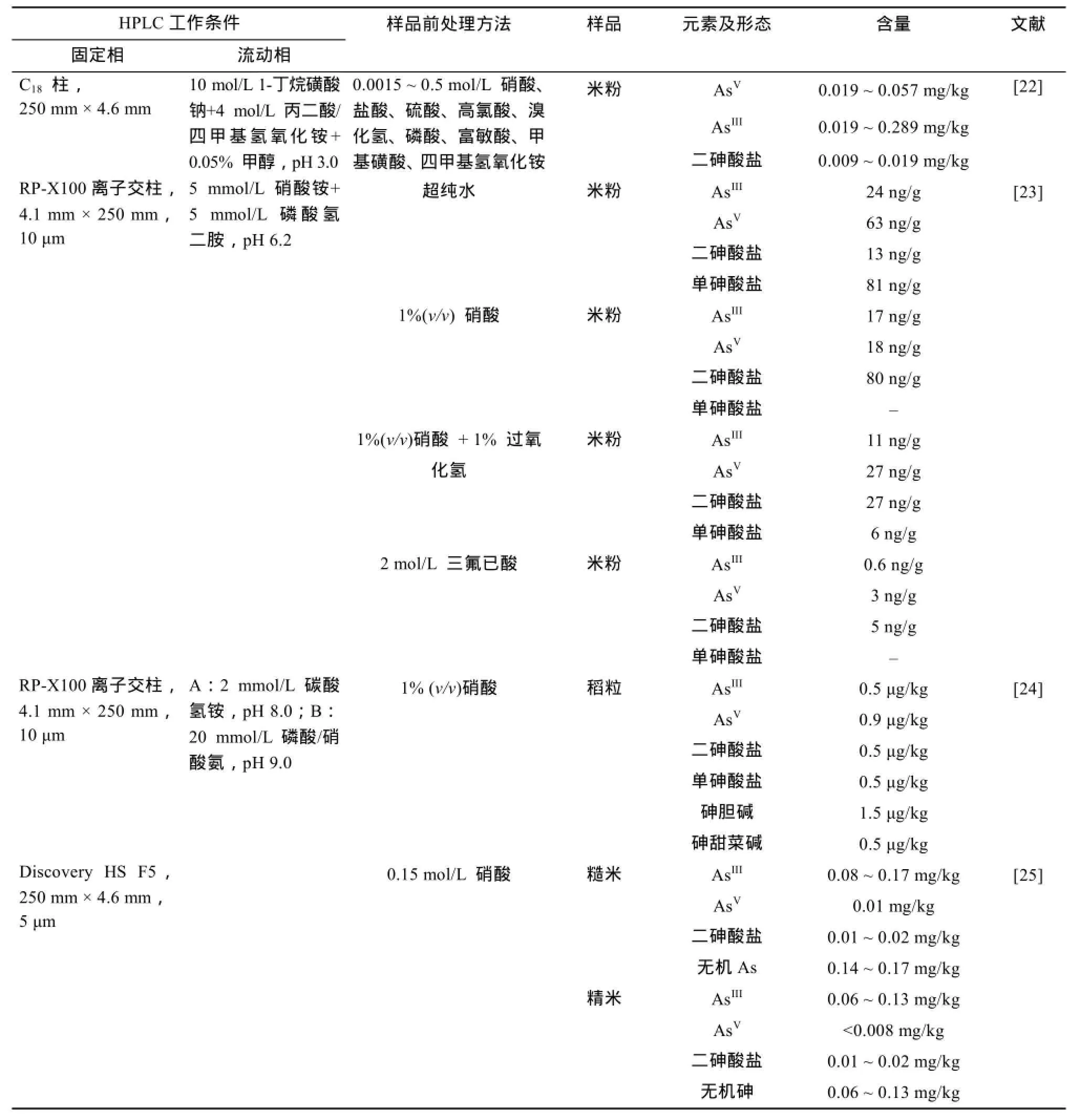
表1 不同的样品前处理方法和HPLC-ICP-MS液相色谱条件对水稻As含量的影响Table1 Effects of different ways of sample pre-treatments and HPLC conditions of HPLC-ICP-MS on contents of As in rice
随着代谢组学在生物学研究领域的兴起,金属组学的研究日益受到科学家们的关注。ICP-MS因其精准的离子检测功能,在定量蛋白组学研究中发挥越来越重要的作用,但是ICP-MS是一种硬离子源、不适用于分子种类的鉴定。电喷洒离子源(electrospray ionization mode,ESI) 作为一种软离子源可以提供难以分散的分子从而保证了金属/类金属与蛋白质/生物分子结合的完整性[34]。因此,ESI-MS作为一种研究生物样品金属分布的常用方法是ICP-MS的很好补充。植物螯合肽通过形成金属-肽复合体在金属脱毒中起重要作用,学者们用反相高效液相色谱电喷雾质谱RP-HPLC-ESI-MS/ICP-MS测定了水稻[35]等植物的Hg螯合肽,这种方法可以获得元素含量和分子结构的信息。Krupp等[35]分离到Hg2+诱导的水稻多种Hg螯合肽包括(Ser)PC2Hg,des-GlyPC2Hg 和 (Glu)PC2Hg。RP-HPLC-ESI-MS/ICP-MS还可以用于分析植物As螯合肽,低pH的流动相(0.1% 甲酸) 有助于稳定As螯合肽复合体[36]。Preud’homme等[37]用尺寸排阻反相液相色谱(size-exclusion-reversed phase liquid chromatography)与ICP-MS和电喷洒离子阱多级质谱联用 (ESI Orbitrap MSn),分析了富Se酵母亚硒酸盐SeIV转化成有机Se化合物代谢的过程。Casal等[38]利用强离子交换HPLC-ICP-MS和ESI Orbitrap MSn联用研究了富硒酵母Se的代谢途径,HPLCICP-MS全波谱扫描分离到27种含Se的代谢物。Arnaudguilhema 等[39]用反相HPLC-ICP-MS检测到酵母64 种Se代谢物,其中含Se-Se 或Se-S 桥的化合物30种,硒醚(selenoethers)14 种, HPLC-ICP- MS与HPLC-ESI-MS 检测结果一致,两者的检出限分别为1 ng/g和2 ng/g。

表2 不同样品前处理方法和HPLC-ICP-MS液相色谱条件对不同植物Se、Cr和Al等含量的影响Table2 Effects of different ways of sample pre-treatments and HPLC conditions of HPLC-ICP-MS on contents of Se, Cr and Al in various plants
2.1.2 HPLC与ICP-MS连接的接口及其应用
HPLC通常通过接口如Teflon 聚四氟乙烯管或PEEK 树脂管与ICP-MS雾化器连接。这种连结方式简单易行,但是由于死体积较大,降低了测定灵敏度。由于HPLC 柱流速一般在100 µl/min ~ 1 ml/min,而ICP-MS 雾化器流速通常在 0 ~ 1 ml/ min,甚至超过1 ml/min,这就要求色谱柱的流速最大限度地与雾化器流速相匹配,以保证样品的有效分离和雾化[40]。
光诱导的化学蒸发器可以作为LC或原子吸收光谱AFS与ICP-MS连接的接口用作Hg的测定,其基本原理是HPLC中的馏分先与有机酸结合,在紫外照射下有机Hg (MeHg、EtHg、PhHg)被转化成气态Hg,然后进入ICP-MS检测[41]。然而当生物样品含有较高的甜菜碱(AsB)时就会影响AsIII的精确度,改用KBH4-HCl发生器(HG)作为接口可以有效提高AsIII的精确度和专一性,因为AsIII、AsV、单砷酸盐MMAV和二砷酸盐DMAV可以被氧化形成AsH3、MeAsH2和Me2AsH,而AsB不能形成氢化物[42]。最近,一种纳米半导体材料的光催化蒸发发生器(photocatalytic vapor generation,PCVG)被用作HPLC 或 AFS与ICP-MS的接口。各种PCVG系统如UV/HCOOH,UV/TiO2-HCOOH,UV/Ag-TiO2-HCOOH和 UV/ZrO2-HCOOH等被用于Se形态的测定:比如以UV/ZrO2-HCOOH为接口对Se的检测灵敏度可达SeVI0.016 ng/ml,SeIV0.014 ng/ml、Se Cys2 0.018 ng/ml, SeMet 0.007 ng/ml,相对标准偏差RSDs小于4.4%[43]。
总之,HPLC-ICP-MS是一种常用的元素化学形态的分析手段,但是它亦有如下局限:①有机溶剂使样品在雾化器和雾室中产生记忆效应。研究认为气旋雾室可减弱记忆效应,但分析重现性变差[40]。②与ICP-MS 中ml级的进样量相比,HPLC-ICP-MS 中µl级的进样量降低了灵敏度。研究认为可以通过减小色谱与雾化器间的传输距离提高雾化效率,如采用直接注射雾化器等提高灵敏度[40]。③色谱柱与雾化器流速的差异造成检测的灵敏度降低。这可以通过注射泵添加柱外尾吹,以及在尾吹流中加入内标来校正仪器漂移、减少梯度洗脱或同位素稀释带来的基体效应[23]。
2.2 飞行时间质谱(TOF-MS)
2.2.1 TOF-MS工作原理 TOF-MS是一种带电离子的质量鉴定方法,即初始能量相同的带电原子/分子漂移固定距离(飞行区与检测器之间)所用的时间与它们本身的质量有关,通过测定漂移时间达到分离离子的目的。TOF-MS每一个获得的谱图都代表了在同一时间间隔内从等离子体中提取的离子所产生的信号。因此,在一次接收过程中对于任何元素的一对同位素TOF-MS都能够获得很好的精密度[44]。在联用技术中,TOF-MS与进样系统的连接就显得重要:以流动注射为例,垂直加速飞行时间质谱(orthogonal acceleration time-of-flight mass spectrometry,ICP-oa-TOF-MS)内置同心雾化器,雾化器一端连接气旋喷洒池,另一端与流动注射系统通过聚四氟乙烯管(内径约0.25 mm)连接[45]。
2.2.2 ICP-TOF-MS的应用及干扰的消除 ICPTOF-MS在植物重金属分析中的应用不如HPLCICP-MS普遍,可以查阅的文献也较少。Qin等[46]利用 ICP-oa-TOF-MS测定了箸叶(Indocalamus tesselatus)As、Pb、Cr和Cd等9种金属元素的含量:Cr为0.08 ~0.55 mg/kg,As为0.99 ~ 1.84 mg/kg,Hg在0.025 ~0.14 mg/kg,Cu和Pb分别为3.2 ~ 7.43 mg/kg、0.81 ~2.92 mg/kg,回收率在96.4% ~ 104.5%,并用国标(GBW07605-Tea)得以验证。Fragni 等[47]用ICP-oa-TOF-MS测定了来自意大利、中国和西班牙的41份番茄制品中15种元素,52Cr、63Cu、75As、114Cd、208Pb 的检测限分别为4.2、9.2、15.7 5.7和 8.8 ng/L,可见,ICP-oa-TOF-MS是一种多元素快速精准的分析方法。近几年,四级杆飞行时间质谱Q-TOF-MS和离子阱飞行时间质谱(ion trap-time-of-flight,IT-TOF)联用,已经用于定性、定量地分析金属复合物与蛋白质、核酸、多肽和有机类金属之间的互作[34]。
TOF-MS具有微秒级的快速检测速度(counts/ sec/1ng/L)和高离子传输速率,大大降低了离子束漂移方向上离子初速度的发散,提高了分辨率(即谱峰最大强度一半处的全峰宽,在一般的仪器条件下约为6Li 500 ~238U 2 200)。但TOF-MS主要局限是样品源中的漂移、闪烁噪声成分和干扰问题。ICP-oa-TOF-MS 中“oa”是垂直加速的意思,指的是垂直飞行时间质量分析器的构造:离子透镜与推斥板垂直,后者与加速区、无场飞行区、反射区和检测器垂直,离子在传输电极作用下垂直进入质量分析器,这样有效避免了样品源漂移、提高了信号值;通过同位素丰度比值测量和信号平均技术可以减小非随机性闪烁噪声的影响[44]。但TOF-MS的分辨率仍难以消除Ni、Cu和Co 等信号的干扰,目前已经有专门用于清除OptiMass 8000 ICP-TOF-MS 光谱干扰的智能离子空白系统(SMARTGATE ion blanking system),它利用智能离子覆盖的光谱范围如11.5 ~ 12.5(12C+)、14 ~ 25 (14N+、16O+、17OH-、18H2O+、28N2+)、29 ~ 32.5(30NO+、32O2+、32S+)、37.5 ~ 42 (40Ar+、41ArH+、80Ar2+)及55.5 ~ 57 (56ArO+) amu,消除由Ar引起的多原子离子以及基体中的大量元素的干扰,还可用于丰度较低的基体元素的数学校正[48]。Fragni等[47]用SMARTGATE来清除番茄样品中Ar、C、O、Na和 S等引起的光谱干扰,用Be、In和 Bi 作为内标有效地清除了基体的干扰、校正了基线的漂移,灵敏度在0.35 ~ 1.51 counts/(sec·ng·L)。
2.3 电热蒸发质谱(ETV-ICP-MS)
2.3.1 ETV-ICP-MS工作原理与应用 Electrothermalvaporisation (ETV)作为一种热化学反应器是实现ICP-MS固体进样的一种具有较高传送效率的方法,样品被送到等离子体之前在高温条件下经过干燥、灰化和蒸发形成元素而实现分离。作为一种固体直接进样系统,比原子发射光谱具有更高的灵敏度,可以瞬间测定多种元素(同位素),近年来越来越受到众多学者的重视。ETV与ICP-MS连接需要一种设计合理的熔炉装置,它既要能满足固体样品蒸发的需要又不能干扰等离子体。目前广泛使用的一种装置是船管形石墨炉[49],为了形成稳定的气溶胶需要不断吹入冷气流使之与样品混合,有助于蒸发的气溶胶冷凝成离子、避免了与管壁的相互作用。这种船管形石墨炉可以通过玻璃、聚乙烯或聚四氟乙烯管连接ICP,一般较短(约30 ~ 60 cm)而内径小(约3 ~ 4 mm)、可承载高速气流(0.3 ~ 0.8 L/min)的连接管是比较理想的[50]。
样品经高温蒸发形成元素或元素与氧、卤素结合成化合物的形式,因此减少了等离子体中氧的形成以及基体中多原子离子的产生,避免了基体物质的峰谱干扰[51]。Lin 和Jiang[52]用超声波悬浮电热蒸发质谱(ultrasonic slurry sampling electrothermalvaporisation,USS-ETV-ICP-MS) 分析了中草药样品As、Cd、Hg和Pb的含量,可检测As、Cd、Hg 和Pb分别为0.3、0.1、0.1 和 0.2 ng/g,比HPLC-ICP-MS测定中草药的检测限低了一个数量级。Huang 等[53]用USS-ETVICP-DRC-MS测定了小麦、水稻等谷物Cr、Fe、Cu、Zn 和Se含量,检出限分别为1、10、4、12 和 2 ng/g。微流控芯片(Microfluidic chips) 进样技术是进几年发展起来的分析微量样品如细胞的方法,Wang 等[54]把这种技术与ETV-ICP-MS联用分析细胞样品(µl或µg级)中的 Cu、Zn、Cd、Hg、Pb和Bi:检出检测限(LODs) 在6.6 ~ 89.3 pg/ml,RSD在4.23% ~ 8.15%(n = 7,c = 1 ng/ml),该方法与HPCL-ICP-MS、ICP-oa-TOF-MS相比,具有更高的灵密度,非常适合用于珍贵样品的分析。
2.3.2 ETV-ICP-MS样品制备方法 草本植物As、Cd、Hg 和Pb的超声电热蒸发样品制备方法一般步骤为:0.5 g粉碎的植物材料加入10 ml纯净水溶解,取1 ml浆样到10 ml 样品管,加入1% (m/v) 8-羟基喹啉(8-Hydroxyquinoline)作为萃取剂,加入As、Cd、Hg 和Pb 标准溶液,纯净水定容至10 ml,然后超声波震荡10 min。1 ml用于测定,含1% (m/v) 8-羟基喹啉的空白用于对照[52]。超声电热蒸发制备谷物样品的方法与草本植物基本相同,只是用三氯甲烷TAC代替8-羟基喹啉作为萃取剂[53]。
2.3.3 ETV-ICP-MS 干扰的消除 在样品灰化和蒸发过程中,基体成分不可避免地被送入等离子体,这不仅影响样品的传送效率,也影响检测的灵敏度。固体样品与基体可能发生反应而改变样品的挥发特性,有研究认为可以通过样品中加入基体校准物来控制,基体校准物的加入促进了基体挥发又不影响样品的挥发[49];还可以加入卤化物来加速非基体物质的蒸发,如0.1% CHF3或CCl4可以加速Cr、Mo、Zr的蒸发[55]。ETV-ICP-MS作为一种固体直接进样的手段,是ICP-MS分析方法的重要补充。今后这一技术将在样品高纯度分析、同质性鉴定等更广阔的领域发挥作用。
2.4 毛细管电泳电感耦合等离子体质谱(CE-ICP-MS)
2.4.1 CE-ICP-MS工作原理与应用 毛细管电泳(capillary electrophoresis,CE)是20世纪80年代发展起来的一种新技术,它根据待分离物组分间淌度和分配行为的差异而实现分离。CE分离用的电解质、缓冲液及pH值在许多元素形态的稳定范围内,是保持分离过程中样品化学特性的一种难得的分离技术。与色谱技术相比,毛细管电泳质谱具有较高的分离效率、所需样品量少、不存在样品与固定相相互作用的干扰、仪器消耗少等优势。Zhao 等[56]用CE-ICP-MS分离大米SeVI、SeIV、SeCys2 (selenocystine) 及SeMet(selenomethionine),其检出限都在0.1 ~ 0.9 ng/ml,回收率 90% ~ 103%,相对标准差RSD 3% ~ 7% (n = 6)。与ETV-ICP-MS类似,CE-ICP-MS同样有较高的分辨率。
2.4.2 CE与ICP-MS联用的接口及其应用 CE与ICP-MS在线联用需要设计合适的接口,保证CE已分离的样品有效转移到质谱仪中,同时实现样品快速的离子化。目前广泛使用的是鞘液接口,它通过一个微型同心雾化器及一个圆锥形的喷室(死体积小)与ICP-MS相连。同心雾化器与毛细管的液流流速的差异使毛细管出口端产生负压,自动将毛细管内液体吸到出口处即自吸现象,从而在毛细管内产生层流,导致CE的分辨率降低、谱峰变宽。解决层流的方法是在CE的出口端外加鞘液,鞘液的流速尽可能与雾化器的自吸量相同以平衡雾化时在毛细管出口端产生的负压,保证 ICP-MS的分离效果[57]。鞘液接口一方面传送电渗流,另一方面连接电泳阴极起到地线的作用,保证毛细管内电流导通。对于一般的雾化器,鞘液接口同样具有兼容性以满足ICP-MS对样品流速的要求。然而,由于自吸现象,鞘液流速会发生变化,研究发现通过外加蠕动泵或注射泵可获得稳定持续的鞘液流速[58-59]。毛细管末端与雾化器不适配是死体积存在的另一因素,死体积导致峰形变宽、峰高变低。Liu等[57]以一个喷洒头用做雾化器,毛细管出口被精确固定在喷洒头末端,这种接口把待测物直接送入雾化器,有效地减小了死体积,在30 min 内成功分离了杭白菊等样品10种As的化合物,检测限在0.9 ~ 3 ng/g。Kovachev等[60]研制了一种毛细管电泳池聚焦雾化器系统(capillary electrophoresis flow focusing nebulization system,CEFFS)作为新型接口。它主要由4部分组成:载体电解质模块、熔融石英毛细管、精密的池聚焦雾化器和一个高压电源。载体电解质模块主要包含一个十字形PEEK接头,一端连接高压电源,另一端连接毛细管,毛细管和一根 Pt电线通过第二个接头连接到喷洒池的底部,Pt电线可作为分离的电极。这种装置的优点是利用以电压产生负荷电流,不像一般的毛细管电泳是通过电渗来驱动。即其电泳速度高于普通的毛细管电泳,因此缩短了分离时间,但是分辨率也降低了,这可以通过提高分离电压提高分辨率。实验表明,在 2 min 之内它可以完成不同形态Cr标准品的分离,检测限分别为0.1 μg/L CrIII、0.2 μg/L CrVI及 0.03 μg/L总Cr[60]。
CE-ICP-MS不仅能分离分析环境中重金属与有机物反应和迁移的化学机理,还可以分离分析金属配位络合物的元素形态,从而进行元素形态的确认和定量分析。但是它仍受接口问题、样品的损失、基体效应和分离过程中可能引起的元素形态变化等问题的限制。CE-ICP-MS未来的发展趋势一方面集中在提高CE的分离能力上,另一方面体现在新型接口的研制,如微流控芯片CE与MS接口,这些将会显著促进CE-ICP-MS技术的发展,以实现多维分离和高通量分析[61]。
3 总结与展望
本文综述了ICP-MS及其几种联用技术的性能特点、在植物重金属分析中的应用以及光谱干扰的排除方法。ICP-MS已经成为重金属元素快速精确有力的分析工具,随着科学的发展和技术的不断进步,它在环境和生物科学等研究领域将发挥更大的作用。作者认为今后ICP-MS及其联用技术应用于植物重金属的研究应从以下几个方面考虑:开发多功能的多通道进样系统(包括各种多通道雾化器和喷室)以及对于各种ICP-MS都有较好的兼容性的接口系统(操作方便、死体积小)以减少仪器开支费用,充分挖掘ICP-MS的应用潜力;研究不同形态的样品雾化过程的热力学、化学特性及其机理;研究雾化过程干扰离子形成的机理,定性、定量地研究干扰离子的种类以及对仪器性能和分析结果的影响;研究多种技术联用的可行性的科学依据,以实现元素的多维分离和高通量分析。
[1] 张桃林. 科学认识和防治耕地土壤重金属污染[J]. 土壤,2015, 47(3): 435-439
[2] 傅传城, 王文勇, 潘剑君, 等. 城乡结合带土壤重金属时空变异研究与源解析-以南京市柘塘镇为例[J]. 土壤学报, 2014, 51(5): 1 066-1 067
[3] 李冰, 周剑雄, 詹秀春. 无机多元素现代仪器分析技术[J]. 地质学报, 2011, 85(11): 1 878-1 916
[4] Husted S, Persson D P, Laursen K H, et al. The role of atomic spectrometry in plant science[J]. Journal of Analytical Atomic Spectrometry, 2011, 26(1): 52-79
[5] Leiterer M, Einax J W, Löser C, et al. Trace analysis of metals in plant samples with inductively coupled plasmamass spectrometry[J]. Fresenius’ Journal of Analytical Chemistry, 1997, 359: 423-426
[6] Rodushkin I, Ödman F, Branth S. Multi-element analysis of whole blood by high resolution inductively coupled plasma mass spectrometry[J]. Fresenius’ Journal of Analytical Chemistry, 1999, 364: 338-364
[7] Fietzke J, Eisenhauer A, Gussone N, et al. Directmeasurement of44Ca/40Ca ratios by MC-ICP-MS using the cool plasma technique[J]. Chemical Geology, 2004, 206: 11-20
[8] Dufailly V, Laurent L N, Guérin T. Determination of chromium, iron and selenium in foodstuffs of animal origin by collision cell technology, inductively coupled plasma mass spectrometry (ICP-MS), after closed vessel microwave digestion[J]. Analytica Chimica Acta, 2006, 565: 214-221
[9] Kalinitchenko I, Wang X D, Sturman B. Simple and effective control of spectral overlap interferences in ICP-MS[J]. Spectroscopy, 2008(Suppl.): 38-46
[10] Pereira C D, Garcia E E, da Silva F V, et al. Behaviour of arsenic and selenium in an ICP-QMS with collision and reaction interface[J]. Journal of Analytical Atomic Spectrometry, 2010, 25: 1 763-1 768
[11] Tanner S D. Characterization of ionization and matrix suppression in inductively coupled ‘cold’ plasma mass spectrometry[J]. Journal of Analytical Atomic Spectrometry,1995, 10: 905-921
[12] Lucimar L, Fialho, Pereira C D, et al. Combination of cool plasma and collision-reaction interface for correction of polyatomic interferences on copper signals in inductively coupled plasma quadrupole mass spectrometry[J]. Spectrochimica Acta Part B, 2011, 66: 389-393
[13] An J S, Lee J, Lee G, et al. Combined use of collision cell technique and methanol addition for the analysis of arsenic in a high-chloride-containing sample by ICP-MS[J]. Microchemical Journal, 2015, 120: 77-81
[14] Way T W, Wiedmeyer R H. A table of polyatomic interferences in ICP-MS[J]. Atomic Spectroscopy, 1998, 19:150-155
[15] Hattendorf B, Günther D. Strategies for method development for an inductively coupled plasma mass spectrometer with bandpass reaction cell: approaches with different reaction gases for the determination of selenium[J]. Spectrochimica Acta B, 2003, 58: 1-13
[16] Guo W, Hu S H, Zhao J, et al. Removal of spectral interferences and accuracy monitoring of trace cadmium in feeds by dynamic reaction cell inductively coupled plasma mass spectrometry[J]. Microchemical Journal, 2011, 97:154-159
[17] Pick D, Leiterer M, Einax J W. Reduction of polyatomic interferences in biological material using dynamic reaction cell ICP-MS[J]. Microchemical Journal, 2010, 95: 315-319
[18] Chrastný V, Komárek M. Copper determination using ICP-MS with hexapole collision cell[J]. Chemical Papers,2009, 63: 512-519
[19] Leentvaar L, Rebhun M. Effect of magnesium and calcium precipitation on coagulation flocculation with lime[J].Water Research, 1982, 16: 655-662
[20] Balcaen L, Woods G, Resano M, et al. Accurate determination of S in organic matrices using isotope dilution ICP-MS/MS[J]. Journal of Analytical Atomic Spectrometry, 2013, 28: 33-39
[21] Balcaen L, Fernandez E B, Resano M, et al. Inductively coupled plasmae Tandem mass spectrometry (ICP-MS/MS):A powerful and universal tool for the interference-free determination of (ultra) trace elements-A tutorial review[J]. Analytica Chimica Acta, 2015, 894: 7-19
[22] Narukawa T, Matsumotto E, Nishimura T, et al. Determination of sixteen elements and arsenic species in brown, polished and milled rice[J]. Analytical Sciences,2014, 30: 245-250
[23] Liu X J, Zhao Q L, Sun G X, et al. Arsenic speciation in Chinese herbal Medicines and human health implication for inorganic arsenic[J]. Environmental Pollution, 2013, 172:149-154
[24] Kim J Y, Kim W-Il, Kunhikrishnan A. Determination of arsenic species in rice grains using HPLC-ICP-MS[J]. Food Science and Biotechnology, 2013, 22: 1 509-1 513
[25] Baba K, Arao T, Yamaguchi N, et al. Chromatographic separation of arsenic species with pentafluorophenyl column and application to rice[J]. Journal of Chromatography A, 2014, 1354: 109-116
[26] Galinha C, Sánchez-Martínez M, Pacheco A M G, et al. Characterization of selenium-enriched wheat by agronomic biofortification[J]. Journal of Food Science and Technology,2015, 52 (7): 4 236-4 245
[27] Novotnik B, Zuliani T, Sˇcanˇcar J, et al. Content of trace elements and chromium speciation in Neem powder and tea infusions[J]. Journal of Trace Elements in Medicine and Biology, 2015, 31: 98-106
[28] Vacchina V, de la Calle I, Séby F. Cr(VI) speciation in foods by HPLC-ICP-MS: investigation of Cr(VI)/food interactions by size exclusion and Cr(VI) determination and stability by ion-exchange on-line separations[J]. Analytical and Bioanalytical Chemistry, 2015, 407: 3 831-3 839
[29] Thosaikhama W, Jitmanee K, Sittipout R, et al. Evaluation of selenium species in selenium-enriched pakchoi(Brassica chinensis Jusl var parachinensis (Bailey) Tsen & Lee) using mixed ion-pair reversed phase HPLC-ICPMS[J]. Food Chemistry, 2014, 145: 736-742
[30] Todolí J L, Grotti M. Fast determination of arsenosugars in algal extracts by narrow bore high-performance liquid chromatography-inductively coupled plasma mass spectrometry[J]. Journal of Chromatography A, 2010, 1217:7 428-7 433
[31] Guo X N, Liu W, Bai X J. Speciation of chromium in chromium yeast[J]. World Journal of Microbiology and Biotechnology, 2014, 30: 3 245-3 250
[32] Hedegaard R V, Rokkjær I, Sloth J J. Total and inorganic arsenic in dietary supplements based on herbs, other botanicals and algae——a possible contributor to inorganic arsenic exposure[J]. Analytical and Bioanalytical Chemistry,2013, 405: 4 429-4 435
[33] Shang D R, Zhao Y F, Zhai Y X. Development of a new method for analyzing free aluminum ions (Al3+) in seafood using HPLC-ICP-MS[J]. Chinese Science Bulletin, 2013,58: 4 437-4 442
[34] Vogiatzis C G, Zachariadis G A. Tandem mass spectrometry in metallomics and the involving role of ICP-MS detection:A review[J]. Analytica Chimica Acta, 2014, 819: 1-14
[35] Krupp E M, Mestrot A, Wielgus J. The molecular form of mercury in biota: Identification of novel mercury peptide complexes in plants[J]. Chemical Communications, 2009,28: 4 257-4 259
[36] Bluemlein K, Raab A, Feldmann J. Stability of arsenic peptides in plant extracts: Off-line versus on-line parallel elemental and molecular mass spectrometric detection for liquid chromatographic separation[J]. Analytical & Bioanalytical Chemistry, 2009, 393: 357-366
[37] Preud'homme H,Far J,Casal G S,et al. Large-scale identification of selenium metabolites by online sizeexclusion-reversed phase liquid chromatography with combined inductively coupled plasma (ICP-MS) and electrospray ionization linear trap-Orbitrap mass spectrometry (ESI-MSn) [J]. Metallomics, 2012,4(5):422-432
[38] Casal S G, Far J, Bierla K , et al. Study of the Secontaining metabolomes in Se-rich yeast by size-exclusioncation-exchange HPLC with the parallel ICP-MS and electrospray orbital ion trap detection[J]. Metallomics,2010, 2(8): 535-548
[39] Arnaudguilhema C, Bierlaa K, Ouerdanea L, et al. Selenium metabolomics in yeast using complementary reversed-phase/ hydrophilic ion interaction (HILIC) liquidchromatographyelectrospray hybrid quadrupole trap/Orbitrap Massspectrometry[J]. Analytica Chimica Acta, 2012, 757: 26-38
[40] Handbook of Hyphenated ICP-MS Applications. Agilent Technologies. http://www.chem.agilent.com
[41] Chen K J, Hsu I H, Sun Y C. Determination of methylmercury and inorganic mercury by coupling short-column ion chromatographic separation, on-line photocatalyst-assisted vapor generation, and inductively coupled plasma mass spectrometry[J]. Journal of Chromatography A, 2009, 1216: 8 933-8 938
[42] Yin Y G, Liu J F, Jiang G B. Recent advances in speciation analysis of mercury, arsenic and selenium[J]. Chinese Science Bulletin, 2013, 58(2): 150-161
[43] Li H M, Luo Y C, Li Z X. Nanosemiconductor-based photo-catalytic vapor generation systems for subsequent selenium determination and speciation with atomic fluorescence spectrometry and inductively coupled plasma mass spectrometry[J]. Analytical Chemistry, 2012, 84:2 974-2 981
[44] GBC Scientific Equipment Pty Ltd. Technical note: The advantages of time-of-flight mass spectrometry for elemental analysis. http://www.gbcsci.com/
[45] Willie S N, Sturgeon R E. Determination of transition and rare earth elements in seawater by flow injection inductively coupled plasma time-of-flight mass spectrometry[J]. Spectrochimica Acta Part B, Atomic Spectroscopy, 2001, 56: 1 707-1 716
[46] Qin Y Y, Zhang Z H, Li L, et al. Inductively coupled plasma orthogonal acceleration time-of-flight mass spectrometry (ICP-oa-TOF-MS) analysis of heavy metal content in Indocalamus tesselatus samples[J]. Food Chemistry, 2013, 141: 2 154-2 157
[47] Fragni R, Trifirò A, Nucci A. Towards the development of a multi-element analysis by ICP-oa-TOF-MS for tracing the geographical origin of processed tomato products[J]. Food Control, 2015, 48: 96-101
[48] Husáková L, Urbanová I, Audrlická-Vavrušová L. Multielement analysis of urine by inductively coupledplasma orthogonal acceleration time-of-flight mass spectrometry[J]. Microchimica Acta, 2011, 173: 173-181
[49] Martín-Esteban A, Slowikowski B. Electrothermal vaporization-Inductively coupled plasma-mass spectrometry(ETV-ICP-MS): A valuable tool for direct multi-element determination in solid samples[J]. Critical Reviews in Analytical Chemistry, 2003, 33(1): 43-55
[50] Venable J, Holcomble J A. Peak broadening from an electrothermal vaporization sample introduction source into an inductively coupled plasma[J]. Spectrochimica Acta Part B: Atomic Spectroscopy, 2001, 56: 1 421-1 440
[51] Aramendia M, Resano M, Vanhaecke F. Determination of toxic trace impurities in titanium dioxide by solid sampling-electrothermal vaporization-inductively coupled plasma mass spectrometry[J]. Journal of Analytical Atomic Spectrometry, 2009, 24(4): 1-50
[52] Lin M L, Jiang S J. Determination of As, Cd, Hg and Pb in herbs using slurry sampling electrothermal vaporisation inductively coupled plasma mass spectrometry[J]. Food Chemistry, 2013, 141: 2 158-2 162
[53] Huang S Y, Jiang S J, Sahayamc A C. Ultrasonic slurry sampling electrothermal vaporization inductively coupled plasmamass spectrometry for the determination of Cr, Fe,Cu, Zn and Se in cereals[J]. Spectrochimica Acta, Part B,2014, 101: 46-50
[54] Wang H, Wu Z K, Zhang Y. et al. Chip-based liquid phase microextraction combined with electrothermal vaporizationinductively coupled plasma mass spectrometry for trace metal determination in cell samples[J]. Journal of Analytical Atomic Spectrometry, 2013, 28: 1 660-1 665
[55] Kirkbright G F, Snook R D. Volatilization of refractory compound elements from a graphite eletrothermal atomization device for sample introduction into an inductively coupled argon plasma[J]. Analytical Chemistry,1979, 51(12): 1 938-1 941
[56] Zhao Y Q, Zheng J P, Fang L, et al. Speciation analysis of mercury in natural water and fish samples by using capillary electrophoresis-inductively coupled plasma mass spectrometry[J]. Talanta, 2012, 89: 280-285
[57] Liu L H, He B, Yun Z J, et al. Speciation analysis of arsenic compounds by capillary electrophoresis on-line coupledwith inductively coupled plasma mass spectrometry using a novel interface[J]. Journal of Chromatography A, 2013,1304: 227-233
[58] Yang G, Xu X, Wang W, et al. A new interface used to couple capillary electrophoresis with inductively coupled plasma mass spectrometry for speciation analysis[J]. Electrophoresis, 2008, 29: 2 862-2 868
[59] Li J X, Umemura T, Odake T, et al. A high-efficiency cross-flow micronebulizer interface for capillary electrophoresis and inductively coupled plasma mass spectrometry[J]. Analytical Chemistry, 2001, 73: 5 992-5 999
[60] Kovachev N, Aguirre M Á, Hidalgo M, et al. Elemental speciation by capillary electrophoresis with inductively coupled plasma spectrometry: A new approach by flow focusing nebulization[J]. Microchemical Journal, 2014, 117:27-33
[61] 李金英, 鲁盛会, 石磊, 等. 毛细管电泳-电感耦合等离子体质谱联用技术及其元素形态分析的新进展[J]. 质谱学报, 2012, 33(4): 193-201
Applications and Advances of Hyphenated Techniques of Inductively Coupled Plasma Mass Spectrometry in Analyzing Heavy Metals of Plants
ZOU Xiaojuan1, YIN Xiaoming1*, LI Rong1,2, YANG Chaoguang1
(1 College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China;2 Jiangsu Key Laboratory for Solid Organic Waste Utilization, Nanjing 210095, China)
Since the introduction in 1980 inductively coupled plasma (ICP) has become an universal technique with high resolution and sensitivity, lower detection limits, and minimal sample consumption for inorganic especially heavy metal element analysis and is widely used in the determination for large ranges of samples. The hyphenated techniques of ICP to mass spectrometry (MS) largely promoted the technology for inorganic multi-element analysis. This paper reviewed the theories,performances, ways to reduce spectral interferences of ICP-MS and related hyphenated techniques from 32 related
in the analysis of heavy metals in plants, so as to provide valuable references for the technology of heavy metal analysis in plants.
Inductively coupled plasma mass spectrometry (ICP-MS); Hyphenated technique; Heavy metals; Plants
X56
10.13758/j.cnki.tr.2016.05.002
卓越农林人才教育培养计划项目和南京农业大学中央高校基本科研业务费科技平台实验技术项目(KJSY0201500236)资助。
*通讯作者(yxm@njau.edu.cn)
邹晓娟(1991—),女,江西九江人,硕士研究生,主要从事环境生物学研究。E-mail: 2013803191@njau.edu.cn
