曲安奈德对棕色挪威大鼠脉络膜新生血管生长的影响①
2016-11-21高小燕何守志
高小燕,何守志
曲安奈德对棕色挪威大鼠脉络膜新生血管生长的影响①
高小燕,何守志
目的观察光凝后即刻玻璃体腔内注射曲安奈德对棕色挪威大鼠脉络膜新生血管生长的影响。方法36只健康棕色挪威大鼠随机分为对照组和实验组,每组18只,随机抽取一眼作为实验眼。建立棕色挪威大鼠脉络膜新生血管动物模型。视网膜光凝后,实验组立即玻璃体腔内注射曲安奈德8μl;对照组在实验眼玻璃体内注射同等容积的等渗平衡盐溶液。分别在光凝后2、4、6周取6只大鼠,采用免疫组化法检测核因子-κB蛋白的表达,测量脉络膜新生血管的最大面积。结果实验组的脉络膜新生血管面积及核因子-κB蛋白的表达低于同期对照组(t>7.450,P<0.001)。结论曲安奈德可抑制棕色挪威大鼠脉络膜新生血管的生长,降低核因子-κB蛋白的表达。
曲安奈德;核因子-κB;脉络膜新生血管;棕色挪威大鼠
[本文著录格式]高小燕,何守志.曲安奈德对棕色挪威大鼠脉络膜新生血管生长的影响[J].中国康复理论与实践,2016,22 (10):1154-1158.
CITED AS:Gao XY,He SZ.Effects of triamcinolone acetonide on choroidal neovascularization in brown Norway rats[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(10):1154-1158.
脉络膜新生血管(choroidal neovascularization,CNV)可以导致严重的和永久的视力丧失,是现在眼科主要致盲的疾病之一。CNV现被广泛地认为属于创伤愈合和组织修复的几个关键过程的一个组成成分[1]。CNV发展是一个复杂过程,包括各种细胞成分参与,以及细胞因子调节的失衡、转录因子的激活、趋化因子的表达等。在CNV的多种发病机制中,炎症作用机制也日益引起人们的重视[2-3]。核因子-κB (nuclear factor-kappa B,NF-κB)是1986年从B细胞核中提取到的核转录因子,参与多种炎症细胞因子及免疫基因表达的转录和调节。NF-κB在眼内新生血管中的研究较少,但已有体内外实验陆续报道该因子参与诱导视网膜新生血管[4]。类固醇合成物是众所周知的抗新生血管形成的药物[5-7]。本实验主要研究玻璃体内注射曲安奈德(triamcinolone acetonide,TA)对CNV的治疗效果及机制,从而为指导临床研究和治疗CNV提供基础理论依据。
1 材料与方法
1.1材料
1.1.1主要仪器与试剂
TA注射液(40 g/L),批号H53021604:昆明积大制药有限公司。小鼠抗大鼠的NF-κB(MAB 0.1m l):北京中杉金桥生物技术有限公司。即用型抗生蛋白链菌素生物素复合体(streptavidin-biotincomplex,SABC)试剂盒、0.01mol/L枸橼酸盐缓冲液:武汉博士德生物工程有限公司。3-氨基-9-乙基卡巴唑(3-am ino-9-ethylcarbozole,AEC)显色试剂盒:北京中杉金桥生物技术有限公司。Novua 2000氪激光机:美国COHERENT公司。25μl微量进样器:上海安亭微量进样器厂。Image-ProPlus5.1图像分析系统:美国MEDIA CYBERNETICS公司。
1.1.2实验动物
36只健康雄性清洁级棕色挪威(brown Norway,BN)大鼠,中国医学科学院实验动物中心提供,体质量200~220 g。动物的使用和管理遵循国家科学技术部颁布的《实验动物管理条例》。
1.2方法
1.2.1CNV模型的建立及动物分组
检查所有大鼠双眼前节和眼底,均正常,按照随机数字表法分为实验组和对照组,每组实验动物随机分为2、4、6周组,每小组6只。选取一眼作为激光光凝眼,另一眼为不光凝正常眼。参照本实验室CNV造模方法[8],采用氪激光(647 nm)距视盘等距离围绕视盘光凝大鼠视网膜。激光参数:功率360mW,光斑直径100μm,曝光时间0.05 s。
1.2.2药物的应用
实验组全麻状态下,1%丁卡因滴眼液表面麻醉后,手术显微镜下,30G针头颞侧角膜缘后0.5mm作一穿刺口,微量注射器从穿刺口进针,约1.5mm深,针尖朝向视神经方向,玻璃体中可见针尖,缓缓注入TA 8μl(320μg)。由散大的瞳孔可观察到玻璃体中TA的白色混悬液体。轻轻拔针后,显微镊子轻夹穿刺口片刻,以利穿刺口闭合。
对照组玻璃体内注射同样容积的等渗平衡盐溶液(balanced salt solution,BSS)。因注射造成晶体损伤的眼均被排除实验。
1.2.3组织病理学检查
分别在2周、4周、6周时,深度麻醉下摘除6只大鼠的眼球,蒸馏水冲洗,置于40 g/L多聚甲醛液中固定2 h。按病理组织学方法梯度酒精脱水、透明、浸蜡、包埋,蜡块4℃保存备用。眼球组织5µm厚度连续切片,置于50℃的蒸馏水中展片,捞片,置烤箱37℃烤片12 h后,4℃保存。常规脱蜡,行HE染色。光学显微镜下观察并拍照。采用Image-Pro Plus 5.1图像分析软件计算400倍光学显微镜下CNV面积。选取每个眼球连续切片中含有最大CNV直径的切片,每个标本测量5张切片,取其平均值。
1.2.4免疫组织化学法
石蜡切片常规脱蜡至水;3%H2O2室温孵育10 m in,阻断内源性过氧化物酶活性,蒸馏水冲洗,PBS浸泡5m in;切片置于盛有0.01mol/L枸橼酸盐缓冲液的抗原修复盒中,微波中火加热15min进行抗原微波炉热修复;滴加封闭用正常山羊血清工作液,室温孵育15m in;滴加小鼠抗大鼠的NF-κB单克隆抗体(1∶70),4℃过夜,0.01mol/L PBS洗涤;滴加生物素标记山羊抗小鼠IgG,室温孵育15m in,0.01mol/L PBS洗涤;滴加辣根酶标记链酶卵白素工作液,37℃孵育40m in,0.01mol/L PBS洗涤;滴加AEC,室温显色,镜下控制反应时间3~10m in,蒸馏水充分洗涤;苏木素轻度衬染10 s,自来水充分水洗,水溶性封片剂封片。用0.01mol/L的PBS取代一抗孵育,作为阴性对照,以试剂盒提供的大鼠肺肿瘤组织切片作为阳性对照。切片内被染成红色的点、团簇为阳性反应物。
1.3图像分析与数据处理
采用Image-Pro Plus 5.1图像分析软件计算400倍光学显微镜下阳性染色区域积分光密度值(integrated optical density,IOD),选取每个眼球连续切片中含有最大CNV直径的切片,每个标本测量5张切片,取其平均值。
1.4统计学分析
采用SPSS 13.0统计学软件进行统计分析。本研究测量指标的数据资料经Shapiro-Wilk检验证实呈正态分布,以(xˉ±s)表示。组间均数经Levene检验方差齐。采用完全随机分组单因素干预多水平实验设计;组内光凝后不同时间组大鼠CNV面积、NF-κB蛋白表达差异用单因素方差分析;两两比较用SNK检验;同一时间内的组间比较用Student t检验。显著性水平α=0.05。
2 结果
光凝后6周内,对照组病理组织切片有清晰的新生血管形成,CNV随时间增厚,CNV中包含胶原组织和管腔中含有红细胞的增殖的血管,炎性细胞主要是巨噬细胞的浸润。实验组CNV随时间呈逐渐增加的趋势,但纤维血管膜增殖形成不明显(图1)。可见光凝处视网膜外层断裂,视网膜色素上皮(retinal pigmentepithelium,RPE)和Bruch膜的缺失,少量的红细胞、炎性细胞浸润在激光斑处,在RPE和Bruch膜的缺失处可见到明显的巩膜。
两组CNV面积均随着时间显著增加(P<0.001),实验组显著小于对照组(P<0.001)。两组NF-κB蛋白表达均随时间显著升高(P<0.001),实验组显著低于对照组(P<0.001)。见表1、表2、图1、图2。
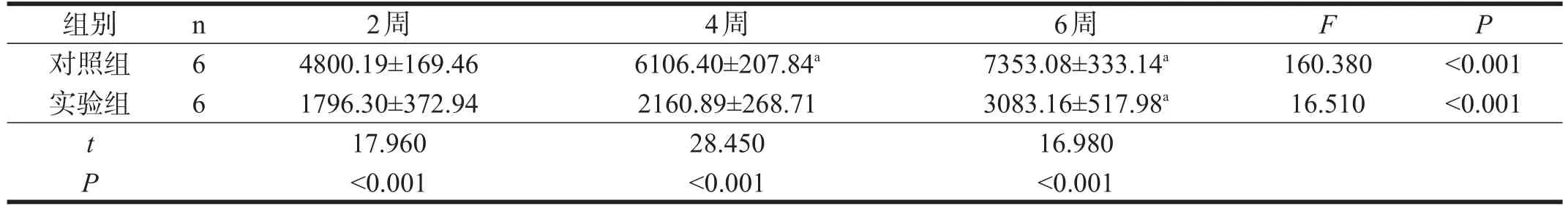
表1 两组CNV面积比较(μm2)
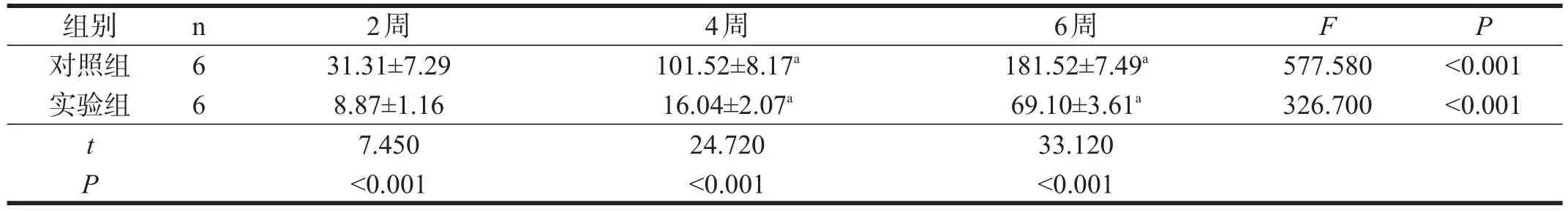
表2 两组NF-κB表达(IOD)
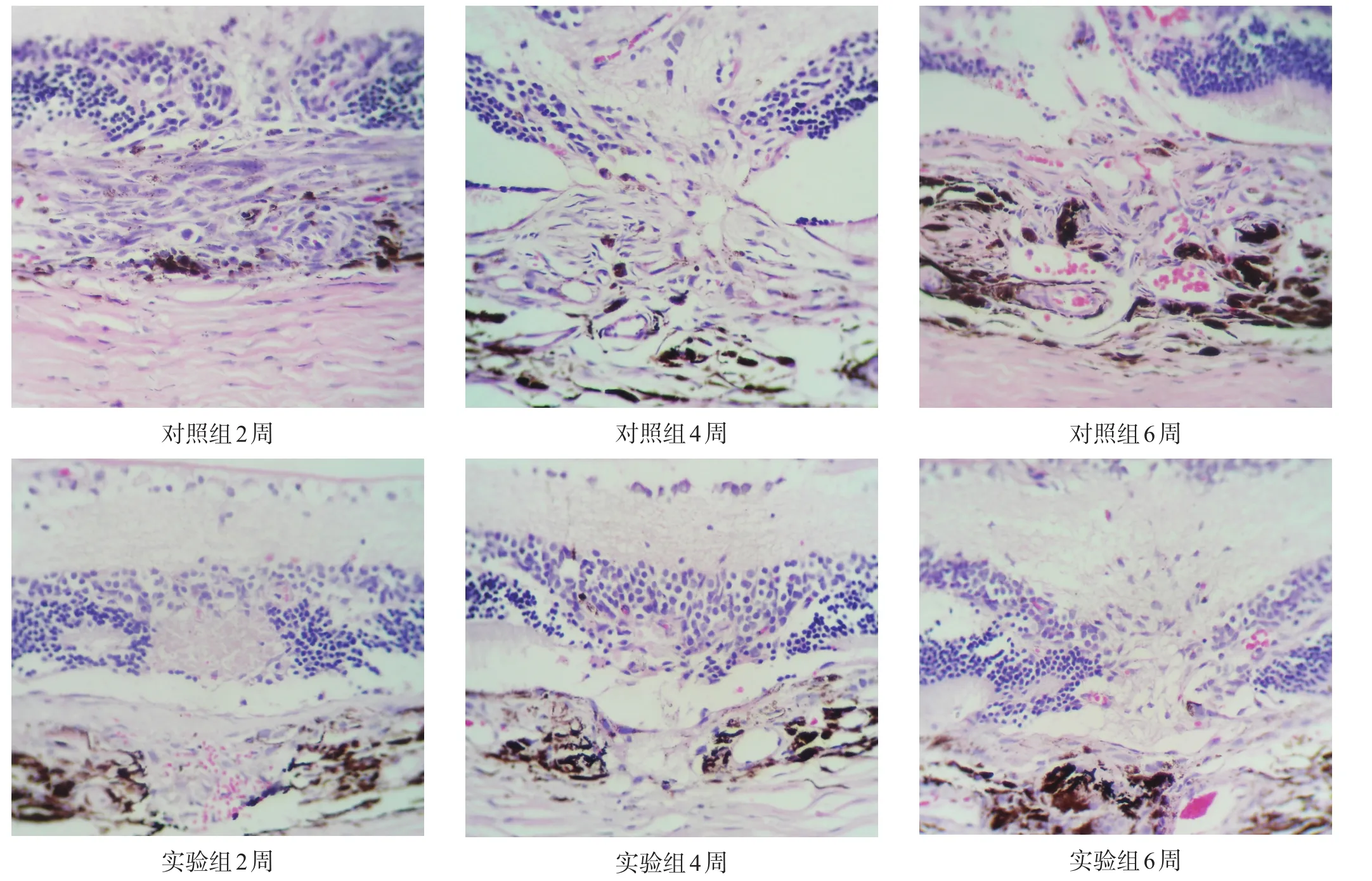
图1 两组CNV面积的变化(HE染色,400×)
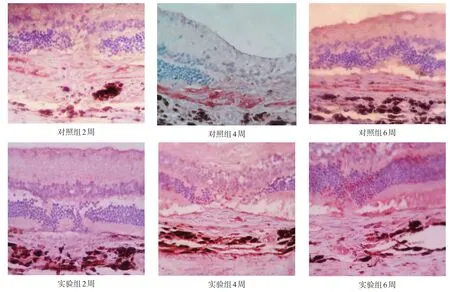
图2 两组NF-κB蛋白表达(免疫组织化学染色,400×)
3 讨论
CNV是许多脉络膜视网膜疾病的最终结局,可导致不可逆性的中心视力损害。治疗CNV的关键在于阻断其发展过程,而药物治疗是最有希望阻断病变发展进程的方法之一[9-12]。早期使用抗血管生成药物来控制CNV的发生、发展逐渐受到重视,皮质类固醇就是其中之一。近期,人们开始关注采用TA玻璃体腔注射治疗眼内新生血管[13-15]。已有大量临床或实验研究发现TA可抑制视网膜CNV形成[16-18],但其可能机制还未知。
本实验研究发现,光凝后即刻玻璃体腔内注射TA 8µl可以显著抑制新生血管形成和发展。
最近,有临床资料证实玻璃体腔内注射TA 25mg可以抑制年龄相关性黄斑变性(age-relatedmacular degeneration,ARMD)患者的新生血管[19-20],但TA治疗CNV的机制还未知。我们通过免疫组化方法发现,在CNV生长的6周内,NF-κB的表达也逐渐增强。NF-κB作为转录调控细胞因子,可能通过多种不同的机制参与CNV的生长发展,通过上调其他细胞因子的表达,起始和促进CNV的生长。有学者发现NF-κB的活化在激光诱导的CNV模型中起到致炎与致新生血管形成的作用[21]。亦有学者在激光诱导的CNV模型中,发现NF-κB的活化可以通过上调基质金属蛋白酶-2(matrixmetallopeptidase-2,MMP-2)表达而促进新生血管形成[22]。已知很多细胞因子的启动子区含有NF-κB的结合位点或识别位点[23],而糖皮质激素是NF-κB的抑制剂[24-25]。本研究显示,TA可以降低棕色挪威大鼠激光斑损伤区中NF-κB的活性,从而影响CNV的生长。
有临床研究表明,TA除抑制新生血管的生长外,还能够改善视力。尽管TA玻璃体内注射在某些方面还存在一些争议,但是对于许多难治性的眼底疾病,如黄斑下CNV、复发性CNV,已显示出一定的优越性[26]。有学者发现N-乙酰半胱氨酸(N-acetyl-cysteine,NAC)可以抑制激光诱导的CNV中NF-κB的活化,从而抑制CNV形成[27]。我们发现,在棕色挪威大鼠CNV模型中激光光凝后即刻玻璃体腔内注射TA,可降低NF-κB的蛋白表达,抑制CNV生长。TA是阻断CNV病程发展的理想药物,并且可能是通过降低NF-κB活性而发挥作用。
本实验仅在光凝后即刻玻璃体内注射TA来干预CNV形成,对于CNV形成之后,TA对CNV的作用尚需要进一步研究。
[1]Liyanage SE,Fantin A,Villacampa P,et al.M yeloid-derived vascular endothelial grow th factor and hypoxia-inducible factor are dispensable for ocular neovascularization-brief report[J].Arterioscler Thromb Vasc Biol,2016,36(1):19-24.
[2]Tan X,Fujiu K,Manabe I,etal.Choroidalneovascularization is inhibited via an intraocular decrease of inflammatory cells in m ice lacking complementcomponentC3[J].SciRep,2015,5:15702.
[3]Levy O,Lavalette S,Hu SJ,et al.APOE iIsoforms control pathogenic subretinal inflammation in age-relatedmacular degeneration[J].JNeurosci,2015,35(40):13568-13576.
[4]YoshidaA,Yoshida S,Hata Y,etal.The roleof NF-kB in retinalneovascularization in the rat:possible Involvementof cytokine-induced neutrophil chemoattractant(CINC),amember of the interleukin-8 fam ily[J]. JHistochem Cytochem,1998,46(4):429-436.
[5]PatelA,Nguyen C,Lu S.Central retinalvein occlusion:a review of current evidence-based treatment options[J].Middle East A fr JOphthalmol,2016,23(1):44-48.
[6]Takata S,Masuda T,Nakamura S,etal.The effectof triamcinolone acetonideon laser-induced choroidalneovascularization inmice using ahypoxia visualization bio-imaging probe[J].SciRep,2015,5:9898.
[7]Ozmen A,Unek G,Kipmen-Korgun D,et al.Glucocorticoid exposure altered angiogenic factor expression via Akt/m TOR pathway in rat placenta[J].Ann Anat,2015,198:34-40.
[8]高小燕,何守志,张新秀.单核细胞趋化蛋白-1在大鼠脉络膜新生血管中的表达[J].眼科研究,2010,28(8):707-711.
[9]Chatziralli I,Theodossiadis G,Em fietzoglou I,et al.Intravitreal ranibizumab for choroidal neovascularization secondary to gyrate atrophy in a young patient:amultimodal imaging analysis[J].Eur JOphthalmol,2015,25(6):e119-122.
[10]Lin TC,Hung KH,Peng CH,etal.Nanotechnology-based drug delivery treatmentsand specific targeting therapy for age-relatedmacular degeneration[J].JChin Med Assoc,2015,78(11):635-641.
[11]Leaderer D,Cashman SM,Kumar-Singh R,etal.Topical application of a G-Quartetaptamer targeting nucleolin attenuates choroidalneovascularization in a model of age-related macular degeneration[J].Exp Eye Res,2015,140:171-178.
[12]Zhao T,Zhang J,Zhang Y,etal.Vascular endothelial grow th factor receptor 2 antibody,BC001,attenuates laser-induced choroidalneovascularization in Rhesusmonkeys(Macacamulatta)[J].JOcul Pharmacol Ther,2015,31(10):611-616.
[13]VerittiD,Sarao V,Lanzetta P.Bevacizumab and triamcinolone acetonide for choroidalneovascularization due to age-relatedmacular degeneration unresponsive to antivascular endothelialgrow th factors[J].JOcul Pharmacol Ther,2013,29(4):437-441.
[14]Pai SA,HebriSP,Lootah AM.Managementof recurrent inflammatory choroidal neovascularmembrane secondary to Vogt-Koyanagi-Harada syndrome,using combined intravitreal injection of bevacizumab and triamcinoloneacetate[J].Indian JOphthalmol,2012,60(6):551-552.
[15]Rishi P,Rishi E,Venkataraman A,et al.Photodynam ic monotherapy or combination treatmentwith intravitreal triamcinolone acetonide,bevacizumab or ranibizumab for choroidal neovascularization associated with pathological myopia[J].Indian J Ophthalmol,2011,59(3):242-246.
[16]Ciulla TA,CriswellMH,Danis RP,etal.Intravitreal triamcinolone accetonide inhibits choroidal neovascularization in laser-related ratmodeal[J].Arch Ophthalmol,2001,119(3):399-404.
[17]Criswell MH,Hu WZ,Steffens TJ,et al.Comparing pegaptanib and triamcinolone efficacy in the rat choroidal neovascularization model[J].Arch Ophthalmol,2008,126(7):946-952.
[18]高小燕,何守志.BN大鼠玻璃体内注射曲安奈德抑制脉络膜新生血管生长[J].眼科新进展,2011,31(3):211-214.
[19]Jonas JB,Kreissig I,Hugger P,etal.Intravitreal triamcinolone acetonide for exudative age related macular degeneration[J].Br JOphthalmol,2003,87(4):462-468.
[20]Shirakata Y,ShiragamiC,Yamashita A,etal.One-year resultsof bevacizumab intravitreal and posterior sub-Tenon injection of triamcinolone acetonide with reduced laser fluence photodynam ic therapy for retinal angiomatousproliferation[J].Jpn JOphthalmol,2012,56(6):599-607.
[21]Lu H,Lu Q,Gaddipati S,et al.IKK2 inhibition attenuates laser-induced choroidalneovascularization[J].PLoSOne,2014,9(1):e87530.
[22]Cai J,Yin G,Lin B,etal.Rolesof NFκB-miR-29s-MMP-2 circuitry in experimental choroidal neovascularization[J].J Neuroinflammation,2014,11:88.
[23]Bancroft CC,Chen Z,Dong G,et al.Coexpression of proangiogenic factors IL-8 and VEGFby human head and neck squamous cell carcinoma involves coactivation by MEK-MAPK and IKK-NF-kappaB signal pathways[J].Clin Cancer Res,2001,7(2):435-442.
[24]A lmaw iWY,Melemedjian OK.Negative regulation of nuclear factor-B activation and function by glucocorticoids[J].J Mol Endocrinol,2002,28(2):69-78.
[25]Gambhir L,Checker R,Sharma D,etal.Thiol dependent NF-κB suppression and inhibition of T-cellmediated adaptive immune responses by a naturally occurring steroidal lactoneWithaferin A[J].ToxicolAppl Pharmacol,2015,289(2):297-312.
[26]Ranson NT,Danis RP,Ciulla TA,et al.Intravitreal triamcinolone in subfoveal recurrence of choroidal neovascularisation after laser treatment in macular degeneration[J].Br J Ophthalmol,2002,86(5):527-529.
[27]Hara R,Inomata Y,KawajiT,etal.Suppression of choroidalneovascularization by N-acetyl-cysteine inmice[J].Curr Eye Res,2010,35(11):1012-1020.
Effectsof Triam cinoloneAcetonide on ChoroidalNeovascularization in Brown Norway Rats
GAO Xiɑo-yɑn,HEShou-zhi
1.Department of Ophthalmology,North China University of Technology Community Health Service Center,Beijing 100144,China;2.Departmentof Ophthalmology,General Hospital of PLA,PLA Eye Center,Beijing 100853,China
Correspondence to GAO Xiɑo-yɑn.E-mail:gaoxy76@sina.com
Objective To observe the effect of intravitreal triamcinolone acetonide injection on choroidal neovascularization in brown Norway rats. Methods Thirty-six healthy brown Norway ratswere divided random ly into controlgroup(n=18)and experimental group(n= 18),while one eyewas chosen random ly asexperimentaleye.The choroidalneovascularizationmodelwasestablishied,while 8μl triamcinolone acetonidewas injected in vitreous body immediately after photocoagulation in the experimental group,and the same volume isotonic balanced salt solution was injected in the controlgroup.The eyes of six ratswere enucleated for histological slices in the second,forth,and sixth week,respectively.The expression of nuclear factor-kappa B was detected with immunohistochem icalmethod,and themax area of choroidalneovascularization was alsomeasured.Results The area of choroidalneovascularization was smaller,and the expression of nuclear factor-kappa B was lower in the experimental group than in the control group(t>7.450,P<0.001).Conclusion Triamcinolone acetonide could effectively inhibit the development of choroidal neovascularization,and decrease the expression of nuclear factor-kappa B in brown Norway rats.
triamcinolone acetonide;nuclear factor-kappa B;choroidalneovascularization;brown Norway rats
10.3969/j.issn.1006-9771.2016.10.009
R773.4
A
1006-9771(2016)10-1154-05
1.北方工业大学社区卫生服务中心眼科,北京市100144;2.中国人民解放军总医院眼科,全军眼科中心,北京市100853。作者简介:高小燕(1976-),女,山东青岛市人,汉族,博士,副主任医师,主要研究方向:眼底病。E-mail:gaoxy76@sina.com。
(2016-04-22
2016-06-03)
