阵列纸芯片比色法检测碱性磷酸酶
2016-11-19陈熙陈锦张慧妍汪付兵王方方吉邢虎何治柯
陈熙 陈锦 张慧妍 汪付兵 王方方 吉邢虎 何治柯

摘 要 采用5溴4氯3吲哚磷酸盐(BCIP)/氯化硝基四氮唑蓝(NBT)显色体系,构建了阵列纸芯片比色检测碱性磷酸酶(ALP)的方法。首先,借助烘干处理方式在光刻法制备的阵列纸芯片微孔中固定显色试剂,然后加入ALP进行显色反应,最后,采用凝胶成像仪和普通照相机成像,读取显色强度(灰度值)进行比色检测。详细考察了显色条件对检测结果的影响,探讨了人血清白蛋白对ALP检测的增色效应,在最佳实验条件下,ALP检测的线性范围为1.5~20 U/L,检出限(3
SymbolsA@ )为0.78 U/L(n=18),比文献报道中纸芯片上检测ALP方法的检出限低约两个数量级。本方法成功用于实际血清样品检测,测定结果与临床值一致。在此基础上,构建了双色阵列纸芯片,通过颜色的变化实现了ALP的可视化半定量检测。
关键词 阵列纸芯片;比色法;碱性磷酸酶
1 引 言
碱性磷酸酶(Alkaline phosphatase, ALP)是一种水解酶,可催化水解底物分子中的磷酸单酯,广泛存在于细菌、真菌及动物中[1]。血清中ALP水平是诊断肝癌、肝硬化、慢性肝炎等肝类疾病的指标,也是原发性肝癌的肿瘤标志物之一[2,3]。ALP也是酶联免疫吸附分析中常用的一种标记酶[4]。因此,建立一种快速、方便、廉价的碱性磷酸酶检测器件,具有重要的理论意义和实际应用价值。常规的ALP检测方法包括显色法[5]、电化学法[6]、荧光法[7]、化学发光法[8]、表面增强拉曼光谱法[9]等。电化学法快速准确,但是难以用于复杂样品的分析,且需要外加电源;荧光法检测装置复杂,需要滤光片及外加光源等;化学发光检测线性范围宽,但缺乏稳定性;而使用拉曼光谱法需要专门的仪器,价格昂贵。
纸芯片是近年来备受关注的一种具有广阔应用前景的微流控分析器件,具有价格低廉、可便携式、生物相容性好、高通量、简单快速、试剂消耗量小等优点[10~13]。随着纸芯片制作方法的不断完善,基于纸芯片的分析检测方法也得到了不断发展[14~18]。其中,显色法直观、快速、稳定,不需要附加光源、电能等复杂仪器设备,研究报道数量最多。
目前,基于纸芯片的ALP显色检测方法也有相关报道。Li等[19]借助BCIP(5溴4氯3吲哚基磷酸盐)/NBT(氯化硝基四氮唑蓝)显色体系开展了纸芯片上显色法检测ALP的可行性研究。Cheng等[20]基于ALP显色体系,构建了纸芯片ELISA检测新方法,实现了IgG和HIV1病原蛋白的分析检测。 Vella等[21]将纸芯片用于肝脏疾病指示物的分析检测,借助纸芯片中滤膜的分离功能,实现了全血中天冬氨酸转氨酶、ALP以及总血清蛋白的分析检测。ALP的检出限为15 U/L,检测灵敏度有待进一步提高。
本研究基于阵列纸芯片比色法检测ALP,通过优化显色反应条件,借助烘干处理方法降低背景信号以及人血清白蛋白增色效应等方式,提高了检测灵敏度。该方法用于实际血清样品的检测,检测结果与临床结果相一致。此外,借助双色阵列纸芯片开展了ALP可视化半定量分析检测研究。
2 实验部分
2.1 仪器与试剂
G17光刻机(成都鑫南光机械设备有限公司),PDCM等离子体清洗器(成都铭恒科技发展有限公司),KQ2200超声波清洗器(昆山市超声仪器有限公司),PB10酸度计(Sartorius),KW4H350烤胶机(上海凯美特功能陶瓷技术有限公司),HZQF160立式全温振荡培养箱(上海一恒科学仪器有限公司),凝胶成像系统(CHEMIDOC XRS,BIORAD),COOLPIX 5400尼康相机,MilliQ Advantage A10超纯水系统(美国Millipore公司)。
牛小肠碱性磷酸酶(ALP,TaKaRa生物科技有限公司),5溴4氯3吲哚磷酸盐(BCIP,TCI化成工业发展有限公司),氯化硝基四氮唑蓝(NBT,北京经科宏达公司),氯化镁、氯化钠和Tris购自Sigma公司。人血清白蛋白(HSA,Biosharp公司),牛血清白蛋白(BSA,Roche文瀚科技),葡萄糖氧化酶(GOD,Amresco公司),辣根过氧化物酶(HRP,武汉博士德生物工程有限公司),胰蛋白酶和溶菌酶(Amresco公司),木瓜蛋白酶(昆明杰辉生物技术有限公司),SU8 2010光刻胶(MicroChem Corp.),TX609滤纸(深圳市庆高实业有限公司)。新鲜人血清由中南医院提供。实验用水为超纯水(18.0 MΩ·cm,25℃)。
2.2 实验方法
采用光刻法[22,23]在滤纸上制作一维阵列式纸芯片,阵列微孔分布为3 × 9,共27个微孔,孔径为2.5 mm。首先配制显色储备液,将2 μL储备液预先滴加于微孔中,放于37℃培养箱中烘干约10 min,然后加入ALP标准溶液进行显色反应,采用凝胶成像仪和普通照相机成像,以显色强度(灰度值)进行比色检测。所配制的BCIP/NBT显色液应放于4℃冰箱避光保存,并且现配现用。显色液的迅速烘干可减少吲哚中间物与空气的接触时间,从而大大降低背景信号。
3 结果与讨论
3.1 检测原理
5溴4氯3吲哚基磷酸盐(BCIP)被碱性磷酸酶水解后生成还原性强的吲哚中间体,NBT作为显色指示剂,能够与吲哚中间体反应生成深蓝紫色的不溶性甲臜。该显色反应用于碱性磷酸酶显色检测时颜色几乎由无色变为深蓝色甚至黑色,显色快速,操作简单,是生物分析检测常用的显色反应体系[24]。基于纸芯片的比色检测法由于纸芯片的富集和浓缩,显色更为明显、快速,有利于增强体系的显色信号。
3.2 反应条件对显色强度的影响
3.2.1 缓冲液pH值对显色强度的影响 碱性磷酸酶是一种碱性酶,其适合的反应条件是碱性条件。在实验过程中,用0.1 mol/L不同pH值的TrisHCl缓冲液配制显色液以及标准溶液。实验结果表明,缓冲溶液的pH值从8.0增加到9.5时,显色强度逐渐增强;而当pH>9.5继续增大时,显色强度降低。该体系最佳反应pH=9.5。在后续的实验中,使用0.1 mol/L TrisHCl缓冲液(pH 9.5)配制所有溶液。
3.2.2 BCIP/NBT对显色强度的影响 BCIP/NBT是一组常用的碱性磷酸酶显色剂。BCIP是碱性磷酸酶的水解底物,其浓度大小对酶促反应有影响。当BCIP的浓度非常低时,酶分子没有被底物饱和,反应速率与BCIP的浓度相关,为一级反应;当BCIP的浓度达到一定水平使酶分子饱和时,反应速率与底物浓度无关,为零级反应。但是当底物的浓度过高时,过量的底物会抑制酶的活性。实验结果表明,当BCIP浓度由1.0 mmol/L增大到4.0 mmol/L时,显色强度变大;而浓度继续增加时,显色反而变浅。当浓度为3~4 mmol/L时,显色强度达到最大,在后续的实验中,BCIP的浓度确定为3 mmol/L。NBT是一种蓝色染料,参与显色反应,能与吲哚基中间体反应生成深蓝紫色的沉淀。实验结果表明,BCIP/NBT的比值对于显色强度有影响。随着BCIP/NBT比值从1.5增大到4.5,显色强度变大;当BCIP/NBT比值在4.5~7.5之间时,显色强度达到最大值;而当BCIP/NBT比值从7.5增大到9.0时,显色逐渐减弱。因此,显色体系最佳BCIP/NBT比例选择5.0。
3.2.3 金属离子对显色强度的影响 研究表明,某些金属离子可以影响ALP的催化活性。Mg2+是碱性磷酸酶的一种激活剂,能提高碱性磷酸酶的催化活性,增强显色结果。实验结果表明,Mg2+浓度在2~7 mmol/L时, 显色强度基本保持不变;Mg2+浓度达到8 mmol/L时,显色强度开始下降。后续实验中Mg2+使用浓度为6 mmol/L。Zn2+对ALP显色反应也具有一定增强作用,实验中选择Zn2+浓度为16 μmol/L。显色反应通常加入NaCl保持离子强度以改善显色结果。实验结果表明,当NaCl浓度为0.1 mol/L时,显色强度最佳。
3.2.4 反应时间对显色强度的影响 显色反应过程中,显色强度随反应时间而变化。考察显色反应5~70 min,实验结果表明,显色强度在30 min时达到最大值,颜色最深。显色时间选择30 min。
3.2.5 反应温度对显色强度的影响 温度是影响酶活性的一个重要因素,不同的酶都有其活性的最适温度。考察温度对碱性磷酸酶显色反应的影响,结果表明,在15~25℃范围内,酶的活性随着温度的升高而升高;当温度达到30℃以上时,放于培养箱中的纸芯片上的反应溶液在未达到足够反应时间前,就已经完全干燥,无法进行反应。因此,显色反应温度设定为25℃。
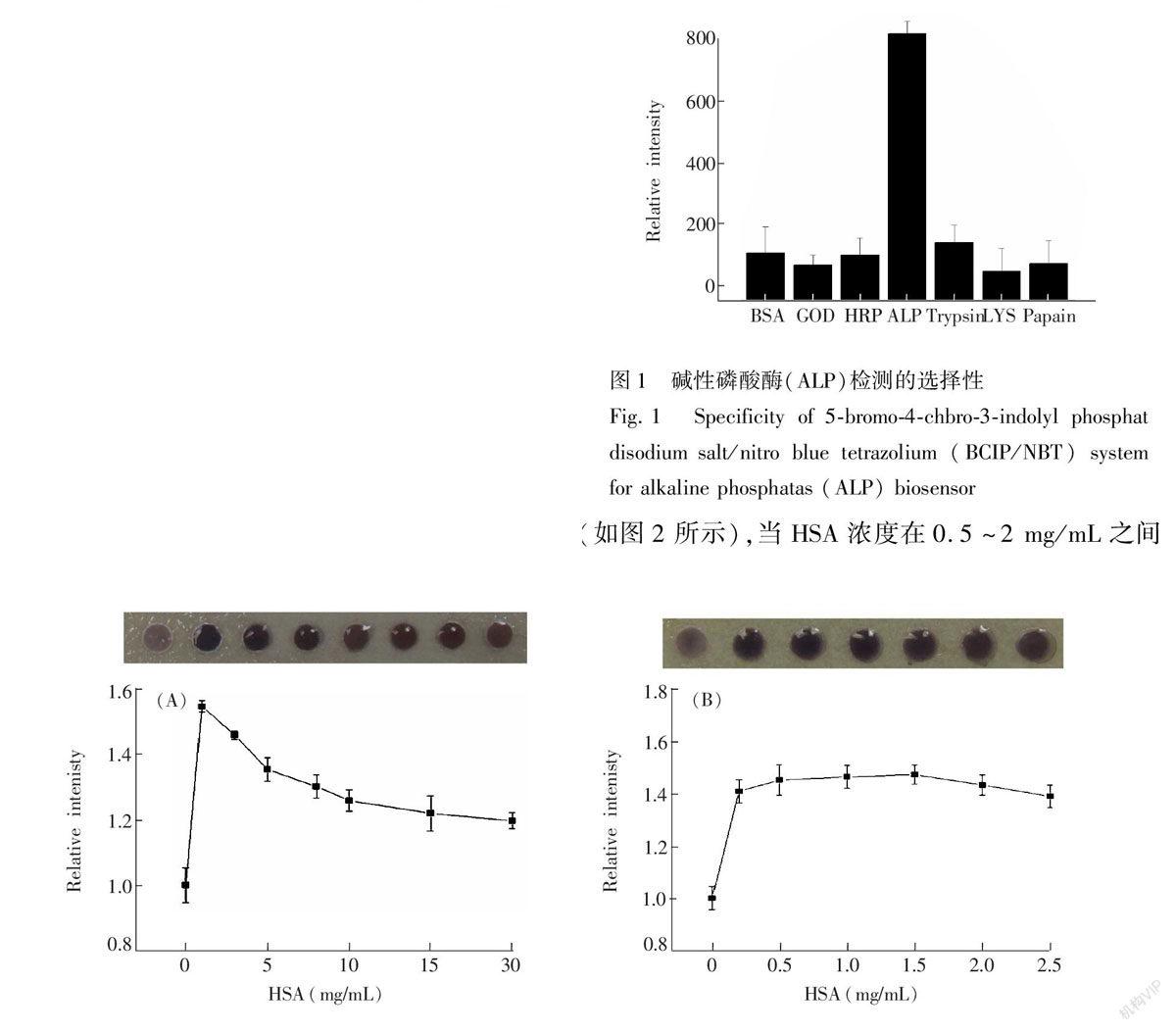
3.2.6 碱性磷酸酶检测的选择性
实验借助酶促反应显色,利用了酶催化特异性、专一性的优点,
图1 碱性磷酸酶(ALP)检测的选择性
Fig.1 Specificity of 5bromo4chbro3indolyl phosphat disodium salt/nitro blue tetrazolium (BCIP/NBT) system for alkaline phosphatas (ALP) biosensor保证了显色检测的选择性和特异性。本实验采用BSA、葡萄糖氧化酶(GOD)、辣根过氧化物酶(HRP)、胰蛋白酶(Trypsin)、溶菌酶(Lysozyme)、木瓜蛋白酶(Papain)6种酶/蛋白进行选择性验证,实验结果如图1所示,碱性磷酸酶的显色远远高于其它酶/蛋白,结果表明,利用BCIP作为显色底物的检测体系具有良好的选择性。
3.2.7 血清HSA对显色强度的影响 血清中含有大量的白蛋白,其中人血清白蛋白(HSA)的存在对检测体系干扰很大,因此,在对实际样品进行检测之前,需考察HSA对检测体系的影响。研究发现,HSA对显色反应有增强作用。实验结果表明(如图2所示),当HSA浓度在0.5~2 mg/mL之间变化时,对于显色的增强效果较好。
图2 人血清白蛋白(HSA)对ALP显色反应的影响结果:(A)HSA浓度分别为1, 3, 5, 8, 10, 15和20 mg/mL;(B)HSA浓度分别为0.2, 0.5, 1.0, 1.5, 2.0, 2.5 mg/mL。
Fig.2 Influence of HSA on intensity for ALP detection. (A) Curve and photographs of ALP detection (30 U/L) in the presence of 1, 3, 5, 8, 10, 15 and 20 mg/mL HSA (high concentration). (B) Curve and photographs of ALP detection (30 U/L) in the presence of 0.2, 0.5, 1.0, 1.5, 2.0, and 2.5 mg/mL HSA (low concentration).
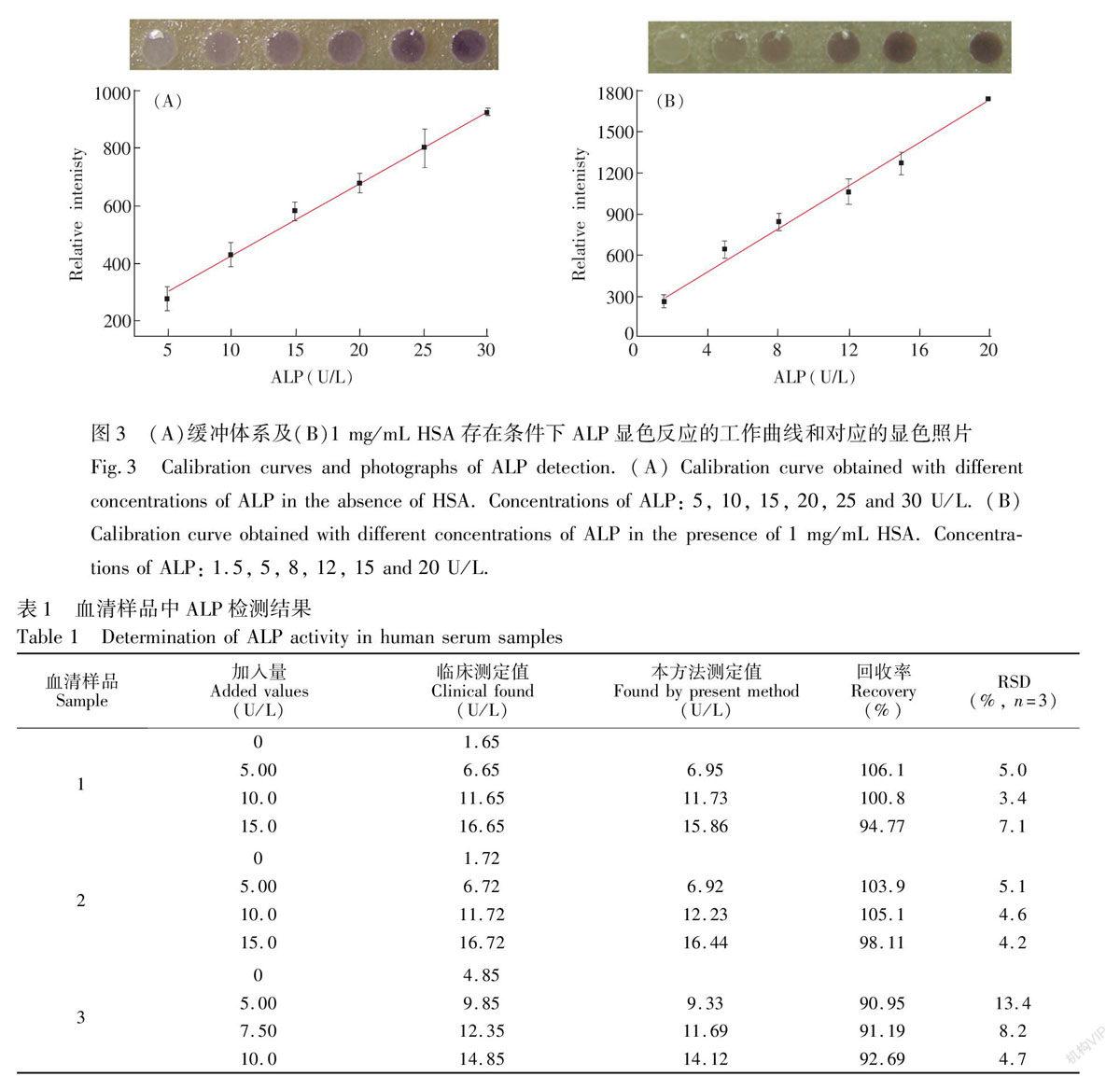
3.3 ALP检测的线性范围和检出限
在最佳实验条件下,比较了缓冲体系及HSA存在条件下的ALP检测的线性范围和检出限,结果如图3所示。缓冲体系中(图3A),ALP检测的线性范围5~30 U/L,回归方程为y=176.59+25x, y为显色强度,x为ALP浓度, R2=0.996(n=3),检出限(3
SymbolsA@ )为2.43 U/L(n=18)。在含有1 mg/mL HSA的条件下(图3B),其线性范围为1.5~20 U/L,回归方程为y=173.99+78.15x, R2=0.997(n=3),检出限(3
SymbolsA@ )为0.78 U/L (n=18)。
3.4 血清中ALP的检测
碱性磷酸酶在正常成年男性血清中的含量为55~125 U/L,而在成年女性血清中的正常值范围为40~100 U/L。血清中HSA的含量约为40~60 mg/mL,在实际样品的检测中,利用其本身已有的HSA对显色进行增色。样品处理方法是将血清稀释40~100倍使HSA浓度在0.5~1.5 mg/mL之间,同时减弱了血清本身颜色的干扰,然后进行加标检测。血清样品从中南医院获得,检测结果如表1所示,本方法检测值与中南医院临床检测参考值具有较好的一致性。
3.5 阵列纸芯片可视化半定量检测ALP
发展方便、快捷、直观的检测方法,尤其是不借助仪器设备的可视化检测方法,对于ALP的检测具有重要的实际意义。由于裸眼对同一种颜色深浅变化的分辨能力远远弱于对于不同颜色之间的识别力,因此加入一种背景色,可使得检测结果更容易被裸眼识别。基于这一原理,在阵列纸芯片中添加背景色,与BCIP/ NBT体系的深蓝紫色混合来指示ALP的浓度,检测结果如图4所示。
与比色检测结果相比,增加背景色后可视化检测结果更直观,当ALP的浓度超过30 U/L时,呈现明显的紫黑色,通过颜色的变化可半定量判断ALP的浓度范围。
4 结 论
本研究构建了阵列纸芯片比色检测法,成功用于碱性磷酸酶的分析检测。通过优化5溴4氯3吲哚磷酸盐(BCIP)/氯化硝基四氮唑蓝(NBT)显色体系的反应条件,借助人血清白蛋白(HSA)的增色效应,提高了碱性磷酸酶的检测灵敏度,达到0.78 U/L,比文献报道中纸芯片上检测碱性磷酸酶的检出限约低两个数量级。本方法用于实际血清样品加标检测,结果比较理想。在此基础上,构建了双色阵列纸芯片,通过颜色的变化实现了碱性磷酸酶的可视化半定量检测。纸芯片比色检测方法简便、结果直观、灵敏度高,为疾病相关指标的检测提供了一种廉价的技术平台,尤其是不借助仪器设备的可视化检测方法的发展,将有利于该技术平台在实际分析中的应用。
References
1 Fernandez N J, Kidney B A. Vet. Clin. Pathol., 2007, 36: 223-233
2 Jia L, Xu J P, Li D, Pang S P, Fang Y, Song Z G, Ji J. Chem. Commun., 2010, 46: 7166-7168
3 Ooi K, Shiraki K, Morishita Y, Nobori T. J. Clin. Lab. Anal., 2007, 21: 133-139
4 Hou F, Zhang Q, Yang J, Li X, Yang X, Wang S, Cheng Z. Biomed. Microdevices, 2012, 14: 729-737
5 Wei H, Chen C, Han B, Wang E. Anal. Chem., 2008, 80: 7051-7055
6 Gyurcsanyi R E, Bereczki A, Nagy G, Neuman M R, Lindner E. Analyst, 2002, 127: 235-240
7 Kim T, Kim H, Choi Y, Kim Y. Chem. Commun., 2011, 47: 9825-9827
8 Hallaway B J, O'Kane D J. Method. Enzymol., 2000, 305: 391-401
9 Ruan C, Wang W, Gu B. Anal. Chem., 2006, 78: 3379-3384
10 Li X, Tian J F, Shen W. Cellulose, 2010, 17: 649-659
11 Martinez A W, Phillips S T, Whitesides G M, Carrilho E. Anal. Chem., 2010, 82: 3-10
12 He Y, Wu Y, Fu J Z, Wu W B. RSC Adv., 2015, 5, 78109-78127
13 Xia Y Y, Si J, Li Z Y. Biosens. Bioelectron., 2016, 77: 774-789
14 Carrilho E, Martinez A W, Whitesides G M. Anal. Chem., 2009, 81: 7091-7095
15 Lu Y, Shi W W, Qin J H, Lin B C. Anal. Chem., 2010, 82: 329-335
16 Wang S M, Ge L, Song X R, Yan M, Ge S G, Yu J H, Zeng F. Analyst, 2012, 137: 3821-3827
17 Kao P K, Hsu C C. Anal. Chem., 2014, 86: 8757-8762
18 Jiang Y, Hao Z X, He Q H, Chen H W. RSC Adv., 2016, 6: 2888-2894
19 Li X, Tian J F, Nguyen T, Shen W. Anal. Chem., 2008, 80: 9131-9134
20 Cheng C M, Martinez A W, Gong J L, Mace C R, Phillips S T, Carrilho E, Mirica K A, Whitesides G M. Angew. Chem. Int. Ed., 2010, 49: 4771-4774
21 Vella S J, Beattie P, Cademartiri R, Laromaine A, Martinez A W, Phillips S T, Mirica K A, Whitesides G M. Anal. Chem., 2012, 84: 2883-2891
22 Chen X, Chen J, Wang F, Xiang X, Luo M, Ji X, He Z. Biosens. Bioelectron., 2012, 35: 363-368
23 ZHANG HuiYan, ZHANG Zhen, JI XingHu, HE ZhiKe. Chinese J. Anal. Chem., 2014, 42(9): 1276-1280
张慧妍, 张 珍, 吉邢虎, 何治柯. 分析化学, 2014, 42(9): 1276-1280
24 FanjulBolado P, HernandezSantos D, GonzalezGarcia M B, CostaGarcia A. Anal. Chem., 2007, 79: 5272-5277
Colorimetic Detection of Alkaline Phosphatase on Microfluidic
Paperbased Analysis Devices
CHEN Xi1, CHEN Jin1, ZHANG HuiYan1, WANG FuBing2, WANG FangFang1, JI XingHu*1, HE ZhiKe1
1(Key Laboratory of Analytical Chemistry for Biology and Medicine, Ministry of Education,
College of Chemistry and Molecular Sciences, Wuhan University, Wuhan 430072, China)
2(Department of Laboratory Medicine, Zhongnan Hospital of Wuhan University, Wuhan 430071, China)
Abstract A lowcost, simple and sensitive colorimetric detection method of alkaline phosphatase (ALP) has been developed on microfluidic paperbased analysis devices. In a typical colorimetric detection, 5bromo4chloro3indolyl phosphate disodium salt (BCIP) and nitro blue tetrazolium (NBT) were firstly added onto the circle array zones of paper devices. Then ALP solutions were spotted to the array zones to perform the colorimetric reaction. The color results were recorded by both Gel Documentation systems and a common camera, and analyzed with Quantity One software. All the reaction conditions were aptimized. Under the optimal conditions, the colorimetric intensity showed a linear correlation to the concentration of ALP in the range of 1.5 to 20 U/L with the limit of detection (LOD) of 0.78 U/L(3σ), which was about two orders of magnitude lower than that of the reported method on μPADs. Besides, it could be applied in spiked real sample analysis with a satisfactory result. In addition, a dualcolor arraybased paper strip has been fabricated for the semiquantitative detection of ALP. The approximate activity of ALP could be simply distinguished by observing the color change with naked eyes.
Keywords Microfluidic paperbased analysis devices; Colorimetric detection; Alkaline phosphatase
(Received 25 February 2016; accepted 7 March 2015)
This work was supported by the National Natural Science Foundation of China (No. 21205089) and the Specialized Research Fund for the Doctoral Program of Higher Education of China (No. 20120141120036).
