小白菜自交不亲和性相关基因的分子标记开发
2016-11-19贾永鹏李霞周国林等
贾永鹏 李霞 周国林等
摘要:以自交亲和系WS-199和自交不亲和系WS-85为亲本杂交获得的F2分离群体为供试材料,采用BSA法结合SNP芯片技术,筛选出与自交不亲和性相关的SNP标记,并将SNP差异位点序列信息与白菜基因组序列进行比对分析,并进一步开发SSR标记,共获得了与自交不亲和性相关的SSR分子标记BrA1-2、BrA1-3和BrA1-14,为分子标记辅助自交不亲和性杂交种生产提供技术支持。
关键词:小白菜;自交不亲和性;SNP;分子标记
中图分类号:S634.3 文献标识码:A 文章编号:1001-3547(2016)08-0038-04
小白菜(Brassiea eampestris ssp.chinensis Makino)又称不结球白菜,营养价值丰富,生长期短,在适宜环境条件下可进行周年种植,为我国长江中下游及南方地区种植的重要蔬菜种类之一。小白菜的自交不亲和现象十分普遍,利用自交不亲和系生产F1代杂交种成为小白菜杂种育种的重要方法之一。但是,由于自交不亲和的表型容易受到环境条件和植株生理状况的影响,导致植株的亲和性难以判断,致使在配置杂交组合和种子生产时,费时费力,准确性差。利用分子标记辅助选择,可以大大提高育种的效率。
小白菜自交不亲和性主要由s位点复等位基因控制。当雄蕊花粉粒携带的s等位基因与雌蕊的基因相同时,花粉管生长受到抑制,表现出自交不亲和;当花粉粒携带的s等位基因与雌蕊的基因不相同时,花粉管正常生长,表现为自交亲和。在育种实践中,能够快速鉴定自交不亲和性的S单元型至关重要。随着分子生物学的发展,利用分子标记鉴定S单元型已成为目前主要的方法之一。前人做了很多研究,Nasrallah等利用SLG6的cDNA克隆作为探针,对多个不同S单元型的全基因组DNA进行RFLP分析,获得了多个与S单元型连锁的RFLPs标记,初步建立了一种利用DNA分子标记技术快速鉴定s单元型的方法,可以在苗期鉴定材料的S单元型,比田间更加可靠;Nishio等利用PCR-RFLP对10个白菜和10个甘蓝材料的SLG基因多态性进行了分析,发现这种方法可以在十字花科的蔬菜中鉴定S单元型以及F1杂种的纯度。寇小培以甘蓝型油菜为材料,利用与自交不亲和基因连锁的分子标记辅助选育油菜自交不亲和系,最终得到了改良的甘蓝型油菜自交不亲和系。因此,分子标记在自交不亲和性中的利用越来越重要,而开发新的自交不亲和性标记成为当前的重点。
本研究以自交亲和系WS-199和自交不亲和系WS-85为亲本构建的F2分离群体为材料,采用BSA法和油菜60K SNP芯片杂交技术,对小白菜自交不亲和性相关基因的分子标记进行设计与开发,为后续利用自交不亲和性进行分子标记辅助育种提供可靠的理论依据与技术支持。
1材料与方法
1.1试验材料
供试材料为自交亲和系WS-199和自交不亲和系WS-85(由武汉市蔬菜科学研究所栽培与采后室提供)为亲本构建的F2分离群体。于2014年9月底,将F2群体种子播于大田,2015年1月将幼苗移栽到大棚中(武汉市黄陂区武湖基地),2015年3月进行套袋自交。所有材料依照田间常规方法进行种植和管理。
1.2试验方法
①F2群体亲和性调查、DNA的提取及BSA混池构建 a.F2群体亲和性调查。在2015年3月对F2群体中的开花植株进行套袋自交,调查植株的角果生长和膨大情况,以及植株的结实情况,最终判断植株的亲和性。
b.DNA提取。选取苗期的小白菜鲜嫩叶片,采用改良CTAB法提取DNA。用UV-1800 PC紫外分光光度计(上海谱达仪器有限公司)测定DNA浓度,用0.8%琼脂糖凝胶电泳检测DNA质量,取部分原液稀释到50 ng/mL作模板,其他放于-20℃保存备用。
c.BSA混池构建。从群体中选取性状明显的亲和系植株和不亲和系植株各17株,采用DNAsecure Plant Kit新型植物基因组DNA提取试剂盒(天根生化科技(北京)有限公司,产品编号DP320)提取DNA,且DNA样品保存在-80℃。利用组群分离分析法(BSA)构建不亲和池与亲和池,对DNA进行等量混合,构成4个不亲和基因池与4个亲和基因池,用于芯片分析及后续引物筛选。
②SNP芯片设计采用油菜60K SNP芯片进行杂交。a.DNA定量、扩增。放在0.1 mol/L NaOH中变性,加入MA2和MSM,放在37℃杂交炉中扩增20~24 h。
b.DNA片段化。加入FMS,在37℃干浴锅1 h。
c.DNA富集。加入155μL异丙醇,在4℃冰箱中放置30 min,倒出液体,室温下干燥1 h。
d.DNA片段回收。加入RA1,用银箔纸封口,在48℃杂交锅中培养1 h。
e.DNA变性。在干浴锅于95℃下变性20 min。
EDNA与芯片杂交。准备杂交盒,在芯片的每个样品孔点样12 μL,放在48℃杂交炉中16~24 h,转速调至5档。
g.洗芯片与染色。
h.芯片扫描。采用BeadArray Reader激光共聚焦扫描系统,并进行数据分析。
③SSR引物设计及筛选通过芯片数据分析处理,将获得的差异序列和白菜基因组进行Blast对比分析,选取同源序列相似度高的基因序列区段,进行下一步SSR引物的开发,并提交到http:∥wsmartins.net/websat/数据库。SSR引物由上海生工工程公司(武汉)合成。
PCR反应体系:DNA模板1 μL,引物1μL,10xPCR Buffer 1μL,dNTPs 0.2 μL,Mg2+0.8 μL,Taq聚合酶0.2μL,用ddH20补充至10 μL。PCR扩增反应程序:94℃3 min;94℃ 30 s,55~56℃ 30 s,72℃30 s,35个循环;72℃ 10 min;25℃ 30 min。将扩增产物采用6%聚丙烯酰胺凝胶(PAGE)电泳检测,在电压200 V下70~80 min后,进行银染和显影,用清水冲洗干净。在室温下自然晾干,统计扩增条带,并拍照保存。
2结果与分析
2.1 SNP芯片分析
对不同混池间芯片分析后,将SNP数据经Genome Studio软件进行基因分型处理,通过不亲和与亲和数据之间的比较分析,共获得100个差异位点,然后从芯片对应数据库中下载这100个差异位点序列,将下载的100个差异位点序列和白菜基因组进行对比,选取同源序列相似度大于98%的位点数据。分析表明,这些位点主要集中分布在白菜基因组的第1连锁群(2517 659~24 006 839)和第10连锁群(8 961 370-16 442 481)。
2.2 SSR分子标记开发
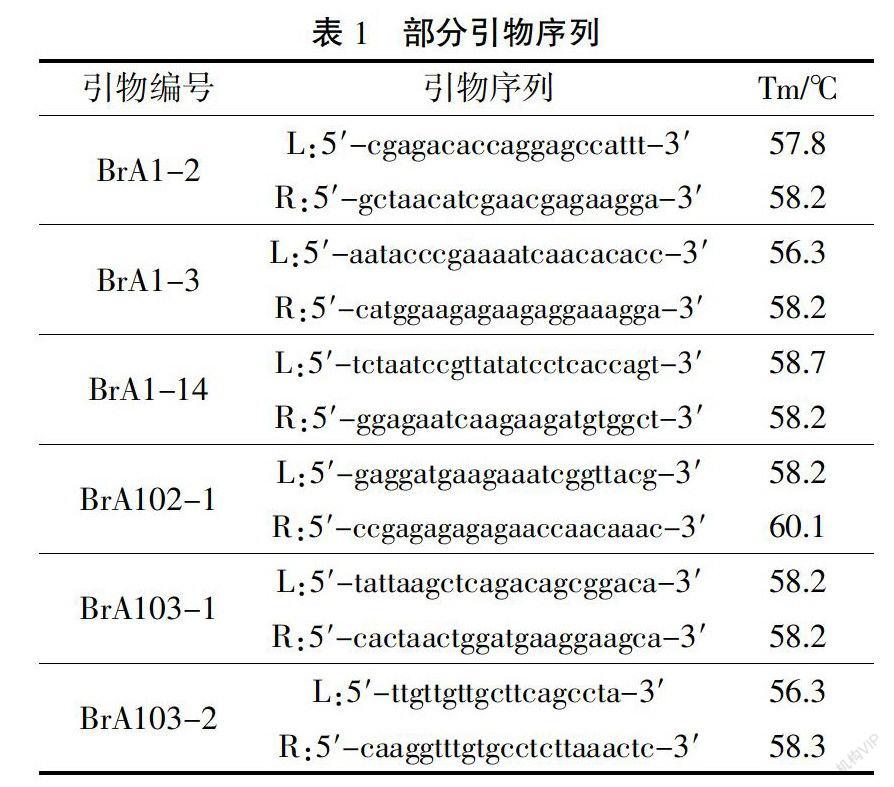
针对第1和第10连锁群上包含的差异碱基序列区段,在线设计SSR引物32对,部分引物序列如表1。将32对引物在亲和池与不亲和池中进行DNA扩增,共有3对引物BrA1-2、BrA1-3和BrA1-14在混合池中表现出多态性(图1)。
2.3群体单株验证
利用引物BrA1-2对F2群体中的亲和单株进行验证。结果表明,90株亲和单株中仅有2个交换单株,遗传距离约2.2 cM(图2)。
3讨论与结论
Batemant4]首次提出了关于自交不亲和性受单位点复等位基因控制的遗传模式,为自交不亲和性研究奠定了重要基础。在s复等位基因位点上包含有S位点特异性糖蛋白SLG、S位点受体激酶SRK、S位点富含半胱氨酸蛋白SCR和SP11。当花粉中的SCR或SP11与柱头中的SRK、SLG相互识别,引发了自交不亲和反应。葛婷婷㈣利用不结球白菜(矮脚黄)002和210为亲本,构建了F2分离群体,开发到了一个与自交不亲和基因连锁的分子标记BrSS15。Katsunori等利用Kal-22(Brasscia rapa substx rapa)和Hal-400(B.rapa substp.pekinensis)构建了F2群体,通过对群体进行2 a的自交不亲和性调查和统计,结合884对SSR标记和55对SNP与indel标记进行了自交不亲和性的QTL分析,定位到了5个高度不亲和性QTL位点BrHLSI-1、BrHLSI-2、BrHLSI-3、BrHLSI-4和BrHLSI-5,它们分别分布在白菜第7、3、2、10、6连锁群上,而BrPUB8在第1连锁群。BrPUB8是PUB8的同源基因,而PUB8可能是调控假性自花授粉植物自交不亲和性的关键基因。
随着全基因组序列鉴定技术的快速发展,SNP标记作为最新分子标记类型,具有密度高、分布范围广、分型简单等优点,在分子遗传研究中逐渐兴起,已成功应用在油菜QTL定位和全基因组关联分析的研究当中。而在白菜研究上,目前,利用油菜60K SNP芯片技术开发标记非常少见。由于进行传统的杂交测试(亲和指数法)时,植株结实会受到外界环境的影响,因此亲和性难以判断,耗费较长的时间和较多的人力。本研究将BSA分析法和SNP芯片技术结合起来,对小白菜中普遍存在的自交不亲和现象进行快速标记开发,并能较快应用于自交不亲和基因类型的鉴定,加快育种的进程,为白菜杂交组合的配置和实现传统育种与分子育种的结合提供参考。
