含1,3,4-噻二唑基团的Mannich碱的合成与抑菌活性的研究*
2016-11-19郑广进张翠忠曾振芳
郑广进,张翠忠,曾振芳
(广西民族师范学院,广西高校桂西南特色植物资源化学重点实验室培育基地,广西 崇左 532200)
含1,3,4-噻二唑基团的Mannich碱的合成与抑菌活性的研究*
郑广进,张翠忠,曾振芳
(广西民族师范学院,广西高校桂西南特色植物资源化学重点实验室培育基地,广西 崇左 532200)
以5-烷基-2-氨基-1,3,4-噻二唑、芳醛及β-萘酚为原料,在微波辐射下经Mannich反应合成了10种未见文献报道的含1,3,4-噻二唑基团的Mannich碱,其结构经IR和1H NMR确证。采用菌丝生长速率法测试了目标化合物的抑菌活性,初步抑菌活性测试结果表明,在50 mg/L的浓度下,所有目标化合物对5种供试植物病原菌均有不同程度的抑菌活性,其中化合物b对番茄细菌性斑点病菌的抑制率达80%以上。
1,3,4-噻二唑;Mannich碱;合成;抑菌活性
1,3,4-噻二唑衍生物具有抗菌[1-2]、抗病毒[3],除草[4]、调节植物生长[5]等生物活性,受到广大农药开发者的青睐,已商品化的含1,3,4-噻二唑基团的农药代表品种有除草剂氟噻草胺[6](Flufenacet),杀菌剂噻菌铜[7](Thiodiazole-copper)等。
Mannich碱类化合物也具有抗真菌[8]、抑菌[9]、除草[10]等多种生物活性。笔者根据活性基团亚结构拼接原理,将1,3,4-噻二唑基团引入Mannich碱结构单元中,设计并合成了10个未见文献报道的含1,3,4-噻二唑基团的Mannich碱(合成路线如图1所示)。采用红外光谱和核磁共振氢谱对其结构进行了确认,并对其抑菌活性进行了初步研究。
1 实 验
1. 1 仪器与试剂
KJ23B-AN美的微波炉,广东美的微波炉制造有限公司;SG-WRR目视熔点仪,上海申光仪器有限公司;Spectrum 65型傅里叶红外光谱仪,美国Perkin Elmer公司;BRUKER AVANCE 600M核磁共振波谱仪,瑞士Bruker 公司。
对照药剂为噻菌灵(triabendazole),纯度98.5%,北京颖泰嘉和科技股份有限公司生产;其他化学试剂均为国产分析纯。中间体5-烷基-2-氨基-1,3,4-噻二唑按文献[11]合成。
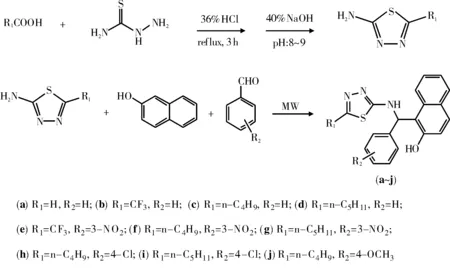
图1 目标产物的合成路线
1. 2 目标化合物的合成通法
在100 mL烧杯中依次加入5 mmol 5-烷基-2氨基-1,3,4-噻二唑、5 mmol β-萘酚和6 mmol芳醛,混匀,用表面皿盖上烧杯口,调节中火档位,间歇辐射8-10 min,冷却,加入适量95%乙醇将之溶解,边搅拌边滴加适量蒸馏水,待有大量固体析出后静置30 min,抽滤,水洗,80%乙醇重结晶即得目标化合物。
1.3 抑菌活性测试
以噻菌灵为阳性对照,采用菌丝生长速率法[12],测试了10个目标化合物在50 mg/L下对5种供试菌株的抑菌活性。抑菌活性的计算公式为:

(1)
2 结果与讨论
2.1 目标产物的结构表征
2.1.1 目标产物a
白色粉状固体,产率50%,熔点:199~200 ℃。
IR(KBr压片):3635(OH);3404(NH);3100(Ar-H); 2879(CH2);1625(C=N);1580,1516 (C=C)。
1H NMR(600 MHz, DMSO-d6/TMS):7.16~8.20 (m,2H,Ar-H),7.25~8.30(m,6H,Ar-H), 7.36(s,1H,CH),7.78~7.81(t,2H,Ar-H),7.95(s,1H,OH), 8.61 (s,1H, Ar-H), 8.63(s,1H,N=CH), 10.32 (s,1H,NH)。
2.1.2 目标产物b
白色粉状固体,产率54%,熔点:153~155 ℃。
IR(KBr压片):3632(OH);3417(NH);3145(Ar-H); 2981(CH2);1625(C=N);1600,1583 (C=C)。
1H NMR(600 MHz,DMSO-d6/TMS):7.15~8.20 (m,2H,Ar-H),7.26~8.31(m,6H,Ar-H),7.34 (s,1H,CH), 7.79~7.81(t,2H,Ar-H),7.98(s,1H,OH), 8.61 (s,1H, Ar-H), 10.28 (s,1H,NH)。
2.1.3 目标产物c
白色粉状固体,产率68%,熔点:149~151 ℃。
IR(KBr压片):3634(OH);3369(NH);3025(Ar-H);2955,2869(CH3);2928,2706(CH2);1626 (C=N);1580,1518 (C=C)。
1H NMR(600 MHz, DMSO-d6/TMS):0.87(t,3H, CH3),1.29~1.33(q,2H,CH2),1.56~1.59(t,2H, CH2),2.78~2.80(t,2H,CH2),7.19~7.29(m,3H, Ar-H),7.41~7.43(t,2H,Ar-H),7.54~7.65(m,2H,Ar-H),7.81~7.83(q,2H,Ar-H), 7.95(s,1H,OH),8.13(s,1H,CH),8.59~8.60(s,2H,Ar-H), 10.32 (s,1H,NH)。
2.1.4 目标产物d
白色粉状固体,产率70%,熔点:158~159 ℃。
IR(KBr压片):3640(OH);3392(NH);3238, 3023 (Ar-H);2985(CH3);1626(C=N);1599(C=C)。
1H NMR(600 MHz,DMSO-d6/TMS):0.85(t,3H,CH3),1.27~1.30(q,2H,CH2),1.56~1.58(t,2H,CH2),2.38~2.40(t,2H,CH2),2.80~2.81(t,2H,CH2),7.20~7.29(m,3H,Ar-H),7.53~7.65(m,3H,Ar-H),7.83~7.85 (q,2H,Ar-H), 7.81(s,1H,CH),8.15(s,1H,OH),8.60~8.64 (m,3H, Ar-H),10.30 (s,1H,NH)。
2.1.5 目标产物e
浅黄色粉状固体,产率55%,熔点:213~115 ℃。
IR(KBr压片):3630(OH);3395(NH);3242,3156 (Ar-H);2984(CH2);1603(C=N);1526 (C=C); 1348 (NO2)。
1H NMR(600 MHz, DMSO-d6/TMS):7.15~7.18 (m,2H,Ar-H),7.25~8.31(m,6H,Ar-H), 7.33(s,1H,CH), 7.68~7.72(t,2H,Ar-H),7.98(s,1H,OH),10.38(s,1H,NH)。
2.1.6 目标产物f
浅黄色粉状固体,产率66%,熔点:172~174 ℃。
IR(KBr压片):3632(OH);3408(NH);3059(Ar-H);2969,2869(CH3);2930(CH2);1625(C=N); 1529(C=C);1346 (NO2)。
1H NMR(600 MHz, DMSO-d6/TMS):7.15~7.18 (m,2H,Ar-H),7.25~8.31(m,6H,Ar-H), 7.33(s,1H,CH), 7.68~7.72(t,2H,Ar-H),7.98(s,1H,OH),10.38(s,1H,NH)。
2.1.7 目标产物g
浅黄色粉状固体,产率71%,熔点:216~218 ℃。
IR(KBr压片):3395(OH);3241(NH),3155,3025(Ar-H);2984(CH3);2811(CH2);1603(C=N); 1536(C=C),1348 (NO2)。
1H NMR(600 MHz, DMSO-d6/TMS):0.83(t,3H,CH3),1.27~1.30(q,2H,CH2),1.56~1.58(t, 2H,CH2),2.77~2.81(t,2H,CH2), 2.97~2.99(t,2H,CH2),7.20~8.08(m,10H,Ar-H), 8.19(s,1H,CH), 8.60(s,1H,OH),10.36(s,1H,NH)。
2.1.8 目标产物h
白色粉状固体,产率70%,熔点:119~120 ℃。
IR(KBr压片):3632(OH);3259(NH);3050(Ar-H); 2919(CH3);1630(C=N);1600,1584(C=C)。
1H NMR(600 MHz, DMSO-d6/TMS):0.85(t,3H,CH3)1.31~1.33(q,2H,CH2),1.54~1.57(t,2H,CH2),2.78~2.84(t,2H,CH2),7.18~8.06(m,10H,Ar-H),8.23(s,1H,CH),8.62(s,1H,OH), 10.28 (s,1H,NH)。
2.1.9 目标产物i
白色粉状固体,产率72%,熔点:203~205 ℃。
IR(KBr压片):3630(OH);3437(NH);3281,3190, 3079(Ar-H);1611(C=N);1600,1524(C=C); 1366(CH3)。
1H NMR(600 MHz, DMSO-d6/TMS):0.83(t,3H, CH3),1.23~1.26(q,2H,CH2),1.56~1.58(t,2H,CH2), 2.38~2.40(t,2H,CH2),2.84~2.87(t,2H,CH2),7.20~7.29(m,3H,Ar-H),7.53~7.65(m,3H,Ar-H),7.83~7.85(q,2H,Ar-H), 7.81(s,1H,CH),8.15(s,1H,OH),8.60~8.64 (m,2H, Ar-H),10.30 (s,1H,NH)。
2.1.10 目标产物j
白色粉状固体,产率77%,熔点:162~164 ℃。
IR(KBr压片):3404(OH);3289(NH);3150(Ar-H); 2971(CH3);2840(CH2);1606(C=N);1598, 1536(C=C)。
1H NMR(600 MHz, DMSO-d6/TMS):0.83(t,3H, CH3),1.23~1.26(q,2H,CH2),1.56~1.58(t,2H,CH2), 2.38~2.40(t,2H,CH2),3.78(s,3H,OCH3),6.94~6.96(m, 4H,Ar-H),7.72~7.74(m,4H,Ar-H),7.90~7.92(t,2H, Ar-H),8.00 (s, 1H,CH),8.10(s,1H,OH),11.30(s,1H,NH)。
2.2 抑菌活性
采用菌丝生长速率法测试了10个目标化合物在50 mg/L下对5种供试菌株的抑菌活性,结果见表1。
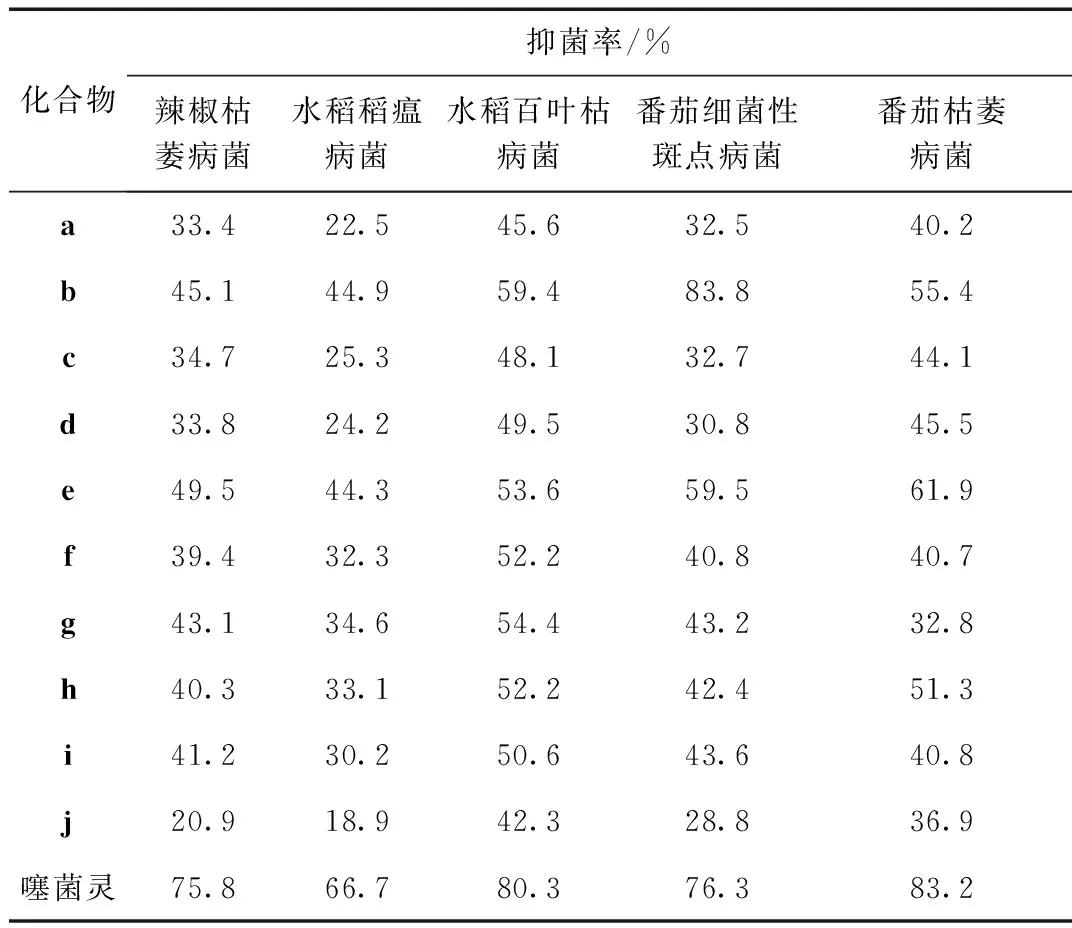
表1 目标化合物对5种植物病原真菌菌丝生长的抑制作用(50 mg/L,72 h)
结果表明,在50 mg/L的浓度下,所有目标化合物对5种供试植物病原菌均有不同程度的抑菌活性,其中化合物b对番茄细菌性斑点病菌的抑制率达80%以上。在芳环结构相同的情况下,比较噻二唑基团上不同取代基对活性的影响,发现b和e的活性比其他化合物的活性高,即噻二唑基团上5位连接吸电子基三氟甲基的化合物的抑菌活性高于连接给电子基的化合物活性;在噻二唑基团相同的情况下,化合物的抑菌活性随芳环结构的变化无明显规律。
3 结 论
本文采用微波辅助合成Mannich碱衍生物,该法简便快捷,反应过程无需额外的溶剂及催化剂,后处理简便,是一种绿色环保的方法。本文所合成的10个目标化合物在50 mg/L的浓度下对5种供试植物病原菌均有不同程度的抑菌活性,部分化合物的活性较高,可以进行进一步的结构优化以寻找具有开发潜力的化合物。
[1] 张奇龙,袁泽利,张云黔,等.新型含2,5-二-(3,5-二甲基吡唑-4-巯基)-1,3,4-噻二唑-M(M=Co2+,Cd2+,Mn2+) 配合物的合成、晶体结构及其抑菌活性研究[J].化学学报,2012(3):152-157.
[2] 杨旭,金淑惠,杨彩霞,等.2-(1,5-亚戊基)-5-取代亚氨基-Δ3-1,3,4-噻二唑啉的合成及杀菌活性[J].农药学学报,2004(1):22-25.[3] 付一峰,左翔,范志金,等.Ugi反应合成4-甲基-1,2,3-噻二唑化合物及其抗烟草花叶病毒活性(文)[J].农药学学报,2010(4):408-416.
[4] 孙召慧,黄伟,贡云芸,等.新型含1,3,4-噻二唑的硫脲化合物的合成及除草活性[J].有机化学学,2013,33(12):2612-2617.
[5] 宋新建,王胜,谭小红,等.N-[5-(4-三氟甲基苯基)-1,3,4-噻二唑-2-基]-N’-芳酰基脲的合成、结构及其生物活性[J].有机化学,2007(1):72-76.
[6] 姜育田,陈同明,李茂青.氟噻草胺的合成[J].农药,2007(11):734-736.[7] 吕旭健.新型杀菌剂噻菌铜的应用技术研究及推广[D].杭州:浙江大学,2009.
[8] 齐平,靳颖华,郭春,等.硫色满酮3位Mannich碱衍生物的合成及其抗真菌活性[J].中国药物化学杂志,2003(3):134-137.
[9] 赵明涛.含噻二唑Mannich碱的合成及抑菌活性研究[D].西安:陕西科技大学,2012.
[10]张成路,唐杰,殷立莹,等.一锅法合成3-取代-1-吗啉基-1,2,4-均三唑Mannich碱及其活性评价[J].有机化学,2016(2):358-363.[11]乐长高,丁健桦,杨思金.5-烷基-2-氨基-1,3,4-噻二唑的合成及应用[J].化学世界,2002(7):366-368.
[12]吴文君.植物化学保护实验技术导论[M].西安:陕西科学与技术出版社,1988:123-127.
Synthesis and Antifungal Activitiy of Mannich Base Containing 1,3,4-thiadiazole*
ZHENGGuang-jin,ZHANGCui-zhong,ZENGZhen-fang
(Guangxi Colleges and Universities Key Laboratory Breeding Base of Chemistry of Guangxi Southwest Plant Resources,Guangxi Normal University for Nationalities, Guangxi Chongzuo 532200, China)
Ten novel mannich bases containing 1,3,4-thiadiazole were synthesized using 5-alkyl-2-amine-1,3,4- thiadiazol, aromatic aldehyde and β-naphthol as raw material via mannich reaction under microwave irradiation. The structures of all compounds were confirmed by IR and1H NMR. The antifungal activitiys of the target compounds were tested by mycelium growth rate method, preliminary bioassay showed that all the synthesized compounds had different inhibition on five tested plant pathogenic fungi at the concentration of 50 mg/L, among them, the inhibition rate of b against Pseudomonas syingae pv. tomato was above 80%.
1,3,4-thiadiazol; mannich base; synthesis; antifungal activitiy
2013年度广西高校科学技术研究项目(2013YB271)。
郑广进(1982-),男,讲师,主要从事有机合成与抑菌活性研究。
O626.25
B
1001-9677(2016)020-0040-03
