鹿源大肠杆菌ESBLs基因型检测与分析
2016-11-18王晓菲刘伟石
冯 涛 王晓菲 刘伟石 薛 原
(东北林业大学野生动物资源学院,哈尔滨,150040)
鹿源大肠杆菌ESBLs基因型检测与分析
冯 涛 王晓菲 刘伟石 薛 原*
(东北林业大学野生动物资源学院,哈尔滨,150040)
ESBLs;
(College of Wildlife Resources,Northeast Forest University,Harbin ,150040,China)
超广谱β-内酰胺酶(ESBLs)是由质粒介导的能使细菌对三代头孢菌素类、单酰胺类及青霉素类耐药的一类酶,可在菌株间转移或传播。由于编码β-内酰胺酶的基因多数存在于细菌体内可转移的质粒上,使得耐药基因可以在细菌之间通过接合和转化等方式进行水平传播,导致耐药菌的广泛传播,严重影响了β-内酰胺类抗生素的治疗效果,成为兽医临床面临的严重问题[1]。ESBLs细菌携带的质粒可能带有对喹诺酮、氨基糖苷类和磺胺类等药物的多种耐药基因,使其具有多重耐药表型,严重影响临床治疗的效果。
ESBLs根据基因同源性的不同,目前可分为5类:TEM型、SHV型、CTX-M型、OXA型和其他类型等[2-3]。本研究旨在对东北地区临床分离的150株鹿源大肠杆菌进行ESBLs 产生情况及基因型检测,这将有助于明确菌株耐药基因潜在的播散趋势,有效监控细菌耐药性。调查东北地区鹿源大肠杆菌ESBLs 流行基因型,为阐明鹿源大肠杆菌耐药与产酶关系奠定基础,并为指导兽医临床合理用药提供依据。
1 材料
1.1 菌株
质控菌:大肠杆菌ATCC25922,购自中国兽医药品监察所;临床菌株:来源于东北地区的养鹿场。
1.2 药品
氨苄西林(AMP)、阿莫西林(AMX)、头孢噻吩(KF)、头孢他啶(CAZ)、头孢曲松(CRO)、阿莫西林/棒酸(AMC)、亚胺培南(IPM)、氨曲南(ATM)、庆大霉素(CN)、卡那霉素(K)、新霉素(NEO)、阿米卡星(AK)、诺氟沙星(NOR)、环丙沙星(CIP)、恩诺沙星(ENR)、氧氟沙星(OFX)、四环素(TE)、强力霉素(DO)、氯霉素(C)、复方新诺明(SXT)、多粘菌素B(PB),购自杭州天和微生物试剂有限公司;头孢他啶/克拉维酸(CAZ/Clav)和头孢噻肟/克拉维酸(CTX/Clav),购自北京天坛药物生物技术开发公司。
1.3 主要仪器和试剂
质粒小量提取试剂盒,北京博大泰克生物基因技术有限责任公司;DNA 片段凝胶回收试剂盒,爱思进生物技术有限责任公司产品;DL5000 DNAladder、taq酶大连宝生物工程有限公产品;DYY-12型多用电泳仪、水平微型电泳槽,北京市六一仪器厂产品;凝胶成相分析系统,美国Alpha Imager 2200公司产品;YEAR 2000 PCR仪,德国Biometra公司产品;3K30 高速冷冻离心机,美国SIGMA 公司产品。
2 方法
2.1 ESBLs检测
按CLSI标准(抗微生物药物敏感性试验操作方法和判断标准)操作和判断。采用K-B纸片法进行药敏实验。
2.2 ESBLs确证实验
2.2.1 初步筛选实验
可悲的是,当一个人如日中天的时候,谁会去想居安思危?“安”的时候不会想到“危”,“安”的时候也不相信有“危”。三十年河东三十年河西,就是对不懂得居安思危的人的惩罚。
以纸片扩散法对受试菌抗药性进行初筛试验,结果判定标准CAZ≤22 mm,CRO ≤25 mm,CTX≤27 mm,ATM≤27 mm者为产生ESBLs。以大肠杆菌ATCC25922作阴性对照。
2.2.2 表型确证试验
将受试菌均匀涂布于M-H 琼脂平板,贴CAZ、CAZ/Clav 和CTX、CTX/Clav 两组纸片,37℃培养16 h,如两组中任一组加克拉维酸比不加克拉维酸抑菌圈直径≥5 mm,可确认为产ESBLs 菌株。
2.3 ESBLs 基因的PCR 扩增及序列分析比较
2.3.1 引物的设计与合成
按照参考文献[4]设计合成引物,引物均由上海英骏生物技术有限公司合成。CTX-M产物长度为905 bp,TEM产物长度为717 bp,SHV产物长度为593 bp,OXA产物长度为198 bp。
2.3.2 PCR扩增模板的制备
将150 株鹿源大肠杆菌接种于的LB 琼脂平板过夜培养后,挑取单个菌落接种于LB 肉汤中,37℃摇床培育12 h,用按吸附柱式质粒小量抽提试剂盒说明提取质粒DNA。
2.3.3 不同型别ESBLs基因的PCR检测
反应条件:94℃预变性5 min,94℃变性1 min,退火1 min,退火温度56.5℃,72℃延伸1 min,从第二步开始共30个循环,72℃延伸5 min。
3 结果
3.1 ESBLs检测结果
各药对质控菌的抑菌圈均符合CISI 规定的标准。150株鹿大肠杆菌ESBLs检测结果表明,在初筛试验中,有84株大肠杆菌检测为疑似产ESBLs 菌株。经确证试验,84株疑似菌株中均为产ESBLs菌株,检出率为56%(84/150)。
3.2 SHV、CTX-M、TEM 、OXA基因的检测结果
以150株临床分离的鹿源大肠杆菌的质粒DNA为模板进行SHV、CTX-M、TEM、OXA基因检测,结果发现SHV、CTX-M、TEM、OXA扩增均为阳性,扩增片段大小与预期目的片段相符(图1、2、3、4)。TEM基因PCR扩增阳性例数为35例,阳性率为23.33%;CTX-M基因检出的阳性例数为5例,阳性率为3.33%;SHV基因检出的阳性例数为38例,阳性率为25.33%;OXA基因检出的阳性例数为12例,阳性率为8%。
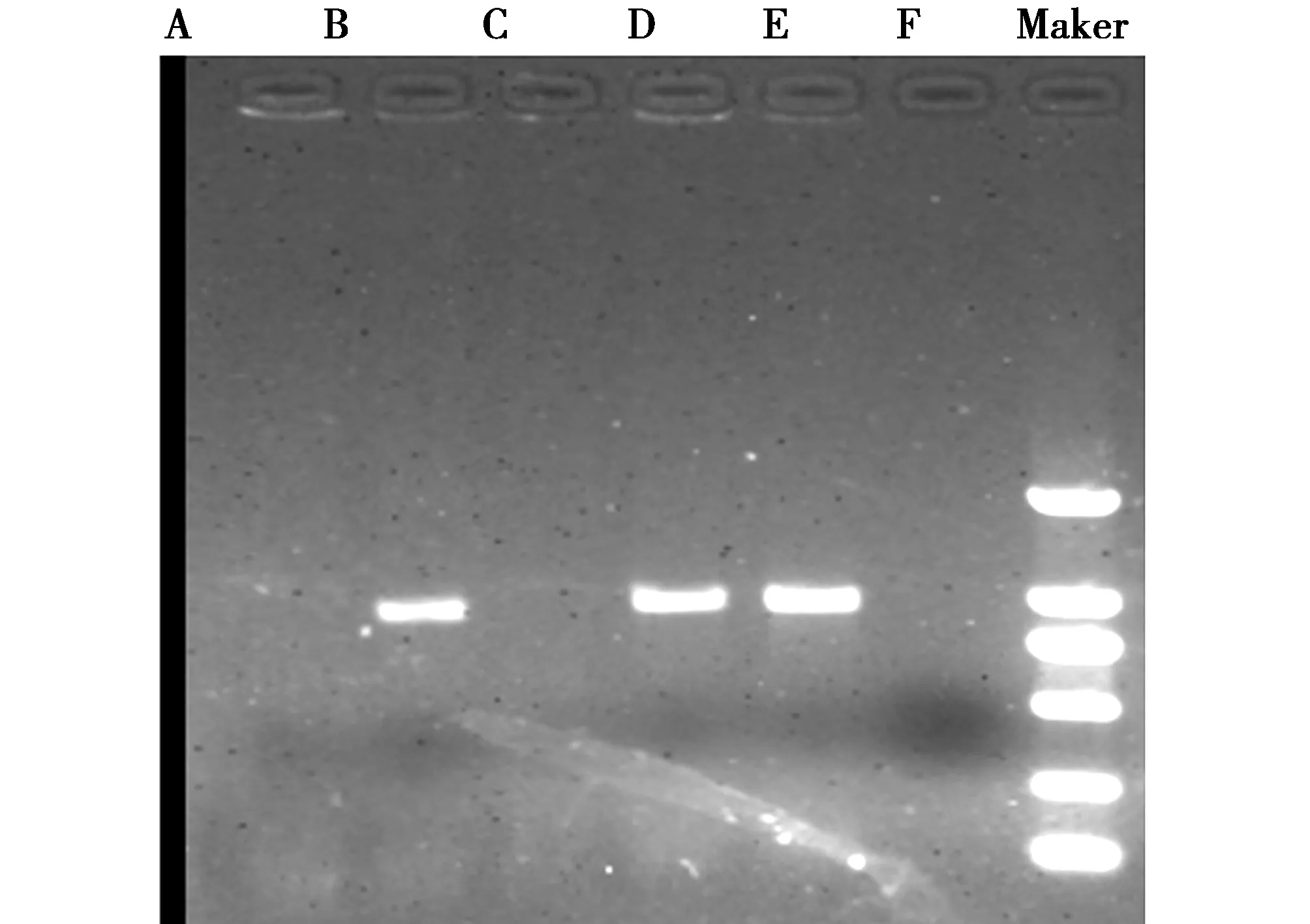
图1 CTX-M基因PCR扩增结果A-F CTX-M基因 Marker 2kbFig.1 PCR amplification product of CTX-M gene
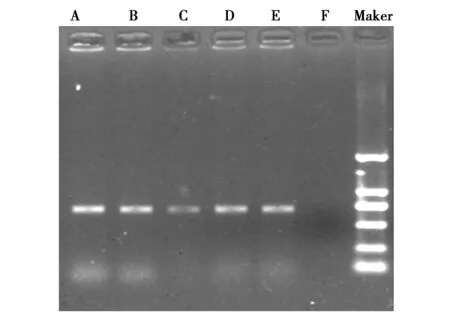
图2 TEM基因PCR扩增结果A-F TEM基因 Marker 2kbFig.2 PCR amplification product of TEM gene
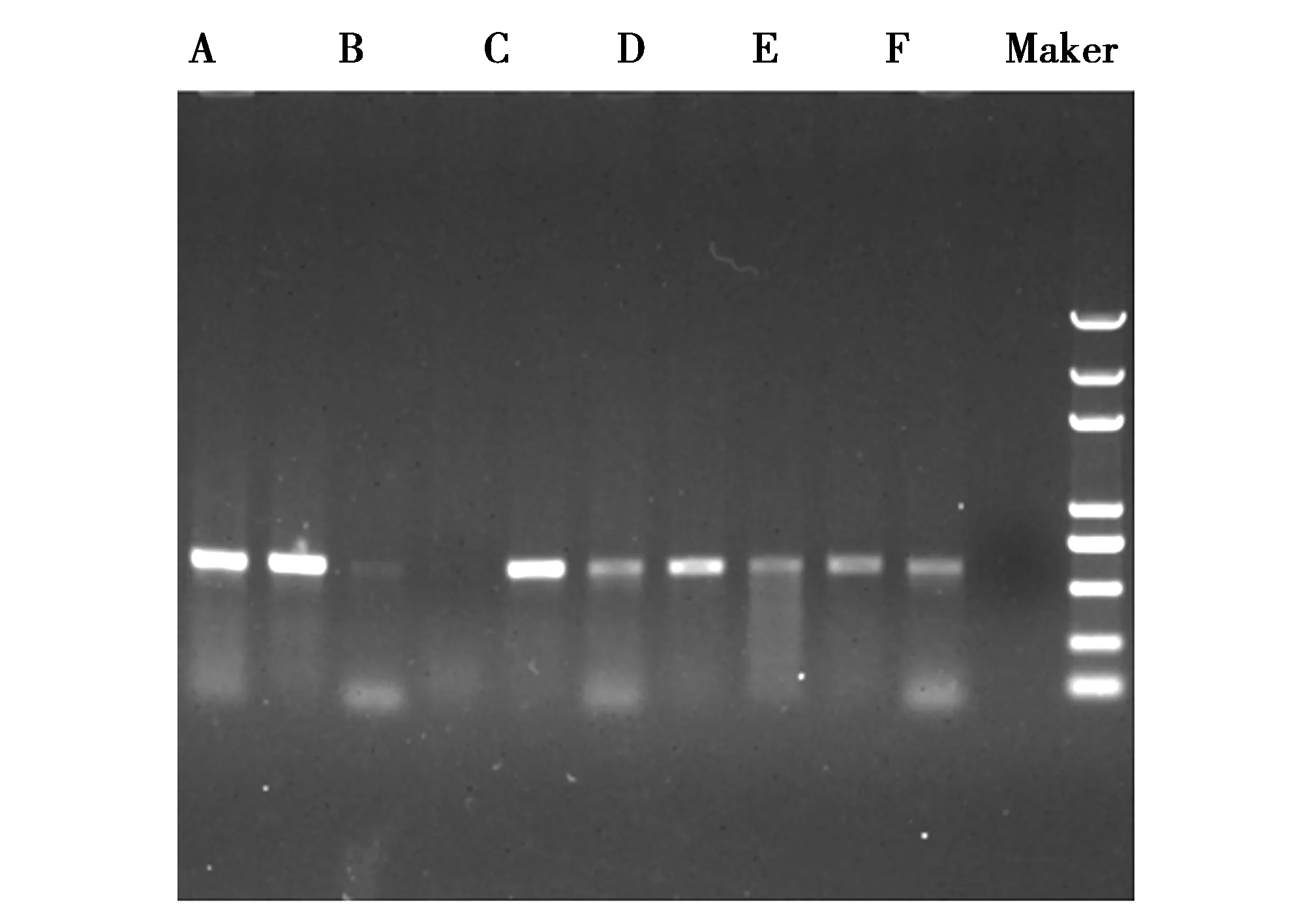
图3 SHV基因PCR扩增结果A-F SHV基因 Marker 5kbFig.3 PCR amplification product of SHV gene
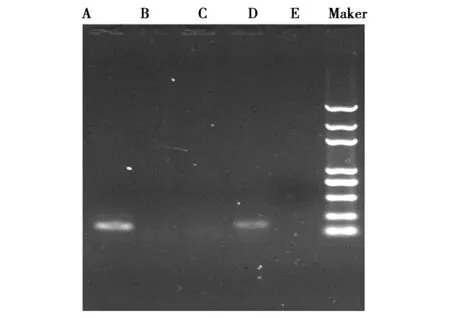
图4 OXA基因PCR扩增结果A-E OXA基因 Marker 5kbFig.4 PCR amplification product of OXA gene
3.3 药敏实验结果
不同药物对150株鹿大肠杆菌耐药率见图5。84株产酶菌的耐药率均比66株不产酶菌高。
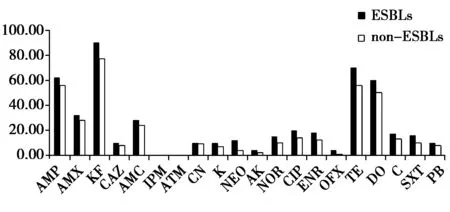
图5 150 株鹿源大肠杆菌对抗菌药的药敏试验及耐药率Fig.4 Antibiotic susceptibility and resistance rates of 150 Escherichia coli strains against agents
4 讨论
ESBLs 现已成为介导革兰阴性杆菌对新型广谱β-内酰胺类抗菌药物耐药的重要机制,造成了临床治疗上的很大困难[5]。大肠杆菌则是产ESBLs的主代表菌株。本试验对150 株临床分离鹿源大肠杆菌进行ESBLs检测采用的是CLSI 推荐的标准方法。共检出84株为产ESBLs 菌,阳性率为56 %。由于临床β-内酰胺酶类抗生素的大量应用及不合理使用,导致耐药菌株广泛传播,尤其产ESBLs 菌引起的耐药现象更为严重[6]。ESBLs由质粒介导,易在同种属甚至不同种属细菌间传递造成暴发流行,给临床治疗带来众多问题。ESBLs 广泛分布于大肠杆菌中,以其水解底物谱广、耐药性强、易传播等特点受到当今各国的普遍关注。产ESBLs的细菌呈世界性流行,不同地区流行的基因型不同。Livermore等[7]发现欧洲各国产ESBLs耐药菌的类型从以TEM、SHV 型变为以CTX-M型为主。
SHV型基因主要位于克雷伯菌中,并不是我国大肠杆菌主要的ESBLs型别[8]。本研究中PCR结果显示,150株鹿源大肠杆菌中SHV型扩增阳性率为25.33%,是东北地区主要的β-内酰胺酶型别。国内也有检出报道,例如上海复旦大学的熊自忠等和北京医院的胡云建等分别在2株和1株大肠杆菌中检测到SHV-12型ESBLs。应加强对养殖场鹿感染菌株耐药性监测,研究耐药基因分子流行病学规律。
[1] 许桂芳,金春光.产超广谱β-内酰胺酶大肠埃希菌耐药性及基因同源性研究[J].中国卫生检验杂志,2009,19(8):1843-1844.
[2] 胡同平,张文兰,张永梅.大肠埃希菌产超广谱β-内酰胺酶株的基因型研究[J].中华医院感染学杂志,2009,19(17):2239-2241.
[3] 许颖,李晓庆,江俊等.产ESBLs大肠埃希菌耐药基因分型研究[J].四川医学,2009,30(9):1363-1365.
[4] Van T T H,Chin J,Chapman T,et al.Safety of raw meat and shellfish in Vietnam:an analysis ofEscherichiacoliisolations for antibiotic resistance and virulence genes[J].International Journal of Food Microbiology,2008,124(3):217-223.
[5] Yan J J,Ko W C,Tsai S H,et al.Dissemination of CTX-M-3and CMY-2β-lactamases among clinical isolates ofEscherichiacoliin southern Taiwan[J].Journal of Clinical Microbiology,2000,38(12):4320-4325.
[6] Rupp M E,Fey P D.Extended spectrum beat-lactamase(ESBL)producing enterobacteriaceae considerations for diagnosis,prevention and drug treatment[J].Drugs,2003,64(4):353-365.
[7] Livermore D M,Canton R,Gniadkowski M,et al.CTX-M:changing the face of ESBLs in Europe[J].Journal of Antimicrobial Chemotherapy,2007,59(2):165-174.
[8] Zong Z,Lü X,Valenzuela J K,et al.An outbreak of carbapenem-resistantAcinetobacterbaumanniiproducing OXA-23 carbapenemase in western China[J].International Journal of Antimicrobial Agents,2008,31(1):50-54.
ESBLs;
Detection of Extended-Spectrum β-Lactamases Genotypeand Antibiotic Resistance Analysis Among Escherichia coli Isolates from Sika Deer in Northeast China
Feng Tao Wang Xiaofei Liu Weishi Xue Yuan*
To detect genotypes of extended-spectrum β-lactamases(ESBLs)in pathogenic enterobacteria cases and guide the use of veterinary drugs,we amplified ESBL genotypes by polymerase chain reaction(PCR)and sequenced and analyzed them.Eighty-four ESBL-positiveEscherichiacolistrains were isolated from sika deer and analyzed for antibiotic resistance.Four different genotypes were detected among these ESBL positive isolates by PCR.The positive rates of TEM,CTX-M,SHV and OXA were 23.33%,3.33%,25.33%,and 8%,respectively.The results showed that the multi-resistance rate among ESBL-positive strains was higher than that of the ESBL-negative strains.
稿件运行过程
2016-04-25
修回日期:2016-05-31
发表日期:2016-11-10
大肠杆菌;
TEM 基因;
SHV基因;
CTX-M基因;
OXA基因
Escherichiacoli;
TEM gene;
SHV gene;
CTX-M gene;
OXA gene
Q959 R446.5
A
2310-1490(2016)04-321-04
采用K-B法检测150株黑龙江、吉林、辽宁的鹿源大肠杆菌对20种抗菌药物的耐药性,了解耐药表型和基因型研究超广谱β-内酰胺酶(ESBLs)的流行情况,以指导临床合理用药。结果表明:以鹿源大肠杆菌的ESBLs耐药质粒为模板均扩增出了与预期片段大小相符的TEM型、SHV型、CTX-M型、OXA型基因。84株大肠杆菌为产ESBLs株,占56%。PCR扩增表明TEM、CTX-M、SHV、OXA阳性率分别为23.33%、3.33%、25.33%、8%。有9株同时检测出TEM和SHV基因(占6%)。药敏试验结果显示产ESBLs大肠杆菌对药物的耐药性明显比非产酶大肠杆菌严重。
国家自然科学基金(31502119);黑龙江省博士后科研启动金(LBH-Q14002);中央高校基本科研业务费(2572015CA21)
冯涛,女,20岁,本科生;主要从事动物药理学研究。
*通讯作者:薛原,E-mail:xueyuan-1978@163.com
