固砷矿物臭葱石组成与结构及其浸出稳定性研究现状
2016-11-18柯平超刘志宏刘智勇李玉虎刘付朋
柯平超,刘志宏,刘智勇,李玉虎,刘付朋
固砷矿物臭葱石组成与结构及其浸出稳定性研究现状
柯平超,刘志宏,刘智勇,李玉虎,刘付朋
(中南大学冶金与环境学院,湖南长沙 410083)
综述了固砷矿物臭葱石的组成与结构性能,及其浸出稳定性研究现状。不同条件下制备的臭葱石样品,会因SO42-夹杂和结晶水量变化,具有不同的组成。已提出双齿双核和双齿单核两种臭葱石结构模型,两者是否属实尚存在争议。臭葱石的溶度积介于10-21.17~10-25.83之间波动。在弱酸性(pH 2~6)、氧化条件下,臭葱石浸出稳定性较高,能较好满足长期堆存要求;而在强酸性或碱性区域,或在还原性条件下,其浸出稳定性较差。
臭葱石;组成;结构;溶解度;浸出稳定性;氧化;还原;平衡
引 言
砷属产大于用的“过剩”元素,广泛伴生于重、贵金属矿中。砷具有-3、0、+3、+5等4种价态,在自然界中存在形态复杂、迁移性强[1]。目前,自然界已发现的含砷矿物多达300余种,其中,砷酸盐、硫化物和氧化物分别约占60%、20%和10%,其余以亚砷酸盐、砷化物、夹杂或合金元素等形式存在[2-4]。砷曾广泛用于农药、医药等方面,现已基本禁用。近十余年来,用于木材防腐剂的砷量急剧减少[5]。目前,砷主要应用于合金添加和砷化镓材料制造,但全球年用量仅数千吨。据美国地质调查局(USGS)报道[6],2011年全球白砷产量为52 kt,其中,中国是最大生产国,达25 kt。据推算,中国每年随有色金属矿石或精矿进入冶炼系统的砷量,至少达到100 kt,其中只有约30 kt稳定固化于炉渣中,其余除少量进入含砷废水净化渣外,大部分富集于各类冶金高砷物料,如高砷烟尘、砷碱渣、硫化砷渣和黑铜粉等,或在系统中循环累积,或转化成白砷产品,部分甚至流向中小企业,造成严重的安全与环境隐患,致使砷污染事件频发[7]。从冶金高砷物料中脱除砷,稳定固化后于专门堆场中堆存,是防治有色冶金“砷害”的重要途径,这已成为国际冶金界的共识[8],亟待开发新技术和经济可行的固砷技术。
固砷技术主要包括包封和矿物固砷两类。包封就是用水泥、玻璃等材料,对含砷物料进行包覆,使其能够稳定堆存。这一方法固废量大、成本高,难以广泛应用[6,9]。
矿物固砷即将砷转化为稳定性高的含砷矿物堆存。固砷矿物的选择,应从浸出稳定性、矿物含砷量、浸出产物毒性、制备难易程度和成本等多方面综合权衡。原生和次生砷矿物,尽管总数多达300余种,但其中能用于固砷的“满意之选”实属难得。要实现砷的稳定固化,根本出路或许在于矿物固砷与包封的结合。
在Ca(Ⅱ)-As(Ⅴ)-H2O体系中,不同条件下能合成一系列砷酸钙矿物,其稳定性较高;但是,砷酸钙在酸性条件下溶解度较大,且其中的Ca(Ⅱ)离子可与溶解态CO2反应,生成碳酸钙而重新释放出砷[10]。因此,砷酸钙类矿物并不宜用作固砷矿物。
在Fe(Ⅲ)-As(Ⅴ)-H2O 体系中,改变反应条件能制备出一系列组成、晶型和结晶度各异的砷酸铁沉淀。其中,臭葱石(FeAsO4·2H2O)因其稳定性高、理论含砷量高达32%、呈结晶态易于液固分离、渣含水低等优点,是目前公认的最佳固砷矿物[11-12],对其开展了广泛的研究。这些研究涉及制备方法、组成和结构性能,以及浸出稳定性等多个方面。其中,浸出稳定性一直是研究的重点,这主要归结于两方面的原因:一是企图将其作为固砷矿物应用的要求;第二,臭葱石是自然界含砷硫化矿风化形成的主要二次砷矿物,其浸出稳定性往往控制着自然界和尾矿库水体中砷的浓度。因此,必然成为地球化学家们研究的热点[13-15]。本文对臭葱石组成和结构性能,以及浸出稳定性等方面的研究现状进行综述,以期促进进一步的深入研究和矿物固砷技术的开发。
1 臭葱石的组成和结构
1.1 制备技术
Dutrizac和 Jambor[16]于1988年采用水热法,以Fe(NO3)3和As(Ⅴ)溶液为原料,用H2SO4调节pH,在160℃下,首次在实验室制备出臭葱石。文献[16]称制备臭葱石的必要条件为:温度高于125℃、As(Ⅴ)浓度大于15 g·L-1。此说并不正确。
1995年,Demopoulos等[17]在Fe(Ⅲ)-As(Ⅴ)- H2O体系中,于90℃下通过分步中和调节pH控制过饱和度,制备出结晶良好的臭葱石。
2008年,Fujita等[18]在Fe(Ⅱ)-As(Ⅴ)-H2O体系中,于95℃下通入氧气或空气氧化Fe(Ⅱ)离子,控制臭葱石沉淀在低过饱和度下进行,制备出颗粒粗大、结晶度高的臭葱石,毒性浸出评价表明,其浸出稳定性很高。这一方法类似于制备针铁矿的“VM”法,为与Demopoulos等的方法相区别,也称之为“改进常压法”[19]。2016年,Kitamura等[20]在改进常压法的基础上,引入超声波装置,使臭葱石的制备过程在超声波场作用下进行,该方法制备出了粒径大于10 μm,结晶度高的臭葱石。
2014年,Okibe等[21]用菌氧化铜精炼废液中的As(Ⅲ),并通过控制体系中Fe(Ⅱ)/ Fe(Ⅲ)和Fe/As摩尔比制备了生物臭葱石。2015年,曹俊雅等[22]在Fe(Ⅱ)-As(Ⅴ)-H2O体系中用铁氧化菌氧化其中的Fe(Ⅱ)离子制备了结晶态臭葱石。由于此类方法均用到微生物氧化,故称为“微生物法”。
1.2 组成
臭葱石理论化学组成为FeAsO4·2H2O。但是在实际制备中,由于原料、制备方法及条件不同,其组成往往会有所改变,如发生SO42-夹杂,出现Fe(AsO4)1-(SO4)(OH)(basic ferric arsenate sulfate, BFAS)或Fe(AsO4)1-0.6x(SO4)·2H2O[20]的组成,或因含水和铁量不同,出现Fe1.22AsO4·2.43H2O、Fe1.22AsO4(OH)0.66·1.77H2O或FeAsO4·2.33H2O[21]等组成。
Gomez等[23]以Fe2(SO4)3和As(Ⅴ)溶液为原料,用水热法制备臭葱石,发现样品的化学组成随Fe/As摩尔比和反应温度不同而改变,归纳为3类,如表1所示。第1类,在Fe/As摩尔比为0.7~1.87,温度150~175℃下,产物为Fe(AsO4)1−0.67x(SO4)·2H2O,其中≤0.20;第2类,在Fe/As摩尔比为0.69~0.93,温度200~225℃下,产物为Fe(AsO4)0.998(SO4)0.01·0.72H2O (ferric arsenate sub-hydrate);第3类,在Fe/As摩尔比为1.67~4.01,温度175~225℃下,产物为Fe(AsO4)1−(SO4)(OH)·(1-)H2O (BFAS),其中0.3<<0.7。这3种产物,都是因FeAsO4·2H2O晶体结构中出现SO42-夹杂和结晶水量改变而形成的,对臭葱石结构性能及其浸出稳定性有较大的影响。臭葱石中的SO42-,究竟是以夹杂还是以吸附的方式存在,目前还存在争议,尚需进一步研究[24]。
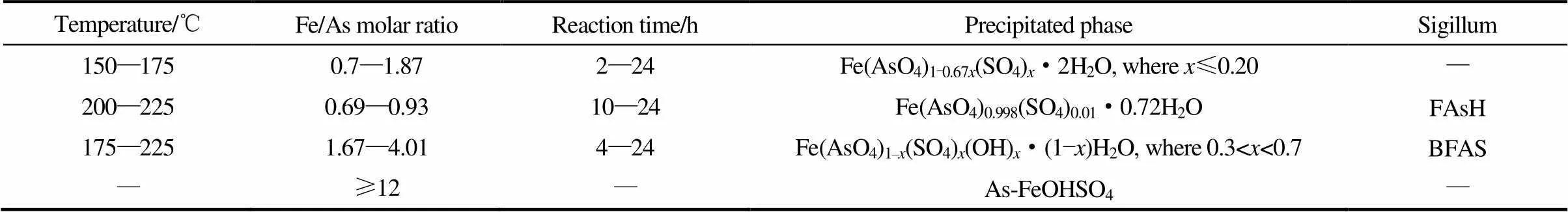
表1 不同条件下水热法制备臭葱石的组成
Berre等[15]为了消除SO42-夹杂对臭葱石结构和性能的影响,以Fe(NO3)3和As(Ⅴ)溶液为原料,采用常压法合成臭葱石,检测表明产物中并无NO3-夹杂。研究表明,在反应初始阶段,生成非晶态臭葱石Fe1.22AsO4·2.33H2O或Fe1.22AsO4(OH)0.66·1.77H2O,随着反应的进行,发生非晶态向晶态的转化。
FeAsO4·2.33H2O(p-c)FeAsO4·2H2O(cr) +0.33H2O (1)
此外,对产物进行元素分析发现,可能发生了FeAsO4·2.33H2O与FeOOH·0.5H2O共沉淀,计算推定FeAsO4·2.33H2O与FeOOH·0.5H2O的摩尔比为4:1。Berre等的结论都是基于元素分析推测得出的,其准确性还有待考证。
Krause等[25]研究砷酸铁化合物的溶解度和浸出稳定性发现,在溶液Fe/As摩尔比大于1时得到的砷铁化合物具有更好的稳定性,推测认为Fe(Ⅲ)、As(Ⅴ)沉淀物并不是FeAsO4·2H2O或FeAsO4·H2O和Fe(OH)3的机械混合物,而是形成了一种称为碱式砷酸铁[FeAsO4·Fe(OH)3]的复杂化合物。然而,这一结论并未得到检测证实。后来,Fujita等[24]研究了在改进常压法中加入Cu2+、Zn2+、Na+对臭葱石的组成和结构及浸出稳定性的影响,结果表明,添加这些离子只会改变体系的氧化还原电势,并不会对臭葱石的组成和结构及浸出稳定性产生明显的影响。Kossoff等[26]研究Sb对制备臭葱石的影响,表明在Fe(Ⅱ)-As(Ⅴ)-Sb(Ⅴ)-H2O体系中As和Sb分别以臭葱石和FeSbO4的形式结晶,且两相相互独立,不互相进入晶格改变其结构。
1.3 结构
臭葱石属斜方晶系,晶胞参数为:0=1.010 nm,0=0.980 nm,0=0.876 nm[13]。关于臭葱石的结构,研究者们提出了两种不同的模型,目前尚无定论。第1种由Demopoulos等[27-29]研究提出。他们对臭葱石样品进行X射线吸收精细结构光谱(XAFS)测试,并从As的K边数据分析得到,臭葱石中Fe—O,As—O分别形成6配位正八面体和4配位正四面体结构,As—Fe原子间距为(0.333±0.002) nm,配位数为3.32;而从Fe的K边数据得到,Fe—As的原子间距为(0.331±0.002) nm,配位数为3.8。As-O-Fe的键角为138°,Fe—O—Fe为111°。基于以上结果,提出了双齿双核结构模型。如图1中 Model 1所示。
Model 1—presented by Demopoulos;Model 2—presented by Dutrizac
第2种由Dutrizac等[30-31]根据XAFS数据提出。XAFS分析表明:在砷酸铁和臭葱石结构中,As—O原子间距相同,均为0.335 nm;而它们的As—Fe间距却不相同,前者为0.335 nm,后者为0.330 nm;两者As—Fe配位数分别为2.1±0.4和2.2±0.3,Fe—O,As—O之间分别形成6配位正八面体和4配位正四面体结构。基于此,提出了双齿单核模型,如图1中Model 2所示。
这两种模型的根本区别在于As-Fe配位数不同,为此双方进行了激烈的争论。Demopoulos等[27]在回复Dutrizac质疑的文章中,对Dutrizac等[30]关于As—Fe配位数的实验数据利用多重散射法和基于多重散射下的曲线拟合法[32]进行了详细推导,得出As—Fe配位数大于2的结论。而Dutrizac的相关文献中仅提供了原始数据和实验结论,并未给出具体的数据处理方法。综上所述,这两种模型都是根据XAFS检测数据推测提出,其正确性还有待进一步实验验证。
2 臭葱石的溶度积和浸出稳定性
臭葱石的溶解度和浸出稳定性是评价臭葱石能否作为固砷矿物的重要标准,因此,对其进行研究具有较大的意义。目前的研究主要从两方面开展:一是采用平衡实验、量热技术和热力学计算等方法,确定臭葱石的基本热力学数据,如溶度积(sp)和生成自由能(D⊝f)[33];二是采用TCLP (toxicity characteristic leaching procedure,US-EPA 1992)[34]或类似方法,测定不同条件下制备的臭葱石样品的浸出稳定性,据此评估其是否满足长期堆存要求[30-34]。这些研究加深了人们对臭葱石浸出稳定性的认识,可以为臭葱石的安全堆存提供依据。
2.1 溶度积
对臭葱石溶度积的研究,最早可追溯至1956年,Chukhlantsev[35]以Fe2(SO4)3和Na3AsO4为原料,采用水热法制备出系列砷酸铁化合物,研究了溶液pH对其溶度积的影响,发现在pH 1.9~3.0的范围内,随着pH增大,sp从10-22.45减小到10-23.24。然而,Chukhlantsev并未考虑制备中可能出现Fe(OH)3、FeOOH沉淀以及SO42-的夹杂,而且认为样品中Fe和As一定是以摩尔比1:1溶解,这显然存在一定的谬误。1978年,Nishimura等[36]以Fe2(SO4)3和Na2HAsO4为原料,在25℃下制备得到非晶态砷酸铁,并测得pH在1~3范围内的sp为10-23.11~-24.52。1981年,Makhmetov等[37]测得pH为3时臭葱石的sp为10-23.48,但并未详细介绍测定方法。1985年,Dove等[38]以FeCl3和Na3AsO4为原料,在95~105℃下,制备得到臭葱石,并用分光光度法和原子吸收法测得(25±0.5)℃下臭葱石的sp为10-21.7±0.5,D⊝f为(-1263.52±0.28)kJ·mol-1。1985~1988年,Krause等[39-40]测定了各种砷酸铁化合物与水及不同pH溶液接触的平衡溶解度,并利用活度理论计算了臭葱石的sp。研究表明,晶态臭葱石具有良好的稳定性,但是由于不同晶形的臭葱石对应的溶解度差异较大,故Krause等在计算溶度积时取其平均值,得到的平均sp值为(3.89±1.36)×10-25,同时发现非晶态臭葱石的sp溶度积比晶态的低3个数量级,这与Nishimura等的研究结果相近。然而Krause等在利用活度理论计算时,将所有的离子的活度系数设定为1,这明显与实际不符。1986~1990年,Robins[41-42]对Krause等的工作进行重复,得到了类似的结果,并发现随着pH增大,臭葱石的溶度积先减小后增大,在pH为3~5的范围内较为稳定。当pH为2时臭葱石中的Fe和As是以1:1的关系发生一致溶解,而当pH大于6时,发生砷酸铁向针铁矿的转变。而不同Fe/As摩尔比下合成的样品,其溶解度不同的原因,主要是生成了砷酸铁和针铁矿,且其比例不同所致。2001年,Zhu等[43]用JESS、Wateq、CHEAQS 3个数据库,以及Chukhlantsev[35]、Makhmetov等[37]和Robins[41-42]发表的相关数据,借助PHREEQC程序,结合活度理论计算了铁、钙、钡砷酸盐的溶度积,研究表明晶态臭葱石的溶度积(sp)介于10-23和10-24之间;当溶液pH在2.0~4.5范围内,臭葱石发生不一致溶解,铁以Fe2O3·H2O的形式沉淀下来。2006年,Langmuir等[44-45]用类似的方法,对前人的工作进行归纳,得出非晶态砷酸铁和臭葱石的溶度积分别约为10-23.0±0.3和10-25.83±0.07;并测定了加拿大麦克柯林湖铀矿尾矿中的系列砷酸铁样品的溶度积,发现当溶液初始pH从2.18升高到7.37时,砷酸铁的sp从10-22.80降低到10-24.67;样品中结晶态臭葱石的比例越高,其稳定性越好。2007年,Bluteau等[46]用常压法合成臭葱石,测得其sp为10-25.4。2012年,Drahota等[33]对从捷克亚希莫夫矿区砷黄铁矿尾矿中分离得到的臭葱石进行热力学性质测定,得出其D⊝f为-1284.8 kJ·mol-1,溶度积(sp)为10-25.83±0.52,与Langmuir等[44-45]得到的结论相一致。
综上所述,研究者们测得的臭葱石的sp在10-21.17~10-25.83之间波动,如图2所示。数据波动是由于臭葱石样品制备方法、离子夹杂以及活度计算方法不同所致。
2.2 浸出稳定性
固砷产物毒性浸出实验是评价其固砷效果最直接、有效的方法。国际上应用最广泛的方法是美国环保署于1992年提出的固体废弃物毒性浸出方法(TCLP)[34];TCLP规定含砷固废的毒性浸出限值为1 mg·L-1。此外,世界上其他许多国家也都制定了毒性浸出方法和限值。中国危险废物鉴别标准为GB 5085.3—2007[48],规定含砷危险固废毒性浸出浓度限值为5 mg·L-1。
基于以上标准,研究者们在研究臭葱石的溶度积时,也对其浸出行为进行了大量研究。其中最具代表性的是Paktunc等[49]、Bluteau等[46]和Fujita等[50-51]的研究结果。
Paktunc等[49]测定了水热法制备纳米晶态臭葱石和非晶态砷酸铁在不同pH条件下的稳定性和溶度积,发现当pH为1、2、3、4、5和7条件下晶态臭葱石中砷的浸出浓度分别为20.8、0.56、0.26、0.24、0.58和5.38 mg·L-1,当pH为2,3,4和5时,非晶态砷酸铁中砷的浸出浓度为90、30、50、和60 mg·L-1。纳米晶态臭葱石在pH为1~5范围内的平均溶度积为10-25。
Bluteau等[46]用常压法制备臭葱石并研究其稳定性,表明在pH为5~9的范围内臭葱石的溶解速率非常缓慢,浸出60周后依然没达到平衡状态,在中性条件下,砷的浸出浓度为5.8 mg·L-1,且随着温度从4℃升高到22℃,溶解度从1.2 mg·L-1升高到5.9 mg·L-1。当温度高达75℃时,臭葱石发生不一致溶解,其中大量的Fe以两线Fe2O3·H2O[26,46]的形式析出,然后又会被非晶态砷酸铁吸附并重新结晶为臭葱石。
Fujita等[50-51]利用改进常压法制备晶态臭葱石,并在不同pH条件下对臭葱石进行浸出实验,发现当pH在3~7范围时,臭葱石相对稳定,砷的浸出浓度小于5 mg·L-1,TCLP毒性浸出实验浸出液中砷浓度小于0.5 mg·L-1;而当pH小于2时,浸出浓度大于20 mg·L-1;pH大于7时,浸出浓度大于50 mg·L-1,有时甚至高达1200 mg·L-1。另外,控制pH在4~6范围时,在臭葱石样品中混入1%(质量)的针铁矿,能够显著提高其稳定性,实验表明,砷的浸出浓度小于0.01 mg·L-1,但若pH超出这个范围,则添加针铁矿没有明显作用。臭葱石中砷的浸出稳定性随pH而改变,这主要归因于在不同pH下,砷浸出机理会发生改变,具体如表2所示。

表2 不同pH下臭葱石的浸出反应方程式
除此之外,Min等[52]用改进常压法制备了臭葱石,并进行了TCLP毒性浸出,得到As的浸出浓度最低为0.5 mg·L-1;Doerfelt等[53]研究了在还原性条件下Fe(Ⅱ) /Fe(Ⅲ)/As(Ⅴ)共沉淀产物的稳定性,表明还原剂通过使浸出液的还原电位处于稳定的较负水平,促进Fe(Ⅲ)的还原,从而提高了As的释放量;Adelman等[54]用硅酸钠凝胶对臭葱石进行包覆,目的是使其在碱性条件下稳定,实验结果却表明该方法不仅不能提高臭葱石的稳定性,反而会促进As的释放。
综上所述可以归纳以下几点:第一,pH在0~3的范围内,随着pH的升高,臭葱石的溶解度不断降低;第二,在pH 5~10的范围内,随着pH升高,溶解度不断升高;第三,pH在3~5的范围内,臭葱石的溶解处于较稳定水平,砷的最低浸出浓度小于0.5 mg·L-1。该结论与图2所示相一致。
3 结论与展望
(1)在不同条件下制备的臭葱石样品中,会出现SO42-夹杂和结晶水含量改变,从而影响臭葱石的组成,一般有3种常见形式:Fe(AsO4)1−0.67x(SO4)·2H2O(其中≤0.20),Fe(AsO4)0.998(SO4)0.01·0.72H2O (FAsH)和Fe(AsO4)1−(SO4)(OH)·(1-)H2O (BFAS)(其中0.3<<0.7);
(2)已提出双齿双核和双齿单核两种臭葱石结构模型。两者是否属实目前还存在争论,有待进一步研究。
(3)臭葱石的sp在10-21.17~10-25.83之间波动。存在波动的原因在于臭葱石的制备方法、离子夹杂以及活度计算方法的不同。
(4)对臭葱石的浸出行为进行研究,加深了对其浸出稳定性的认识:一是臭葱石仅在弱酸性(pH 2~6)、氧化条件下浸出稳定性较高,能较好满足长期堆存要求;在强酸性或碱性区域,或在还原性条件下,其浸出稳定性较差;第二,臭葱石浸出存在一致性溶解(congruent dissolution,铁与砷等摩尔比溶解进入溶液)和非一致性溶解(incongruent dissolution,溶解的铁大部分呈水铁矿析出)两种机理,其转折点大致在pH 2.0~2.5 之间[46]。
(5)臭葱石作为固废在弱酸、氧化性条件下堆存,其溶解机理为非一致性溶解。在众多研究中臭葱石的溶度积和浸出行为根据制备的和测定的条件不同有较大的差异,需要进一步研究其组成结构和浸出稳定性之间的关系。
(6)臭葱石作为一种固砷矿物很难像其他功能材料一样有具体的应用。但近年来,随着科技的发展,在医学上已经提出亚砷酸治疗白血病[55],电子工业上高纯砷化镓的合成[56]等课题,这些都是含砷物料资源化的重要方向。相信在不久的将来,臭葱石的资源化必定能实现。
References
[1] HOPKIN W. The problem of arsenic disposed in non-ferrous metals production[J]. Environmental Geochemistry and Health, 1989, 11(3/4): 101-112.
[2] BOWELL R J. Sulphide oxidation and arsenic speciation in tropical soils[J]. Environ. Geochem. Health, 1994, 16: 84.
[3] BOWELL R J, PARSHLEY J. Arsenic cycling in the mining environment. Characterization of waste, chemistry, and treatment and disposal[C]//Proceedings and Summary Report on U.S. EPA Workshop on Managing Arsenic Risks to the Environment. Denver, Colorado, USA, 2001.
[4] BOWELL R J, PARSHLEY J V. Control of pit-lake water chemistry by secondary minerals, Summer Camp pit[J]. Getchell Mine, Nevada. Chem. Geol., 2005, 215: 373-385.
[5] WANG S L, MULLIGAN C N. Occurrence of the arsenic contamination in Canada: sources, behavior and distribution[J]. Science of the Total Environment, 2006, 366: 701-721.
[6] RIVEROS G, UTIGARD T A. Disposal of arsenic in copper discharge slags[J]. Journal of Hazardous Materials, 2000, B77: 241-252.
[7] 邱定蕃. 有色冶金与环境保护[M]. 长沙: 中南大学出版社, 2015: 288. QIU D F. Nonferrous Metallurgy and Environment Protection [M]. Changsha: CSU Press, 2015: 288.
[8] FILIPPOU D, GEORGE P, DEMOPOLPUS G P. Arsenic immobilization by controlled scorodite precipitation[J]. Journal of Metal, 1997, (12): 52-55.
[9] PAUL M R. Arsenic encapsulation using Portland cement with ferrous sulfate/lime and Terra-bandTMtechnologies—microcharacterization and leaching studies[J]. Science of the Total Environment, 2012, 420: 300-312.
[10] ZHU Y N, ZHANG X H, XIE Q L,. Solubility and stability of calcium arsenates at 25℃[J]. Water, Air, and Soil Pollution, 2006, 169: 221-238.
[11] WEJHAM N J, MALATTA K A, VUKCEVIC S. The stability of iron phases presently used for disposal from metallurgical system—a review[J]. Mineral Engineering, 2000, 13 (8/9): 911-931.
[12] MONHEMIUS A J, SWASH P M. Removing and stabilizing As from copper refining circuits by hydrothermal processing[J]. Journal of Metal, 1999, (9): 30-33.
[13] DRAHOTA P, FILIPPI M. Secondary arsenic minerals in then environment: a review[J]. Environment International, 2009, 35: 1243-1255.
[14] GOMEZ M A, BECZE L, CUTLER J N,. Hydrothermal reaction chemistry and characterization of ferric arsenate phases precipitated from Fe2(SO4)3-As2O5-H2SO4solutions[J]. Hydrometallurgy, 2011, 107: 74-90.
[15] BERRE J F L, GAUVIN R, DEMOPOULOS G P. A study of the crystallization kinetics of scoroditethe transformation of poorly crystalline ferric arsenate in weakly acidic solution[J]. Colloids and Surface, 2008, 315: 117-129.
[16] DUTRIZAC J E, JAMBOR J L. The synthesis of crystalline scorodite, FeAsO4·2H2O[J]. Hydrometallurgy, 1988, (3): 377-384.
[17] DEMOPOULOS G P, DROPPERT D J, VEERT G. V. Precipitation of crystalline scorodite (FeAsO·2H2O) from chloride solutions[J]. Hydrometallurgy, 1995, 38: 245-261.
[18] FUJITA T, TAGUCHI R, ABUMIYA M,Novel atmospheric scorodite synthesis by oxidation of ferrous sulfate solution(PartⅠ)[J]. Hydrometallurgy, 2008, 90: 92-102.
[19] 刘志宏, 杨校锋, 刘智勇, 等. 制备方法对臭葱石浸出稳定性的影响[J]. 过程工程学报, 2015, (3): 412-417. LIU Z H, YANG X F, LIU Z Y,. Effects of synthesis methods for scorodite on its leaching stability[J]. The Chinese Journal of Process Engineering, 2015, (3): 412-417.
[20] KITAMURA Y, OKAWA H, KOTA T,Effect of ultrasound intensity on the size and morphology of synthesized scorodite particles[J]. Advance Powder Technology, 2016, 27: 891-897.
[21] OKIBE N, KOGA M, MORISHITAS,Microbial formation of crystalline scorodite for treatment of As(III)-bearing copper refinery process solution using[J]. Hydrometallurgy, 2014, 143: 34-41.
[22] 曹俊雅, 叶栩文, 杜娟, 等. 铁氧化菌对含砷溶液中砷沉淀和臭葱石晶体形成的影响[J]. 过程工程学报, 2015, 15(2): 307-312. CAO J Y, YE Y W, DU J,Effects of iron oxidation bacteria on arsenic precipitation and the formation of crystalline scorodite from arsenic-containing solution[J]. The Chinese Journal of Process Engineering, 2015, 15(2): 307-312.
[23] GOMEZ M A, BECZE L, CUTLE J N,. Hydrothermal reaction chemistry and characterization of ferric arsenate phases precipitated from Fe2(SO4)3-As2O5-H2SO4solutions[J]. Hydrometallurgy, 2011, 107: 74-90.
[24] FUJITA T, TAGUCHI R, ABUMIYA M,Effects of zinc, copper and sodium ions on ferric arsenate precipitation in a novel atmospheric scorodite process[J]. Hydrometallurgy, 2008, 93: 30-38.
[25] KRAUSE E, ETTEL V A. Solubilities and stabilities of ferric arsenate compounds[J]. Hydrometallurgy, 1989, 22: 311-337.
[26] KOSSOFF D, WELCH M D, HUDSON-EDWARDS K A. Scorodite precipitation in the presence of antimony[J]. Chemical Geology, 2015, 406: 1-9.
[27] JIANG D T, CHEN N, DEMOPOULOS G P,Response to the comment by D. Paktunc on“Structural characterization of poorly-crystalline scorodite, iron(Ⅲ)-arsenate co-precipitates and uranium mill neutralized raffinate solids using X-ray absorption fine structure spectroscopy”[J]. Geochimica et Cosmochimica Acta, 2010, 74: 4597-4602.
[28] CHEN N, JIANG D T, CUTLER J,. Structural characterization of poorly-crystalline scorodite, iron(Ⅲ)-arsenate co-precipitates and uranium mill neutralized raffinate solids using X-ray absorption fine structure spectroscopy[J]. Geochimica et Cosmochimica Acta, 2009, 73: 3260-3276.
[29] GOMEZ M A, ASSAAOUDI H, BECZE L,. Vibrational spectroscopy study of hydrothermally produced scorodite (FeAsO4·2H2O), ferric arsenate sub-hydrate (FAsH; FeAsO4·0.75 H2O) and basic ferric arsenate sulphate (BFAS; Fe[(AsO4)1−x(SO4)(OH)]·H2O)[J]. Journal of Raman Spectroscopy, 2010, 41(41): 212-221.
[30] PAKTUNC D, DUTRIZAC J, GERTSMAN V. Synthesis and phase transformations involving scorodite, ferric arsenate and arsenical ferrihydrite: implications for arsenic mobility[J]. Geochimica et Cosmochimica Acta, 2008, 72: 2649-2672.
[31] PAKTUNC D. Comment on “Structural characterization of poorly-crystalline scorodite, iron(III)-arsenate co-precipitates and uranium mill neutralized raffinate solids using X-ray absorption fine structure spectroscopy” by N. Chen, D.T. Jiang, J. Cutler, T. Kotzer, Y.F. Jia, G.P. Demopoulos and J.W. Rowson[J]. Geochimica et Cosmochimica Acta, 2010, 74: 4589-4596.
[32] 储旺盛. T-EXAFS研究过渡金属二硼化物的晶格动力学行为及其同位素效应[D]. 安徽: 中国科学技术大学, 2007. CHU W S. The lattice dynamics behavior of the second transition metal boride and isotope effect studied by T-EXAFS[D]. Anhui: University of Science and Technology of China, 2007.
[33] MAJZLAN J, DRAHOTA P, FILIPPI M,Thermodynamic properties of scorodite and parascorodite (FeAsO4·2H2O), Kankite (FeAsO4·3.5H2O), and FeAsO4[J]. Hydrometallurgy, 2012, 117: 47-56.
[34] Environment Protection Agency of US. Information and documentation-rules for bibliographic references and citations to information resources: 1311[S]. Washington, DC, 1992.
[35] CHUKHLANTSEV V G. The solubility products of a number of arsenates[J]. Anal. Chem. (USSR), 1956, (11): 565-571.
[36] NISHIMURA T, ROBINS R G. Crystalline phases in the system Fe(Ⅲ)-As(Ⅴ)-H2O at 25℃[C]//DUTRIZAC J E, HARRIS G B. Iron Control and Disposal. Proceedings of the 2nd International Symposuim on Iron Control in Hydrometallurgy. Ottawa, Canada, 1996: 521-533.
[37] MAKHMETOV M Z, SAGADIEVA A K, CHUPTRAKOV V I. Solubility of iron arsenate[J]. Appl. Chem. (USSR), 1981, (54): 823-824.
[38] DOVE P M, RIMSTIDT J D. The solubility and stability of scorodite, FeAsO4·2H2O[J]. Am. Miner., 1985, 70: 838-844.
[39] KRAUSE E, ETTEL V A. Solubilities and stabilities of ferric arsenate compounds[J]. Hydrometallurgy, 1989, 22: 311-337.
[40] KRAUSE E, ETTEL V A. Ferric arsenate compounds: are they environmentally safe? Solubilities of basic ferric arsenates[C]//OLIVER A J. Impurity Control and Disposal 15th Annual Hydrometallurgy Meeting. Montreal, Canada: Canadian Institute of Mining, Metallurgy and Petroleum, 1985: 5.
[41] ROBINS R G. Solubility and stability of scorodite, FeAsO4·2H2O: discussion[J]. Am. Miner., 1987, 72: 842-844.
[42] ROBINS R G. The stability and solubility of ferric arsenate-an update[C]//GASKELL D R. EPD Congress 90. TMS Annual Meeting, 1990: 93-104.
[43] ZHU Y N, MERKEL B J. The dissolution and solubility of scorodite, FeAsO4·2H2O—evaluation and simulation with PHREEQC2, Wiss[J]. Mitt. Inst. fur Geologie, TU Bergakedemie Freiberg, German, 2001, 18: 1-12.
[44] LANGMUIR D, MACDONALD M, ROWSON A. Predicting arsenic concentrations in the porewaters of buried uranium mill tailings[J]. Geochim. Cosmochim. Acta, 1999, 63: 3379-3394.
[45] LANGMUIR D, MACDONALD M, ROWSON A. Solubility products of amorphous ferric arsenate and crystalline scorodite (FeAsO4·2H2O) and their application to arsenic behavior in buried mine tailings[J]. Geochim. Cosmochim. Acta, 2006, 70: 2942-2956.
[46] BLUTEAU M C, DEMOPOULOS G P. The incongruent dissolution of scorodite—solubility, kinetics and mechanism[J]. Hydrometallurgy, 2007, 87: 163-177.
[47] MAJZLAN J, DRAHOTA P, FILIPPI M. Secondary arsenic minerals in the environment: a review[J]. Environment International, 2009, 35: 1243-1255.
[48] 中华人民共和国国家环境保护总局, 国家质量监督检验检疫总局. 危险废物鉴别标准 浸出毒性鉴别: GB 5085.3—2007 [S]. 北京: 中国标准出版社, 2007. State Environmental Protection Administration and General Administration of Quality Supervision of the People’s Republic of China, Standardization Administration of the People’s Republic of China. Identification standards for hazardous wastes—identification for extraction toxicity: GB 5080.3—2007 [S]. Beijing: Standards Press of China, 2007.
[49] PAKTUNC D, BRUGGEMAN K. Solubility of nanocrystalline scorodite and amorphous ferric arsenate: implications for stabilization of arsenic in mine wastes[J]. Applied Geochemistry, 2010, 25: 674-683.
[50] FUJITA T, FUJIEDA S, SHINODA K,Environmental leaching characteristics of scorodite synthesized with Fe(II) ions[J]. Hydrometallurgy, 2012, 111/112: 87-102.
[51] FUJITA T, TAGUCHI R, KUBO H,Imobilization of arsenic from novel synthesized scorodite—analysis on solubility and stability[J]. Master Tras., 2008, (2): 321-331.
[52] MIN X B, LIAO Y P, CHAI L Y,Removal and stabilization of arsenic from anode slime by forming crystal scorodite[J]. Trans. Nonferrous Met. Soc. China, 2015, 25: 1298-1306.
[53] DOERFELT C, FELDMANN T, DAENZER R,Stability of continuously produced Fe(II)/Fe(III)/As(V) co-precipitates under periodic exposure to reducing agents[J]. Chemosphere, 2015, 138: 239-246.
[54] ADELMAN J G, ELOUATIK S, DEMOPOULOS G P. Investigation of sodium silicate-derived gels as encapsulants for hazardous materials—the case of scorodite[J]. Journal of Hazardous Materials, 2015, 192: 108-117.
[55] 张亭栋, 李元善. 癌灵Ⅰ号治疗急性粒细胞白血病临床分析及实验研究[J]. 中西医结合杂志, 1984, 4(1): 19-20. ZHANG T D, LI Y S. Clinical analysis and experimental research of acute granulocytic leukemia by Ailing-1[J]. Chinese Journal of Integrated Traditional and Western Medicine, 1984, 4(1): 19-20.
[56] MISHRA K K, UPADHYAY G K, UPADHAYAYA K S. Crystal synamic study of gallium arsenide (GaAs) using a theoretical approach of van der Waals three-body force shell model (VTSM)[J]. Physical Science International Journal, 2012, 2(2): 91-106.
Research status on composition, structure, and leaching stability of an arsenic solidification mineral scorodite
KE Pingchao, LIU Zhihong, LIU Zhiyong, LI Yuhu,LIU Fupeng
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, Hunan, China)
The research status on the composition, structure and leaching stability of scorodite, a well known arsenic solidification mineral, was reviewed. The scorodite samples prepared under different conditions had varying compositions due to the inclusion of sulfate together with the change of crystal water amount. Two structure models of scorodite were proposed as bidentate binuclear model and bidentate mononuclear model separately, but there was controversy on which one being true. The solubility product of scorodite fluctuated between 10-21.17and 10-25.83. The leaching stability of scorodite was higher in weak acidic (pH 2—6) solutions under oxidative conditions than that in strong acidic and alkaline solutions or under reductive conditions. Thus, it was concluded that scorodite could be stockpiled safely but in weak acidic (pH 2—6) and oxidative environment.
scorodite; composition; structure; solubility; leaching stability; oxidation; reduction; equilibrium
2016-04-27.
Prof. LIU Zhihong, zhliu@mail.csu.edu.com
10.11949/j.issn.0438-1157.20160556
TF 811
A
0438—1157(2016)11—4533—08
柯平超(1992—),男,博士研究生。
国家自然科学基金项目(51574285)。
2016-04-27收到初稿,2016-07-28收到修改稿。
联系人:刘志宏。
supported by the National Natural Science Foundation of China (51574285).
