曲妥珠单抗联合新辅助化疗用于HER2过度表达乳腺癌的临床观察
2016-11-18闫海山张冰雁鹤壁市人民医院肿瘤放疗科河南鹤壁458030
闫海山,张冰雁(鹤壁市人民医院肿瘤放疗科,河南鹤壁 458030)
曲妥珠单抗联合新辅助化疗用于HER2过度表达乳腺癌的临床观察
闫海山*,张冰雁(鹤壁市人民医院肿瘤放疗科,河南鹤壁458030)
目的:探讨曲妥珠单抗联合新辅助化疗用于乳腺癌的临床疗效及安全性,并探讨其对患者肿瘤组织人表皮生长因子受体2(HER2)蛋白、B7同源体1(B7-H1)和白细胞介素2(IL-2)表达的影响。方法:选取经病理活检确诊且免疫组化检测联合荧光原位杂交技术检测结果为HER2过度表达的62例乳腺癌患者为研究对象,按随机数字表法分成观察组和对照组,各31例。对照组患者术前予以卡铂+多西他赛新辅助化疗方案;观察组患者在化疗基础上联合注射用曲妥珠单抗静脉滴注,第1周剂量为4 mg/kg,第2~18周剂量均为2 mg/kg,每周1次,持续治疗18周。化疗结束2周后行乳腺癌改良根治术。观察两组患者的临床疗效及不良反应发生情况,比较两组患者治疗前后病灶组织中HER2蛋白、B7-H1与IL-2表达情况;随访1年,记录两组患者的肿瘤复发、转移及生存率。结果:治疗后,观察组患者的总有效率为83.87%,显著高于对照组的58.06%,差异有统计学意义(P<0.05);观察组患者病灶组织的HER2蛋白检测结果为非过度表达者有19例(61.29%),显著多于对照组的11例(35.48%),差异有统计学意义(P<0.05);观察组患者病灶组织B7-H1与IL-2表达阳性率显著低于治疗前和对照组治疗后,差异均有统计学意义(P<0.05)。两组患者不良反应发生率比较,差异无统计学意义(P>0.05)。在为期1年的随访中,两组患者除生存率比较差异无统计学意义(P>0.05)外,观察组患者的复发率与转移率均明显低于对照组,差异有统计学意义(P<0.05)。结论:在乳腺癌改良根治术前应用曲妥珠单抗联合新辅助化疗方案,可有效改善HER2过度表达的乳腺癌患者病灶组织HER2蛋白、B7-H1与IL-2的表达,提高临床疗效,且用药安全,患者术后肿瘤复发、转移的风险较低。
曲妥珠单抗;新辅助化疗;乳腺癌;人表皮生长因子受体2;B7同源体1;白细胞介素2
据不完全统计,近年来我国乳腺癌的发病率逐年递增,且有年轻化的发展趋势[1],现已成为重大公共卫生问题。相关研究证实,人表皮生长因子受体2(HER2)、B7同源体1(B7-H1)和白细胞介素2(IL-2)均可在乳腺癌病灶组织内检出,其中HER2表达情况同乳腺癌的生存期之间存在紧密联系[2];B7-H1作为重要的免疫抑制分子,可对肿瘤微环境产生影响;而IL-2则能在一定程度上反映机体免疫状态,为有效评估患者病情发展情况提供条件。目前,新辅助化疗在乳腺癌综合治疗中的意义已获得普遍认可[3],但对曲妥珠单抗的临床应用价值仍存在争议。有研究认为,曲妥珠单抗作为一种重组DNA衍生的人源化单克隆抗体,用药后不仅能阻滞癌细胞的生长,还可通过刺激机体免疫细胞达到摧毁癌细胞的目的,抑癌、抗癌效果理想[4]。为探讨曲妥珠单抗联合新辅助化疗对乳腺癌患者病灶组织中相关指标表达的影响,以评估该疗法对乳腺癌患者的临床疗效及预后提升的意义,笔者对此进行了研究。
1 资料与方法
1.1纳入与排除标准
纳入标准:(1)经病理活检确诊且免疫组化检测联合荧光原位杂交技术(FISH)检测结果为HER2过度表达[5]者;(2)符合《中国抗癌协会乳腺癌诊治指南与规范(2011版)》中乳腺癌相关诊断标准[6]及相关治疗适应证者。
排除标准:(1)相关治疗禁忌证者或既往手术史者;(2)入组前有化疗史或放疗史者;(3)合并乳腺组织慢性炎症、其他严重器质性病变、自身免疫性疾病、其他原发性恶性肿瘤、肝肾功能不全、凝血功能障碍者;(4)HER2非过度表达者;(5)临床资料不全者;(6)合并精神疾病或意识障碍者;(7)未成年或年龄>80岁者。
1.2研究对象
选取2012年2月-2014年2月于我院就诊的62例乳腺癌患者为研究对象,全为女性,按随机数字表法分成观察组和对照组,各31例。两组患者的年龄、肿瘤大小、病理分型、TNM分期等一般资料比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。本研究方案经医院医学伦理委员会审核通过,患者均知情同意并签署知情同意书。
表1 两组患者一般资料比较(±s)Tab 1 Comparison of general data between 2groups(±s)

表1 两组患者一般资料比较(±s)Tab 1 Comparison of general data between 2groups(±s)
病理分型,例组别n 年龄,岁肿瘤大小,cm 黏液腺癌 髓样癌TNM分期,例Ⅰ级 Ⅲ级观察组对照组t/χ2P 31 31 41.3±3.5 42.0±3.3 0.810 0.421 4.5±1.7 4.6±1.6 0.238 0.812浸润性导管癌14 14 0.000 1.000浸润性小叶癌11 10 0.072 0.788 44 23 34 88 0.000 1.000 0.218 0.641 0.161 0.688Ⅱ级20 19 0.069 0.793 0.000 1.000
1.3治疗方法
对照组患者术前予以卡铂(CBP)+多西他赛(TXT)新辅助化疗方案:注射用卡铂(扬子江药业集团有限公司,批准文号:国药准字H20044616,规格:100 mg)100 mg+5%葡萄糖注射液稀释至10 mg/ml后再加5%葡萄糖注射液500 ml混合均匀,每个化疗周期的第1天以200~400 mg/m2静脉滴注;多西他赛注射液(齐鲁制药有限公司,批准文号:国药准字H20041129,规格:1 ml∶40 mg)于每个化疗周期的第1天以75 mg/m2静脉滴注;该化疗方案3周为1个周期,持续治疗6个周期。观察组患者在上述化疗基础上联合注射用曲妥珠单抗[Roche Pharma(Schweiz)Ltd.,注册证号:国药准字J20110020,规格:440 mg(20 ml)/瓶]静脉滴注,第1周剂量为4 mg/kg,第2~18周剂量均为2 mg/kg,每周1次,持续治疗18周。化疗结束2周后,参考《中国抗癌协会乳腺癌诊治指南与规范(2011版)》[6]中相关操作规范及要求行乳腺癌改良根治术。
1.4检测方法
治疗前病灶样本通过空心针穿刺肿瘤部位获取,治疗后病灶样本通过乳腺癌改良根治术获取,两次取样位置相同。取样后使用10%中性甲醛固定,常规脱水制成石蜡切片,低温保存备用待检。采用免疫组化法检测病灶样本的HER2蛋白、B7-H1和IL-2表达水平(试剂盒分别购自北京安必奇生物科技有限公司、上海盈公生物技术有限公司、上海古朵生物科技有限公司),对HER2蛋白检测结果为(++)者行FISH检测。
1.5观察指标及评估方法
1.5.1观察指标①观察两组患者的临床疗效及不良反应发生情况;②比较两组患者治疗前后病灶组织中HER2蛋白、B7-H1和IL-2表达情况;③随访1年,记录两组患者的肿瘤复发率、转移率和生存率。
1.5.2临床疗效评估标准参考《乳腺癌HER2检测指南(2009版)》[5]及《中国抗癌协会乳腺癌诊治指南与规范(2011版)》[6]中相关标准评估。完全缓解(CR):影像学复查显示病灶完全消失;部分缓解(PR):影像学复查显示病灶体积缩小50%以上;疾病稳定(SD):影像学复查显示病灶体积缩小0~50%或增加0~25%;疾病进展(PD):影像学复查显示病灶体积增加25%以上或出现新病灶。总有效(RR)=CR+PR。
1.5.3B7-H1与IL-2表达的评估标准[7]B7-H1与IL-2的阳性物质均为棕黄色颗粒物且细胞膜及细胞质着色。细胞着色强度评分——0分:无色;1分:淡黄色;2分:棕黄色;3分:棕褐色。细胞百分比评分——0分:无阳性细胞;1分:阳性细胞计数<10%;2分:阳性细胞计数为11%~50%;3分:阳性细胞计数为51%~75%;4分:阳性细胞计数>75%。B7-H1/IL-2阳性表达:细胞着色强度评分结果×细胞百分比评分结果≥3分,反之为阴性表达。
1.5.4HER2蛋白表达的评估标准[6](-):无着色或细胞膜着色的肿瘤细胞计数<10%;(+):微弱、不完整细胞膜着色的肿瘤细胞计数>10%;(++):弱至中度完整细胞膜着色的肿瘤细胞计数>10%;(+++):清晰、完整的细胞膜着色的肿瘤细胞计数>10%。(-)或(+)为HER2蛋白非过度表达,(+++)为HER2蛋白过度表达;(++)者需再次行FISH检测,以(+)为HER2蛋白过度表达,其他则为非过度表达。
1.6统计学方法
采用SPSS 19.0软件对数据进行统计分析。计量资料以±s表示,采用t检验;计数资料以例或率表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1两组患者临床疗效比较
治疗后,观察组患者的总有效率为83.87%,显著高于对照组的58.06%,差异有统计学意义(P<0.05),详见表2。

表2 两组患者临床疗效比较[例(%%)]Tab 2 Comparison of clinical efficacy between 2 groups [case(%%)]
2.2两组患者病灶组织HER2蛋白表达比较
两组患者治疗前均经免疫组化检测联合FISH检测,确诊为HER2过度表达。治疗后,观察组患者病灶组织HER2蛋白检测结果为非过度表达者有19例(61.29%),显著多于对照组的11例(35.48%),差异有统计学意义(P<0.05),详见表3。
2.3两组患者治疗前后病灶组织B7-H1与IL-2表达比较
治疗前,两组患者病灶组织B7-H1与IL-2表达比较,差异均无统计学意义(P>0.05);治疗后,观察组患者病灶组织B7-H1与IL-2表达阳性率分别为35.48%和6.45%,显著低于治疗前和对照组治疗后,差异均有统计学意义(P<0.05),详见表4。
2.4两组患者不良反应发生率比较
两组患者治疗期间不良反应发生率比较,差异无统计学意义(P>0.05),详见表5。

表3 两组患者病灶组织HER2蛋白表达比较[例(%%)]Tab 3 Comparison of the expression of HER2 protein in lesion tissues between 2groups[case(%%)]
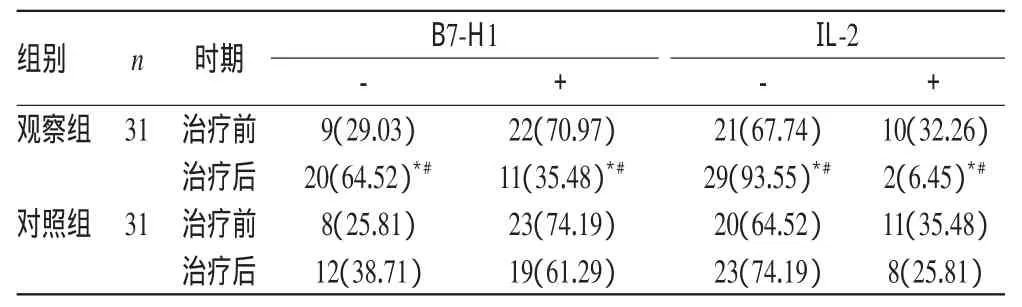
表4 两组患者治疗前后病灶组织B7-H1与IL-2表达比较[例(%%)]Tab 4 Comparison of the expression of B7-H1 and IL-2 in lesion tissues between 2 groups before and after treatment[case(%%)]
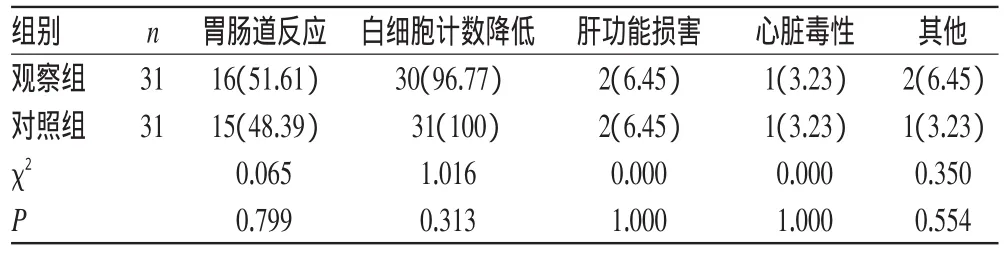
表5 两组患者不良反应发生率比较[例(%%)]Tab 5 Comparison of the incidence of ADR between 2 groups[case(%%)]
2.5两组患者随访期内复发、转移与生存率比较
在为期1年的随访中,两组患者除生存率比较差异无统计学意义(P>0.05)外,观察组患者的复发率与转移率均明显低于对照组,差异有统计学意义(P<0.05),详见表6。

表6 两组患者随访期内复发、转移与生存率比较[例(%%)]Tab 6 Comparison of recurrence,metastasis and survival rates between 2groups during follow-up[case(%%)]
3 讨论
乳腺癌是一种临床较为常见的恶性肿瘤,以女性为高发群体,对患者健康威胁较大。目前,临床对乳腺癌的发病机制尚未有定论,仅发现其发生存在一定规律性,25~55岁的女性患病率较高,家族遗传、月经初潮<12岁、绝经时间>55岁、错失乳腺良性疾病最佳治疗时间、长期吸烟或酗酒、胸部接受高剂量放射线照射、晚婚晚育等均为本病发生的独立危险因素[8],需引起临床重视。
新辅助化疗又称为术前化疗,通过全身化疗+乳腺癌改良根治术的方式提升抗癌效果、延长患者生存时间、改善其预后质量。临床已对该治疗方案在乳腺癌患者综合治疗中的应用价值予以认可,如谢奕彪等[9]在报告中指出,新辅助化疗相较于常规的辅助化疗,具有早期抑制乳腺癌亚临床散播病灶、增强肿瘤化疗敏感性、提升整体抗癌效果的优势[10],对促进乳腺癌患者病情转归有利。
随着临床研究的深入,越来越多的学者发现HER2在乳腺癌的发生、发展中起着重要作用[11],HER2过度表达可能缩短乳腺癌患者的生存期,于其预后提升不利。临床不仅可将其看作肿瘤靶向治疗药物选择的重要靶点[12],还可作为评估临床疗效及患者预后水平的有效指标,为医师制订针对性治疗方案提供依据。曲妥珠单抗是一种由重组DNA衍生的人源化单克隆抗体,可选择性地作用于HER2的细胞外部位[13],通过提高在HER2上的附着率抑制人体表皮生长因子在HER2上的附着,以此阻滞癌细胞生长,达到抑癌目的。当前临床对曲妥珠单抗在乳腺癌中的应用研究多集中于根治术后辅助治疗上,其在术前化疗中的应用价值还存在较大争议。本研究以此为方向,发现在乳腺癌改良根治术前予以曲妥珠单抗联合新辅助化疗方案的观察组患者的临床总疗效及肿瘤细胞在术后的转移、复发抑制效果均显著优于仅予以新辅助化疗方案的对照组患者,且用药安全性突出,对心脏毒性反应轻微,无因用药至治疗终止病例,同刘君等[14]报告结论基本一致。提示该联合疗法在HER2过度表达乳腺癌患者术前治疗中的应用价值较高,不仅能通过促进肿瘤细胞凋亡和阻滞细胞生长周期、抑制血管生成等手段达到抑癌、抗癌目的,还具备良好的用药安全性。
此前已有学者就B7-H1与IL-2在乳腺癌病灶组织中的表达及临床意义展开分析,认为其表达程度同乳腺癌患者病情的严重程度密切相关[15],可作为临床指导乳腺癌综合治疗的有效依据应用于诊疗过程中,以此提升治疗方案的针对性与安全性,全面提升治疗效果,延长患者生存时间。本研究也发现,B7-H1在病灶组织中的阳性率较高,为72.58%(45/62),同邹小盼等[16]报告结论类似;而IL-2在病灶组织中的阳性率较低,仅为33.87%(21/62),提示临床可将病灶组织中的高B7-H1表达和低IL-2表达作为乳腺癌诊断及评估病情的有效指标,以此缩短诊疗时间、提高诊疗效率。观察组患者治疗后病灶内上述指标的阳性率均较治疗前明显降低,表明曲妥珠单抗联合新辅助化疗能有效促进乳腺癌患者病情转归,抗癌效果理想。
综上所述,在乳腺癌改良根治术前应用曲妥珠单抗联合新辅助化疗方案,可有效改善HER2过度表达的乳腺癌患者病灶组织HER2蛋白、B7-H1与IL-2的表达,提高临床疗效,且用药安全,患者术后肿瘤复发、转移的风险较低。但受样本量的限制,本研究结论尚待后续扩大样本量深入分析。
[1] 郑莹,吴春晓,张敏璐,等.乳腺癌在中国的流行状况和疾病特征[J].中国癌症杂志,2013,23(8):561.
[2] 李慧慧,马飞,曾瑄,等.乳腺癌HER2的表达与临床病理特征的关系[J].中华医学杂志,2011,91(2):76.
[3] 应雪珍,黄春军.曲妥珠单抗联合术前辅助化疗用于HER2阳性乳腺癌的临床观察[J].中国药房,2015,26(29):4104.
[4]殷科,曹永晋.曲妥珠单抗新辅助化疗表皮生长因子受体2阳性乳腺癌的临床疗效及安全性评价[J].中国临床药理学杂志,2015,31(9):725.
[5]《乳腺癌HER2检测指南(2009版)》编写组.乳腺癌HER2检测指南:2009版[J].中华病理学杂志,2009,38(12):836.
[6]中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范:2011版[J].药品评价,2012,9(6):26.
[7] 陈陆俊,孙静,张磊,等.负性协同刺激分子B7-H1和B7-H3在乳腺癌组织中的表达及其临床意义[J].中国肿瘤生物治疗杂志,2009,16(3):277.
[8]陶苹,胡耀月,黄源,等.亚裔女性乳腺癌危险因素的Meta分析[J].中华流行病学杂志,2011,32(2):164.
[9] 谢奕彪,边莉,王涛,等.曲妥珠单抗联合蒽环类及紫杉类方案在乳腺癌新辅助化疗中安全性的观察和分析[J].中国癌症杂志,2012,22(5):396.
[10] 陈伟财,何劲松,吴恢升,等.TCH与TAC新辅助化疗在HER2过表达乳腺癌中的疗效观察[J].中国肿瘤临床,2014,41(6):373.
[11]耿强,钱晓龙,付丽,等.乳腺癌HER2检测的概况与进展[J].中国肿瘤临床,2014,41(10):671.
[12] 刘亮,李明春.以表皮生长因子受体为作用靶点的抗肿瘤药物研究进展[J].中国药房,2015,26(5):711.
[13] 陈伟财,何劲松,王敏,等.联合曲妥珠单抗新辅助化疗对HER2过表达乳腺癌的疗效[J].中华普通外科杂志,2011,26(9):783.
[14] 刘君,杨艳芳,顾林,等.曲妥珠单抗在HER2阳性乳腺癌患者新辅助治疗中的应用研究进展[J].中国肿瘤临床,2014,41(16):1065.
[15]洪荫,涂健,朱旬,等.免疫共刺激分子B7-H1在乳腺癌组织中的表达及其临床意义[J].临床与实验病理学杂志,2015,31(11):1232.
[16]邹小盼,郑新宇.B7同源体1和白细胞介素2在乳腺癌组织中的表达及其临床意义[J].中华乳腺病杂志:电子版,2015,9(4):247.
(编辑:胡晓霖)
Clinical Observation of Trastuzumab Combined with Neoadjuvant Chemotherapy for HER2 Overexpressing Breast Cancer
YAN Haishan,ZHANG Bingyan(Dept.of Radiotherapy,Hebi Municipal People’s Hospital,Henan Hebi 458030,China)
OBJECTIVE:To investigate clinical efficacy and safety of trastuzumab combined with neoadjuvant chemotherapy on breast cancer,and discuss its effects on the expression of HER2 protein,B7 homolog 1(B7-H1)and IL-2.METHODS:62 patients with breast cancer confirmed by pathological biopsy,whose test results of immunohistochemistry combined with fluorescence in situ hybridization(FISH)was overexpression of HER2,were selected as the research object.They were randomly divided into observation group and control group with 31 cases in each group.Control group was given carboplatin combined with docetaxel neoadjuvant chemotherapy before surgery.Observation group was additionally given Trastuzumab for injection intravenously 4 mg/kg in the first week,2 mg/kg in second-eighteenth week,once a week,for consecutive 18 weeks.Modified radical mastectomy was conducted 2 weeks after chemotherapy.Clinical efficacy and the occurrence of ADR were observed in 2 groups.The expression of HER2 protein,B7-H1 and IL-2 in tumor tissues were compared between 2 groups before and after treatment.With 1-year follow-up,tumor recurrence rates,metastasis rates and survival rates were recorded in 2 groups.RESULTS:After treatment,total effective rate of observation group was 83.87%,which was significantly higher than that of control group(58.06%),with statistical significance(P<0.05);the test result of HER2 protein in lesion tissues was non-overexpression in 19 cases(61.29%)in observation group which was significantly higher than that of control group(11 cases,35.48%),with statistical significance(P<0.05);the positive expression rates of B7-H1 and IL-2 in lesion tissues of observation group were significantly lower than those before treatment and control group after treatment,with statistical significance(P<0.05).There was no statistical significance in the incidence of ADR between 2 groups(P>0.05).During 1-year follow-up period,except that there was no statistically significant difference in survival rate between 2 groups(P>0.05),the recurrence rate and metastasis rate of observation group were significantly lower than those of control group,with statistical significance(P<0.05).CONCLUSIONS:The application of trastuzumab combined with neoadjuvant chemotherapy before breast cancer modified radical mastectomy can effectively improve the expression levels of HER2 protein,B7-H1 and IL-2 in lesion tissue of patients with breast cancer,promote clinical efficacy with good safety and low risk of tumor recurrence and metastasis after operation.
Trastuzumab;Neoadjuvant chemotherapy;Breast cancer;HER2;B7-H1;IL-2
R737.9
A
1001-0408(2016)29-4127-04
10.6039/j.issn.1001-0408.2016.29.31
*主治医师。研究方向:肺癌、消化道肿瘤、乳腺癌。电话:0392-3220113。E-mail:495235474@qq.com
(2015-12-23
2016-05-12)
