甲状腺乳头状癌合并Graves病淋巴结转移癌的高危因素分析
2016-11-18刘跃武王梦一王文泽刘洪沨李小毅高维生
谢 勇,刘跃武,王梦一,王文泽,刘洪沨,李小毅,高维生
中国医学科学院 北京协和医学院 北京协和医院 1基本外科 2病理科,北京 100730
·论 著·
甲状腺乳头状癌合并Graves病淋巴结转移癌的高危因素分析
谢 勇1,刘跃武1,王梦一1,王文泽2,刘洪沨1,李小毅1,高维生1
中国医学科学院 北京协和医学院 北京协和医院1基本外科2病理科,北京 100730
目的 总结甲状腺乳头状癌合并Graves病患者相关淋巴结转移癌的特征以及对预后的影响,为临床治疗提供依据。方法 2004年1月至2013年12月在北京协和医院收治的甲状腺乳头状癌合并Graves病的患者98例,根据有无淋巴结转移分为淋巴结转移阳性组(n=34)和淋巴结转移阴性组(n=64),对两组患者的一般情况、血生化指标、病理结果和预后进行比较。结果 两组患者在性别(χ2=0.2113,P=0.6458)、年龄(t=1.7000,P=0.0922)、肿瘤直径(t=1.2559,P=0.2122)、是否为多灶肿瘤(χ2=1.9170,P=0.1661)等方面差异均无统计学意义。淋巴结转移阳性组的中位促甲状腺激素受体抗体(TR-Ab)水平为4.84 U/L,明显高于阴性组的2.99 U/L(t=2.0169,P=0.0465);两组患者在血清促甲状腺激素(t=0.0257,P=0.9800)、游离三碘甲状腺原氨酸(t=1.3610,P=0.1770)、游离甲状腺素(t=0.0082,P=0.9930)、甲状腺过氧化物酶抗体(t=0.0177,P=0.9860)和甲状腺球蛋白抗体水平(t=1.1450,P=0.2550)等方面差异均无统计学意义。术后病理结果显示,淋巴结转移阳性组患者的肿瘤突破包膜比例(26.5%比9.38%;χ2=5.006,P=0.0253)和淋巴结复发率(14.7%比1.56%;χ2=4.583,P=0.0323)均明显高于阴性组。淋巴结转移阳性组和阴性组的远处转移率分别为5.88%和0。结论 合并Graves病甲状腺乳头状癌患者的淋巴结转移与肿瘤大小关系尚不明确,其淋巴结转移的高危因素是TR-Ab升高及肿瘤突破包膜,且淋巴结复发率更高。
甲状腺乳头状癌;Graves病;淋巴结转移;危险因素
ActaAcadMedSin,2016,38(5):554-558
甲状腺乳头状癌的发病率逐年上升,其中约0.15%~15%的患者合并甲状腺功能亢进[1- 4],其生物学特性及治疗原则各家报道不一[5- 7]。以往多数研究对甲状腺功能亢进的原因缺乏分析,尤其缺乏对Graves病这类甲状腺功能亢进患者的报道,研究多集中于首发诊断为甲状腺功能亢进的患者,且多数患者手术指征为甲状腺功能亢进,合并甲状腺结节体积较小甚至术前未发现结节,术后病理才发现合并甲状腺乳头状癌。目前对于甲状腺乳头状癌合并Graves病患者的淋巴结转移癌在疾病特征上有无特别之处尚无明确结论,本研究总结了此类患者相关淋巴结转移癌的特征以及对预后的影响,以期为今后的临床治疗提供依据。
对象和方法
对象 2004年1月至2013年12月在北京协和医院收治的甲状腺乳头状癌合并Graves病患者98例,占同期甲状腺乳头状癌患者的1.99%(98/4926),其中,男11例,女87例,中位发病年龄44岁(17~75岁)。入选标准:(1)超声诊断甲状腺结节不能除外恶性,且合并Graves病;(2)术后病理证实为甲状腺乳头状癌。排除标准:术前因Graves病接受过放射性碘治疗。Graves病诊断标准:(1)甲状腺功能亢进合并甲状腺吸碘率增加;(2)存在促甲状腺激素受体抗体(thyrotrophin receptor antibody,TR-Ab),甲状腺核素扫描提示弥漫性高摄取。98例患者的Graves病中位病程为49个月(1~373个月),发现甲状腺结节到接受手术的中位时间为8个月(1~72个月),其中19例(19.4%)患者在发现甲状腺结节的同时诊断为Graves病。所有患者均行甲状腺及颈部淋巴结超声,血清促甲状腺激素(thyroid stimulating hormone,TSH)、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、游离甲状腺素(free thyroxine,FT4)、甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPO-Ab)、甲状腺球蛋白抗体(thyroglobulin antibody,TG-Ab)、TR-Ab、甲状腺吸碘率和甲状腺核素扫描等检查。
方法 所有患者手术前均常规口服抗甲状腺药物治疗直到甲状腺功能正常,然后行卢戈氏液口服10滴每日3次准备2~4周。根据患者术前超声提示结节大小、部位、是否有可疑恶性肿瘤特征,有无侵犯甲状腺包膜、是否有可疑淋巴结转移和转移淋巴结部位及术前穿刺病理结果或术中冰冻病理结果等特点,参照美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)甲状腺癌临床指南[8],对于术前超声未发现侧方淋巴结异常表现的患者采取双侧甲状腺全切合并第6区淋巴结清扫;若术前超声提示侧方淋巴结形态异常,如皮髓质分解不清、钙化、血流信号丰富且不规则等特征,则行双侧甲状腺全切合并第6区及侧方淋巴结清扫。
术后患者参照NCCN甲状腺癌临床指南进行综合治疗及随诊[8]。所有患者均采取TSH抑制治疗。对于肿瘤未突破包膜、颈部淋巴结无转移患者不进行放射性碘同位素等治疗,对肿瘤突破包膜、合并颈部淋巴结转移、远处转移等情况可选用放射性碘同位素治疗。术后每半年进行颈部超声复查甲状腺床及颈部淋巴结复发情况,监测血TSH及甲状腺球蛋白(thyroglobulin,TG)。对于血Tg异常患者行胸部CT、腹部超声、全身骨扫描等监测远处转移情况。
根据术后病理结果将98例患者分为淋巴结转移阳性组(n=34)和淋巴结转移阴性组(n=64)两组,对两组患者的一般情况、血生化指标、病理结果和预后进行比较。
统计学处理 采用SPSS 11.5统计软件,计量资料以中位数表示,计数资料以计数表示;计量资料的组间比较采用独立样本t检验,计数资料的组间比较采用四格表卡方检验;多因素分析采用二分类Logistic回归分析法;P<0.05为差异有统计学意义。
结 果
两组患者一般情况的比较 淋巴结转移阳性组和阴性组患者在性别(χ2=0.2113,P=0.6458)、年龄(t=1.7000,P=0.0922)、肿瘤直径(t=1.2559,P=0.2122)、是否为多灶肿瘤(χ2=1.9170,P=0.1661)等方面差异均无统计学意义(表1)。
两组患者血生化指标的比较 淋巴结转阳性组的中位TR-Ab水平为4.84 U/L,明显高于阴性组的2.99 U/L(t=2.0169,P=0.047);两组患者在TSH(t=0.0257,P=0.9800)、FT3(t=1.3610,P=0.1770)、FT4(t=0.0082,P=0.9930)、TPO- Ab(t=0.0177,P=0.9860)和TG- Ab(t=1.1450,P=0.2550)等方面差异均无统计学意义(表2)。
两组患者手术和病理结果的比较 淋巴结阴性组64例患者中,有59例行双侧甲状腺切除合并第6区颈部淋巴结清扫,5例行双侧甲状腺切除合并第6区及侧方颈部淋巴结清扫;淋巴结阳性组34例患者中,有20例行双侧甲状腺切除合并第6区颈部淋巴结清扫,14例行双侧甲状腺切除合并第6区及侧方颈部淋巴结清扫。术后病理检查结果显示,淋巴结转移阳性组的肿瘤包膜突破率为26.5%(9/34),明显高于淋巴结阴性组的9.38%(6/64)(χ2=5.006,P=0.0253)。淋巴结转移阳性组侧方淋巴结转移阳性为11例(78.6%),淋巴结阴性组为0例。
两组患者的预后比较 随访发现淋巴结转移阳性组有5例(14.7%)淋巴结复发,其中2例为中央区淋巴结,3例为侧方淋巴结;术后8个月及术后31个月时发现2例肺部转移,远处转移率为5.88%。相对应淋巴结阴性组仅有1例中央区淋巴结复发,复发率为1.56%;无远处转移。两组患者的淋巴结复发差异有统计学意义(χ2=4.583,P=0.0323)。
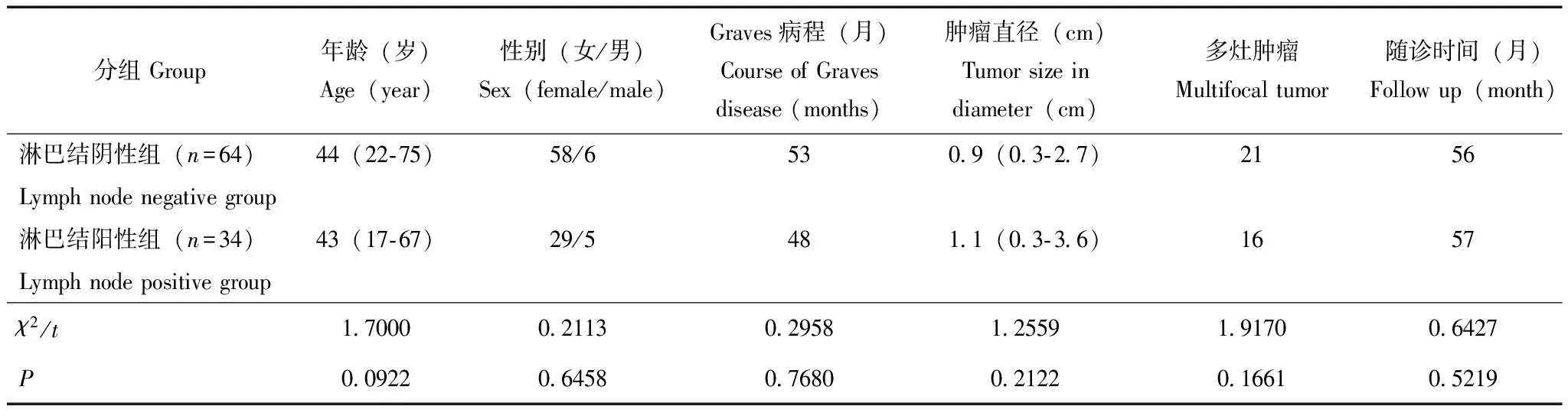
表 1 两组患者一般情况的比较
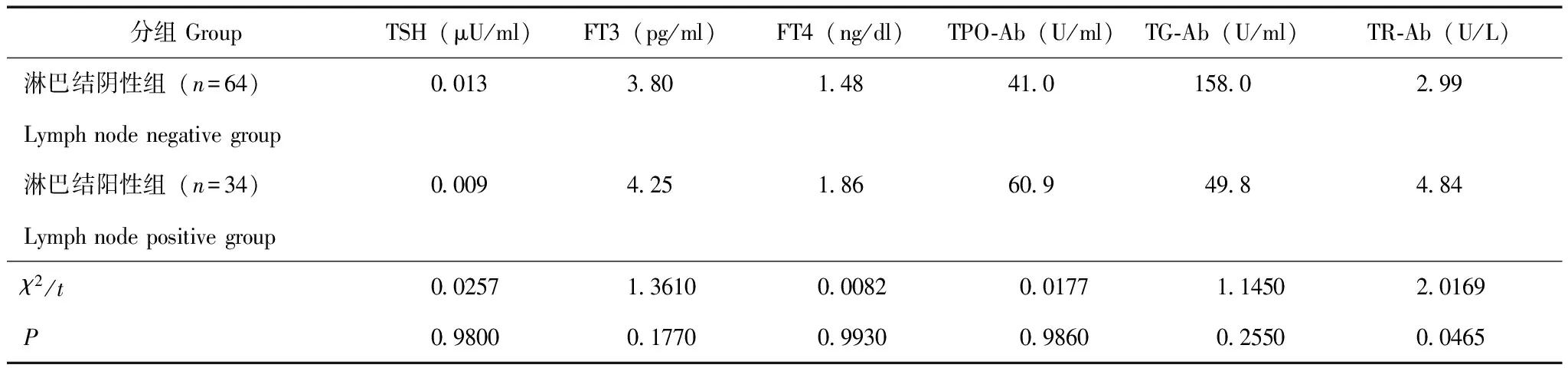
表 2 两组患者血生化指标的比较
TSH:促甲状腺素;FT3:游离三碘甲状腺原氨酸;FT4:游离甲状腺素;TPO-Ab:甲状腺过氧化酶抗体;TG-Ab:甲状腺球蛋白抗体;TR-Ab:甲状腺受体抗体
TSH: thyroid stimulating hormone; FT3: free triiodothyronine; FT4: free thyroxine; TPO-Ab:thyroid peroxidase antibody; TG-Ab:thyroid globulin antibody; TR-Ab:thyroid receptor antibody
讨 论
合并Graves病的甲状腺乳头状癌占所有甲状腺乳头状癌的比率各家报道不一[9],本组资料为1.99%(98/4924),推测其原因可能为大部分研究病例数目较少,各医疗中心收治患者病种及治疗策略存在差异,各研究对甲状腺功能亢进的诊断标准也存在差异。随着超声的广泛应用,甲状腺结节的检出率有上升趋势,其中女性患者占多数,本组98例中女性患者比例高达88.8%,与既往研究相符[10]。
本研究根据术后病理是否有淋巴结转移分为两组,原因如下:(1)在手术治疗策略上两组存在区别。根据NCCN指南,若存在淋巴结转移需行颈部淋巴结清扫,反之仅需切除甲状腺腺体。目前临床在术前尚无确诊颈部淋巴结转移的有效方法,故寻找两组患者的特征及差异,对手术方式选择很有帮助。(2)最近研究表明,合并淋巴结转移癌的患者预后更差。甲状腺乳头状癌区域淋巴结转移对预后的影响存在争议[11]。然而,Podnos等[12]通过对SEER数据库中19 918例患者的回顾性分析结果显示,淋巴结阴性患者有更好的长期预后,尤其是大于45岁的中老年患者[13]。
研究显示,影响淋巴结转移的危险因素中最主要的为肿瘤大小及是否突破甲状腺包膜[14- 15]。Karatzas等[16]研究发现,肿瘤大于1.0 cm甲状腺乳头状癌患者淋巴结转移率明显上升。本组资料显示,对于合并Graves病甲状腺乳头状癌患者,是否合并淋巴结转移与肿瘤直径无明显关系,两组患者肿瘤直径中位数分别为0.9 cm及1.1 cm,推测其原因可能与多数甲状腺功能亢进患者随诊密切,可更早发现肿瘤有关。
Mirallié等[17]的多因素回归分析结果显示,肿瘤突破甲状腺包膜及甲状腺外侵犯为淋巴结转移的预测因素。本研究发现,淋巴结转移阳性组的肿瘤包膜突破率为26.5%(9/64),明显高于淋巴结阴性组的18.8%(6/34),提示肿瘤突破甲状腺包膜与淋巴结转移阳性显著相关。
对于合并Graves病的甲状腺乳头状癌病例,TR- Ab与疾病的预后关系一直存在争议。TSH和TR- Ab与TSH受体结合会刺激甲状腺分泌及甲状腺肿瘤生长。Graves病患者TSH受到抑制,TR- Ab在细胞代谢中发挥了主要作用[18]。有报道表明,血清高水平的TR- Ab表达与甲状腺乳头状癌的转移呈正相关[6,19]。然而最近Yano等[7]研究结果显示,TR- Ab的表达与甲状腺乳头状癌的转移并无相关性。本研究中淋巴结转移阳性组的TR- Ab水平明显升高,提示TR- Ab可能参与了甲状腺乳头状癌的转移过程,推测其机制可能为TR- Ab激活癌细胞的cAMP通路从而刺激了癌细胞的生长[19]。
本研究结果还发现,在肿瘤较小时就可以出现淋巴结转移,肿瘤直径中位数0.9 cm,总体淋巴结转移率为34.7%。此外,淋巴结转移的患者常合并侧方淋巴结转移(32.4%),也易出现淋巴结复发(14.7%),因此对于此类患者应给予积极的治疗。
合并Graves病是否影响甲状腺乳头状癌患者的预后目前也存在争议。有报道指出合并Graves病的甲状腺乳头状癌具有更强的侵袭性,更易发生淋巴结转移,预后更差[20- 21]。然而最近大宗的报道并没有证据显示合并Graves病会加重肿瘤的发展[7,22]。在临床上也存在着两种截然相反的观点。一种观点是合并Graves病的甲状腺乳头状癌预后更差,需要更大范围的手术及更积极的同位素治疗,另一种观点是这类患者普遍预后更好。推测原因可能为:(1)既往研究多针对Graves病患者,术前是否怀疑合并甲状腺恶性结节的描述不详细,部分患者术前没有甲状腺结节的诊断,从而选取研究对象时合并了相当一部分甲状腺隐匿癌的患者,而这类患者临床预后自然较好,干扰了总体判断。(2)由于总体病例数相对较小,难以进行分层分析。本研究中合并Graves病的肿瘤直径中位数为0.9 cm,推测是因为甲状腺功能亢进患者在治疗过程中更频繁地接受甲状腺超声检查,从而能更早发现甲状腺肿瘤,更及时得到治疗,所以较普通甲状腺患者分期更早,也是影响预后的一个重要因素。
由于合并Graves病是否影响甲状腺乳头状癌患者的预后存在争议,所以其治疗方式,尤其是手术范围也存在争议[23]。传统观点认为对这类患者应该行甲状腺全切加上区域淋巴结清扫,术后行放射性同位素治疗[24]。然而最近越来越多的证据表明,应该根据术前肿瘤分期来决定手术范围[7,25]。我们认为,由于目前没有证据显示扩大手术范围对预后有利,因此结合术前超声及术中对肿瘤的检查能有效地在手术时对肿瘤分期。根据肿瘤分期,按照普通甲状腺乳头状癌治疗原则来决定手术范围是合适的,但对于TR- Ab增高患者,建议采取更加积极的手术方式和随诊。
本研究存在以下局限性:(1)相关病例数量有限,难以进行前瞻性对照研究;(2)甲状腺乳头状癌的自然病程缓慢,预后良好,所以需要更长的随诊时间以期待有更多的发现。
[1]Linos DA,Karakitsos D,Papademetriou J. Should the primary treatment of hyperthyroidism be surgical[J]. Eur J Surg,1997,163(9):651- 657.
[2]Kraimps JL,Bouin-Pineau MH,Mathonnet M,et al. Multicentre study of thyroid nodules in patients with Graves’ disease[J]. Br J Surg,2000,87(8):1111- 1113.
[3]Gabriele R,Letizia C,Borghese M,et al. Thyroid cancer in patients with hyperthyroidism[J]. Horm Res,2003,60(2):79- 83.
[4]Calò PG,Tatti A,Farris S,et al. Differentiated thyroid carcinoma and hyperthyroidism: a frequent association[J]. Chir Ital,2005,57(2):193- 197.
[5]Cappelli C,Braga M,De Martino E,et al. Outcome of patients surgically treated for various forms of hyperthyroidism with differentiated thyroid cancer: experience at an endocrine center in Italy[J]. Surg Today,2006,36(2):125- 130.
[6]Kikuchi S,Noguchi S,Yamashita H,et al. Prognosis of sm-all thyroid cancer in patients with Graves’ disease[J]. Br J Surg,2006,93(4):434- 439.
[7]Yano Y,Shibuya H,Kitagawa W,et al. Recent outcome of Graves’ disease patients with papillary thyroid cancer[J]. Eur J Endocrinol,2007,157(3):325- 329.
[8]Tuttle RM,Haddad RI,Ball DW,et al. Thyroid carcinoma,version 2.2014[J]. J Natl Compr Canc Netw,2014,12(12):1671- 1680.
[9]Tam AA,Kaya C,Kilic FB,et al. Thyroid nodules and thyroid cancer in Graves’ disease[J]. Arq Bras Endocrinol Metabol,2014,58(9):933- 938.
[10]Gul K,Di RKA,Ki YG,et al. Thyroid carcinoma risk in patients with hyperthyroidism and role of preoperative cytology in diagnosis[J]. Minerva Endocrinol,2009,34(4):281- 288.
[11]Cooper DS,Doherty GM,Haugen BR,et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer[J]. Thyroid,2009,19(11):1167- 1214.
[12]Podnos YD,Smith D,Wagman LD,et al. The implication of lymph node metastasis on survival in patients with well-differentiated thyroid cancer[J]. Am Surg,2005,71(9):731- 734.
[13]Zaydfudim V,Feurer ID,Griffin MR,et al. The impact of lymph node involvement on survival in patients with papillary and follicular thyroid carcinoma[J]. Surgery,2008,144(6):1070- 1078.
[14]Zhou YL,Gao EL,Zhang W,et al. Factors predictive of papillary thyroid micro-carcinoma with bilateral involvement and central lymph node metastasis: a retrospective study[J]. World J Surg Oncol,2012,10(1):67- 72.
[15]Pyo JS,Sohn JH,Kang G,et al. Characteristics of neck level Ⅵ lymph nodes in papillary thyroid carcinoma: correlation between nodal characteristics and primary tumor[J]. Endocr Pathol,2015,26(1):15- 20.
[16]Karatzas T,Vasileiadis I,Kapetanakis S,et al. Risk factors contributing to the difference in prognosis for papillary versus micropapillary thyroid carcinoma[J]. Am J Surg,2013,206(4):586- 593.
[17]Mirallié E,Sagan C,Hamy A,et al. Predictive factors for node involvement in papillary thyroid carcinoma. Univariate and multivariate analyses[J]. Eur J Cancer,1999,35(3):420- 423.
[18]Van Sande J,Lejeune C,Ludgate M,et al. Thyroid stimulating immunoglobulins,like thyrotropin activate both the cyclic AMP and the PIP2 cascades in CHO cells expressing the TSH receptor[J]. Mol Cell Endocrinol,1992,88(1- 3):R1- R5.
[19]Filetti S,Belfiore A,Amir SM,et al. The role of thyroid-stimulating antibodies of Graves’ disease in differentiated thyroid cancer[J]. N Engl J Med,1988,318(12):753- 759.
[20]Belfiore A,Garofalo MR,Giuffrida D,et al. Increased aggressiveness of thyroid cancer in patients with Graves’ disease[J]. J Clin Endocrinol Metab,1990,70(4):830- 835.
[21]Stocker DJ,Burch HB. Thyroid cancer yield in patients with Graves’ disease[J]. Minerva Endocrinol,2003,28(3):205- 212.
[22]Edmonds CJ,Tellez M. Hyperthyroidism and thyroid cancer[J]. Clin Endocrinol (Oxf),1988,28(2):253- 259.
[23]Wei S,Baloch ZW,LiVolsi VA. Thyroid carcinoma in patients with Graves’ disease: an institutional experience[J]. Endocr Pathol,2015,26(1):48- 53.
[24]Pellegriti G,Belfiore A,Giuffrida D,et al. Outcome of differentiated thyroid cancer in Graves’ patients[J]. J Clin Endocrinol Metab,1998,83(8):2805- 2809.
[25]Duh QY. Thyroid cancer in Graves disease: incidental cancer versus clinical cancer[J]. Ann Surg Oncol,2004,11(4):356- 357.
Risk Factors of Lymphnode Metastasis in Patients with Thyroid Papillary Carcinoma Associated with Graves Disease
XIE Yong1,LIU Yue-wu1,WANG Meng-yi1,WANG Wen-ze2,LIU Hong-feng1,LI Xiao-yi1,GAO Wei-sheng1
1Department of General Surgery,2Department of Pathology,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
LIU Yue-wu Tel:010- 69152611,E-mail:liuyuewu615@vip.sina.com
Objective To summarize the characteristics of lymph node metastasis in patients with papillary thyroid carcinoma accompanied with Graves disease,and to provide evidence for clinical treatment. Methods Totally 98 patients with papillary thyroid carcinoma and Graves disease who had been treated in Peking Union Medical College Hospital from January 2004 to December 2013 were divided into the lymph node metastasis positive group (n=34) and lymph node metastasis negative group (n=64). The general information,blood biochemical results,pathological results,and prognoses were compared between these two groups. Results These two groups showed no significant differences in gender (χ2=0.2113,P=0.6458),age (t=1.7000,P=0.0922),tumor diameter (t=1.2559,P=0.2122),and multifocal tumors (χ2=1.9170,P=0.1661). The median level of thyrotropin receptor antibody (TR-Ab) value in the lymph node metastasis positive group was 4.84 U/L,which was significantly higher than that in the negative group which was 2.99 U/L (t=2.0169,P=0.0465). There were no significant differences in serum thyroid stimulating hormone (t=0.0257,P=0.9800),free triiodothyronine (t=1.3610,P=0.1770),free thyroxine (t=0.0082,P=0.9930),thyroid peroxidase antibody (t=0.0177,P=0.9860),and thyroglobulin antibody levels (t=1.1450,P=0.2550) between two groups. The postoperative pathological results showed that tumor capsular invasion rate (26.5%vs. 9.38%;χ2=5.006,P=0.0253) and lymph node recurrence rate (14.7%vs. 1.56%;χ2=4.583,P=0.0323) were significantly higher in the positive group than in the negative group. The distal metastasis rate in the positive group and negative group were 5.88% and 0,respectively. Conclusions There is no definite association between lymph node metastasis and tumor size in patients with thyroid papillary carcinoma associated with Graves disease. The risk factors for lymph node metastasis include TR-Ab and tumor capsular invasion,with a higher incidence of lymph nodes recurrence.
thyroid papillary carcinoma;Graves disease;lymph node metastasis;risk factor
刘跃武 电话:010- 69152611,电子邮件:liuyuewu615@vip.sina.com
R736.1
A
1000- 503X(2016)05- 0554- 05
10.3881/j.issn.1000- 503X.2016.05.011
2015- 11- 23)
