丹参酮ⅡA对重症胰腺炎肺损伤大鼠的保护作用研究*
2016-11-18吴燕丽龚
吴燕丽龚 静△刘 芳
(1.华中科技大学同济医学院附属同济医院,湖北 武汉 430030;2.湖北省武汉市第十一医院,湖北 武汉 430000)
·研究报告·
丹参酮ⅡA对重症胰腺炎肺损伤大鼠的保护作用研究*
吴燕丽1龚 静1△刘 芳2
(1.华中科技大学同济医学院附属同济医院,湖北 武汉 430030;2.湖北省武汉市第十一医院,湖北 武汉 430000)
目的 探讨丹参酮ⅡA对重症急性胰腺炎肺损伤的作用及机制。方法 100只大鼠随机分为正常组、模型组、血红素加氧酶-1(HO-1)诱导组、环氧合酶-2(COX-2)抑制组和丹参酮ⅡA组5组各20只,后4组大鼠采用传统的牛磺胆酸钠法进行造模,丹参酮ⅡA组于术后给予40 mg/kg的丹参酮ⅡA腹腔注射,HO-1诱导组于造模后5 min静脉注射牛血晶素,COX-2抑制组于造模前2 h灌胃Celeeoxib水溶液,模型组、正常组给予等体积0.9%氯化钠注射液。分别观察各组大鼠血清中肿瘤坏死因子-α(TNF-α)与HO-1含量,肺组织匀浆中的髓过氧化物酶 (MPO)、COX-2含量以及肺组织的病理学变化。结果 各组大鼠肺组织病理学改变,正常组大鼠的肺组织结构完整,肺泡腔清晰,肺泡隔无水肿、炎细胞浸润等改变;模型组大鼠肺间质充血明显伴多量以淋巴细胞为主的炎细胞浸润,肺泡隔明显增厚,部分肺泡代偿性扩张;HO-1诱导组、COX-2抑制组大鼠肺间质轻度充血,肺泡隔轻度增厚,偶见局灶性炎细胞(淋巴细胞为主);丹参酮IIA组大鼠的肺间质充血、肺泡隔增厚、增厚范围及炎细胞浸润较模型组减轻。造模后3 h,模型组大鼠体内TNF-α、HO-1含量均高于正常组(均P<0.05),随后模型组大鼠体内TNF-α、HO-1含量急剧上升。造模后3 h,HO-1诱导组、COX-2抑制组与丹参酮ⅡA组大鼠体内的TNF-α含量开始下降,与模型组比较差别不大(P>0.05);而HO-1含量开始升高与模型组比较差别不大(P>0.05);造模后12 h,TNF-α含量与模型组比较下降(P<0.05),HO-1含量与模型组比较升高(P<0.05)。造模后3 h,模型组大鼠肺组织中MPO、COX-2含量均高于正常组(均P<0.05),随后模型组大鼠肺组织中MPO、COX-2含量均急剧上升(均P<0.05)。造模后3 h,HO-1诱导组、COX-2抑制组与丹参酮ⅡA组肺组织中MPO、COX-2含量开始降低,但与模型组比较差别不大 (均P>0.05),造模后12 h,MPO、COX-2含量与模型组比较降低(均P<0.05)。结论 丹参酮ⅡA对重症胰腺炎引起的肺损伤有明显改善作用,其机制可能是通过调控HO-1与COX-2的表达发挥肺损伤的保护作用。
重症急性胰腺炎 肺损伤 丹参酮ⅡA 血红素加氧酶-1 环氧合酶-2
当机体发生重症急性胰腺炎时,在胰腺本身出现缺血、坏死的基础上,多合并全身性反应,导致其他脏器功能的紊乱,严重者导致多个脏器功能的衰竭,其中急性肺损伤(ALI)是SAP死亡的首要原因[1]。有资料显示,机体内血红素加氧酶-1(HO-1)及环氧合酶-2(COX-2)的表达与急性肺损伤的发生机制存在着明显的相关性[2]。研究发现丹参酮ⅡA对重症胰腺炎以及脓毒症引起的肺损伤均有明显的保护作用[3-4],但其是否通过调控HO-1与COX-2的表达发挥肺损伤的保护作用尚不清楚,因此,本研究通过建立重症急性胰腺炎大鼠模型,拟观察重症急性胰腺炎肺损伤大鼠肺内HO-1及COX-2的表达情况及丹参酮ⅡA干预后的变化,探讨丹参酮ⅡA对重症胰腺炎肺损伤保护的具体机制。现报告如下。
1 材料与方法
1.1 实验动物 清洁级健康雄性Wistar大鼠100只,体质量180~220 g,由同济医学院动物实验中心提供(动物合格证号:SCXK鄂2009-0003)。
1.2 药物和试剂 丹参酮ⅡA磺酸钠注射液 (诺新康,2 mL∶10 mg,上海第一生化药业有限公司产品,国药准字H31022558);牛血晶素(HO-1诱导剂),美国B&D公司生产;牛磺胆酸钠,Celeeoxib美国Sigma公司生产;髓过氧化物酶(MPO)检测试剂盒,由武汉博士德生物有限公司提供;白介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)、HO-1与COX-2 ELISA检测试剂盒,均由北京华耐特生物科技有限公司提供,其他试剂均为国产分析纯。
1.3 分组与造模 100只大鼠按随机数字表法分为5组,即正常组、模型组、HO-1诱导组、COX-2抑制组以及丹参酮ⅡA组,每组20只。采用3%的戊巴比妥钠静脉注射充分麻醉大鼠,于大鼠腹正中线作切口常规开腹,逐层入腹,充分暴露肝门部肝总管及胰胆管,血管夹夹闭胆胰管入肝门段及十二指肠处,并逆行胆胰管内注射器注射5%牛磺胆酸钠(0.1 mL/100 g),观察到腹腔胰腺组织出现弥漫性出血点时拔出针头,去除血管夹,缝合腹部。
1.4 给药方法 HO-1诱导组于造模后5min向肠系膜静脉注射牛血晶素75 μg/kg。丹参酮ⅡA组术后腹腔注射40 mg/kg的丹参酮ⅡA磺酸钠注射液。COX-2抑制组于造模前2 h灌胃Celeeoxib水溶液,正常组和模型组给予等体积生理盐水灌胃。5组大鼠均于同一环境下饲养。
1.5 标本采集与检测 各组于造模后3、12 h分别进行腹部动脉采血,获得血清用于TNF-α、HO-1检测,然后分别处死10只大鼠,立即取右肺下叶按试剂盒要求进行MPO、COX-2活性检测。其中TNF-α、HO-1、MPO、COX-2含量测定按照试剂盒说明书进行操作;造模后12 h HE染色观察大鼠肺组织病理学变化,依次采用甲醛固定、石蜡包埋、切片(5 μm)、HE染色、光镜观察肺组织病理学变化。
1.6 统计学处理 应用SPSS17.0统计软件。计量资料以(±s)表示,采用t检验,组间不同时间点采用重复测量数据的方差分析。计数资料以率或构成比表示,采用χ2检验,等级资料采用非参数秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠肺组织病理学改变 见图1。如图示,正常组大鼠的肺组织结构完整,肺泡腔清晰,肺泡隔无水肿、炎细胞浸润等改变;模型组大鼠肺间质充血明显伴多量以淋巴细胞为主的炎细胞浸润,肺泡隔明显增厚,部分肺泡代偿性扩张;HO-1诱导组、COX-2抑制组大鼠肺间质轻度充血,肺泡隔轻度增厚,偶见局灶性炎细胞(淋巴细胞为主);丹参酮ⅡA组大鼠的肺间质充血、肺泡隔增厚、增厚范围及炎细胞浸润较模型组减轻。
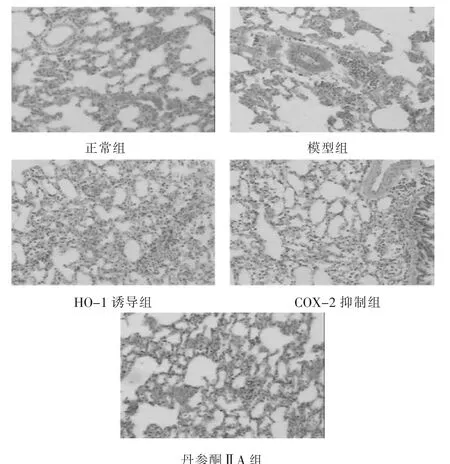
图1 各组大鼠肺组织病理学改变(HE染色,10倍)
2.2 各组大鼠血清中TNF-α、HO-1含量比较 见表1。结果示,造模后3 h,模型组大鼠体内TNF-α、HO-1含量均高于正常组(均P<0.05),随后模型组大鼠体内TNF-α、HO-1含量急剧上升。HO-1诱导组、COX-2抑制组与丹参酮ⅡA组造模后3 h,大鼠体内的TNF-α含量开始下降,与模型组比较差别不大(P>0.05);而HO-1含量开始升高与模型组比较差别不大 (P>0.05);造模后12 h,TNF-α含量与模型组比较下降(P<0.05),HO-1含量与模型组比较升高(P<0.05)。
表1 各组大鼠造模后血清中TNF-α、HO-1含量比较(ng/mL,±s)
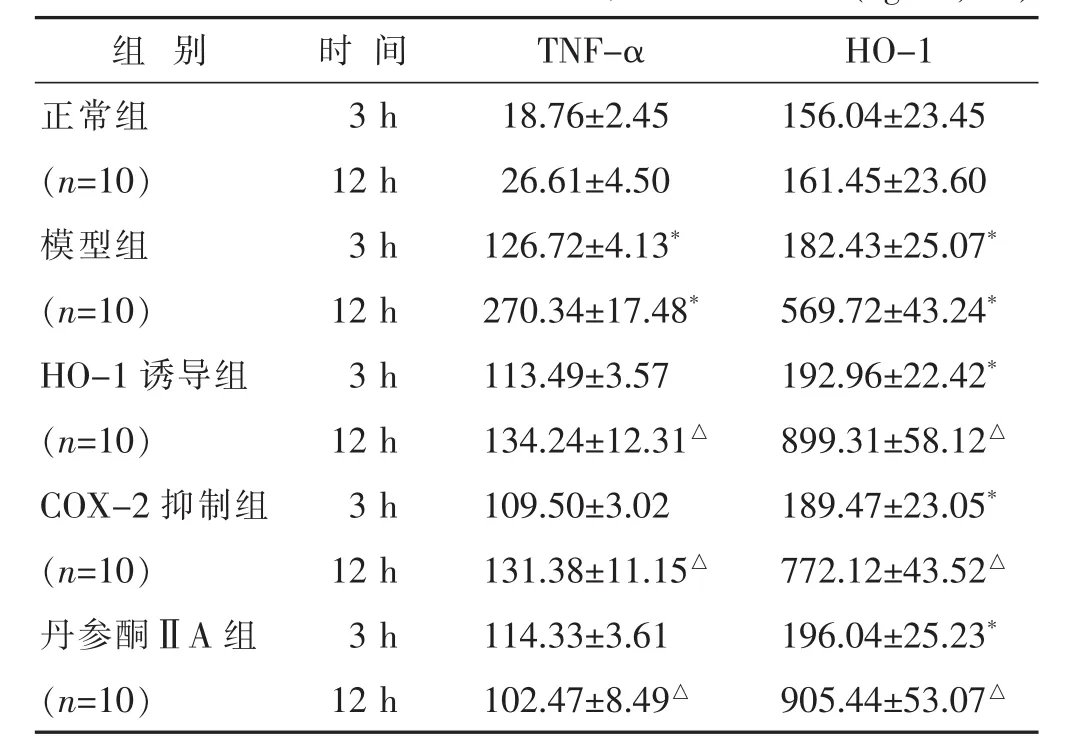
表1 各组大鼠造模后血清中TNF-α、HO-1含量比较(ng/mL,±s)
与正常组同时期比较,*P<0.05;与模型组同时期比较,△P<0.05。下同。
组别 时间 TNF-α HO-1正常组 3 h 18.76±2.45 156.04±23.45(n=10) 12 h 26.61±4.50 161.45±23.60模型组 3 h 126.72±4.13*182.43±25.07*(n=10) 12 h 270.34±17.48*569.72±43.24*HO-1诱导组 3 h 113.49±3.57 192.96±22.42*(n=10) 12 h 134.24±12.31△899.31±58.12△COX-2抑制组 3 h 109.50±3.02 189.47±23.05*(n=10) 12 h 131.38±11.15△772.12±43.52△丹参酮ⅡA组 3 h 114.33±3.61 196.04±25.23*(n=10) 12 h 102.47±8.49△905.44±53.07△
2.3 各组大鼠肺组织中MPO、COX-2含量比较 见表2。结果示,造模后3 h,模型组大鼠肺组织中MPO、COX-2含量均高于正常组(均P<0.05),随后模型组大鼠肺组织中MPO、COX-2含量均急剧上升 (均P<0.05)。造模后3 h,HO-1诱导组、COX-2抑制组与丹参酮ⅡA组肺组织中MPO、COX-2含量开始降低,但与模型组比较差别不大(均P>0.05),造模后12 h,MPO、COX-2含量与模型组比较降低(均P<0.05)。
表2 各组大鼠肺组织中MPO、COX-2含量比较(±s)
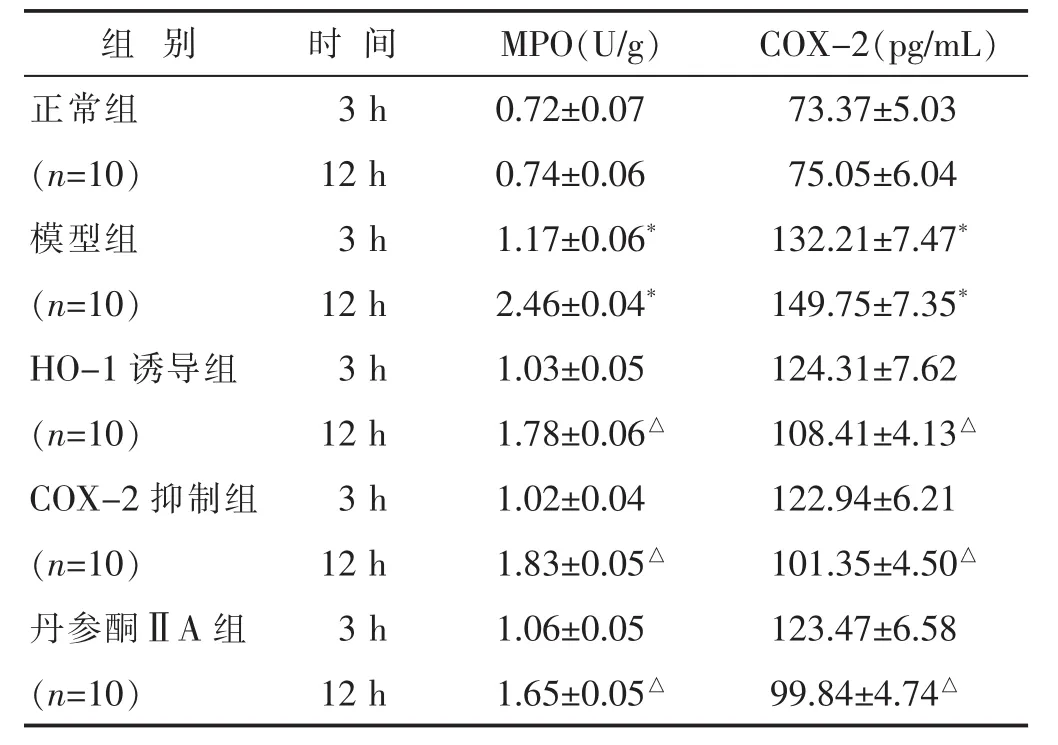
表2 各组大鼠肺组织中MPO、COX-2含量比较(±s)
?
3 讨 论
急性胰腺炎发生机制比较复杂[5],资料显示,病因刺激机体后可以激活胰酶,继而胰腺发生炎症反应[6]。该病往往伴发有其他器官的相关疾病[7]。急性胰腺炎往往会引起全身发生炎症,约四分之一的患者往往最后发展为重度急性胰腺炎,其病死率高达31%[8]。急性肺损伤是在重症急性胰腺炎发病初期伴发的一种很常见的但很严重的全身性症状[9]。目前,根据与重症急性胰腺炎伴发相关性肺损伤疾病相关的大量资料,可以发现体内含有的IL-1等多种炎性因子既有利于推动急性胰腺炎局部炎症的发展,也有助于引发机体全身发生炎症反应,某些促炎因子过表达往往会加剧急性胰腺炎的严重程度。COX-2是体内一种非常重要的关键酶,其与炎症的关系相当密切,因此其被称为启动炎症反应的关键酶[10]。研究表明HO-1是一种应激蛋白,当机体遭受到外界的氧化应激的时候,机体就会自发地激活体内的抗氧化保护系统,而HO-1就是其中一员[11]。
本研究病理学结果表明HO-1诱导组和COX-2抑制组大鼠肺组织的病理学损害得到明显改善;与正常组比较,模型组大鼠造模后3 h,大鼠体内的TNF-α、HO-1、MPO与COX-2含量均升高。与模型组比较,HO-1诱导组与COX-2抑制组大鼠经治疗后均有不同程度恢复,其中12 h时恢复显著,该结果与先前报道结果一致[11-12]。因此重症急性胰腺炎肺损伤大鼠HO-1与COX-2均高表达,HO-1高表达可以抗肺损伤,而COX-2高表达则会加剧肺损伤。
丹参酮ⅡA是中药丹参的主要成分之一,相关研究发现丹参酮ⅡA有消炎抗菌、消除氧自由基、抗氧化等作用,可降低TNF-α、IL-1、IL-6等关键炎症因子的表达[13-15]。本实验结果示,丹参酮ⅡA干预后,大鼠的肺间质充血、肺泡隔增厚、增厚范围及炎细胞浸润较模型组明显减轻,且能提高重症急性胰腺大鼠血HO-1水平,降低重症急性胰腺大鼠肺COX-2水平,同时也改善了炎性因子TNF-α和MPO的异常水平的变化,结果示丹参酮ⅡA对重症胰腺炎引起的肺损伤有明显的改善作用,其机制可能是通过调控HO-1与COX-2的表达发挥肺损伤的保护作用。
[1] 张全,曹丽叶,程树杰,等.重症急性胰腺炎模型大鼠肺组织血红素加氧酶-1的表达及意义[J].中国普通外科杂志,2013,22(9):1164.
[2] 张磊,张飞虎,潘曙明,等.血红素加氧酶-1高表达对重症急性胰腺炎大鼠脏器功能的保护作用及其机制[J].肝胆胰外科杂志,2013,25(3):210-214.
[3] 刘明东,石亮亮,邹晓平.丹参酮ⅡA对急性胰腺炎相关性肺损伤的干预作用[J].中国中西医结合消化杂志,2011,19(1):18-22.
[4] 周红成,丁伶灵,赵荣.丹参对脓毒症小鼠的治疗作用研究[J].临床合理用药杂志,2015,8(11):107-108.
[5] 赵洪礼,吴战军.细胞因子与重症急性胰腺炎关系研究进展[J].临床消化病杂志,2010,22(1):61-63.
[6] 胥楠,芦灵军,陈晓理,等.环氧化酶-2抑制剂对急性胰腺炎大鼠继发全身炎症反应保护作用的实验研究[J].肝胆胰外科杂志,2008,20(4):258-260.
[7] 赵丽梅,冯志杰.重症急性胰腺炎合并多脏器功能障碍综合征的非手术治疗[J].世界华人消化杂志,2009,17(11): 1061-1068.
[8] 李琦,沙焕臣,马清涌,等.白藜芦醇对大鼠重症急性胰腺炎胰腺组织COX-2和iNOS表达的影响[J].西安交通大学学报:医学版,2009,30(1):14-16.
[9] 薛翠华,高振军,李秋萍,等.塞来昔布对大鼠重症急性胰腺炎血清TNF-A,IL-1β,IL-6及IL-8水平的影响[J].江苏大学学报:医学版,2009,19(6):496-498.
[10]陈善正.环氧合酶-2在大鼠重症急性胰腺炎及相关性肺损伤中作用机制的实验研究[D].长沙:中南大学,2008.
[11]安艳明,吴新民,郭亚民,等.HIF-1,COX-2在实验性高原重症急性胰腺炎中的表达[J].青海医学院学报,2010,31(3):10-17.
[12]李春生,蔡雷,王银平,等.COX-2在重症急性胰腺炎所致肝脏损伤中的作用[J].中国普外基础与临床杂志,2010,17(4):343-347.
[13]Ren ZH,Tong YH,Xu W,et al.Tanshinone II A attenuates inflammatory responses of rats with myocardial infarction by reducing MCP-1 expression[J].Phytomedicine,2010,17(3-4):212-218.
[14] Zhang Y,Zhang L,Chu W,et al.Tanshinone IIA inhibits miR-1 expression through p38 MAPK signal pathway in postinfarction rat cardiomyocytes[J].Cell Physiol Biochem,2010,26(6):991-998.
[15]刘明东 沈永华.丹参酮ⅡA对重症急性胰腺炎肺损伤大鼠炎性细胞因子的影响[J].中国中西医结合杂志,2015,35(11):1361-1366.
The Effect of TanshinoneⅡA on Lung Injury with Severe Acute Pancreatitis in Rats
WU Yanli,GONGJing,LIU Fang. Tongji Hospital Affiliated to Tongji Medical College of Huazhong University of Science and Technology,Hubei,Wuhan 430030,China.
Objective:To investigate the effect and mechanism of TanshinoneⅡA on lung injury with severe acute pancreatitis in rats.Methods:The rats were randomly divided into the normal group,the model group,HO-1 induced group,COX-2 inhibition group and TanshinoneⅡA group.The latter four groups of rats were modeled by traditional method of taurocholic acid sodium.Rats in TanshinoneⅡA group were given 40mg/kg TanshinoneⅡA intraperitoneal injection after the operation.Rats in HO-1 induced group were injected hemin by intravenous 5 min after modeled.2 h before the building lavage,rats in COX-2 inhibition group were given Celeeoxib aqueous solution by gavage.Rats in the model group were given the same volume of saline.The content of TNF-α and HO-1 in serum,MPO and COX-2 in lung tissue homogenate and pathological changes of lung tissue were detected.Results:Compared with the normal group,TNF-α,HO-1,MPO,and COX-2 contents in rats in the model group were significantly increased(P<0.05).Pathological changes were observed in lung tissue.Compared with the model group,rats in TanshinoneⅡA group,HO-1 induced group and COX-2 inhibition group all had differ-ent degrees of recovery after treatment,especially after 12 hours of treatment(P<0.05).Conclusion:HO-1 and COX-2 contents in the lung injury rats all increase.The high expression of HO-1 can resist the lung injury,and the high expression of COX-2 will aggravate the lung injury.Tanshinone IIA can improve the lung injury induced by severe acute pancreatitis,The mechanism may be related to the regulation of the expression of HO-1 and COX-2.
Severe acute pancreatitis;Lung injury;TanshinoneⅡA;Heme oxygenase-1;Cyclooxygenase 2
R285.5
A
1004-745X(2016)10-1870-04
10.3969/j.issn.1004-745X.2016.10.011
湖北省自然科学基金项目(2012FFB02410)
△(电子邮箱:beidxing@163.com)
(2016-06-24)
