悬浮固化分散液液微萃取-毛细管电泳法测定水中磺酰脲类除草剂
2016-11-17李明昕邹晓莉
朱 婧, 李明昕, 王 倩, 任 琳, 郑 波, 雍 莉, 邹晓莉*
(1. 四川大学华西公共卫生学院卫生检验与检疫系, 四川 成都 610041;
2. 四川省疾病预防控制中心, 四川 成都 610041)
研究论文
悬浮固化分散液液微萃取-毛细管电泳法测定水中磺酰脲类除草剂
朱 婧1, 李明昕1, 王 倩1, 任 琳2, 郑 波1, 雍 莉2, 邹晓莉1*
(1. 四川大学华西公共卫生学院卫生检验与检疫系, 四川 成都 610041;
2. 四川省疾病预防控制中心, 四川 成都 610041)
建立了悬浮固化分散液液微萃取-毛细管电泳法同时测定水中磺酰脲类除草剂残留的方法。以十二醇为萃取剂、甲醇为分散剂,采用悬浮固化分散液液微萃取技术对水样进行分离提取,并结合毛细管电泳法进行测定。该方法可以有效提取、分离、检测水中残留的微量苯磺隆、吡嘧磺隆、苄嘧磺隆等9种磺酰脲类除草剂,各待测物在10.0~1 000 μg/L范围内线性关系良好,相关系数r≥0.992,方法检出限为2.40~7.50 μg/L,方法精密度为6.55%~13.9%。将该方法用于实际水样的测定,取得了较满意的结果,加标回收率为82.0%~104%。该方法简便快速,适合水中磺酰脲类除草剂的同时测定。
悬浮固化分散液液微萃取;毛细管电泳;磺酰脲类除草剂;水样
磺酰脲类除草剂是一类被广泛使用的微量高效除草剂[1-3]。随着磺酰脲类除草剂使用范围的扩大,其残留对人类健康和环境造成的危害越来越受到人们的关注,尤其在水环境中的残留,因为水的流动性可能会带来更为广泛的污染和危害。为了更有效地对其进行风险评估和实施管理,建立快速高效的测定方法是必要的。
目前,我国检测磺酰脲类除草剂的方法主要有色谱法[4,5]和色谱-质谱联用法[6]。毛细管电泳法是20世纪80年代发展起来的液相分离技术,与高效液相色谱法相比,具有分辨率高、样品和溶剂使用量少、成本低等优点,该方法在除草剂测定方面有一定的应用[7,8]。但磺酰脲类除草剂通常以痕量水平存在于水环境中,且水样中可能存在多种杂质的干扰,若直接检测通常无法满足水样分析的要求,因此需要在分析前对样品进行净化和浓缩。近年来液相微萃取作为一种新的样品前处理方法引起了学者们的关注,该技术集萃取和富集于一体,操作简便,环保高效,已广泛运用于痕量分析领域[9-13]。分散液液微萃取(dispersive liquid-liquid microextraction, DLLME)[14]是液相微萃取的模式之一,它辅以分散剂的作用,萃取剂以微小的液滴分散在样品溶液中形成乳浊液,能够实现高效快速的萃取。为了让萃取剂更易被收集,悬浮固化液液微萃取(solidification of floating organic drop with liquid phase microextraction, SFO-LPME)技术[15]于2007年被提出,该技术采用低密度并具有适当熔点的试剂作为萃取剂,萃取完成后,萃取剂被冷冻成片状浮于样品溶液表面,更易取出。2008年,Leong等[16]将悬浮固化技术与分散液液微萃取结合,使其达到了高效、简便易行的目的。
本实验结合悬浮固化分散液液微萃取技术与毛细管电泳技术分离、测定水中9种磺酰脲类除草剂残留,为水中磺酰脲类除草剂的测定提供了一种新的思路。
1 实验部分
1.1 仪器与试剂
P/ACETMMDQ毛细管电泳仪配紫外检测器(美国Beckman公司);未涂层弹性石英毛细管(50.0 cm×50.0 μm,有效长度43.0 cm,河北永年光导纤维厂); Millipore Synergy 185超纯水机(美国Millipore公司)。
标准品(纯度≥98%):苯磺隆(tribenuron-methyl)、吡嘧磺隆(pyrazosulfuron-ethyl)、甲磺隆(metsulfuron-methyl)、噻吩磺隆(thifensulfuron-methyl)、烟嘧磺隆(nicosulfuron)、甲磺胺磺隆(mesosulfuron-methyl)、丙苯磺隆(procarbazone sodium)购自德国Dr. Ehrenstorfer公司,氯磺隆(chlorsulfuron)、苄嘧磺隆(bensulfuron-methyl)购自美国Sigma公司。
乙腈、甲醇为色谱纯(美国Fisher公司);磷酸二氢钾、硼砂、硼酸、盐酸、氢氧化钠均为分析纯(成都科龙化工试剂厂);实验用水均为超纯水。
混合标准储备液的配制:分别准确称取各标准品适量,用甲醇溶解并稀释至1 g/L,保存于-20 ℃冰箱。
混合标准工作液的配制:准确吸取一定量的混合标准储备液,用甲醇稀释至100 mg/L,保存于4 ℃冰箱。
1.2 实验过程
1.2.1 样品处理
取10.0 mL水样于离心管中,加入0.1 mol/L盐酸溶液调节水样pH值至3.0,加入2.0 g氯化钠,振摇至其全部溶解后注入50 μL十二醇和200 μL甲醇混合溶剂使样液成乳浊液,于30 ℃水浴3 min,以3 000 r/min的速度离心3 min。放置冰箱冷冻至十二醇凝结成固体,取出上层凝固的十二醇转移至Eppendorf管,于30 ℃温浴融化,加入50 μL甲醇混匀,以12 000 r/min的速度离心2 min后取上清液进样分析。
1.2.2 毛细管电泳分离条件
未涂层弹性石英毛细管;柱温:25 ℃;缓冲溶液:60.0 mmol/L硼砂-10%(体积分数)乙腈(pH 10.0);检测波长:230 nm;分离电压:15 kV;进样方式:压力进样(3.45 kPa);进样时间:5 s。
试验前用0.1 mol/L的NaOH溶液冲洗毛细管柱5 min,然后用超纯水冲洗5 min,最后用缓冲溶液冲洗10 min;两次进样之间用缓冲溶液冲洗2 min;试验结束后先用0.1 mol/L NaOH溶液冲洗毛细管柱10 min,最后用超纯水冲洗10 min,以保证毛细管柱的清洁。
1.2.3 工作曲线
用水将9种磺酰脲类除草剂标准工作液逐级稀释,配制成质量浓度为10.0、50.0、100、250、500、1 000 μg/L的标准溶液。上述标准溶液按照1.2.1节所述步骤进行微萃取,按1.2.2节所述条件进行分离、分析。以各待测物的质量浓度为横坐标、各待测物峰面积为纵坐标绘制工作曲线,求得回归方程和相关系数。
2 结果与讨论
2.1 样品前处理条件的选择
对悬浮固化分散液液微萃取的主要影响因素进行了优化,以加标空白水样为样本(加标量为1.00 mg/L)考察萃取效率。
考察了十二醇、十一醇以及正十六烷对9种磺酰脲类除草剂的萃取效率,十二醇对9种磺酰脲类除草剂的萃取效率最优,各除草剂回收率比十一醇高5%~8%,比正十六烷高40%~50%,因此选择十二醇作为萃取剂。在此基础上,在20.0~150 μL范围内考察萃取剂体积对9种磺酰脲类除草剂萃取效率的影响。结果表明,在20.0~50.0 μL范围内,萃取效率随着萃取剂体积的增大而增大;但加入的萃取剂大于50.0 μL后,萃取效果变化不大。综合考虑萃取效率和富集倍数,选择50.0 μL十二醇作为萃取剂的体积。
分别考察了甲醇、乙腈、丙酮3种常用的分散剂对萃取效率的影响。结果表明,加入甲醇时的萃取效率最优,可达75%~98%。还考察了分散剂体积对萃取效率的影响,以20.0~250 μL的甲醇作为分散剂进行试验,结果表明,当甲醇加入量小于150 μL时,随着甲醇加入量的增大,9种磺酰脲类除草剂的萃取效率增大,当甲醇的加入量在150~250 μL时萃取效率稳定,大于250 μL后萃取效率下降。因此选择分散剂甲醇的体积为200 μL。
考察了溶液pH值在2.0~10.0范围内时的萃取效率。结果表明,当溶液呈碱性时,萃取效率较低(15%~40%);当溶液呈酸性时,萃取效率有明显增加。当pH<4.0时,9种磺酰脲类除草剂萃取效率稳定。因此选择萃取溶液pH值为3.0。
考察了氯化钠质量浓度在25~300 g/L范围内时的萃取效率。在优化的实验条件下,氯化钠质量浓度为150~300 g/L时萃取效率达到最大且保持稳定。因此选择在200 g/L氯化钠质量浓度条件下进行微萃取。
考察了萃取温度在15~50 ℃范围内时的萃取效率,结果表明,在15~25 ℃范围内,萃取效率略有上升;在25~35 ℃范围内,萃取效率变化不大;当萃取温度超过35 ℃时,萃取效率有所下降,可能与磺酰脲类除草剂的热不稳定性有关。因此选择30 ℃为萃取温度。
在萃取温度为30 ℃的条件下,在0~10 min范围内考察了萃取时间对萃取效率的影响,结果表明,萃取时间超过2 min,萃取效率稳定,故选择3 min作为萃取时间。
萃取条件的优化结果见表1。

表 1 萃取条件的优化
2.2 毛细管电泳分离条件的优化
2.2.1 缓冲溶液种类的选择
考察了分离、测定磺酰脲类除草剂常用的毛细管电泳缓冲溶液,即磷酸二氢钾缓冲溶液和硼砂缓冲溶液对分离效果的影响。结果表明,单独使用磷酸二氢钾缓冲溶液或硼砂缓冲溶液作为缓冲体系时,9种磺酰脲类除草剂出峰不完全或者不能得到有效分离。在磷酸二氢钾缓冲溶液中加入一定量乙腈后,9种待测物能得到有效分离,峰形较好,但在此种缓冲体系中,待测物出峰不稳定且基线波动严重。在硼砂缓冲液中加入一定量乙腈后,9种待测物也能达到有效分离,且基线更平稳。因此,选择硼砂-乙腈作为缓冲液体系,并进一步对分离条件进行了优化。
2.2.2 硼砂浓度的优化
分别配制硼砂浓度为10.0~100 mmol/L的缓冲溶液,考察硼砂浓度对分离效果的影响。结果表明,硼砂浓度越高,待测物分离效果越好。当硼砂浓度达到60.0 mmol/L时,9种磺酰脲类除草剂均得到有效分离且基线平稳;但当硼砂浓度高于80.0 mmol/L后,加入乙腈会使缓冲溶液中出现少许结晶。因此选择硼砂浓度为60.0 mmol/L。
2.2.3 缓冲溶液pH值的优化
由于磺酰脲类除草剂为弱酸性化合物(解离平衡常数pKa为3.3~5.2),随着溶液pH值的增加,解离程度逐渐增大,在毛细管电泳体系中,其泳动速度会发生差异性变化,从而改变分离度。调节硼砂缓冲溶液pH值在3.0~11.0范围内,考察缓冲溶液pH值对分离效果的影响。结果表明,随着电泳缓冲溶液pH值的增大,分离度改善,但同时使毛细管内壁硅醇基的质子化程度升高,电渗流增大,各磺酰脲类除草剂保留时间延长。将缓冲溶液pH值控制在10.0,出峰最接近的甲磺隆和氯磺隆分离度能达到1.0以上,分析可在10 min内完成。
2.2.4 乙腈含量的优化
选择乙腈作为缓冲溶液的有机改性剂,结果表明,加入乙腈后各待测物的分离有很大改善,在5%~15%(体积分数)范围内改变乙腈含量,进一步考察其对分离效果的影响。结果表明,乙腈含量越高,分离度越好,但考虑到乙腈加入量太大,容易产生气泡,使得基线不稳定,所以选择乙腈含量为10%(体积分数),此时出峰最接近的甲磺隆和氯磺隆分离度能达到1.0以上。
2.2.5 检测波长的优化
相关文献[17-20]报道磺酰脲类除草剂的检测波长一般在214~254 nm范围内。在上述优化的缓冲溶液下,考察了214~254 nm波长对测定结果的影响。结果表明,随着波长增加,灵敏度下降,但基线噪音变小。综合考虑检测灵敏度、基线平稳度和峰形,选用230 nm作为检测波长。在选定的毛细管电泳分离条件下得到的标准溶液(100 μg/L)电泳图见图1。
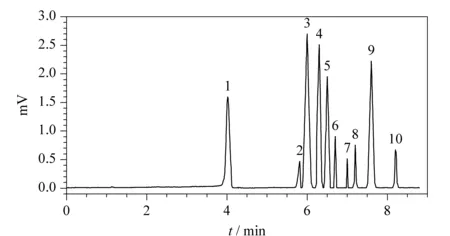
图 1 混合标准溶液(100 μg/L)电泳图Fig. 1 Electrophoretogram of the mixed standard solution (100 μg/L) 1. methanol; 2. nicosulfuron; 3. thifensulfuron-methyl; 4. metsulfuron-methyl; 5. chlorsulfuron; 6. mesosulfuron-methyl; 7. pyrazosulfuron-ethyl; 8. bensulfuron-methyl; 9. procarbazone sodium; 10. tribenuron-methyl.
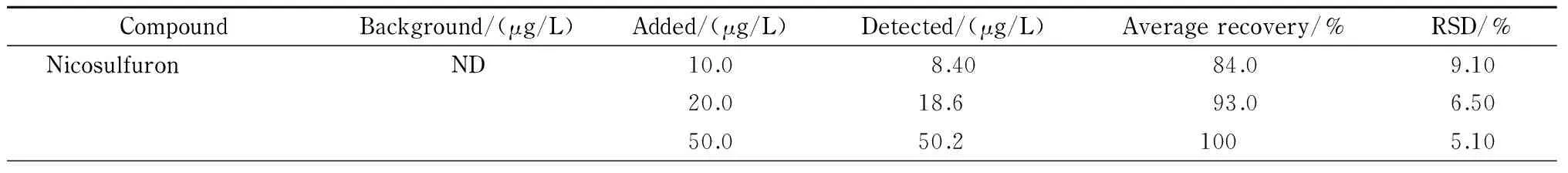
CompoundBackground/(μg/L)Added/(μg/L)Detected/(μg/L)Averagerecovery/%RSD/%NicosulfuronND10.08.4084.09.1020.018.693.06.5050.050.21005.10
2.3 方法指标
2.3.1 线性关系、检出限及富集因子
按照1.2.3节配制系列混合标准溶液并绘制工作曲线,考察方法的线性范围、检出限和富集因子,结果见表2。各待测物在10.0~1 000 μg/L范围内线性关系良好,相关系数r≥0.992。以3倍S/N对应的质量浓度为方法检出限(method detection limits, MDLs),各待测物的方法检出限为2.40~7.50 μg/L。待测物的富集因子(enrichment factor, EF)定义为分析物在悬浮有机相中的质量浓度cfloated与在水样中的初始质量浓度c0之间的比值,即EF=cfloated/c0。在10.0 mL水样中,各待测物的EF为86.6~103。

表 2 10 mL水样中磺酰脲类除草剂的相关系数、方法检出限和富集因子
Linear range: 10.0-1 000 μg/L.
2.3.2 精密度
取同一混合标准溶液,重复进样6次进行测定,以峰面积的相对标准偏差(RSD)考察仪器精密度,RSD为5.09%~11.6%。制备6份空白加标水样(加标量为100 μg/L),按照1.2.1节步骤处理后进行毛细管电泳分析,以峰面积的相对标准偏差考察方法精密度,RSD为6.55%~13.9%。
2.3.3 加标回收率
在相同的水样中分别加入低、中、高3个水平的混合标准溶液,按照1.2.1节步骤处理后,进行毛细管电泳分析。分别计算加标回收率和RSD,结果如表3所示,方法的回收率及RSD分别为82.0%~104%和4.60%~11.5%。
2.4 实际样品的测定
在选定的毛细管电泳分离条件和萃取条件下,随机采取四川省成都市水样20份(5份管道水、5份河水、10份农田水)进行分析,其中1份农田水样中检出氯磺隆、苄嘧磺隆、丙苯磺隆,质量浓度分别为39.6、33.1和20.1 μg/L。图2为该农田水样品和加标农田水样品电泳图。

表 3 (续)
ND: not detected.

图 2 (a)农田水样和(b)加标农田水样电泳图Fig. 2 Electrophoretograms of (a) a farmland water sample and (b) a spiked farmland water samplePeak Nos. are the same as those in Fig. 1.
3 结论
建立了悬浮固化分散液液微萃取-毛细管电泳检测水中多种磺酰脲类除草剂的方法,该方法操作简便快捷,可获得较高的萃取效率,对环境友好,适用于水样的批量分析。
[1] Duan Q, Li Z, Zhao G L, et al. Agrochemicals Research and Application, 2011, 15(1): 13
段强, 李振, 赵国玲, 等. 农药研究与应用, 2011, 15(1): 13
[2] Wang X F, Guan C H, Fan Z W, et al. Agrochemicals, 2011, 50(1): 9
王险峰, 关成宏, 范志伟, 等. 农药, 2011, 50(1): 9
[3] Zhang Y X. World Pesticides, 2013, 35(6): 30
张翼翾. 世界农药, 2013, 35(6): 30
[4] Jiang L H, Ma J P, Hou L W, Journal of Qingdao Technological University, 2015, 36(5): 73
姜莲华, 马继平, 侯丽玮, 等. 青岛理工大学学报, 2015, 36(5): 73
[5] Tang K J, Zhou Z E, Yu R L, et al. Acta Agriculturae Universitatis Jiangxiensis, 2014, 36(2): 326
汤凯洁, 周志娥, 余瑞龙, 等. 江西农业大学学报, 2014, 36(2): 326
[6] Wang L Z, Huang X Y, Wang D F, et al. Chinese Journal of Chromatography, 2015, 33(5): 501
王连珠, 黄小燕, 王登飞, 等. 色谱, 2015, 33(5): 501
[7] Lanaro R, Costa J L, Cazenave S O S, et al. J Forensic Sci, 2015, 60: 241
[8] Dinelli G, Vicari A, Bonetti A. J Chromatogr A, 1995, 700: 195
[9] Xi C P, Yuan J P, Li L, et al. Chinese Journal of Analysis Chemistry, 2008, 36(11): 1559
习春鹏, 苑金鹏, 李磊, 等. 分析化学, 2008, 36(11): 1559
[10] Carlos E A, Alves R D, De Queiroz M E L R , et al. J Braz Chem Soc, 2013, 24(8): 1217
[11] Basheer C, Lee H K. J Chromatogr A, 2004, 1057: 163
[12] Sobhi H R, Yamini Y, Abadi R H H B. J Pharm Biomed Anal, 2007, 45(5): 769
[13] Chamsaz M, Hossein Arbab-Zavar M, Akhondzadeh J. Anal Sci, 2008, 24(6): 799
[14] Mohammad R, Yaghoub A, Mohammad-Reza M H, et al. J Chromatogr A, 2006, 1116: 1
[15] Zanjani M R K, Yamini Y, Shariati S, et al. Anal Chim Acta, 2007, 585(2): 286
[16] Leong M I, Huang S D. J Chromatogr A, 2008, 1211: 8
[17] Jin Y, Yao J B, Zhao Y, et al. Inspection and Quarantine Science, 2008, 18(6): 7
金雁, 姚家彪, 赵颖, 等. 检验检疫科学, 2008, 18(6): 7
[18] Yu Y F, Gao W, Gen N, et al. Agrochemicals, 2009, 48(11): 811
俞幼芬, 高巍, 耿宁, 等. 农药, 2009, 48(11): 811
[19] Qi Y, Zhan C R, Zhang X Z, et al. Chinese Journal of Chromatography, 2004, 22(6): 634
祁彦, 占春瑞, 张新忠, 等. 色谱, 2004, 22(6): 634
[20] Wu C X, Li M, Wang G C, et al. Pesticide Science and Administration, 2006, 25(10): 6
吴春先, 立明, 王广成, 等. 农药科学与管理, 2006, 25(10): 6
Health and Family Planning Commission Project of Sichuan Province (No. 14H1236).
Solidification of floating organic drop dispersive liquid-liquid microextraction combined with capillary electrophoresis for the determination of sulfonylurea herbicides in water
ZHU Jing1, LI Mingxin1, WANG Qian1, REN Lin2, Zheng Bo1, YONG Li2, ZOU Xiaoli1*
(1. Department of Sanitary Technology, West China School of Public Health, Sichuan University, Chengdu 610041, China; 2. Center for Disease Control and Prevention of Sichuan Province, Chengdu 610041, China)
A novel method of solidification of floating organic drop dispersive liquid-liquid microextraction for the simultaneous determination of sulfonylurea herbicides in water samples by capillary electrophoresis was established. Sulfonylurea herbicides in water samples were extracted by solidification of floating organic drop dispersive liquid-liquid microextraction using dodecanol as extractant and methanol as dispersive solvent, and were determined with capillary electrophoresis. Nine kinds of sulfonylurea herbicides such as tribenuron-methyl, pyrazosulfuron-methyl, bensulfuron-methyl and so on were detected by this method. The good linearities were obtained in the range of 10.0-1 000 μg/L. The correlation coefficiencies were not less than 0.992. The method detection limits (MDLs) ranged from 2.40 to 7.50 μg/L. The relative standard derivations (RSDs) of the method were 6.55%-13.9%. The method was applied for the determination of water samples and showed satisfactory results. The spiked recoveries ranged from 82.0% to 104%. The method is quick, sensitive and suitable for the batch analysis of sulfonylurea herbicides in water samples.
solidification of floating organic drop dispersive liquid-liquid microextraction (SFO-DLLME); capillary electrophoresis (CE); sulfonylurea herbicides; water sample
10.3724/SP.J.1123.2016.06012
2016-06-08
四川省卫生与计划生育委员会项目(14H1236).
O658
A
1000-8713(2016)11-1120-06
* 通讯联系人.E-mail:zouxl_1113@163.com.
