意大利蜜蜂工蜂幼虫饲粮的适宜亚硒酸钠添加水平
2016-11-17苏中渠张卫星郗学鹏王红芳胥保华
苏中渠,张卫星,郗学鹏,王红芳,胥保华
(山东农业大学动物科技学院,山东泰安 271018)
意大利蜜蜂工蜂幼虫饲粮的适宜亚硒酸钠添加水平
苏中渠,张卫星,郗学鹏,王红芳,胥保华
(山东农业大学动物科技学院,山东泰安 271018)
【目的】探索意大利蜜蜂(Apis mellifera ligustica)工蜂幼虫日粮的适宜亚硒酸钠水平,为意大利蜜蜂工蜂幼虫发育阶段硒的营养需要提供依据。【方法】共取1 440只1日龄意大利蜜蜂工蜂幼虫并平均分为两批,每批720只,一批用于化蛹率、羽化率的测定,一批用于理化指标和分子指标的测定。两批幼虫均按单因素完全随机设计分成6组,对照组饲喂基础日粮,试验组分别饲喂亚硒酸钠添加量为0.2、0.4、0.6、0.8、1.0 mg·kg-1的日粮,每组5个重复,每个重复24只幼虫。取3、5、7日龄幼虫测定体重、总抗氧化能力(total antioxidant capacity,T-AOC)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)活性、丙二醛(malondialdehyde,MDA)含量、酚氧化酶(phenoloxidase,PO)活性,取5日龄幼虫测定硒磷酸合成酶(selenide water dikinase,SelD)、丝氨酰-tRNA合成酶(seryl-tRNA synthetase,SerRs)、SECIS-结合蛋白1(SECIS-binding protein 1,Sbp1)、SECIS-结合蛋白2(SECIS-binding protein 2,Sbp2)基因表达量;7日龄时统计化蛹率。【结果】与对照组相比,日粮添加亚硒酸钠水平为0.2—0.6 mg·kg-1时显著提高了幼虫的T-AOC(P<0.05),日粮添加亚硒酸钠水平为0.2—0.8 mg·kg-1时显著提高了幼虫的T-SOD活性(P<0.05),各试验组均显著降低了幼虫的MDA含量(P<0.05)。日粮添加亚硒酸钠水平为0.4 mg·kg-1时幼虫的PO活性显著高于对照(P<0.05)。日粮添加亚硒酸钠水平为0.6 mg·kg-1时5日龄幼虫的SelD、SerRs、Sbp1、Sbp2基因表达水平显著高于对照(P<0.05)。日粮添加亚硒酸钠水平为0.4 mg·kg-1时幼虫化蛹前体重显著高于对照(P<0.05)。与对照组相比,日粮添加亚硒酸钠水平为0.2 mg·kg-1时,幼虫化蛹率显著提高(P<0.05)。【结论】人工饲养条件下基础日粮硒水平为0.21 mg·kg-1时,根据幼虫化蛹前体重、化蛹率做拟合曲线得出意大利蜜蜂工蜂幼虫日粮适宜亚硒酸钠添加水平为0.24—0.33 mg·kg-1,即意大利蜜蜂工蜂幼虫的适宜硒水平为0.32—0.36 mg·kg-1。
意大利蜜蜂;工蜂幼虫;亚硒酸钠;适宜添加水平
0 引言
【研究意义】在昆虫生理学中硒被认为具有重要作用[1]。研究表明硒元素是对生长、发育、抗癌和免疫都有作用的重要微量元素[2-3],因此,研究蜜蜂对硒的营养需要量对蜜蜂的健康养殖具有重要意义。【前人研究进展】国内外大量研究表明,畜禽及昆虫日粮添加硒对机体具有有益影响。ROTRUCK等[4]证明硒在细胞抗氧化作用中占据重要地位;MARTINROMERO等[5]发现用含硒量10 nmol·L-1—1 μmol·L-1的培养基饲养果蝇,其存活率比对照组提高约一倍,并且日粮添加硒能显著提高果蝇繁殖能力。同时,有研究认为硒摄入不足会降低鳞翅目幼虫的免疫力[6],而酚氧化酶与蜜蜂的免疫密切相关[7],可作为蜜蜂免疫的重要指标。另外,在特定时期,硒对蚕幼虫的生长及生理状态均有益[8]。富硒食物饲养的黄粉虫可抵抗更低的温度[9]。硒蛋白是硒元素在机体内发挥功能的关键,ALLMANG等[10]描述的真核生物硒代谢通路中丝氨酰-tRNA合成酶(seryl-tRNA synthetase,SerRs)、硒磷酸合成酶(selenide water dikinase,SelD)、SECIS-结合蛋白2(SECIS-binding protein 2,Sbp2)基因在合成硒蛋白的过程中起重要作用。SerRs的作用是合成tRNASer,tRNASer是合成tRNASec的前体物质;SelD是Sec-tRNASec的组成部分;Sbp2是硒蛋白合成过程中的关键蛋白,作用是与硒蛋白mRNA上的SECIS片段以及核糖体结合,并且其N端被预测有核定位信号,能穿梭核质[11-18]。SECIS-结合蛋白1(SECIS-binding protein 1,Sbp1)在人类研究中上被认为是抑癌作用的重要载体,但在昆虫中的作用尚不明确。【本研究切入点】意大利蜜蜂(Apis mellifera ligustica)是国际饲养最广泛的西方蜜蜂亚种,目前,硒对意大利蜜蜂的营养作用研究较少,其幼虫对硒的营养需要更是未见报道。【拟解决的关键问题】研究日粮硒水平对意大利蜜蜂幼虫抗氧化能力、免疫性能、硒蛋白合成相关基因表达水平、化蛹前体重以及化蛹率的影响,探明意大利蜜蜂工蜂幼虫日粮亚硒酸钠的适宜添加水平。
1 材料与方法
试验用意大利蜜蜂蜂群饲养于山东农业大学试验蜂场,试验用幼虫的饲养及生理生化指标的测定均于2015年在山东农业大学动物科技学院完成。
1.1 试验材料
1 日龄意大利蜜蜂工蜂幼虫和新鲜蜂王浆取自山东农业大学试验蜂场。亚硒酸钠(AR级,货号1021133)由西亚试剂公司提供。
1.2 试验设计与日粮配方
选取蜂王遗传背景相似、群势相当的蜂群作为姐妹王群,在姐妹王群中共取1 440只1日龄蜜蜂幼虫,720只用于化蛹率、羽化率的测定,另外720只用于酶活性测定。试验幼虫均按单因素完全随机设计分别分成6组。日粮中添加的亚硒酸钠水平分别为0、0.2、0.4、0.6、0.8、1.0 mg·kg-1,每组5个重复,每个重复24只。对照组参照VANDENBERG等[19]的配方配制基础日粮,试验组在其基础上添加0.2、0.4、0.6、0.8、1.0 mg·kg-1的亚硒酸钠,幼虫饲粮组成见表1。

表1 幼虫日粮配方Table1 Compositions of larval recipe
1.3 饲养管理
试验前向巢箱内靠近蜂王巢脾的位置放入1张空脾,将蜂王限制在此位置产卵。12—18 h后提出加入的空脾并检查产卵情况,产卵量符合要求即可提入继箱进行孵化,卵期一般为3 d。第4天将孵化的1日龄幼虫用移虫针移至预热好的加入了200 μL饲粮的人工王台内,饲养于温度34.5℃,相对湿度95%的恒温培养箱中,每天更换日粮。饲养至第6天末或第7天初的时候,幼虫开始直立或排便。将其转移至提前放置好灭菌王台的24孔细胞培养板内准备化蛹。蛹期温度34.5℃,相对湿度为75%。
1.4 测定指标
1.4.1 幼虫抗氧化酶活性 将取出的3、5、7日龄的幼虫,按质量体积比制备成10%的组织匀浆,4℃离心机2 500 r/min离心10 min,吸取上清。制备1%的组织匀浆,黄嘌呤氧化法测定总超氧化物歧化酶活性(T-SOD);10%的组织匀浆用Fe3+还原法测定总抗氧化能力(T-AOC),硫代巴比妥酸(TBA)法测定丙二醛(MDA),试剂盒均购自南京建成生物工程研究所,使用UV-2450紫外分光光度计测定。
1.4.2 幼虫酚氧化酶 随机取5日龄和7日龄的幼虫,每组5个重复,用毛细管取其血淋巴共40 μL,加入少许苯基硫脲(防止血淋巴氧化),-80℃保存。测定时取出化冻离心,双抗体夹心法测定酚氧化酶(PO)水平,试剂盒购自上海郎顿生物技术有限公司,使用酶标仪在450 nm波长下测定吸光度。
1.4.3 5日龄幼虫SerRs、SelD、Sbp1、Sbp2基因表达水平 随机取5日龄幼虫,采用在低温条件下用全自动样品快速破碎仪进行组织破碎,使用Total RNA Kit试剂盒(OMEGA,USA)提取蜜蜂总RNA,Transcriptor First Strand cDNA Synthesis Kit(Roche,USA)将总RNA反转录为cDNA,-20℃保存待用。参照FastStart Universal SYBR Green Master(Roche,USA)试剂盒的说明书配置20 μL体系,ABI 7500系统测定目的基因的相对表达量。定量引物的设计及合成均由上海生工生物有限公司完成,引物信息见表2。

表2 基因引物序列Table2 Sequences of gene primers
1.4.4 幼虫体重 每组随机取3、5、7日龄的幼虫放入已称重的1.5 mL离心管内,电子天平称重(精确至0.0001 g),计算幼虫体重,每组5个重复,之后样品存于-80℃冰箱,用于后续指标测定。
1.4.5 化蛹率 用于测定此指标的幼虫从第1天饲养至第7天的过程中每天检查记录幼虫的生长状况,将已死亡个体移出,记录至全部化蛹为止,根据存活个体计算幼虫化蛹率。
1.5 数据分析
数据采用SAS9.2软件进行单因素方差分析(one-way ANOVA),多重比较采用Duncan氏法,P<0.05表示差异显著,P<0.01表示差异极显著,数据均用“mean±SD”的格式表示。

表3 饲粮亚硒酸钠添加水平对意大利蜜蜂工蜂幼虫总抗氧化能力的影响Table3 Effects of diets sodium selenite supplementation on the T-AOC of A. m. ligustica worker larval

表4 饲粮亚硒酸钠添加水平对意大利蜜蜂工蜂幼虫总超氧化物歧化酶活力的影响Table4 Effects of diets sodium selenite supplementation on the T-SOD activities of A. m. ligustica worker larval
2 结果
2.1 饲粮亚硒酸钠水平对意大利蜜蜂工蜂幼虫抗氧化能力的影响
2.1.1 对工蜂幼虫总抗氧化能力的影响 日粮添加0.2—1.0 mg·kg-1亚硒酸钠对3日龄幼虫的总抗氧化能力(T-AOC)均有提高的作用(P<0.05),且随着添加水平的增加3日龄幼虫的T-AOC呈上升趋势,其中添加1.0 mg·kg-1亚硒酸钠时,3日龄幼虫的T-AOC最高(P<0.05),0.8 mg·kg-1添加组次之,0.2、0.4、0.6 mg·kg-1的试验组之间差异不显著(P>0.05);5日龄幼虫的T-AOC随着亚硒酸钠添加水平的升高呈现先上升后下降的趋势,添加0.4 mg·kg-1的试验组T-AOC显著高于各试验组及对照组(P<0.05),添加0.2和0.6 mg·kg-1的组次之,二者差异不显著(P>0.05),但显著高于对照组(P<0.05),0.8和1.0 mg·kg-1的试验组差异不显著(P>0.05),显著低于对照组(P<0.05)(表3)。
2.1.2 对工蜂幼虫总超氧化物歧化酶活力的影响添加水平为0.2 、0.4 、0.6、0.8 mg·kg-1的试验组提高了3日龄幼虫的总超氧化物歧化酶(T-SOD)活性,显著高于对照组和添加水平为1.0 mg·kg-1的试验组(P<0.05),添加水平为1.0 mg·kg-1的试验组与对照组差异不显著(P>0.05)。5、7日龄幼虫与3日龄结果一致(表4)。
2.1.3 对工蜂幼虫丙二醛含量的影响 日粮亚硒酸钠水平显著地影响了3、5、7日龄幼虫的丙二醛(MDA)含量(P<0.05)。3日龄幼虫对照组MDA含量显著高于各试验组(P<0.05),添加水平为0.4、0.6、0.8 mg·kg-1的试验组MDA含量差异不显著(P>0.05),显著低于硒添加水平为1.0 mg·kg-1的试验组(P<0.05),0.2 mg·kg-1的试验组与添加水平为0.4、0.6 mg·kg-1的试验组差异不显著(P>0.05),显著高于添加水平为0.8 mg·kg-1的试验组(P<0.05);5日龄幼虫对照组MDA含量显著高于各试验组(P<0.05),添加水平为0.2、0.4、0.6 mg·kg-1的试验组MDA含量显著低于添加水平为1.0 mg·kg-1的试验组(P<0.05),3个添加水平间差异不显著(P>0.05),添加水平为0.4 mg·kg-1的试验组MDA含量显著低于添加水平为0.8 mg·kg-1的试验组(P<0.05);7日龄幼虫对照组MDA含量显著地高于各试验组(P<0.05),添加水平为0.2、0.4 mg·kg-1的试验组MDA含量显著低于添加水平为0.8、1.0 mg·kg-1的试验组(P<0.05),与添加水平为0.6 mg·kg-1的试验组差异不显著(P>0.05)(表5)。

表5 饲粮亚硒酸钠添加水平对意大利蜜蜂工蜂幼虫丙二醛含量的影响Table5 Effects of diets sodium selenite supplementation on the MDA content of A. m. ligustica worker larval
2.2 饲粮亚硒酸钠水平对5、7日龄意大利蜜蜂工蜂幼虫免疫能力的影响
日粮亚硒酸钠水平显著地影响了5、7日龄幼虫的酚氧化酶(PO)活性(P<0.05)。幼虫生长至5日龄时,添加水平为0.6 mg·kg-1的试验组PO活性最高,1.0 mg·kg-1的试验组PO活性最低,添加水平为0.8 mg·kg-1的组显著低于0.2和0.4 mg·kg-1组(P<0.05),但与对照组差异不显著(P>0.05);7日龄幼虫添加水平为0.4 mg·kg-1的组PO活性显著高于其余各组(P<0.05),添加水平0.2和0.6 mg·kg-1的组显著高于0.8 mg·kg-1的组(P<0.05),但与对照差异不显著(P>0.05),1.0 mg·kg-1的组PO活性最低(表6)。

表6 饲粮亚硒酸钠添加水平对意大利蜜蜂工蜂幼虫酚氧化酶活性的影响Table6 Effects of diets sodium selenite supplementation on the PO activity of A. m. ligustica worker larval
2.3 饲粮亚硒酸钠水平对5日龄意大利蜜蜂工蜂幼虫SelD、SerRs、Sbp1、Sbp2基因表达水平的影响
随着亚硒酸钠添加水平的增加,对5日龄幼虫SelD、SerRs、Sbp1、Sbp2基因表达量有显著影响(P<0.05)。各试验组的SelD基因与对照组表达量差异显著(P<0.05),添加量为0.2 mg·kg-1的组显著低于其余试验组(P<0.05),其余各组间差异不显著(P>0.05);各试验组Sbp2基因总体呈现逐渐升高的趋势,1.0 mg·kg-1的组显著高于除0.6 mg·kg-1的其余试验组(P<0.05),0.6 mg·kg-1的试验组显著高于对照组(P<0.05),与0.4 mg·kg-1的试验组差异不显著(P>0.05),对照组与0.2、0.4和0.8 mg·kg-1的试验组差异不显著(P>0.05);0.6 mg·kg-1的试验组SerRs基因显著高于除0.4和1.0 mg·kg-1的其余各试验组(P<0.05),除0.4 mg·kg-1以外其余各试验组与对照差异不显著(P>0.05);0.6 mg·kg-1的试验组Sbp1基因显著高于其余试验组(P<0.05),对照组与0.8和1.0 mg·kg-1的试验组差异不显著(P>0.05),显著低于0.2和0.4 mg·kg-1的试验组(P<0.05)(图1)。
2.4 饲粮亚硒酸钠水平对意大利蜜蜂工蜂幼虫体重的影响
幼虫饲粮亚硒酸钠水平对3、5、7日龄幼虫体重有显著影响(P<0.05)。亚硒酸钠添加水平为0.2 mg·kg-1的试验组3日龄幼虫体重显著高于添加1.0 mg·kg-1试验组(P<0.05),对照组与各试验组之间差异不显著(P>0.05)。幼虫生长至5日龄后,随着添加水平的提高,幼虫体重呈现出先上升后下降的总体趋势,0.2 mg·kg-1的试验组体重显著高于对照组和其余各试验组(P<0.05),0.4 mg·kg-1的试验组与对照组差异不显著(P>0.05),其余各试验组显著低于对照(P<0.05)。幼虫饲粮亚硒酸钠水平对7日龄幼虫体重影响显著(P<0.05),添加水平为0.4 mg·kg-1的试验组体重显著高于空白组和其他试验组(P<0.05),添加水平为0.2、0.6 mg·kg-1的试验组对照组体重与差异不显著(P>0.05),显著高于添加水平为0.8 mg·kg-1试验组(P<0.05),添加水平为1.0 mg·kg-1的试验组体重最低(图2)。
2.5 饲粮亚硒酸钠水平对意大利蜜蜂工蜂化蛹率的影响
幼虫饲粮亚硒酸钠水平对化蛹率有显著的影响(P<0.05)。硒添加水平为0.2 mg·kg-1的试验组显著高于对照组(P<0.05)。对照组与亚硒酸钠添加水平为0.4 mg·kg-1的试验组化蛹率差异不显著(P>0.05),但显著高于添加水平为0.6和0.8 mg·kg-1的试验组(P<0.05),硒添加水平为1.0 mg·kg-1的试验组不能成功化蛹(图3)。
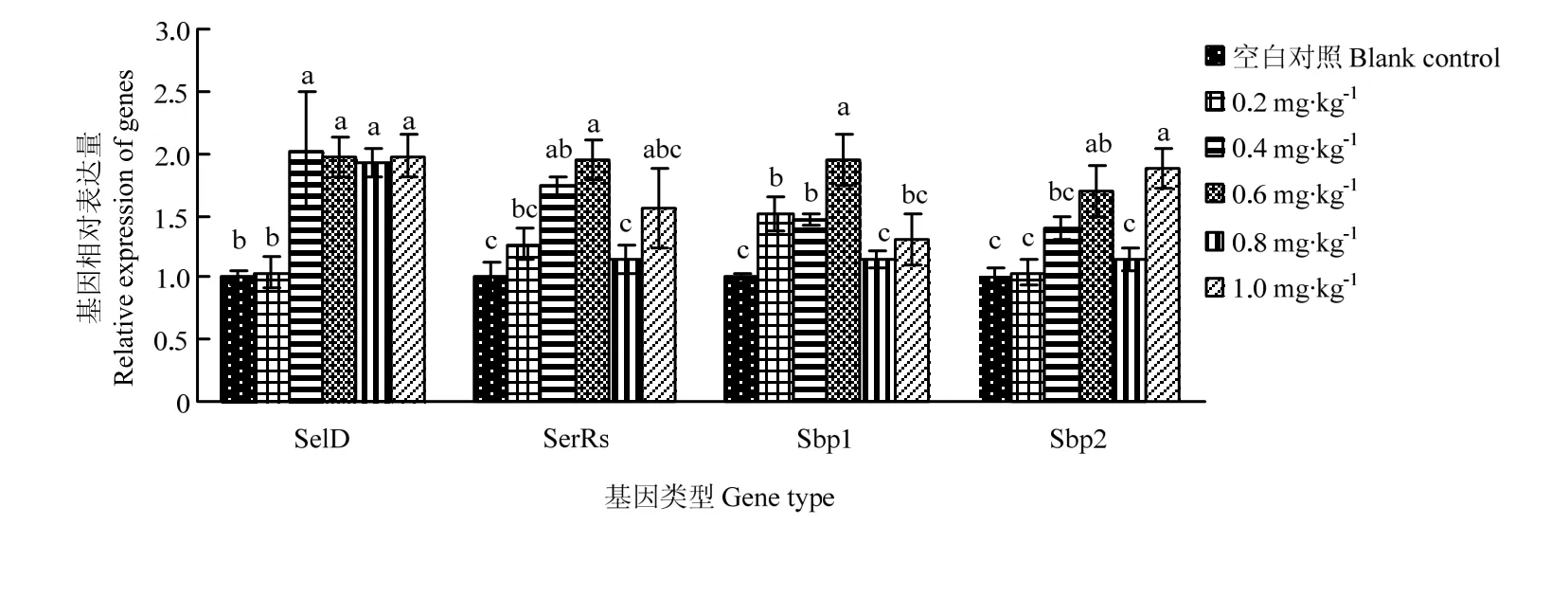
图1 5日龄幼虫SelD、SerRs、Sbp1、Sbp2基因表达水平Fig. 1 SelD, SerRs, Sbp1, Sbp2 genes expression levels of 5-day-old larvae
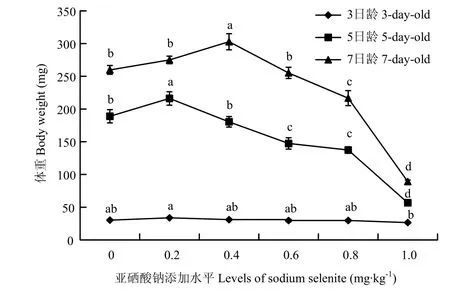
图2 不同日龄幼虫体重Fig. 2 The body weight of different days larvae
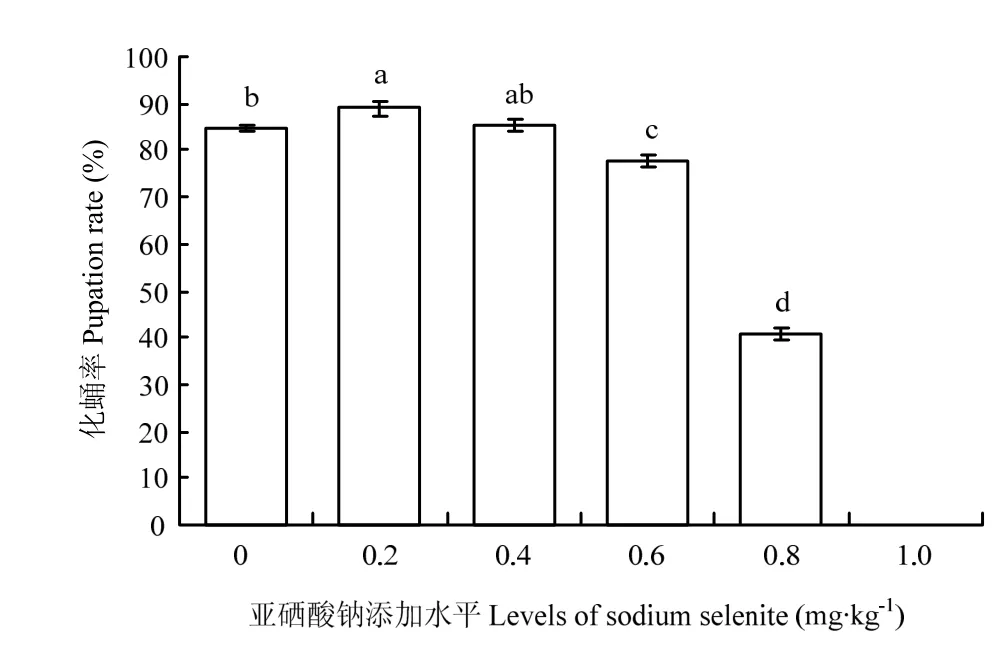
图3 幼虫化蛹率Fig. 3 The pupation rate of larvae
3 讨论
3.1 饲粮内的亚硒酸钠水平对幼虫抗氧化性的影响
机体抗氧化能力的强弱与健康程度有着密切的联系,而硒可以影响动物机体的抗氧化能力。T-AOC可反映机体总抗氧化能力的强弱;T-SOD可消除超氧阴离子自由基,保护细胞免受损伤;MDA反映机体脂质过氧化物含量。硒是硒蛋白谷胱甘肽过氧化酶(glutathione-peroxidase,GSH-PX)活性中心的重要组成部分,缺硒会导致GSH-PX活性降低及合成受阻,本试验没能测定出蜜蜂幼虫体内的GSH-PX,原因可能是蜜蜂幼虫体内GSH-PX含量较低,不在所用试剂盒(南京建成)测定范围内。本试验结果与张艳艳等[20]所测的结果一致,动物缺硒会使机体合成抗氧化酶的能力下降,从而使机体脂质过氧化增强,导致自由基水平和MDA含量升高[21]。随着硒含量的添加,机体MDA含量呈现先下降后上升的趋势,这是因为机体添加适量硒后抗氧化性逐渐增强,清除氧自由基的能力提升,MDA含量下降;而当硒过量后,硒取代蛋白质内的硫元素,对机体产生毒性作用,降低机体抗氧化性,MDA含量上升。
本研究表明,日粮添加硒可以提高意大利蜜蜂幼虫的总抗氧化能力以及SOD活力,同时降低了机体的MDA含量,这说明日粮添加硒可能影响到了其GSH-PX的活性与合成。
3.2 饲粮内的亚硒酸钠水平对幼虫免疫性能的影响
PO是昆虫体内重要的酶,其生成的活性物质是微生物细胞破坏作用的重要部分[22-24],且其在昆虫的体液和细胞免疫中具有重要作用,该酶主要参与昆虫的表皮硬化、微生物黑化包被[25]以及伤口的愈合过程。
王宝维等[26]发现硒可以促进鹅免疫器官的生长,增强机体免疫;林玉才等[27]的研究指出硒缺乏会导致雏鸡免疫器官发育不良,机体免疫功能下降。硒摄入不足对鳞翅目幼虫具有抑制免疫的作用,可以提升机体感染微生物的概率,而微生物感染与昆虫体内的PO活性密切相关[5]。本研究表明,日粮添加适量硒可以显著提高意大利蜜蜂幼虫的酚氧化酶活性,说明硒可以增强幼虫免疫能力,保证机体的健康生长。
3.3 饲粮内的亚硒酸钠水平对幼虫SerRs、SelD、Sbp1、Sbp2基因表达水平的影响
本研究表明,随着硒水平的升高,SerRs水平也升高,0.6 mg·kg-1的时候表达量达到最高;而SelD基因表达量也是随着硒水平的增大升高,0.4 mg·kg-1表达量最高;Sbp2的表达量随着硒添加量的增加一直在升高,添加1.0 mg·kg-1的组有最高表达量,说明蜜蜂合成硒蛋白所用通路可能与古生菌、哺乳动物的硒代谢通路有相似之处,均会用到丝氨酸的tRNA作为Sec-tRNASec的前体物质,且SelD与Sbp2均参与了意大利蜜蜂工蜂幼虫体内硒蛋白的合成。Sbp1随着硒添加水平的增加也在增加,在0.6 mg·kg-1时达到最大值,但其对意大利蜜蜂工蜂幼虫的作用目前尚不明了,试验结果与果蝇上类似[5]。
3.4 饲粮内的亚硒酸钠水平对幼虫体重的影响
黎观红等[28]发现日粮硒添加水平为0.10—0.50 mg·kg-1时可以显著提高泰和乌骨鸡的日增重及降低料重比;王宝维等[26]发现日粮添加硒源可以提高鹅各阶段的体增重;CANTOR等[29]研究表明日粮添加硒代蛋氨酸或亚硒酸钠可提高4周龄火鸡的体重和采食量,且存在剂量-效应关系;张艳艳等[20]的研究发现2—3月龄的生长肉兔日粮内添加0.15 mg·kg-1的硒后可增加其平均日增重。
幼虫阶段是蜜蜂生长发育过程中的重要阶段,而幼虫体重可直观地反映出幼虫的生长发育速度。本研究表明,添加适量的亚硒酸钠可以促进幼虫的生长,但当添加量高于0.4 mg·kg-1后幼虫体重显著降低,说明硒在蜜蜂体内存在剂量效应。添加0.6 mg·kg-1亚硒酸钠的试验组5日龄幼虫体重与对照差异显著,而7日龄差异不显著的原因可能是因为硒对昆虫的毒性有延迟发育的作用,如烟芽夜蛾(Heliothis virescens)[30]和蛆症异蚤蝇(Megaselia scalaris)[31],至第7天此组可能才完成正常发育。
3.5 饲粮内的亚硒酸钠水平对幼虫化蛹率的影响
昆虫需要硒这种微量营养素来完善其多样的生活史参数[5]。化蛹率和羽化率作为昆虫变态发育的过程,是直接反应幼虫发育状况的重要指标。本研究表明,添加适量的亚硒酸钠可在一定程度上提高幼虫的化蛹率,而硒添加量高于0.4 mg·kg-1的试验组化蛹率显著降低,甚至不能化蛹,这与HLADUN等[32]的结果有相似之处,原因是当日粮硒过量后,硒可以取代像半胱氨酸和胱氨酸这类含硫氨基酸内的硫并影响蛋白质折叠,从而扰乱细胞代谢并导致畸形,导致个体发育受到影响。
4 结论
人工饲养基础日粮硒水平为0.21 mg·kg-1条件下,幼虫饲粮硒水平的不同可影响幼虫抗氧化性、免疫性能、硒蛋白合成相关基因表达量化蛹率、化蛹前体重、化蛹率,且以亚硒酸钠为硒源时,通过对幼虫化蛹前体重、化蛹率做拟合曲线,得出亚硒酸钠适宜添加水平为0.24—0.33 mg·kg-1,亦即硒的适宜添加水平为0.32—0.36 mg·kg-1。
[1] GOLUBKINA N, SHESHNITSAN S, KAPITALCHUK M. Ecological importance of insects in selenium biogenic cycling. International Journal of Ecology, 2014, 2014: Article ID 835636.
[2] BECK M A, JEAN H, LEVANDER O A. Host nutritional status: the neglected virulence factor. TRENDS in Microbiology, 2004, 12(9): 417-423.
[3] ELLIS D R, SALT D E. Plants, selenium and human health. Current Opinion in Plant Biology, 2003, 6(3): 273-279.
[4] ROTRUCK J T, POPE A L, GANTHER H E, SWANSON A B,HAFEMAN D G, HOEKSTRA W G. Selenium: biochemical role as a component of glutathione peroxidase. Science, 1973, 179(4073): 588-590.
[5] MARTIN-ROMERO F J, KRYUKOV G V, LOBANOV A V,CARLSON B A, LEE B J, GLADYSHEV V N, HATFIELD D L. Selenium metabolism in Drosophila: selenoproteins, selenoprotein mRNA expression, fertility, and mortality. The Journal of Biological Chemistry, 2001, 276(32): 29798-29804.
[6] POPHAM H J R, SHELBY K S, POPHAM T W. Effect of dietaryselenium supplementation on resistance to baculovirus infection. Biological Control, 2005, 32(3): 419-426.
[7] LAUGHTON A M, BOOTS M, SIVA-JOTHY M T. The ontogeny of immunity in the honey bee, Apis mellifera L. following an immune challenge. Journal of Insect Physiology, 2011, 57(7): 1023-1032.
[8] VIJAYA A, RAO B, SMITHA S. Effects of selenium on the physiology of heart beat, oxygen consumption and growth in silkworm Bombyx mori L. American-Eurasian Journal of Toxicological Sciences,2010, 2(4): 215-219.
[9] AUDAS A, HOGAN G R, RAZNIAK H. Incubation temperature as a modifying factor on survival of Tenebrio molitor reared in selenium-containing media. Journal of Toxicology & Environmental Health, 1995, 44(1): 115-122.
[10] ALLMANG C, WURTH L, KROL A. The selenium to selenoprotein pathway in eukaryotes: More molecular partners than anticipated. Biochimica et Biophysica Acta General Subjects, 2009, 1790(11): 1415-1423.
[11] COPELAND P R, DRISCOLL D M. Purification, redox sensitivity,and RNA binding properties of SECIS-binding protein 2, a protein involved in selenoprotein biosynthesis. The Journal of Biological Chemistry, 1999, 274(36): 25447-25454.
[12] COPELAND P R, FLETCHER J E, CARLSON B A, HATFIELD D L,DRISCOLL D M. A novel RNA binding protein, SBP2, is required for the translation of mammalian selenoprotein mRNAs. The EMBO Journal, 2000, 19(2): 306-314.
[13] LESCURE A, ALLMANG C, YAMADA K, CARBON P, KROL A. cDNA cloning, expression pattern and RNA binding analysis of human selenocysteine insertion sequence (SECIS) binding protein 2. Gene, 2002, 291(1/2): 279-285.
[14] COPELAND P R, STEPANIK V A, DRISCOLL D M. Insight into mammalian selenocysteine insertion: domain structure and ribosome binding properties of Sec insertion sequence binding protein 2. Molecular & Cellular Biology, 2001, 21(5): 1491-1498.
[15] KINZY S A, CABAN K, COPELAND P R. Characterization of the SECIS binding protein 2 complex required for the co-translational insertion of selenocysteine in mammals. Nucleic Acids Research, 2005,33(16): 5172-5180.
[16] CABAN K, KINZY S A, COPELAND P R. The L7Ae RNA binding motif is a multifunctional domain required for the ribosome-dependent Sec incorporation activity of Sec insertion sequence binding protein 2. Molecular & Cellular Biology, 2007, 27(18): 6350-6360.
[17] BUBENIK J L, DRISCOLL D M. Altered RNA binding activity underlies abnormal thyroid hormone metabolism linked to a mutation in selenocysteine insertion sequence-binding protein 2. The Journal of Biological Chemistry, 2007, 282(48): 34653-34662.
[18] DONOVAN J, CABAN K, RANAWEERA R, GONZALEZ-FLORES J N, COPELAND P R. A novel protein domain induces high affinity selenocysteine insertion sequence binding and elongation factor recruitment. The Journal of Biological Chemistry, 2008, 283(50): 35129-35139.
[19] VANDENBERG J D, SHIMANUKI H. Technique for rearing worker honeybees in the laboratory. Journal of Apicultural Research, 1987,26(2): 90-97.
[20] 张艳艳, 李福昌. 日粮不同硒水平对2~3月龄肉兔生长性能、抗氧化指标和肉质的影响. 动物营养学报, 2010, 22(1): 82-87.
ZHANG Y Y, LI F C. Effects of different dietary selenium levels on growth performance, antioxidant indices and meat quality of meat rabbits from 2 to 3 months of age. Journal of Animal Nutrition, 2010,22(1): 82-87. (in Chinese)
[21] 高铭宇, 杨鹰, 袁莉, 刘欣, 杨保收, 金久善, 陈越. 硒和锌相互作用及对肉用鸡胰腺抗氧化功能的影响.中国兽医科技, 2001, 31(4): 23-26.
GAO M Y, YANG Y, YUAN L, LIU X, YANG B S, JIN J S, CHEN Y. Interaction between selenium and zinc and the effect on pancreas antioxidant function of broiler. Chinese Journal of Veterinary Science and Technology, 2001, 31(4): 23-26. (in Chinese)
[22] ZHAO P, LI J, WANG Y, JIANG H. Broad-spectrum antimicrobial activity of the reactive compounds generated in vitro by Manduca sexta phenoloxidase. Insect Biochemistry & Molecular Biology, 2007,37(9): 952-959.
[23] KAN H, KIM C H, KWON H M, PARK J W, ROH K B, LEE H,PARK B J, ZHANG R, ZHANG J, SÖDERHÄLL K, HA N C, LEE B L. Molecular control of phenoloxidase-induced melanin synthesis in an insect. The Journal of Biological Chemistry, 2008, 283(37): 25316-25323.
[24] CERENIUS L, BABU R, SÖDERHÄLL K, JIRAVANICHPAISAL P. In vitro effects on bacterial growth of phenoloxidase reaction products. Journal of Invertebrate Pathology, 2010, 103(1): 21-23.
[25] HUANG L H, CHRISTENSEN B M, CHEN C C. Molecular cloning of a second prophenoloxidase cDNA from the mosquito Armigeres subalbatus: prophenoloxidase expression in blood-fed and microfilariae-inoculated mosquitoes. Insect Molecular Biology, 2001,10(1): 87-95.
[26] 王宝维, 王娜, 葛文华, 岳斌, 张名爱, 史雪萍. 不同硒源对鹅早期生产性能、屠宰性能、肉品质、肌肉常规养分、免疫与抗氧化功能的影响. 中国农业科学, 2011, 44(14): 3016-3026.
WANG B W, WANG N, GE W H, YUE B, ZHANG M A, SHI X P. Effects of different selenium sources on production performance,slaughter performance, meat quality, immune and antioxidant in the early goose. Scientia Agricultura Sinica, 2011, 44(14): 3016-3026. (in Chinese)
[27] 林玉才, 杨颗粒, 武瑞. 硒缺乏对雏鸡免疫器官生长发育的影响.黑龙江畜牧兽医, 2010(9): 115-116.
LIN Y C, YANG K L, WU R. Effect of lacking selenium on chickens of the immunologic organs’ growing. Heilongjiang Journal of Animal Science and Veterinary Medicine, 2010(9): 115-116. (in Chinese)
[28] 黎观红, 徐海燕, 许兰姣, 瞿明仁, 游金明, 易中华, 潘珂. 日粮硒添加水平对泰和乌骨鸡生产性能及组织黑色素含量的影响. 中国农业科学, 2011, 44(13): 2777-2786.
LI G H, XU H Y, XU L J, QU M R, YOU J M, YI Z H, PAN K. Effects of dietary selenium supplementation on growth performance and melanin content in tissues of Taihe silky fowls. Scientia Agricultura Sinica, 2011, 44(13): 2777-2786. (in Chinese)
[29] CANTOR A H, MOOREHEAD P D, MUSSER M A. Comparative effects of sodium selenite and selenomethionine upon nutritional muscular dystrophy, selenium-dependent glutathione peroxidase, and tissue selenium concentrations of turkey poults. Poultry Science, 1982,61: 478-484.
[30] POPHAM H J R, SHELBY K S. Effect of inorganic and organic forms of selenium supplementation on development of larval Heliothis virescens. Entomologia Experimentalis et Applicata, 2007,125(2): 171-178.
[31] JENSEN P D, RIVAS M D, TRUMBLE J T. Developmental responses of a terrestrial insect detritivore, Megaselia scalaris (Loew) to four selenium species. Ecotoxicology, 2005, 14(3): 313-322.
[32] HLADUN K R, KAFTANOGLU O, PARKER D R, TRAN K D,TRUMBLE J T. Effects of selenium on development, survival, and accumulation in the honeybee (Apis mellifera L.). Environmental Toxicology & Chemistry, 2013, 32(11): 2584-2592.
(责任编辑 岳梅)
Appropriate Level of Sodium Selenite for Apis mellifera ligustica Worker Bee Larvae Feed
SU Zhong-qu, ZHANG Wei-xing, CHI Xue-peng, WANG Hong-fang, XU Bao-hua
(College of Animal Science and Technology, Shandong Agricultural University, Taian 271018, Shandong)
【Objective】The objective of this study is to find an appropriate level of sodium selenite which added in the food of Apis mellifera ligustica worker larvae, and to provide a theoretical basis for the nutritional needs of Se.【Method】A total of 1 440 one-day old larvae were randomly allotted into 2 batches, each batch involve 720 larvae, one of the batch was used to measure the pupation rate and eclosion rate, the other was used to measure enzyme activity and molecular index. Two batches were all randomly divided into 6 groups, the control group was fed basic diet and the treatment groups were fed different diets with sodium selenite at the levels of 0.2, 0.4, 0.6, 0.8, and 1.0 mg·kg-1, respectively. Each group had 5 repetitions and involved 24 larvae in each. The 3-, 5-and 7-day-old larvae were used to measure larvae weight, T-AOC (total antioxidant capacity), T-SOD (total superoxide dismutase),MDA (malondialdehyde), and PO (phenoloxidase). The gene expression of SelD, SerRs, Sbp1 and Sbp2 were measured by using 5-day-old larvae. The pupation rate was calculated at 7-day-old.【Result】Compared with the control group, when the added levels of sodium selenite were 0.2-0.6 mg·kg-1, the T-AOC was significantly increased (P<0.05), when the added levels of sodium selenite were 0.2-0.8 mg·kg-1, the activity of T-SOD was significantly increased (P<0.05) and the MDA content of all the treatment groups was significantly decreased (P<0.05). When the added level of sodium selenite was 0.4 mg·kg-1, the activity of PO was significantly increased (P<0.05). When the added level of sodium selenite was 0.6 mg·kg-1, the gene expression levels of SelD, SerRs, Sbp1and Sbp2 was significantly higher than the control in 5-day-old larvae (P<0.05). When the added level of sodium selenite was 0.4 mg·kg-1, the weight before pupation was significantly higher than the control (P<0.05). Compared with the control group, when the added level of sodium selenite was 0.2 mg·kg-1, the pupation rate were significantly increased (P<0.05). 【Conclusion】Under artificial condition, when the selenium level of basic diet was 0.21 mg·kg-1, the appropriate level of sodium selenite which added in the food of A. m. ligustica worker larvae was 0.24-0.33 mg·kg-1by the fitting curve which involve the weight before pupation and the pupation rate, and it means that the appropriate level of selenium which added in the food of A. m. ligustica worker larvae is 0.32-0.36 mg·kg-1.
Apis mellifera ligustica; worker bee larvae; sodium selenite; appropriate level
2016-04-21;接受日期:2016-07-01
国家蜂产业技术体系建设专项资金(CARS-45)、山东省农业良种工程项目
联系方式:苏中渠,E-mail:15705484470@163.com。通信作者胥保华,E-mail:bhxu@sdau.edu.cn
