水稻窄卷叶突变体nrl4的表型分析与基因定位
2016-11-17曾冬冬金晓丽石春海
梁 容,秦 冉,曾冬冬,郑 希,金晓丽,石春海
(1浙江大学农业与生物技术学院,杭州 310058;2浙江大学农生环测试中心,杭州 310058)
水稻窄卷叶突变体nrl4的表型分析与基因定位
梁 容1,秦 冉1,曾冬冬1,郑 希2,金晓丽1,石春海1
(1浙江大学农业与生物技术学院,杭州 310058;2浙江大学农生环测试中心,杭州 310058)
【目的】研究水稻卷叶突变体叶形变化的分子机理,鉴定出新的水稻卷叶基因。【方法】利用EMS诱变籼稻品种浙农34,获得一个窄卷叶突变体,命名为nrl4(narrow and rolling leaf 4)。在抽穗期随机选取野生型浙农34和nrl4各10株,对其进行表型观察和主要农艺性状调查等,并测定叶绿素含量;同时用Zeiss荧光显微镜观察剑叶中部叶片横切面维管束的数目并统计泡状细胞数量。以多代自交稳定的突变体nrl4为母本与野生型浙农34杂交,观察植物F1和F2叶片表型,统计F2中性状分离比并作卡方测验,分析突变表型的遗传行为。利用nrl4与粳稻品种浙农大104杂交,采用F2分离群体进行基因精细定位。利用定量表达对定位区间内5个预测的基因进行相对表达量的分析。【结果】与野生型相比,窄卷叶突变体nrl4抽穗期时全部叶片卷曲且变窄、叶绿素含量升高;株高稍有增加,结实率增大,籽粒明显变长、变窄。窄卷叶突变体nrl4功能叶夹角不同程度减小,叶形更为直立。突变体叶近轴表面特有的泡状细胞数目降低、体积变小,导致叶片向内卷曲。突变体nrl4的叶脉数减少,叶片变窄,中脉一侧2个大维管束之间的小维管束平均为4.5个,而野生型为6.0个。遗传分析表明,突变体nrl4和浙农34杂交的F1表型正常,F2群体中正常植株与窄卷叶突变植株的分离比符合3∶1,表明突变体nrl4的突变性状受1对隐性核基因控制;利用SSR和InDel分子标记将nrl4定位在水稻第3染色体长臂3M11103和3M1115之间、物理距离约为53 kb的区间。在这一区间内,有5个预测注释基因,序列比对和表达分析表明在野生型浙农34和突变体nrl4之间,这些基因序列及启动子序列均未发生变化,但是LOC_Os03g19770在突变体叶片中的表达量显著增加。【结论】 nrl4叶片变窄与维管束数目减少有关,叶片发生内卷与泡状细胞数目减少、体积变小有关。水稻窄卷叶突变体nrl4的性状由1对隐性核基因控制,该基因位于第3染色体InDel标记3M11103和 3M1115物理距离约为53 kb的区间内,预测区间内基因序列及5′UTR区未发现碱基变异,但LOC_Os03g19770在突变体叶片中的表达量达到了野生型植株叶片的17.5倍,推测LOC_Os03g19770为候选基因。
水稻(Oryza sativa L.);窄卷叶突变体(nrl4);表型分析;遗传分析;基因定位
0 引言
【研究意义】叶片是植物重要的光合器官,其大小和卷曲度与水稻株型和产量有关。在生产实际中,叶片的适度卷曲可以提高叶片尤其是后期功能叶的直立度,有利于改善水稻植株的受光条件、延缓叶片衰老,提高水稻产量。【前人研究进展】目前,利用突变体研究水稻叶形变化的分子机理已较为普遍,其突变体主要来源于物理方法(如γ射线等)和化学方法(如EMS)的诱变[1]。研究表明,叶片细胞结构(如泡状细胞)和极性发育异常都会导致叶片卷曲[2-3],按卷曲方向可分为内卷和外卷。迄今,已经定位和克隆了多个与窄叶和卷叶相关的基因,分布于水稻除第8染色体之外的11条染色体上[4]。其中,突变体rl14的卷叶基因位于第10染色体上,编码了一个未知功能的2OG-Fe (Ⅱ)氧化酶,通过控制次生细胞壁的组分影响着叶片中的水分运输,进而导致近轴面泡状细胞体积减小引发叶片向内卷曲[5]。编码MYB家族的SHAQKYF转录因子SLL1[2]/RL9[3]位于第9染色体,也调控着叶片近远轴发育的极性。水稻oul1突变体由于其ROC5被敲除,导致叶片外卷[6];水稻ROC5和拟南芥GLABRA2同源,均编码具有亮氨酸拉链保守结构域的蛋白,对影响叶片形态的泡状细胞的发育起负调控作用。水稻突变体acl1的卷叶基因编码一个无保守结构域的功能未知蛋白,该基因突变后会导致近轴面的泡状细胞数量增加,使叶片外卷[7]。SRL1通过负向调节编码水稻液泡H+-ATPase亚基和H+-焦磷酸酶基因的表达,抑制近轴面的泡状细胞形成,叶片向内卷曲[8]。利用SSR标记,刘晨等[9]将内卷叶基因rl16(t)定位在第9染色体长臂51 kb的区间内;陈涛等[10]以辐恢838/nrl(t)为定位群体,将nrl(t)突变体的卷叶基因定位于水稻第11染色体短臂末端约160 kb长度的范围内。窄叶基因NAL1控制着水稻生长素的极性运输和维管束排列模式,该基因突变后植株表现出窄叶、矮化;水稻nal9突变体在整个生育期都表现出窄叶的表型,并且苗期叶片呈浅绿色、株高变矮、穗变小以及分蘖增加等[11]。卷叶突变体rl10(t)[12]、rl11(t)[13]、nal3(t)[14]、nal2[15]、rl14[5]和窄卷叶突变体nrl1[16]等也都表现出窄叶的特征。【本研究切入点】尽管目前与水稻叶片宽度或卷曲度有关的基因定位和克隆的研究较多,但叶片变窄、变卷的分子机理研究尚有待于进一步的深化;而且上述窄叶、卷叶或者窄卷叶材料往往伴随着一些影响高产的不利性状,如育性下降、株型矮小等,使其应用价值降低。因此发现和鉴定出叶片适度卷曲、具有一定育种利用价值的突变体材料以及相应的新基因具有明显的现实意义。籼稻浙农34经甲基磺酸乙酯(EMS)诱变获得的窄卷叶突变体nrl4(narrow and rolling leaf 4),表现为叶片内卷且变窄,叶色变深,株高增加,主穗结实率增大,千粒重增加,可作为新的育种材料加以研究。【拟解决的关键问题】本研究通过开发新的InDel标记,对新的窄卷叶突变体nrl4进行表型分析和基因定位,旨在为下一步基因克隆提供一定的理论基础,也可为研究水稻叶片发育的分子机制提供新的种质资源。
1 材料与方法
1.1 试验材料
籼稻品种浙农34经EMS诱变后,经筛选和连续多代自交得到能稳定遗传的窄卷叶突变体nrl4。2013年夏在浙江大学试验农场用窄卷叶突变体nrl4分别与粳稻品种浙农大104、野生型籼稻品种浙农34杂交,得到F1,F1自交得F2;2014年夏在杭州种植亲本、F2群体。对遗传分析群体进行表型观察,统计叶片正常与卷曲的植株数,进行卡方检验;采集F2定位群体中的窄卷叶植株叶片进行基因定位。
1.2 农艺性状考察
抽穗期随机选取野生型和突变体各10株,分别统计其株高(cm)、主穗总粒数(粒)、整株结实率(%)、千粒重(g)等农艺性状。测定剑叶、倒二叶和倒三叶的叶长(cm)和叶宽(cm,叶片展开时最宽处)。同时计算功能叶的叶片卷曲指数(leaf rolling index,LRI)[17],LRI=(Lw-Ln)/Lw,其中,Lw为叶片展开时最宽处的宽度,Ln为叶片最宽处自然卷曲后两叶缘之间的距离;并且测量功能叶的叶夹角,即叶脉近轴面与茎秆之间的夹角。
1.3 组织切片观察
在抽穗期分别取野生型浙农34和突变体nrl4的鲜叶,徒手切片后在NIKON显微镜下观察,结束后用FAA固定液体(70%乙醇90 mL、40%甲醛5 mL和冰醋酸5 mL)固定,经脱水、透明、石蜡包埋。取10 μm的横切片,用番红、固绿染色,在Zeiss荧光显微镜下观察、照相,应用Image-Pro Plus6.0软件测量出每平方毫米泡状细胞数量[18]。
1.4 叶绿素含量分析
在抽穗期分别取野生型浙农34和突变体nrl4各10株的剑叶,参照Lichtenthaler[19]的方法测定叶绿素含量。取剑叶0.05 g,剪碎后用乙醇和丙酮的1∶1混合液提取叶绿素,用紫外可见分光光度计(型号TU-1810PC)测定上清液在663 nm和645 nm的吸光值,按照Chla=11.24A663-2.04A645、Chlb=20.13A645-4.19A663和Chl(a+b)=7.05A663+18.09A645公式分别测定叶片单位鲜重叶绿素a、叶绿素b和总叶绿素含量。
1.5 基因初定位
在利用浙农大104和突变体nrl4构建的定位群体F2中,随机选取正常叶和窄卷叶各10株,用CTAB法[20]提取DNA后,分别构建野生型池和突变体池,用BSA(Bulked segregation analysis)法筛选与目的基因连锁的分子标记。利用在浙农34和浙农大104之间有多态性、均匀覆盖在水稻12条染色体上的272个InDel和SSR标记,初步确定该窄卷叶基因在染色体上的位置。20 μL PCR反应体系包含2.0 μL 10×PCR buffer、1 μL 50 ng·μL-1DNA模板、0.3 μL 2.5 mmol·L-1dNTPs、15.7 μL ddH2O、0.6 μL 10 μmol·L-1引物和0.4 μL 5 U·μL-1Taq DNA聚合酶。PCR反应程序为94℃5 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,35个循环;72℃ 10 min,4℃保存。PCR产物经6%非变性聚丙烯酰胺凝胶电泳、银染后观察[21-23]。
1.6 基因精细定位
从Gramene(http://www.gramene.org/)获取籼稻品种9311和粳稻品种日本晴目标区间的基因组序列,并通过NCBI序列匹配数据库(http://blast.stva.ncbi.nlm.nih.gov/Blast.cgi?PAGE_TYPE=BlastSearc h&BLAST_SPEC=blast2seq&LINK_LOC=align2seq)比对,使用DNASTAR和Primer5.0设计开发新的标记。从中选取扩增效果好、多态性明显的标记,利用F2定位群体中1 809个窄卷叶单株对窄卷叶基因进行精细定位。
1.7 RNA提取、实时荧光定量PCR
提取分蘖盛期野生型和突变型叶片总RNA,经反转录合成cDNA第一条链,设计引物进行PCR扩增,反应体系及反应条件参照DRR047A定量反转录试剂盒说明书(宝生物工程(大连)有限公司)。内参基因选为Actin1(Forward primer:5′-CTTCATAGGAATG GAAGCTGCGGGTA-3′;Reverse primer: 5′-CGACCA CCTTGATCTTCATGCTGCTA-3′),采用2×SYBR Green master mix 荧光染料,20 μL PCR 体系(SYBR®Premix Ex TaqTMII 10 μL、上下游引物各0.8 μL、cDNA 1 μL和RNase/DNase-free water 7.4 μL),设3次重复。荧光PCR反应在Roche LightCycler96实时荧光定量PCR仪上进行。反应条件为95℃ 30 s;95℃ 10 s,60℃ 10 s,72℃ 10 s,共40个循环,应用2-ΔΔCT的方法计算基因表达量的相对变化。引物由擎科生物工程有限公司合成。
2 结果
2.1 表型分析
与抽穗期野生型植株相比,突变体nrl4的剑叶叶长平均增加6.72%,叶宽平均减少47.62%,全株叶片卷曲,而剑叶、倒二叶、倒三叶的卷曲度分别为为45%、37%和32%。窄卷叶突变体nrl4的剑叶、倒二叶和倒三叶的夹角均小于野生型植株,其株型更为直立。此外,突变体nrl4的其他农艺性状也有较大的变化,如突变体植株略高于野生型,但主穗粒数和主穗实粒数显著低于野生型,分别减少了41.42%和33.96%,而整株结实率升高了11.94%(表1)。因此,该基因的突变不仅影响到叶片的形态,同时还对株高、穗长、结实率等农艺性状有较大的影响(图1)。
2.2 叶片形态的组织切片观察
石蜡切片分析表明,抽穗期时在突变体nrl4的剑叶中部横切面中,可以观察到突变体的大维管束数目明显要少于野生型,约减少了11.76%(图2-A);而小维管束数目减少得更多,仅为野生型浙农34的56.60%(图2-B),并且中脉一侧的2个大维管束之间的小维管束数目在野生型平均为6.0个,在突变体nrl4中平均为4.5个(图2-D)。突变体nrl4的泡状细胞也表现为体积变小(图3)、数量减少(图2-C)。
2.3 叶绿素含量分析
抽穗期野生型浙农34和突变体nrl4的叶绿素含量表明,突变体中的叶绿素a、叶绿素b和总叶绿素含量均升高,分别为野生型的1.72倍、1.80倍和1.72倍,差异达到极显著水平(图4)。
2.4 突变体的遗传分析
用表型正常的野生型浙农34与突变体nrl4杂交,F1表型正常,说明该突变体性状受隐性基因控制。F2中正常单株为921株,卷叶单株为311株。经χ2检验,该分离比符合3∶1(χ2=0.027<χ20.05= 3.84),表明该窄卷叶形状由1对隐性核基因控制。
2.5 基因定位
利用分布于水稻12条染色体上、在浙农34和浙农大104之间有多态性差异的272对InDel和SSR标记进行初步定位,发现位于第3染色体的标记3M8和3M10与突变体位点连锁。为进一步缩小定位区间,在3M8和3M10之间又开发了2个亲本之间存在多态性的分子标记3M1083、3M1088、3M1090、3M1097、3M1108、3M11103和3M1115等(表2)。利用这些标记对F2中1 809株卷叶单株进行筛选分析,最后将目的基因定位在InDel标记3M11103和3M1115之间,物理距离约为53 kb(图5)。该区段内尚未发现与窄卷叶有关的基因,因此,推测NRL4为一个新的窄卷叶调控基因。
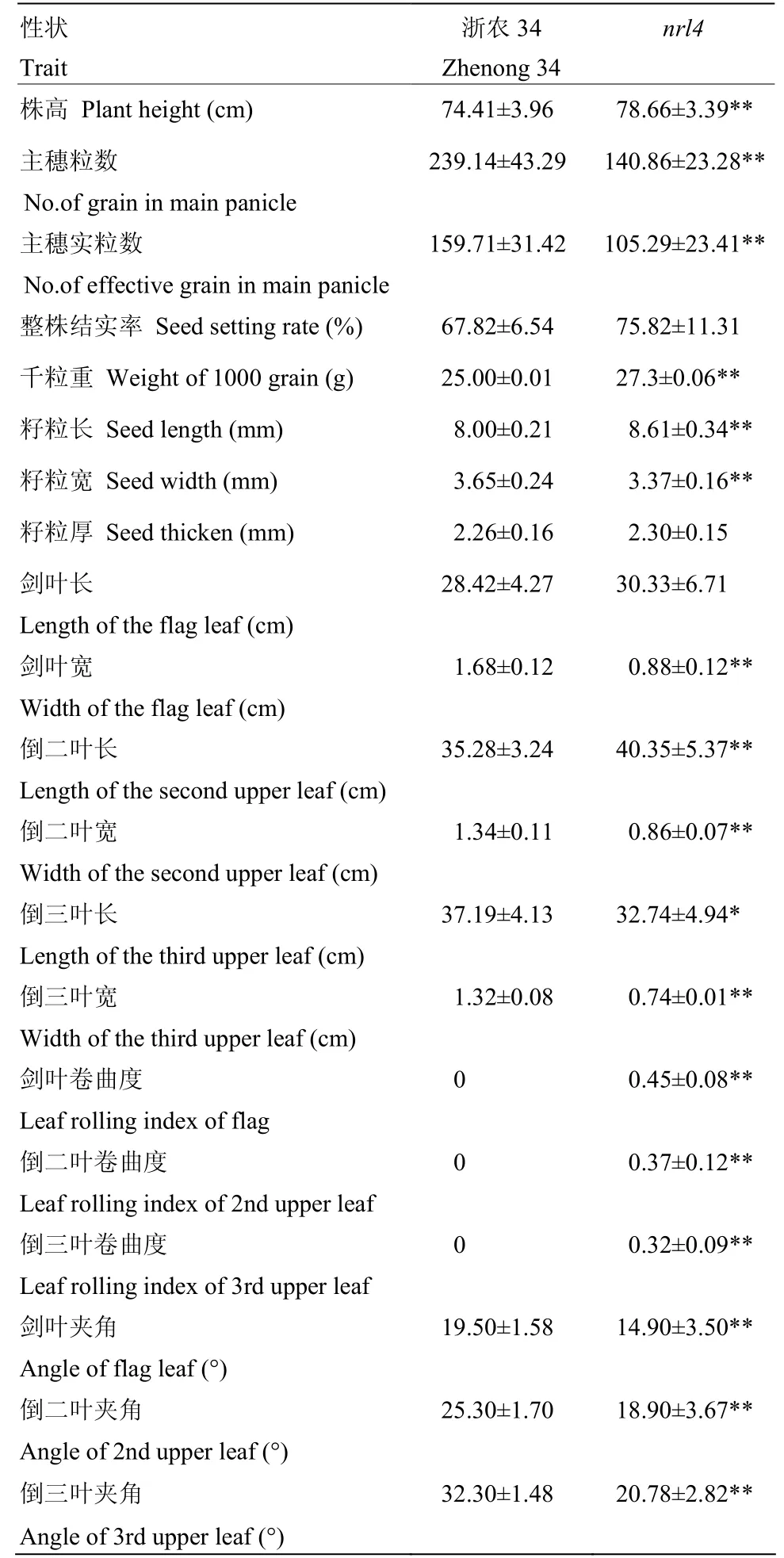
表1 野生型浙农34与窄卷叶突变体nrl4性状的比较Table1 Comparison of morphological traits between the wild type Zhenong34 and mutant type nrl4
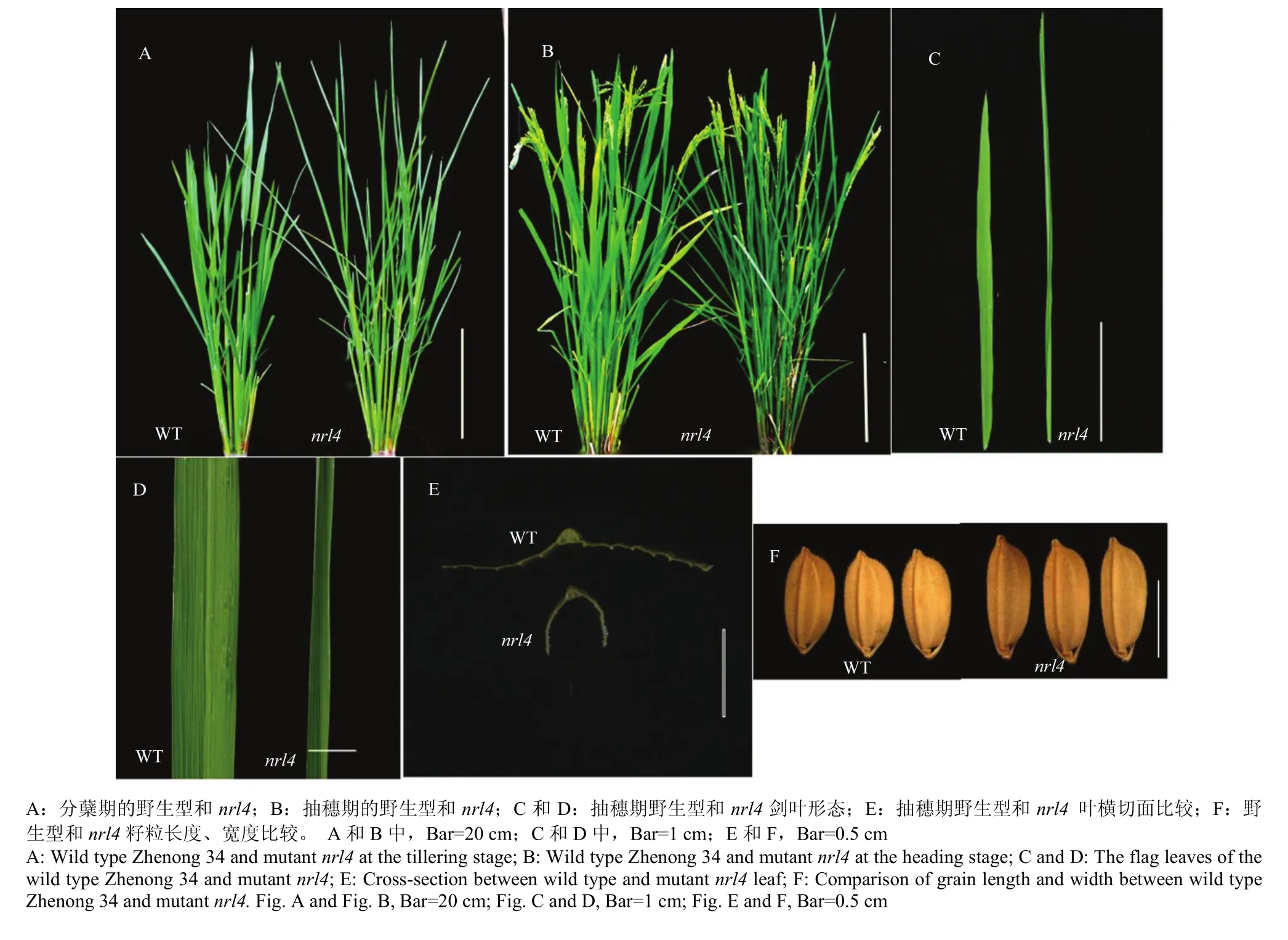
图1 野生型浙农34和突变体nrl4表型分析Fig. 1 Phenotype of wild-type (WT) and nrl4 mutant
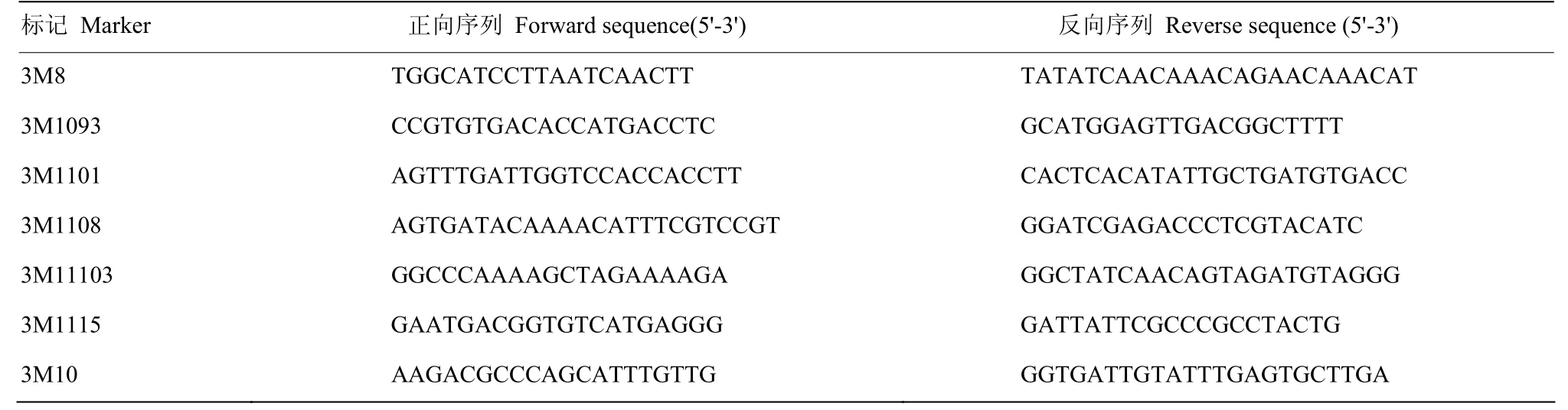
表2 第3染色体上的连锁标记Table2 Polymorphic markers used in the fine mapping on chromosome 3 in rice
2.6 候选基因分析
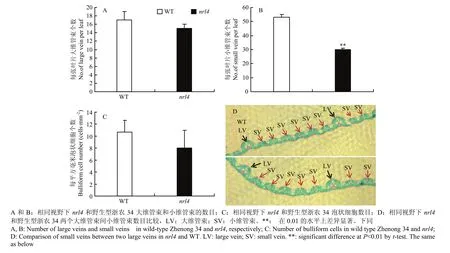
图2 窄卷叶突变体nrl4和野生型浙农34的叶片结构比较Fig. 2 Comparison of the structure of leaf between wild type Zhenong 34 and a mutant nrl4
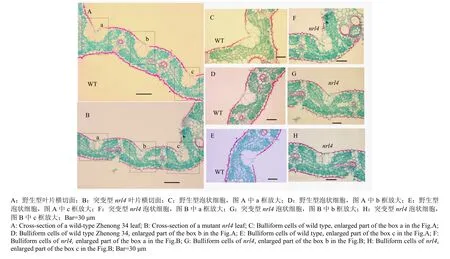
图3 窄卷叶突变体nrl4和野生型浙农34叶片横切面泡状细胞观察Fig. 3 Histological observation of bulliform cells in transverse section of blades in wild-type (WT) and nrl4 mutant in tillering stage
根据Rice genome annotation project(http://rice. plantbiology.msu.edu/cgi-bin/gbrowse/rice/)提供的信息显示,该区间内有5个开放阅读框(表3),分别为LOC_Os03g19760、LOC_Os03g19770、LOC_Os03g19780、 LOC_Os03g19800和LOC_Os03g19820。其中,LOC_ Os03g19760编码一类卤酸脱卤酶超家族水解酶,在拟南芥中的同源基因为AT1G56500。AT1G56500编码叶绿体中的类囊膜蛋白,上面分布着与植物叶片光吸收效率有关的类硫氧还蛋白和连接在叶绿体基质感光片上卤酸脱卤酶域的β-螺旋结构域。LOC_Os03g19770编码富含甘氨酸的细胞壁蛋白——是一类组成细胞壁主要成分的结构蛋白,构建植物细胞的基本框架,在维持植物细胞机械强度中起着作用,与细胞生长有关。研究表明,富含甘氨酸蛋白在维管束的厚壁组织中含量丰富(厚壁组织为植物体提供支撑力),使植物能够承受拉力、弯曲等外界胁迫[24]。LOC_Os03g19780、LOC_Os03g19800和LOC_Os03g19820编码3个未知的表达蛋白。从这些基因预测分析,LOC_Os03g19760与叶绿体发育相关,LOC_Os03g19770是厚壁组织的组分,因此与叶片发育有关。通过对预测区间内的5个基因全长和5′端UTR序列分析,在浙农34和突变体nrl4之间5个预测的基因和5′端UTR的序列上未发现存在差异。随后,对这5个基因表达水平进行检测(图6),在突变体nrl4中,与厚壁组织有关的基因LOC_Os03g19770的表达量是野生型浙农34的17.5倍,显著升高。而其他基因表达量则上调或者下调,但表达量变化不显著。厚壁细胞的缺失和减少能使叶片失去支撑而发生卷曲,而LOC_Os03g19770编码的富含甘氨酸的细胞壁蛋白,在维管束的厚壁组织中含量丰富,使植物能够承受拉力、弯曲等压力。所以,推测LOC_Os03g19770为候选基因。

图4 nrl4和野生型浙农34剑叶叶绿素含量Fig. 4 Chlorophyll content of the nrl4 and WT Zhenong34 flag leave

图5 NRL4在第3染色体上的定位Fig. 5 Linkage map of NRL4 on chromosome 3 in rice

表3 NRL4定位区间内基因功能预测Table3 Funtion prediction about genes in NRL4 mapped region
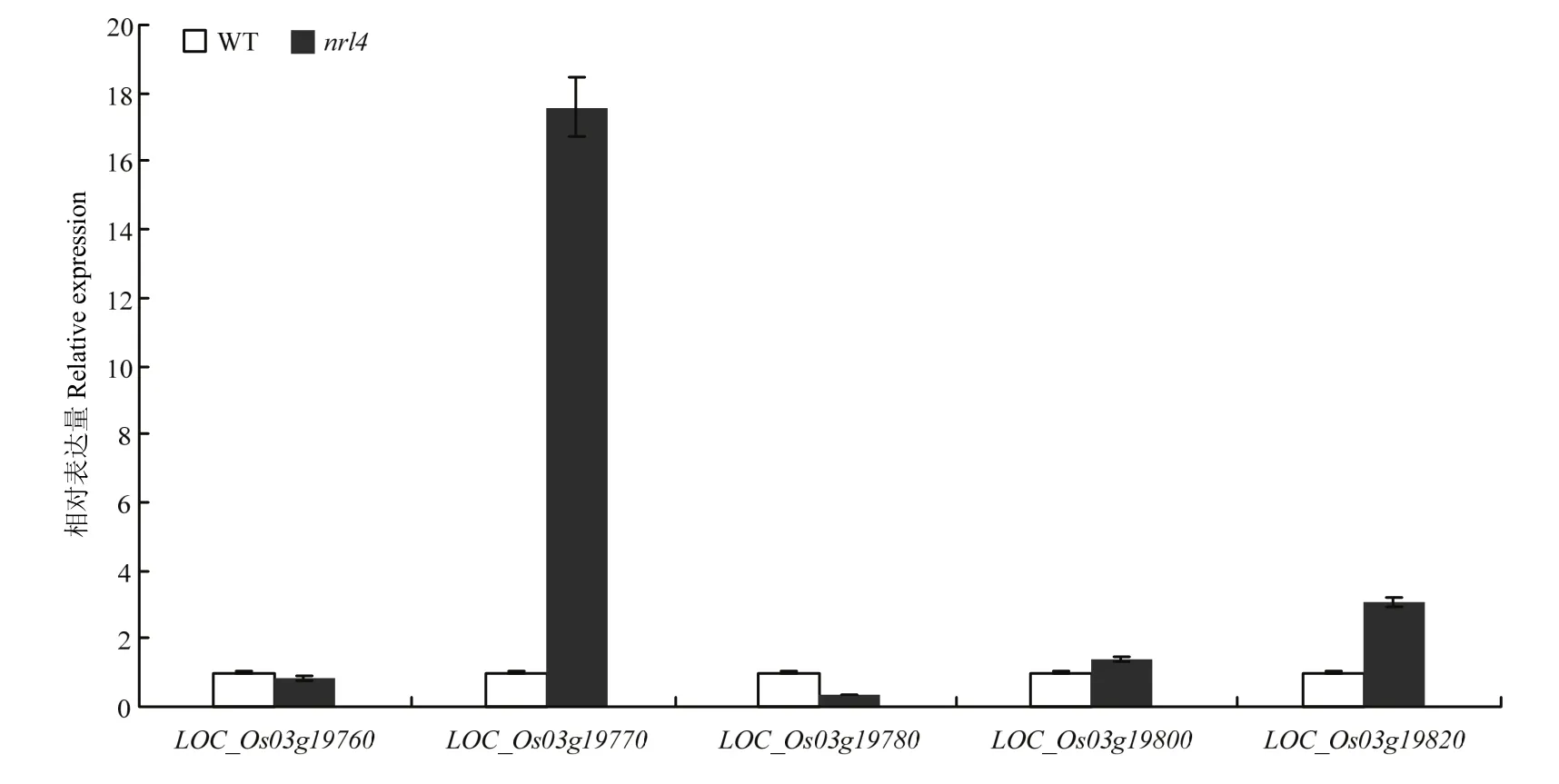
图6 预测基因的相对表达量Fig. 6 Relative expression of predicted genes
3 讨论
株型与水稻产量有着密切关系,其中叶形是遗传育种工作者考虑的重要性状之一。叶片的适度卷曲能保持叶片直立而不披垂,有利于改善植物中后期受光条件和增加光合积累。研究发现,许多与叶片极性发育相关的基因、miRNA、以及叶片生理结构异常和生长素含量变化等都可能引起叶片卷曲。叶片发育包括叶原基的形成和叶极性的建立2个阶段,而叶极性的建立会直接影响叶片的形态[25]。HD-ZIPⅢ类基因[26]参与茎尖分生组织(SAM)的发育和水稻叶近-远轴极性的建立,超表达植株中叶片会发生近轴面化,导致叶片内卷或变成棒状;拟南芥中的PHABuLOSA(PHB)、PHAVLOuTA(PHV)和REVOLuTA(REV)[27],以及玉米Roll leaf 1(rld1)[28]都属于HD-ZIP III基因家族,这些基因均调控着叶片卷曲。KANADI(KAN)[29]可在侧生器官远轴面特异性表达,参与叶片极性建立过程。拟南芥KAN基因家族成员的双、多突变体植株表现出明显的近轴面化特征,与之相反KAN过表达则会导致侧生器官的远轴面化(外卷)[30],SHALLOTLIKE1(SLL1)是水稻中与拟南芥KAN1同源基因,水稻sll1突变体叶片向内卷曲成葱状。
microRNA(miRNA)作为一种具有基因表达调节功能的小RNA分子,可能是一类进化上保守的、在生命中起着重要调控作用的一类分子[31]。miRNA的靶基因大多数是编码调节植物生长发育、信号转导、蛋白降解、细胞发育及分化的转录因子,包括与器官极性建立相关调控因子,它们能有效地抑制相关蛋白质的合成,导致靶mRNA的降解,产生基因沉默[32]。在拟南芥发育过程中的HD-ZIP III基因家族成员PHABuLOSA(PHB)、PHAVLOuTA(PHV)和REVOLuTA(REV),以及玉米Roll1(Rld1)在远轴面的表达都受到miRNA166/165的调控[33-35],通过降解PHB、PHV和REV的mRNA,抑制HD-ZIP III类基因在叶片远轴面的表达从而维持叶片正确的近远轴极性特征。在水稻分生组织缺陷的突变体sho1(shoot organization 1)和sho2(shoot organization 2)[36]中,部分叶片呈现极度卷曲,通过检测小RNA分子发现,miRNA166丰度明显增加,靶基因OSHB1和OSHB2表达下调。所以,在卷叶的形态建成过程中,miRNA发挥着调控作用。
多数植物的叶片包含厚壁组织、泡状细胞、木质部、维管束、叶肉细胞等,这些组织或者结构异常通常会导致叶片形态的变化。窄叶突变体nal1基因位于第4染色体上[37],表现为叶片变窄、大小维管束数目减少以及维管束排列方式的改变,说明该基因调节维管束排列模式。Adl1编码一个植物特异的半胱氨酸蛋白酶,能促进表皮细胞特别是泡状细胞的发育,是叶原基细胞近远轴极性建立所必需的,突变体叶片向远轴面卷曲[38]。大部分卷叶突变体都伴有植株变矮、结实率降低等不利于性状,而本研究发现的窄卷叶突变体nrl4在全生育期高度卷曲,其株高增加、株型较紧凑、叶绿素含量升高、千粒重增加,可以作为遗传和育种材料加以研究。细胞学分析发现,其泡状细胞数目减少、体积变小,引起叶片内卷;其大维管束和小维管束数目均显著减少,与叶片变窄有关,这也为前人所证实[11]。本研究对该窄卷叶突变体进行遗传分析和基因定位,将nrl4基因定位在第3染色体长臂Indel标记3M11103和3M1115之间,物理距离约为53 kb。网站http://rice.plantbiology.msu.edu/cgi-bin/ gbrowse/rice/注释结果显示,其内有5个注释基因LOC_Os03g19760、LOC_Os03g19770、LOC_Os03g19780、LOC_Os03g19800和LOC_Os03g19820。LOC_Os03g19760编码一类卤酸脱卤酶超家族水解酶,在拟南芥中存在的同源基因AT1G56500是编码叶绿体中的一种类囊膜蛋白,与植物叶片的光合效率有关,突变体nrl4叶片中叶绿素含量显著增加,可能与此基因表达量的改变、进而影响叶绿体的发育有关;LOC_Os03g19770编码富含甘氨酸的细胞壁蛋白,在维持植物机械强度中发挥作用,在水稻叶片维管束厚壁组织中含量丰富,使植物能够承受外界拉力等胁迫。而水稻叶片中维管束处厚壁组织异常,会使其叶片形态发生变化[39]。LOC_Os03g19780、LOC_Os03g19800、LOC_Os03g19820编码3种未知的表达蛋白。测序结果表明预测区间内的5个基因序列和上游启动子区域2 kb范围内的碱基序列在野生型浙农34和突变型nrl4之间没有差异,但是LOC_Os03g19770在突变体叶片中的表达量有显著提高,可能影响了厚壁组织的形成。这说明突变产生在转录水平上,可能是一种新的突变模式。这一结果有也许会涉及到表观遗传机制,如DNA甲基化作用[40]。此外,与叶片极性发育相关的一些基因、miRNA、以及叶片生理结构异常和生长素含量变化等方面都可能引起叶片卷曲,本研究中在定位区间内是否存在miRNA基因,以及在候选基因表达过程中是否发生非DNA水平的变化,使得还需要进一步研究以确定此新基因。该基因目前尚未被报道,且遗传行为简单,相应突变体具有一些有利于育种工作的农艺性状,因而在卷叶分子机理研究和高产育种中具有重要的应用价值。
目前,在第3染色体长臂上已经发现了2个隐性卷叶基因nrl2(t)和sll2,但均不在标记3M11103和3M1115之间,并且植株表型与突变体nrl4存在差异。因此,可以认为NRL4属于一个控制窄卷叶的新基因,试验结果为NRL4的克隆及水稻叶发育机理的阐述奠定了一定基础。
4 结论
通过EMS诱变,获得了突变体nrl4,其表现为叶片发生明显内卷、窄化,试验结果表明内卷可能与泡状细胞数目减少、体积减小有关,维管束数目减少引起叶片窄化。其次该突变体还表现出水稻叶片增长、叶绿素含量升高、籽粒变长、主穗结实率提高,但其主穗总粒数和主穗实粒数均有所减少。该突变性状受控于1对核隐性基因,定位于第3染色体长臂Indel标记3M11103和3M1115之间,距离约为53 kb。该区间内有5个预测基因,编码序列及5′端UTR区未发生碱基变异,但LOC_Os03g19770在突变体叶片中的表达量显著提高。推测该基因为一个控制水稻窄卷叶性状的新基因。
[1] 叶俊, 吴建国, 杜婧, 郑希, 张志, 石春海. 水稻“9311”突变体筛选和突变体库构建. 作物学报, 2006, 10(32): 1525-1529,1599-1600.
YE J, WU J G, DU J, ZHENG X, ZHANG Z, SHI C H. The sereening of mutants and construction of rice mutant population of variety“9311” of rice (Oyrza sativa L.). Acta Agronomica Sinica, 2006,10(32): 1525-1529, 1599-1600. (in Chinese)
[2] ZHANG G, XU Q, ZHU X, QIAN Q, XUE H. SHALLOT-LIKE1 is a KANADI transcription factor that modulates rice leaf rolling byregulating leaf abaxial cell development. The Plant Cell, 2009, 21(3): 719-735.
[3] YAN S, YAN C J, ZENG X H, YANG Y C, FANG Y W, TIAN C Y,SUN Y W, CHENG Z K, GU M H. ROLLED LEAF 9, encoding a GARP protein, regulates the leaf abaxial cell fate in rice. Plant Molecular Biology, 2008, 68(3): 239-250.
[4] YI J, ZHUANG C, WANG X, CAO Y, LIU Y, MEI M. Genetic analysis and molecular mapping of a rolling leaf mutation gene in rice. Journal of Integrative Plant Biology, 2007, 49(12): 1746-1753.
[5] FANG L K, ZHAO F M, CONG Y F, SANG X C, DU Q, WANG D Z,LI Y F, LING Y H, YANG Z L, HE G H. Rolling-leaf14 is a 2OG-Fe(II) oxygenase family protein that modulates rice leaf rolling by affecting secondary cell wall formation in leaves. Plant Biotechnology Journal, 2012, 10(5): 524-532.
[6] ZOU L P, SUN X H, ZHANG Z G, LIU P, WU J X, TIAN C J, QIU J L, LU T G. Leaf rolling controlled by the homeodomain leucine zipper class IV gene roc5 in rice. Plant Physiology, 2011, 156(3): 1589-1602.
[7] LI L, SHI Z Y, LI L, SHEN G Z, WANG X Q, AN L S, ZHANG J L. Overexpression of ACL1 (abaxially curled leaf 1) increased bulliform cells and induced abaxial curling of leaf blades in rice. Molecular Plant, 2010, 3(5): 807-817.
[8] XIANG J J, ZHANG G H, QIAN Q, XUE H W. SEMI-ROLLED LEAF1 encodes a putative glycosylphosphatidylinositol-anchored protein and modulates rice leaf rolling by regulating the formation of bulliform cells. Plant Physiology, 2012, 159(4): 1488-1500.
[9] 刘晨, 孔维一, 尤世民, 钟秀娟, 江玲, 赵志刚, 万建民. 一个水稻卷叶基因的遗传分析和精细定位. 中国农业科学, 2015, 48(13): 2487-2496.
LIU C, KONG W Y, YOU S M, ZHONG X J, JIANG L, ZHAO Z G,WAN J M. Genetic analysis and fine mapping of a novel rolled leaf gene in rice, Scientia Agricultura Sinica, 2015, 48(13): 2487-2496.(in Chinese)
[10] 陈涛, 刘燕清, 张亚东, 朱镇, 赵庆勇, 周丽慧, 姚姝, 于新, 赵凌,王才林. 水稻窄卷叶突变体nrl(t)的遗传分析与基因定位. 华北农学报, 2014, 29(4): 37-43.
CHEN T, LIU Y Q, ZHANG Y D, ZHU Z, ZHAO Q Y, ZHOU L H,YAO S, YU X, ZHAO L, WANG C L. Genetic analysis and gene mapping of a narrow and rolled mutant nrl(t) in rice. Acta Agriculturae Boreali-Sinica, 2014, 29(4): 37-43. (in Chinese)
[11] LI W, WU C, HU G C, XING L, QIAN W J, SI H M, SUN Z X,WANG X C, FU Y P, LIU W Z. Characterization and fine mapping of a novel rice narrow leaf mutant nal9. Bulletin of Botany, 2013, 55(11): 1016-1025.
[12] LUO Z K, YANG Z L, ZHONG B Q, LI Y G, XIE R, ZHAO F M,LING Y H, HE G H. Genetic analysis and fine mapping of a dynamic rolled leaf gene, RL10(t), in rice (Oryza sativa L.). Genome, 2007,50(9): 811-817.
[13] ZHOU Y, FANG Y X, ZHU J Y, LI S Q, GU F, GU M H, LIANG G H. Genetic analysis and gene fine mapping of a rolling leaf mutant(rl11(t)) in rice (Oryza sativa L.). Chinese Science Bulletin, 2010,55(17): 1763-1769.
[14] WANG D K, LIU H Q, LI K L, LI S J, TAO Y Z. Genetic analysis and gene mapping of a narrow leaf mutant in rice (Oryza sativa L.). Chinese Science Bulletin, 2009, 54(5): 752-758.
[15] CHO S H, YOO S C, ZHANG H, PANDEYA D, KOH H J, HWANG J Y, KIM G T, PAEK N C. The rice narrow leaf 2 and narrow leaf 3 loci encode WUSCHEL-related homeobox 3A (OsWOX3A) and function in leaf, spikelet, tiller and lateral root development. New Phytologist, 2013, 198(4): 1071-1084.
[16] HU J, ZHU L, ZENG D, GAO Z, GUO L, FANG Y, ZHANG G,DONG G, YAN M, LIU J, QIAN Q. Identification and characterization of NARROW AND ROLLED LEAF 1, a novel gene regulating leaf morphology and plant architecture in rice. Plant Molecular Biology,2010, 73(3): 283-292.
[17] 冯萍, 邢亚迪, 刘松, 郭爽, 朱美丹, 娄启金, 桑贤春, 何光华, 王楠. 水稻卷叶突变体rl28的特性与基因定位. 作物学报, 2015,41(8): 1164-1171.
FENG P, XING Y D, LIU S, GUO S, ZHU M D, LOU Q J, SANG X C, HE G H, WANG N. Traits and gene mapping of the rolled mutant rl28 in rice. Acta Agronomica Sinica, 2015, 41(8): 1164-1171. (in Chinese)
[18] 许扬, 赵英凯, 毕明刚, 刘妍. Image-Pro Plus图像分析软件定量鸡胚尿囊膜血管新生面积的方法. 中国比较医学杂志, 2007, 17(12): 745-747, 773.
XU Y, ZHAO Y K, BI M G, LIU Y. The use of digital Image-Pro Plus to quantitate angiogenesis in the chick embryo chorioallantoicmembrane. Chinese Journal of Comparative Medicine, 2007, 17(12): 745-747,773. (in Chinese)
[19] LICHTENTHALER H K. Chlorophylls, carotenoids. Pigments of photosynthetic biomembranes. Methods in Enzymology, 1987, 148(C): 350-382.
[20] MURRAY M G, Thompson W F. Rapid isolation of high molecular weight plant DNA. Nucleic Acids Research, 1980, 8(19): 4321-4326.
[21] SANG X, HE G, ZHANG Y, YANG Z, PEI Y. The simple gain of templates of rice genomes DNA for PCR. Hereditas, 2003, 25(6): 705.
[22] MCCOUCH S R, CHEN X, PANAUD O, TEMNYKH S, XU Y, CHOY G. Microsatellite marker development, mapping and applications in rice genetics and breeding. Plant Molecular Biology, 1997, 35(1): 89-99.
[23] WU D, WU H, WANG C, TSENG H, HWU K. Genome-wide InDel marker system for application in rice breeding and mapping studies. Euphytica, 2013, 192(1): 131-143.
[24] KELLER B, TEMPLETON M D, LAMB C J. Specific localization of a plant cell wall glycine-rich protein in protoxylem cells of the vascular system. Proceedings of the National Academy of Sciences of the USA, 1989, 86(5): 1529-1533.
[25] 姚健. 水稻卷叶突变体的遗传分析和基因定位研究[D]. 扬州: 扬州大学, 2012.
YAO J. Genetic analysis and gene mapping of the rolled mutant in rice[D]. Yangzhou: Yangzhou University, 2012. (in Chinese)
[26] COMELLI R N, GONZALEZ D H. Conserved homeodomain cysteines confer redox sensitivity and influence the DNA binding properties of plant class III HD-Zip proteins. Archives of Biochemistry and Biophysics, 2007, 467(1): 41-47.
[27] BAO N, LYE K, BARTON M K. MicroRNA binding sites in arabidopsis class III HD-ZIP mRNAs are required for methylation of the template chromosome. Developmental Cell, 2004, 7(5): 653-662.
[28] JUAREZ M T, TWIGG R W, TIMMERMANS M C. Specification of adaxial cell fate during maize leaf development. Development, 2004,131(18): 4533-4544.
[29] KERSTETTER R A, TAYLOR R A, BOLLMAN K, BOMBLIES K,POETHIG R S. KANADI regulates organ polarity in Arabidopsis. Nature, 2001, 411(6838): 706-709.
[30] IZHAKI A, BOWMAN J L. KANADI and class III HD-Zip gene families regulate embryo patterning and modulate auxin flow during embryogenesis in Arabidopsis. The Plant Cell, 2007, 19(2): 495-508.
[31] KIDNER C A, MARTIENSSEN R A. The developmental role of microRNA in plants. Current Opinion in Plant Biology, 2005, 8(1): 38-44.
[32] YIN J Q, WANG Y. RNA-mediated gene regulation system: Now and the future. International Journal of Molecular Medicine, 2002, 10(4): 355-365.
[33] MALLORY A C, REINHART B J, JONES-RHOADES M W, TANG G, ZAMORE P D, BARTON M K, BARTEL D P. MicroRNA control of PHABULOSA in leaf development: Importance of pairing to the microRNA 5 region. The EMBO Journal, 2004, 23(16): 3356-3364.
[34] KINDER C A, MARTIENSSEN R A. Spatially restricted microRNA directs leaf polarity through ARGONAUTE1. Nature, 2004, 428(6978): 81-84.
[35] JUAREZ M T, KUI J S, THOMAS J, HELLER B A, TIMMERMANS M C. microRNA-mediated repression of rolled leaf 1 specifies maize leaf polarity. Nature, 2004, 428(6978): 84-88.
[36] ITOH J, KITANO H, MATSUOKA M, NAGATO Y. Shoot organization genes regulate shoot apical meristem organization and the pattern of leaf primordium initiation in rice. The Plant Cell, 2000, 12(11): 2161-2174.
[37] JIANG D, FANG J J, LOU L M, ZHAO J F, YUAN S J, YIN L, SUN W, PENG L X, GUO B T, LI X Y. Characterization of a null allelic mutant of the rice NAL1 gene reveals its role in regulating cell division. PLoS ONE, 2015, 10(2): e0118169.
[38] HIBARA K, OBARA M, HAYASHIDA E, ABE M, ISHIMARU T,SATOH H, ITOH J, NAGATO Y. The ADAXIALIZED LEAF 1 gene functions in and embryonic pattern formation in rice. Developmental Biology, 2009, 334(2): 345-354.
[39] 张水军, 曾千春, 卢秀萍, 李文正. 植物富含甘氨酸蛋白的研究进展. 中国农学通报, 2010, 26(14): 54-58.
ZHANG S J, ZENG Q C, LU X P, LI W Z. Progress on plant glycine-rich protein. Chinese Agricultural Science Bulletin, 2010,26(14): 54-58. (in Chinese)
[40] 张玲, 郭爽, 汪玲, 张天泉, 庄慧, 龙珏臣, 何光华, 李云峰. 水稻矮化并花发育异常突变体dwarf and deformed flower 2 (ddf2) 的基因定位与候选基因分析. 中国农业科学, 2015, 48(10): 1873-1881.
ZHANG L, GUO S, WANG L, ZHANG T Q, ZHUANG H, LONG J C, HE G H, LI Y F. Gene mapping and candidate gene analysis of a dwarf and deformed flower 2 (ddf2) mutant in rice (Oryza sativa). Scientia Agricultura Sinica, 2015, 48(10): 1873-1881. (in Chinese)
(责任编辑 李莉)
Phenotype Analysis and Gene Mapping of Narrow and Rolling Leaf Mutant nrl4 in Rice (Oryza sativa L.)
LIANG Rong1, QIN Ran1, ZENG Dong-dong1, ZHENG Xi2, JIN Xiao-li1, SHI Chun-hai1
(1College of Agriculture and Biotechnology, Zhejiang University, Hangzhou 310058;2Analysis Center of Agrobiology and Environmental Science, Zhejiang University, Hangzhou 310058)
【Objective】 Rice leaf mutant was used to study molecular mechanisms of leaf traits, and to identify the related novel rolling genes in rice.【Method】 The mutant with narrow and rolling leaves was derived from the indica cultivar Zhenong34 induced by ethyl methylsulphonate (EMS), named nrl4. At heading stage, nrl4 and WT Zhenong 34 were randomly selected 10 strains to measure the main agronomic traits and chlorophyll content of nrl4 and WT were tested at the same time. The bulliformcells were observed and counted as well as the number of large and small veins in transverse section of blade under the Zeiss microscope. The leaf phenotype of the F1plants and F2population which derived from the crossing of nrl4 with Zhenong 34 were investigated and the segregation ratio of normal and rolling leaves were analyzed by chi-square test in the F2population. The F2population from crossing of nrl4 with Zhenong 104 was used for genetic analysis and gene fine mapping. Five genes in the located region were analyzed by gene quantitative expression. 【Result】 Morphological analysis showed that all leaves of mutant nrl4 were narrow and rolling. In addition, compared with wild type Zhenong 34, plant height, seed setting rate in main panicle and pigment content of mutant nrl4 were increased, as well as grain length of nrl4, but the width of grain was decreased. Leaf angles of functional leaves were all decreased leading to more erecting plant type. Statistical analysis suggested that the rolling leaf phenotype might be caused by the change of number and size of bulliform cells which especially existed at the adaxial side of blade; moreover, in accordance with reduced leaf blade width, leaves of nrl4 contain a decreased number of large veins and small veins. There were 6.0 small veins between two large veins on one side of main vein averagely in mutant nrl4 leaf while there were 4.5 in wild type Zhenong34. Genetic analysis indicated that the mutant trait was controlled by a single recessive gene, the gene nrl4 was located in a confined region of 53 kb flanked by two InDel makers 3M11103 and 3M1115 on the long arm of chromosome 3, where five annotated genes were predicted. Based on the result of sequencing, there was no mutation occurred in the gene sequence and promoter sequence of these predicted genes, but strong changes in gene expression pattern of LOC_Os03g19770 according to the real time quantitative PCR. These results are very valuable for further study on this gene. 【Conclusion】 The narrow leaves are related to reduced number of vasculars, moreover the rolling blade of mutant nrl4 might resulted from the decreased area and number of bulliform cells. The mutant nrl4 is controlled by a single recessive nuclear gene, which is located on chromosome 3, between 3M11103 and 3M1115 with a physical distance of 53 kb. No nucleotide sequence mutation was found to occur in the gene sequence or the 5′UTR of all annotated genes, but the expression of LOC_Os03g19770 is strongly promoted in mutant nrl4, which is 17.5 times of wild type and it may be the candidate gene.
rice (Oryza sativa L.); narrow and rolling leaf mutant; phenotype analysis; genetic analysis; gene mapping
2016-05-03;接受日期:2016-07-15
浙江省重大科技攻关专项(2012C12901-2)、浙江省科技厅水稻产业科技创新服务平台、高等学校学科创新引智计划(Grant B14027)、教育部创新团队资助项目(IRT1185)
联系方式:梁容,Tel:15925663413;E-mail:m15925663413@163.com。通信作者石春海,Tel:0571-88982691;Fax:0571-88982691;E-mail:chhshi@zju.edu.cn
