贺兰山地区油松根际固氮菌的多样性研究
2016-11-17牛艳芳陈立红
牛艳芳, 陈立红, 闫 伟
(内蒙古农业大学, 内蒙古 呼和浩特 010019)
贺兰山地区油松根际固氮菌的多样性研究
牛艳芳, 陈立红, 闫 伟
(内蒙古农业大学, 内蒙古 呼和浩特 010019)
对贺兰山北寺自然保护区油松(Pinustabulaeformis)的根际土壤固氮菌多样性和群落结构进行研究。采用阿须贝培养基对土壤中的固氮菌进行分离和纯化,用通用引物27f/1492r对固氮菌进行16S rDNA扩增并测序,应用 DNAMAN 6.0软件进行多序列比对,用 MEGA 4.0软件构建聚类树。结果表明: 从贺兰山北寺油松根际土壤中分离出的固氮菌属于假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、叶杆菌属(Phyllobacterium)、节杆菌属(Arthrobacter)、根瘤菌属(Rhizobium)、类芽孢杆菌属(Paenibacillus)、鞘氨醇单胞菌属(Sphingomonas)、柄细菌属(Caulobacter)、土地杆菌属(Pedobacter) 等9个不同的类群,其中假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、叶杆菌属(Phyllobacterium)、节杆菌属(Arthrobacter)是优势类群。这表明贺兰山北寺地区油松根际土壤中固氮菌具有较丰富的多样性。
贺兰山; 油松; 固氮菌; 多样性
贺兰山呈南北走向,属阴山山脉,地理坐标为东经105°41′—106°05′、北纬38°20′— 39°12′,坐落于阿拉善高原与银川平原之间,是毛乌素沙地、乌兰布和沙漠、腾格里沙漠与银川平原的重要分界线,是连接青藏高原、蒙古高原和华北植物区系的枢纽[1-2]。贺兰山特殊的地理位置和地理环境塑造了贺兰山独特的生物类群,是我国西部干旱区重要的生物资源宝库,生物类型具有典型的多样性和交叉性[3]。贺兰山具有典型的大陆性气候特征,年降水量275 mm,年平均气温8.5 ℃。森林覆盖度是13.4%,森林地带土壤为山地灰褐土,偏弱碱性。森林类型主要为针叶林,在贺兰山阴坡海拔1980-3100 m之间分布有温性针叶林(油松林Pinustabulaeformis)、寒温性针叶林(青海云杉林Piceacrassifolia)和亚高山针叶林(青海云杉林含高寒灌木);在贺兰山阳坡海拔1800~2700 m之间分布有灰榆(Ulmusglaucescens)和杜松(Juniperusrigida)疏林,此外还有虎榛子、高山柳、山杨、丁香等树种的分布[4]。目前,对贺兰山植物的多样性研究较多,但是对土壤微生物多样性的研究明显不足,很有必要加大对贺兰山地区土壤微生物的研究力度。
固氮菌可以将空气中的分子态氮转化为植物可以利用氮源,生物固氮作用是生物圈氮素的主要来源,对于森林植被的生长发育具有重要的作用[5-10]。森林生态系统作为陆地生态系统的主体,在调节全球碳平衡和减缓全球气候变化进程中扮演着重要角色,具有其它生态系统无可替代的作用[11-13]。因此,研究内蒙古地区主要针叶树种根际固氮菌的多样性和群落结构具有重要的意义,可为森林生态系统的可持续发展提供理论依据。本文对贺兰山北寺自然保护区主要针叶树种油松根际土壤固氮菌进行分离、纯化和鉴定,分析其土壤中固氮菌的多样性和群落结构特性,以期为筛选适合于内蒙古及西部地区的优良固氮菌菌株和固氮菌菌剂的开发奠定基础。
1 材料与方法
1.1样品采集
土壤样品采集地点在贺兰山北寺自然保护区的油松林。采集油松根际土壤装入无菌的封口袋编号标记,带回后放置于4 ℃冰箱储藏。
1.2根际土壤固氮菌的分离纯化
采用阿须贝培养基(葡萄糖10 g、KH2PO40.2 g、MgSO4·7H2O 0.2 g、NaCl 0.2 g、CaSO40.2 g、CaCO35 g、琼脂15 g、蒸馏水1000 mL,pH 7.0~7.2)分离和纯化土壤样品中的固氮菌。称取土样10 g,放入装有90 mL无菌水的加玻璃珠的三角瓶中,在摇床上150 r/min振荡20 min。依次制成10-3、10-4、10-5三个不同稀释度的土壤悬液,分别接种到培养皿中,用无菌玻璃棒涂布均匀,28℃恒温培养6~7天。将培养出来的固氮菌菌落利用划线法进行分离,约4~5代可以分离到纯种的固氮菌。将纯化后的固氮菌保存到试管,放到4℃冰箱备用[14-16]。
1.316SrDNA片段扩增
利用SDS法提取固氮菌基因组DNA。以基因组DNA为模板,采用细菌通用引物27f(5′-AGAGTTTGATCCTGGCTCAG-3′)/ 1492r(5′-GGTTACCTTGTTACGACTT-3′)扩增16S rDNA。反应体系如下(总体积25 μL):12.5 μL Daeam Tap Green PCR Master Mix(2X),1.0 μL 10 μmol/L引物27f,1 μL 10 μmol/L引物1492 r,1.0 μL模板DNA,9.5 μL ddH2O。扩增反应条件:95 ℃ 3 min;95 ℃ 30 s,43 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 15 min[17-18]。
1.4聚类树构建
由上海生工生物工程有限公司进行PCR产物测序,将测定的序列通过Blast与 GenBank 中已知菌种的 16S rDNA序列同源性比较进行菌种鉴定,利用DNAMAN软件多序列比对并人工校对,利用MEGA(version 4.0)软件计算Kimura’s two-parameter遗传距离并构建UPGMA自展一致系统发育树,自展重复总数为1000[19]。
2 结果与分析
2.1固氮菌鉴定及聚类分析
采用阿须贝无氮培养基对采自贺兰山北寺油松根际土壤中的固氮菌进行分离。根据菌落形态、大小和颜色,分离出47株固氮菌。以通用引物27 f 和1492r 对分离菌株的16S rDNA 基因片段进行扩增,并通过16S rDNA序列对固氮菌菌株进行鉴定。应用 DNAMAN 6.0 软件对分离出菌株的16S rDNA序列进行多序列比对,用MEGA 4.0软件构建聚类树。
从图1可以看出,贺兰山北寺地区油松根际土壤中固氮菌具有较丰富的多样性,它们分布于9个系统发育分支上。菌株 AY2、AY3、AY5、AY10、AY36、AY42、AY44、AY47、AY48、AY50、AY 52、AY 53 等菌株聚在一起,属于叶杆菌属(Phyllobacterium);菌株 AY4、AY7、AY12、AY13、AY15、AY21、AY22、AY25、AY33、AY41、AY 43等菌株聚在一起,属于假单胞菌属(Pseudomonas);菌株 AY8、AY9、AY14、AY16、AY17、AY23、AY26、AY40、AY46、AY49等菌株聚在一起,属于节杆菌属(Arthrobacter);菌株AY24、AY31、AY32、AY34、AY35、AY37等菌株聚在一起,属于芽孢杆菌属(Bacillus);菌株 AY1、AY6、AY19、AY30等菌株聚在一起,属于根瘤菌属(Rhizobium);菌株AY20属于柄细菌属(Caulobacter),菌株AY29属于鞘氨醇单胞菌属(Sphingomonas);菌株AY39属于类芽孢杆菌属(Paenibacillus),菌株AY11属于土地杆菌属(Pedobacter)。
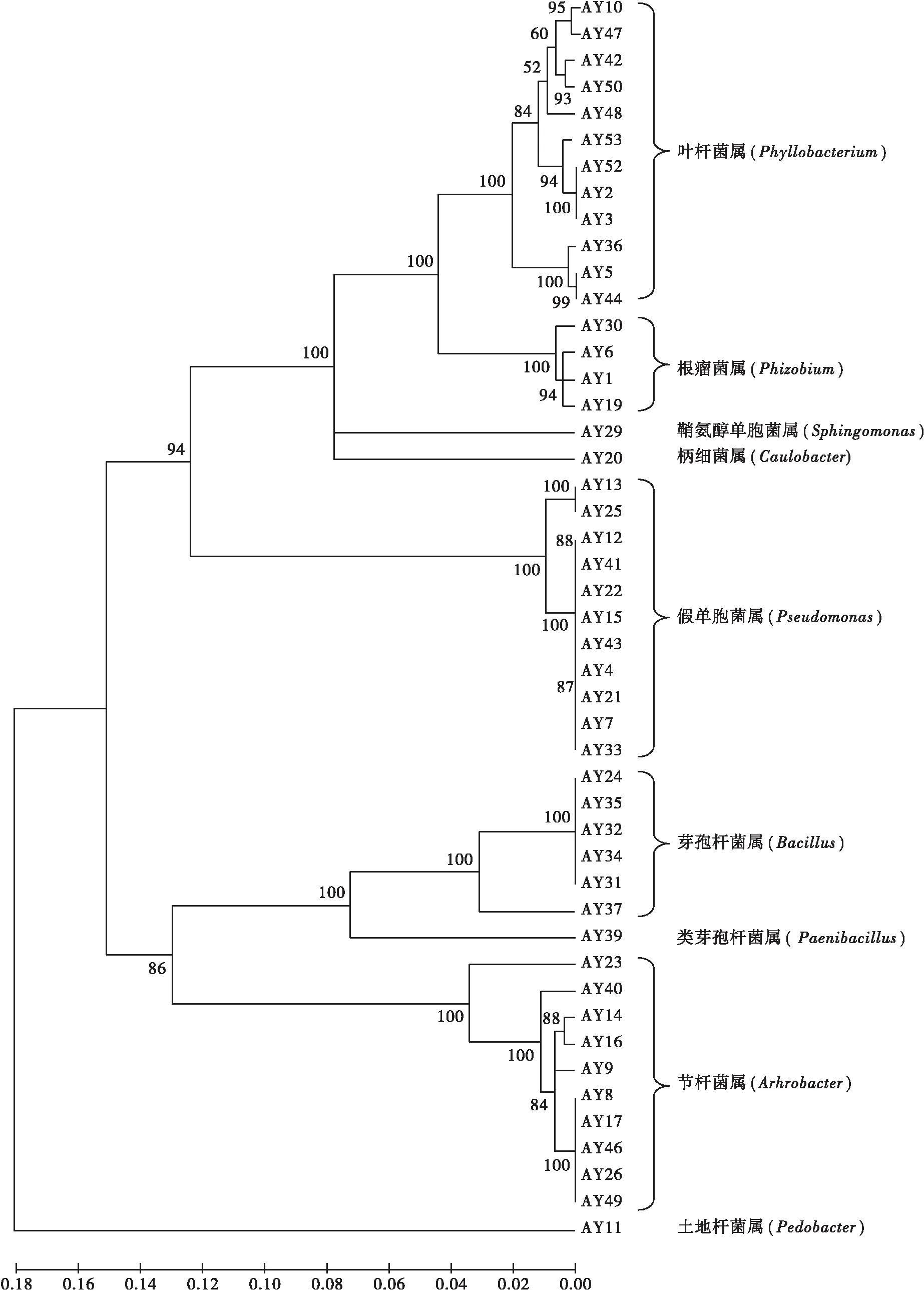
图1 固氮菌基于16S rDNA序列的聚类树Fig.1 UPGMA tree based on 16S rDNA sequences from nitrogen-fixing bacteria strains
2.2贺兰山油松根际固氮菌群落结构分析
从贺兰山北寺油松根际土壤中共分离出固氮菌47株。其中假单胞菌属(Pseudomonas)有11株,占23.40%;叶杆菌属(Phyllobacterium)有12株,占25.53%;节杆菌属(Arthrobacter)有10株,占21.28%;芽孢杆菌属(Bacillus)有6株,占12.77%;根瘤菌属(Rhizobium)有4株,占8.51%;其它类芽孢杆菌属(Paenibacillus)、鞘氨醇单胞菌属(Sphingomonas)、柄细菌属(Caulobacter)、土地杆菌属(Pedobacter)等4个属的固氮菌4株,共占8.51%。在贺兰山北寺油松根际土壤中假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、叶杆菌属(Phyllobacterium)、节杆菌属(Arthrobacter)是优势属,它们的数量从多到少的顺序为:叶杆菌属(Phyllobacterium)>假单胞菌属(Pseudomonas)>节杆菌属(Arthrobacter)>芽孢杆菌属(Bacillus)。不同固氮菌类群所占的比率详见表1。
3 结论与讨论
植物根际促生菌( PGPR) 是在植物根际定殖并可促进植物生长的细菌,其中根际固氮菌是PGPR中重要功能菌群之一[18]。我国对植物根际固氮菌的研究,主要在水稻、小麦、玉米、大豆、棉花、烟草、甘蔗、枸杞、茶等粮食和经济作物上。韩晓阳等[8]在山东茶园土壤中分离出6 株高效固氮菌株,经鉴定为褐球固氮菌(Azotobacterchrococcum)和恶臭假单胞菌(Pseudomonasputida),接种该固氮菌可明显促进茶树根、茎、叶的生长。王超群等[20]从大豆根际土壤中分离的固氮菌为微杆菌(Microbacteriumsp.)、链霉菌(Streptomycessp.)和小单孢菌(Micromonosporasp.)等,不但具有一定的固氮能力并能分泌 IAA,在制备大豆生物菌肥方面具有较好的应用前景。刘骁蒨等[21]研究了秸秆还田与施肥对稻田土壤微生物生物量及固氮菌群落结构的影响。
目前,对森林树种根际固氮菌的研究相对较少。本文从贺兰山北寺油松根际土壤中分离出的47株固氮菌,它们分布于9个系统发育分支上,其中假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、叶杆菌属(Phyllobacterium)、节杆菌属(Arthrobacter) 属于优势类群。该结果表明贺兰山北寺油松根际土壤中固氮菌具有较丰富的多样性。
[1] 杜茜, 闫兴富. 贺兰山植被类型多样性及空间分布特征[J]. 安徽农业科学, 2010, 38(7):3666-3667.
[2] 刘秉儒, 张秀珍, 胡天华, 等. 贺兰山不同海拔典型植被带土壤微生物多样性[J]. 生态学报, 2013, 33(22):7211-7220.
[3] 朱宗元, 马毓泉, 刘钟龄, 等. 阿拉善—鄂尔多斯微生物多样性中心的特有植物和植物区系的性质[J]. 干旱区资源与环境, 1999, 13(2): 1-15.
[4] 梁存柱, 朱宗元, 王炜, 等. 贺兰山植物群落类型多样性及其空间分布[J]. 植物生态学报, 2004 , 28(3):361-368.
[5] 王绍友, 李季伦. 固氮酶催化机制及化学模拟生物固氮研究进展[J]. 自然科学进展, 2000, 10 (6): 481-490.
[6] 赵秀云, 韩素芬. 杨树根际固氮菌的分离、筛选和鉴定[J]. 南京林业大学学报, 2000, 24(3):17-20.
[7] 覃小红, 黄宝灵, 善华. 固氮菌对桉树促生作用及其影响因素试验[J]. 林业实用技术, 2012(8):3-5.
[8] 韩晓阳, 李智, 张丽霞, 等. 茶园土壤高活性固氮菌的筛选鉴定及接种效果初步研究[J]. 茶叶科学, 2014, 34(5):497-505.
[9] 周德明, 李蓉. 杉木根际固氮菌筛选及其溶磷性与分泌 IAA 特性研究[J]. 四川师范大学学报:自然科学版, 2012, 35(4):562-566.
[10] 郭飞, 蒋雪刚, 黄宝灵, 等. 促生菌接种马尾松育苗试验[J]. 广西林业科学, 2013, 42(1):71-76.
[11] JC Gorden, CT Wheeler. 森林生态系统中的生物固氮[M]. 王沙生, 译. 北京:中国林业出版社, 1990:237-280.
[12] 陈奋飞, 庄捷, 王逸群. 我国林木固氮的研究现状和前景展望[J]. 湖南林业科技, 2006, 33(4): 4-7.
[13] 王岩, 沈其荣. 土壤微生物量及其生态效应[J]. 南京农业大学学报, 1996, 19(4): 45-51.
[14] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
[15] 丁延芹, 王建平, 刘元, 等. 几株固氮芽孢杆菌的分离与鉴定[J]. 农业生物技术学报,2004, 12(6): 690-697.
[16] 凌娟, 董俊德, 张燕英, 等. 一株红树林根际固氮菌的分离、鉴定以及固氮活性测定[J]. 热带海洋学报,2010,29(5): 149-153.
[17] 田国杰, 王晗, 陈立红. 内蒙古赤峰地区主要树种根际固氮菌的分离和鉴定[J]. 内蒙古林业科技, 2016, 42(1): 21-26.
[18] 唐贻军, 程洁, 梅丽娟, 等. 植物根际促生菌的筛选及鉴定[J]. 微生物学报,2010, 50(7): 853-861.
[19] Tamura K, Dudley J, Nei M, et al. MEGA4: Molecular evolutionary genetics analysis (MEGA) software version 4.0[J].Molecular Biology and Evolution, 2007, 24(8):1596-1599.
[20] 王超群, 刘 帅, 王晓璐, 等. 大豆根际高效自生固氮菌分离鉴定与特性研究[J]. 大豆科学, 2015, 34(5):850-854.
[21] 刘骁蒨, 涂仕华, 孙锡发, 等. 秸秆还田与施肥对稻田土壤微生物生物量及固氮菌群落结构的影响[J].生态学报, 2013, 33( 17) :5210-5218.
Diversityofnitrogen-fixingbacteriaisolatedfromPinustabulaeformisinHelanMountains
NIU Yanfang, CHEN Lihong, YAN Wei
(Inner Mongolia Agricultural University, Huhehot 010019, China)
The diversity and community structure of nitrogen-fixing bacteria isolated fromPinustabulaeformisrhizosphere in Helan Mountains was studied. Nitrogen-fixing bacteria from rhizosphere soil were isolated and purified by Ashby’s Medium, the 16S rDNA gene of nitrogen-fixing bacteria was amplified using primers 27f/1492r and sequenced, the alignment of 16S rDNA sequences was conducted by DNAMAN 6.0, and the neighbor-joining phylogenetic tree was constructed by MEGA 4.0 software. The results showed that nitrogen-fixing bacteria isolated fromP.tabulaeformisbelonged to nine groups, which werePseudomonas,Bacillus,Phyllobacterium,Arthrobacter,Rhizobium,Paenibacillus,Sphingomonas,Caulobacter,Pedobacter,andPseudomonas,Bacillus,Phyllobacterium,Arthrobacterwere dominant groups. The results indicated that nitrogen-fixing bacteria fromP.tabulaeformisin Helan Mountains have rich diversity.
Helan Mountains;Pinustabulaeformis; nitrogen-fixing bacteria; diversity
2016-06-20
国家自然科学基金项目(31260173)。
牛艳芳(1977-),女,内蒙古包头人,博士研究生,研究方向为林木生物技术。
陈立红,女,博士,副教授;E-mail:chenlihong@imau.edu.cn
Q 93
A
1003-5710(2016)05-0017-05
10.3969/j. issn. 1003-5710. 2016. 05. 004
(文字编校:张 珉)
