阿萨希毛孢子菌和头状地霉菌血流感染的鉴别诊断初探
2016-11-17钱雪峰KrupakarJyothi凌春华黄建安
钱雪峰,Krupakar Jyothi,赵 晔,凌春华,黄建安,季 成
(苏州大学附属第一医院,江苏 苏州 215006)
·论著·
阿萨希毛孢子菌和头状地霉菌血流感染的鉴别诊断初探
钱雪峰,Krupakar Jyothi,赵 晔,凌春华,黄建安,季 成
(苏州大学附属第一医院,江苏 苏州 215006)
目的 为临床微生物实验室建立少见类酵母样真菌血流感染诊断和鉴别诊断方法提供参考。方法 采用临床资料分析,形态学检查、生化反应和分子生物学技术相结合的方法,对阿萨希毛孢子菌和头状地霉菌血流感染进行诊断和鉴别诊断。结果 病例1和病例2类酵母样真菌血流感染均发生于患者白血病化疗后粒细胞缺乏期,患者病情严重,相似度高。挑取病例1、2血平皿上培养菌落进行革兰染色镜检,前者可见菌丝、关节孢子和小分生孢子,菌丝分枝分隔粗细不等,关节孢子长短不一,多呈矩形和桶型;后者可见中隔透明的菌丝断裂成关节孢子,呈长方形,不产生芽生分生孢子。API 20C AUX鉴定,提示分别为阿萨希毛孢子菌、头状地霉菌。所得序列在NCBI上进行比对,结果分别为阿萨希毛孢子菌、头状双足囊菌-头状地霉菌的有性期。结论 综合应用多种技术手段有助于提高类酵母样真菌血流感染诊断的准确性。将毛孢子菌和地霉菌鉴定到种水平有利于提高临床对该类少见真菌感染的认识,合理选择抗真菌药物和改善预后。
血流感染; 阿萨希毛孢子菌; 头状地霉菌; 类酵母样真菌; 鉴别诊断
[Chin J Infect Control,2016,15(10):764-768]
随着医学技术的发展和有效治疗措施的不断推出,许多疾病病死率得到不同程度的控制,患者生命得以延长。但同时也造成患有严重基础疾病和免疫功能受损的患者数量的明显增加,特别是在重症监护病房(ICU)、血液科和肿瘤科病房,医院获得性真菌感染的机会明显上升[1-3]。对法国300个ICU的调查显示,侵袭性假丝酵母菌感染的病死率高达45.9%[4]。特别是非白假丝酵母菌感染的比例有逐渐增高的趋势。既往不常见的丝状真菌、暗色丝状真菌和其他类酵母样真菌在致命性侵袭性感染中所占的比重越来越大[5-6]。普通假丝酵母菌通常可通过显色平皿和自动化微生物鉴定仪酵母菌鉴定卡进行分析,但一些少见类酵母样真菌却无法完全依此进行鉴定。如对毛孢子菌和地霉菌种属的鉴定,传统的API 20C AUX system 和VITEK 2 Compact YST system确鉴率仅为70.8%、 56.3%,误鉴率高[7],目前临床尚缺乏统一标准化的检测方法。我们通过分析阿萨希毛孢子菌(Trichosporonasahii)和头状地霉菌(Geotrichumcapitatum)血流感染的临床资料,结合病原形态学检查、生理生化反应和分子生物学技术,对两种类酵母样真菌血流感染进行诊断和鉴别诊断。现将结果报告如下。
1 资料与方法
1.1 资料 病例1,患者男性,48岁,初治急性红白血病,于2010年6月1日入住本院,血常规白细胞计数(WBC)2.05×109/L,中性粒细胞(N)0.38×109/L,血红蛋白(Hb)122g/L,血小板计数(PLT) 29×109/L。6月3日经外周静脉置入中心静脉导管(PICC),化学治疗(化疗)后血白细胞未见明显下降。6月22日复查骨髓穿刺提示未缓解,改予IA方案再次诱导化疗, 7月10日出现发热39.2°C,WBC 0.19×109/L,N 0.01×109/L,血CMV-DNA和PP65检查阴性,7月14日起连续两次血培养真菌生长,疑似阿萨希毛孢子菌。给予脂质体两性霉素B联合亚胺培南/西司他丁钠、利奈唑胺抗感染治疗,粒细胞集落刺激因子(G-CSF)及促红细胞生成素(EPO)促进造血恢复。
病例2,患者男性,13岁,初治急性单核细胞白血病,2010年8月9日因间断中等度发热入院。查血常规:WBC 346.87×109/L,Hb 109g/L,PLT 52×109/L。骨髓穿刺示急性单核细胞白血病。先后给予白细胞清除3次,羟基脲降白细胞治疗,但白细胞仍维持在200×109/L左右,8月10置入股静脉导管,给予IA方案诱导化疗,8月19日复查骨髓穿刺:急性单核细胞白血病化疗后未缓解伴骨髓抑制(幼稚单核细胞45%)。8月20日再予Ara-C 100mg/m2/d,2 d化疗。期间反复出现高热,予亚胺培南/西司他丁钠联合替考拉宁、米卡芬净热峰不降。8月24日起给予G-CSF刺激粒系造血。9月6日起外周血培养连续两次真菌生长,考虑为真菌败血症,两性霉素B加量至3 mg/kg/d,并联合伏立康唑口服加强抗真菌治疗。9月12日起脱离粒细胞缺乏期,WBC 4.32×109/L,N 3.12×109/L,体温降至基础体温。9月13日起连续3次血培养回报无菌生长,提示真菌败血症得到有效控制。9月15日复查骨髓穿刺提示本病缓解,幼单核细胞1%。
1.2 方法
1.2.1 形态学鉴定 分别接种血平皿、假丝酵母菌显色平皿和SDA平皿,进行革兰染色镜检。
1.2.2 生化反应鉴定 采用法国生物梅里埃VITEK2 Compact 鉴定仪YST卡鉴定和API 20C AUX鉴定。
1.2.3 分子生物学鉴定 使用天根生化酵母基因组DNA试剂盒提取基因组DNA。真菌核糖体大亚基26SD1/D2区引物:NL-1F:GCATATCAATAAGCGGAGGAAAAG;NL-4R:GGTCCGTGTTTCAAGACGG[8];核糖体DNA的内转录间隔区(ITS)引物:ITS1:TCCGTAGGTGAACCTGCGG;ITS4:TCCTCCGCTTATTGATATGC。PCR扩增26S和ITS序列:反应体系50 μL,dd H2O 41.25 μL,10×Buffer(含2.0 mmol/L MgCl2)5 μL,dNTP(10mmol/L)1 μL,primer(10 mol/L)各1 μL,Taq酶0.25 μL,模板DNA 0.5 μL。反应程序:94°C 4 min;94 °C 0.5 min,56 °C 1 min,72 °C 1 min,30个循环;72 °C 7 min。PCR产物回收:按生工生物SK1131试剂盒说明。目的片段连接反应:5 μL T4 DNA连接酶2×快速连接缓冲液,1 μL Pgem-T Vector,4 μL PCR product,16°C连接过夜。连接产物转化:50 μL 感受态细胞置于冰上,解冻后将细胞均匀悬浮。加入10 μL连接液冰上放置30 min,42°C水浴90 s,冰上放置15~20 min。加400 μL SOC培养基,37°C 200~250 r/mim振荡培养1 h。室温下4 000 r/mim离心5 min,吸去400 μL 上清,用剩余的培养基将细胞悬浮。将细菌涂布在预先用20 μL 100 mmol/L IPTG和100 μL 20 mg/mL X-gal 涂布的氨苄西林平板上。37°C下正向放置1 h,倒置培养过夜。选择白色菌落,挑至5 mL含氨苄西林LB试管,37°C摇床过夜。使用生工SK1191 UNIQ-10 柱式质粒小量抽提试剂盒提取质粒DNA,M13+/-测序,所得序列在NCBI上进行比对。
1.2.4 抗真菌药物体外敏感性试验 采用丹麦Rosco公司药敏纸片和改良Shadomy琼脂,检测两种类酵母样真菌对氟康唑、酮康唑、伊曲康唑、两性霉素B、咪康唑和5-氟胞嘧啶6种抗真菌药物的敏感性。标准菌株ATCC 64548和ATCC 64550白假丝酵母菌作药敏试验质控菌株。
2 结果
2.1 病原表型鉴定结果 病例1,血平皿上菌落形态:35°C培养24 h后,菌落白色、干燥、边缘不整齐,牢固黏附于培养基上,边缘触之易碎,菌落较小,48 h后顶部呈粉末状。假丝酵母菌显色平皿上生长产绿色色素的菌落。SDA上形态:27 °C培养24 h,奶油色、稍干燥、表面呈粉状、边缘有宽而深的裂隙。镜检:革兰染色后可见菌丝、关节孢子和小分生孢子,菌丝分枝分隔粗细不等,关节孢子长短不一,多呈矩形和桶型。见图1。VITEK2 Compact 鉴定仪YST卡:87%为阿萨希毛孢子菌。API 20C AUX鉴定: 30°C孵育24、48 h,提示为阿萨希毛孢子菌。
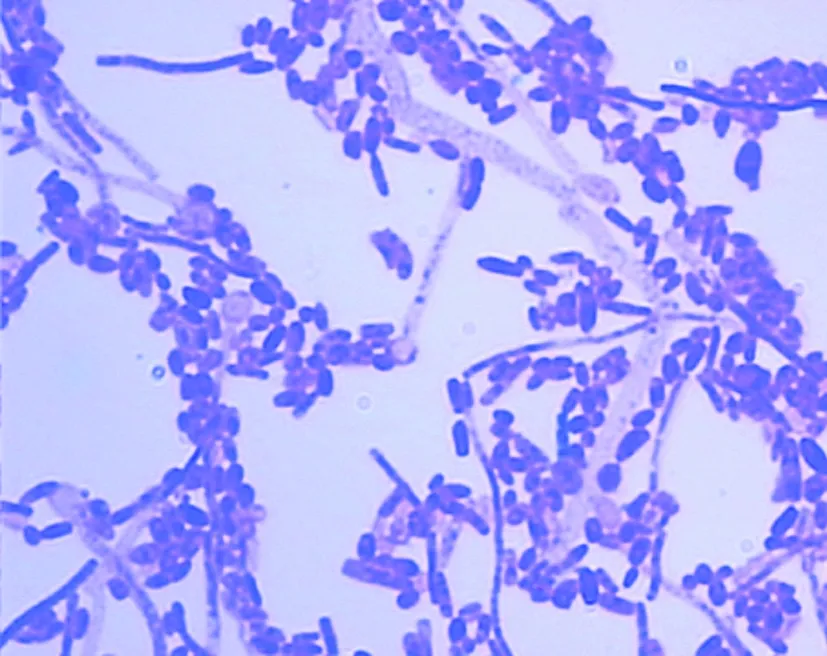
图1 阿萨希毛孢子菌
病例2,血平皿上菌落形态:35°C培养24 h后,菌落白色、中小、偏干、边缘呈粉末状。假丝酵母菌显色平皿上呈淡粉红色、湿润柔软、边缘皱折。SDA上形态:27 °C培养24 h,白色、表面堆积呈脑回状,边缘薄呈细小粉末状。镜检可见中隔透明的菌丝断裂成关节孢子,呈长方形,不产生芽生分生孢子。见图2。VITEK2 Compact 鉴定仪YST卡:79%为头状地霉菌。API 20C AUX鉴定提示为头状地霉菌。
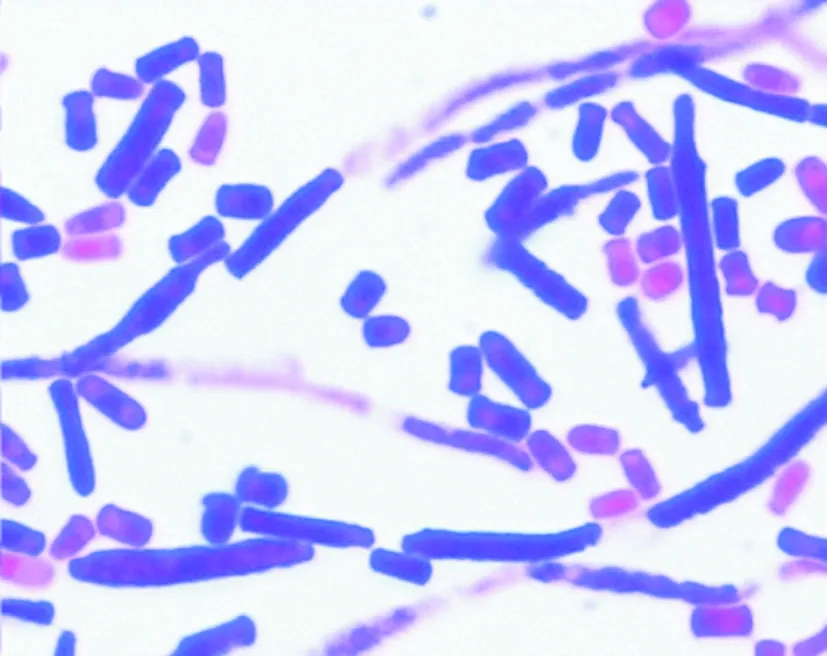
图2 头状地霉菌
2.2 病原体分子生物学鉴定结果 提取患者分离菌的质粒DNA,测序所得序列在NCBI上进行比对,结果病例1为阿萨希毛孢子菌,26S rDNA D1/ D2区域序列为642 bp,转录间区(ITS)为543 bp,;病例2为头状双足囊菌-头状地霉菌(Dipodascuscapitatus)的有性期,26S rDNA D1/ D2区域序列为452 bp, ITS为466 bp。
2.3 抗真菌药物体外敏感性试验结果 阿萨希毛孢子菌对大多数抗真菌药物处于中介水平,仅对伊曲康唑和咪康唑敏感;而头状地霉菌对酮康唑、两性霉素B和5-氟胞嘧啶敏感。见表1。
表1 2株类酵母样真菌对抗真菌药物的体外药敏感结果
Table 1 In vitro antifungal susceptibility testing results of two kinds of yeast-like fungi
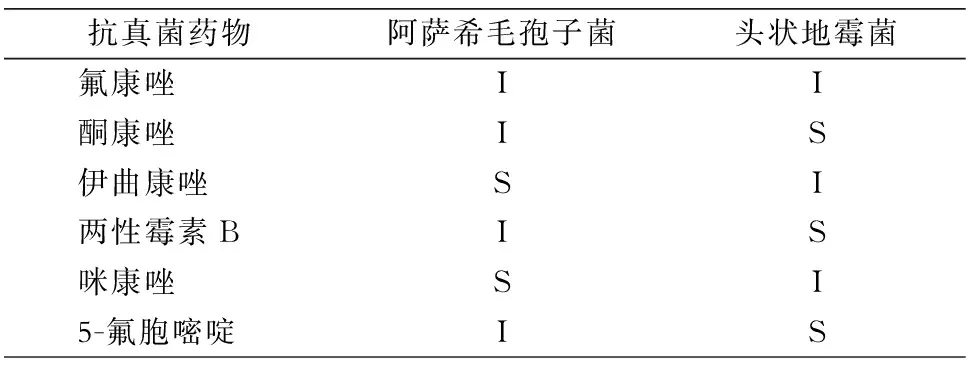
抗真菌药物阿萨希毛孢子菌头状地霉菌氟康唑II酮康唑IS伊曲康唑SI两性霉素BIS咪康唑SI5-氟胞嘧啶IS
I:中介;S:敏感
3 讨论
丝孢酵母属为半知菌亚门隐球菌科真菌,该菌可以引起表浅部位感染、深部侵袭性感染,患者预后极差。阿萨希毛孢子菌是近年由丝孢酵母属中新确定的一个种,也是临床侵袭性毛孢子菌属中最常见的致病菌,多见于粒细胞减少的白血病、淋巴瘤患者、器官移植,以及重度免疫缺陷患者[9-11],病死率高达42%~80%[12]。
地霉菌属内孢霉纲,除具关节分生孢子外还具有由合轴延伸细胞产生的分生孢子,以前曾将此菌分类于毛孢子菌属,形态上有时难于与毛孢子菌区别。地霉属目前最常引起侵入性及系统性感染者为头状地霉菌,所引起的感染包括败血症、呼吸道感染、胃肠道感染、心内膜炎、肝肾感染、口腔感染、脑膜炎、骨髓炎和椎间关节盘炎,多见于急性白血病患者。90%以上是侵袭性感染[13],致死率超过50%[9]。
在长度为500~600 bp的26S rDNA D1/ D2区域和rRNA转录间区( ITS),绝大多数酵母菌种间具有明显的序列差异,而同一种内不同菌株间的碱基差异却≤1%[14]。目前,几乎所有真菌D1/ D2区域的碱基序列已测定并公布,丝孢酵母属内所有种菌株的ITS序列也已测定并公布。DNA序列数据为类酵母样真菌的鉴定提供了便利条件。当未知菌株的相应序列测定后,在数据库内进行同源性比对,就可判定该菌与哪个种的序列相同或最相近。文中1例阿萨希毛孢子菌和1例头状地霉菌血流感染均发生于化疗后粒细胞缺乏期间,并且连续多次血培养阳性,可确定为真菌血流感染,而非污染。综合临床资料分析,病原形态学检查、生理生化反应和分子生物学技术等多种手段,有助于提高类酵母样真菌血流感染检出的可靠性与准确性,有利于提高临床对该类少见真菌感染的认识,合理选择抗真菌药物和改善预后。
阿萨希毛孢子菌对伏立康唑最敏感,而对卡泊芬净耐药[10, 15-16],对两性霉素B的敏感性存在地区差异,国外多数耐药[10, 16],而国内大陆地区仍敏感。头状地霉菌则对两性霉素B高度敏感,其次是伏立康唑[17]。体外药物敏感性试验表明,阿萨希毛孢子菌对大多数抗真菌药物处于中介水平,仅对伊曲康唑和咪康唑敏感;而头状地霉菌对氟康唑、伊曲康唑和咪康唑处于中介水平,对酮康唑、两性霉素B和5-氟胞嘧啶敏感。临床治疗的结果也显示,病例1在给予两性霉素B经验性治疗后,尽管阿萨希毛孢子菌对两性霉素B处于中介水平,但随着粒细胞的回升,感染得到有效控制。病例2在给予米卡芬净后热峰不降,药敏也提示该头状地霉菌对米卡芬净不敏感,改予两性霉素B和伏立康唑后,真菌败血症得到控制。另一个不容忽视的事实是2例类酵母样真菌血流感染均发生在粒细胞缺乏期,而感染的控制均发生在粒细胞缺乏缓解期,提示患者自身免疫状况对感染控制的作用。另外,我们建议在确诊真菌败血症时拔除PICC或深静脉导管,有利于感染的控制。
近年来,临床上毛孢子菌病和地霉菌病的发病率呈上升趋势,但是对抗真菌药物敏感性的研究依然十分有限,且存在地区差异,目前尚缺乏可参考的经验性治疗方案。我们建议有条件的单位保存菌株,进一步研究,以期今后能为少见类酵母样真菌的治疗积累经验和提供数据。
[1] Cruciani M, Serpelloni G. Management of Candida infections in the adult intensive care unit[J]. Expert Opin Pharmacother, 2008,9(2):175-191.
[2] Pfaller MA, Diekema DJ. Epidemiology of invasive candidiasis: a persistent public health problem[J]. Clin Microbiol Rev, 2007, 20(1):133-163.
[3] Guery BP, Arendrup MC, Auzinger G, et al. Management of invasive candidiasis and candidemia in adult non-neutropenic intensive care unit patients: Part I. Epidemiology and diagnosis[J]. Intensive Care Med, 2009,35(1):55-62.
[4] Leroy O, Gangneux JP, Montravers P, et al. Epidemiology, management, and risk factors for death of invasive Candida infections in critical care: a multicenter, prospective, observational study in France (2005-2006) [J]. Crit Care Med, 2009, 37(5):1612-1618.
[5] Dimopoulos G, Ntziora F, Rachiotis G, et al.Candidaalbicansversus non-albicans intensive care unit-acquired bloodstream infections: differences in risk factors and outcome[J]. Anesth Analg, 2008, 106(2):523-529.
[6] Groll AH, Walsh TJ. Uncommon opportunistic fungi: new nosocomial threats[J]. Clin Microbiol Infect, 2001,7 (Suppl 2):8-24.
[7] Guo LN, Xiao M, Kong F, et al. Three-locus identification, genotyping, and antifungal susceptibilities of medically importantTrichosporonspecies from China[J]. J Clin Microbiol, 2011, 49(11):3805-3811.
[8] Kurtzman CP, Robnett CJ. Identification of clinically important ascomycetous yeasts based on nucleotide divergence in the 5’ end of the large-subunit (26S) ribosomal DNA gene[J]. J Clin Microbiol, 1997, 35(5): 1216-1223.
[9] Girmenia C, Pagano L, Martino B, et al. Invasive infections caused byTrichosporonspecies andGeotrichumcapitatumin patients with hematological malignancies: a retrospective multicenter study from Italy and review of the literature[J]. J Clin Microbiol, 2005, 43 (4):1818-1828.
[10] Chagas-Neto TC, Chaves GM, Melo AS, et al. Bloodstream infections due toTrichosporonspp.: species distribution,Trichosporonasahiigenotypes determined on the basis of ribosomal DNA intergenic spacer 1 sequencing, and antifungal susceptibility testing[J]. J Clin Microbiol, 2009, 47(4):1074-1081.
[11] Matsue K, Uryu H, Koseki M, et al. Breakthrough trichosporonosis in patients with hematologic malignancies receiving micafungin[J]. Clin Infect Dis, 2006,42(6):753-757.
[12] Ruan SY, Chien JY, Hsueh PR. Invasive trichosporonosis caused byTrichosporonasahiiand other unusualTrichosporonspeciesat a medical center in Taiwan[J]. Clin Infect Dis,2009,49(1):e11-e17.
[14] Fell JW, Boekhout T, Fonseca A, et al. Biodiversity and systematics of basidiomycetous yeasts as determined by large-subunit rDNA D1/D2 domain sequence analysis[J]. Int J Syst Evol Microbiol, 2000, 50 (Pt 3):1351-1371.
[15] Hazirolan G, Canton E, Sahin S, et al. Head-to-head comparison of inhibitory and fungicidal activities of fluconazole, itraconazole, voriconazole, posaconazole, and isavuconazole against clinical isolates ofTrichosporonasahii[J]. Antimicrob Agents Chemother, 2013, 57(10): 4841- 4847.
[16] Kalkanci A, Sugita T, Arikan S, et al. Molecular identification, genotyping, and drug susceptibility of the basidiomycetous yeast pathogenTrichosporonisolated from Turkish patients [J]. Med Mycol, 2010, 48(1):141-146.
[17] Girmenia C, Pizzarelli G, D’Antonio D, et al. In vitro susceptibility testing ofGeotrichumcapitatum: comparison of the E-test, disk diffusion, and sensititre colorimetric methods with the NCCLS M27-A2 broth microdilution reference method [J]. Antimicrob Agents Chemother,2003, 47, (12):3985-3988.
(本文编辑:左双燕)
Differential diagnosis in bloodstream infection withTrichosporonasahiiandGeotrichumcapitatum
QIANXue-feng,KrupakarJyothi,ZHAOYe,LINGChun-hua,HUANGJian-an,JICheng
(TheFirstAffiliatedHospitalofSoochowUniversity,Suzhou215006,China)
Objective To provide reference for establishing diagnosis and differential diagnosis methods of rare yeast-like fungal bloodstream infection for clinical microbiology laboratory. MethodsTrichosporonasahii(T.asahii) andGeotrichumcapitatum(G.capitatum) bloodstream infection was diagnosed and differentially diagnosed through clinical data analysis, morphological examination, biochemical reactions,and molecular biology technology.Results Two types of yeast-like fungal bloodstream infections in case 1 and case 2 both occurred in leukemia agranulocytosis phase after chemotherapy, such infections were serious and highly similar. The cultivated colonies on blood agar plates of case 1 and case 2 were performed gram stain and microscopic examination. Hyphae, arthrospores and microconidia were visible in the former, thickness of hyphae branches and length of arthrospores were different, most presented rectangular and barrel shape; the latter can be seen hyphae with transparent septum broken up into arthrospores, presented rectangular shape, did not produce blastoconidia. Identification with API 20C AUX showed that they wereT.asahiiandG.capitatum. The PCR product sequences were compared with NCBI, suggesting thatT.asahiiandG.capitatumwere at sexual stage. Conclusion Comprehensive application of a variety of technical methods is helpful for improving the diagnosis accuracy of bloodstream infection with yeast-like fungi, identifyingTrichosporonandGeotrichumto the species level may help physicians to understand such rare fungal infection, choose antifungal agents rationally, and improve clinical prognosis.
bloodstream infection;Trichosporonasahii;Geotrichumcapitatum; yeast-like fungus; differential diagnosis
2015-11-01
国家自然科学基金(81501425)
钱雪峰(1974 -),男(汉族),江苏省苏州市人,副主任检验师,主要从事病原生物检测和医院感染预防与控制相关研究。
季成 E-mail: jichengsky@hotmail.com
10.3969/j.issn.1671-9638.2016.10.011
R379
A
1671-9638(2016)10-0764-05
