熊本牡蛎单体苗种生产技术研究*
2016-11-17王昌勃孔令锋于瑞海
王昌勃, 李 琪, 孔令锋,于瑞海
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
熊本牡蛎单体苗种生产技术研究*
王昌勃, 李 琪**, 孔令锋,于瑞海
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
采用肾上腺素诱导法和先固着后脱基法,研究了熊本牡蛎(Crassostreasikamea)单体苗种生产技术,确定了单体苗种的最佳生产方法。研究表明:采用肾上腺素诱导法生产单体熊本牡蛎,诱导效果与肾上腺浓度、诱导时间、幼虫密度有关。浓度实验显示,1×10-4mol/L是单体熊本牡蛎最佳诱导浓度;诱导时间实验显示,1 h是单体熊本牡蛎最佳诱导时间;密度实验显示,1 000 ind/mL是单体熊本牡蛎最佳诱导密度。采用先固着后脱基法生产单体熊本牡蛎,结果显示:灰色聚乙烯波纹板生产单体牡蛎,幼虫易附着,剥离方便,单体率显著高于筛绢网、塑料薄膜、网衣和聚丙烯扁条(P< 0.05)。经过25天培育,单体稚贝和固着稚贝壳高分别为(1 953±395)和(1 875±660) μm,单体牡蛎游离状态对生长速度无显著影响(P> 0.05)。研究结果显示,药物诱导法稚贝中间培育需要特殊设施,不利于生产技术推广;以灰色聚乙烯波纹板作为附着基,利用先固着后脱基法生产单体牡蛎,是一种可行的熊本牡蛎单体苗种生产技术。
熊本牡蛎;单体苗种;肾上腺素;聚乙烯波纹板
牡蛎(Ostreidae)由于味道鲜美,营养丰富,深受消费者喜爱,是世界很多国家重要的经济贝类[1-3]。2013年中国养殖贝类产量1 272万t,占世界总产量的83.4%,其中牡蛎占我国总产量的33%[4]。由于牡蛎营群居固着生活,生长过程存在空间和饵料竞争,从而降低了牡蛎商品价值和产量。单体牡蛎呈游离状态,生长不受空间限制,壳形规则美观,易于放养和收获[5-9],售价远高于普通牡蛎,为欧美国家普遍采用。
1960年代人们从扇贝(Pectinidae)等附着基将牡蛎剥离后培养,标志着单体牡蛎养殖的开始。其后人们不断改善附着基和剥离方法,减少了稚贝死亡率,逐渐形成了先固着后脱基的方法,但是相关研究不深入,鲜有大规模生产的报道[10]。Hidu等[11]开发了颗粒采苗法,即采用眼点幼虫规格的颗粒作为眼点幼虫附着基进行单体牡蛎苗种的培育。随着对无脊椎动物幼虫附着变态机理的深入研究,发现多种神经内分泌物具有诱导幼虫附着、变态的作用,尤其肾上腺素可以诱导牡蛎不固着变态,被用于单体牡蛎苗种生产[11-16]。我国单体牡蛎的研究从1980年代末开始,虽然也获得了一定的研究成果[9,17-19],但还没有大规模生产的报道。肾上腺素药物诱导法是国外比较常见的单体苗种生产方法,最高可达90%以上单体率。肾上腺素能显著诱导多种牡蛎不固着变态,诱导效果受肾上腺素浓度和诱导时间影响,同时不同种间的变态率和最佳诱导条件有差异[20],因此,肾上腺素诱导生产单体牡蛎,必须确定该种最佳肾上腺素诱导条件。此外,肾上腺素是一种激素类药物,容易污染环境,亟需一种新的单体牡蛎生产方法来替代[21]。
我国牡蛎养殖业发展迅速,但同时也面临养殖品种单一、种质退化、病害频发等许多问题,养殖牡蛎市场价格低。发展新的牡蛎养殖品种,促进国内牡蛎养殖多样化,是提高牡蛎商品价值的重要措施[22-23]。熊本牡蛎(Crassostreasikamea)属于巨蛎属(Crassostrea),主要分布在日本有明海和中国中南部,韩国海区也有少量分布[24-26]。在美国,熊本牡蛎是重要的牡蛎养殖种类之一,肉质可口细腻,深受消费者喜爱,商品经济价值高。因其产卵期晚,在夏季有良好品质,能够填补夏季因长牡蛎品质下降造成的牡蛎市场的空白,具有广阔的市场空间[26-28]。目前,熊本牡蛎育苗技术研究较少[27],单体苗种生产尚未报道,开展单体熊本牡蛎苗种培育技术研究对于开发牡蛎养殖新品种具有重要意义。
本研究采用肾上腺素诱导法和先固着后脱基法,对熊本牡蛎单体苗种生产进行了研究,旨在为单体熊本牡蛎人工养殖提供基础资料。
1 材料和方法
1.1 亲本和幼虫培育
实验所用熊本牡蛎采自美国俄勒冈州,暂养2~3 d,移至室内培育池中促熟培养,水温26 ℃,盐度28~30。性腺发育成熟后,采用解剖法辨别雌雄并采集精卵,将适量的精卵混合10 min,授精后洗去多余精子。将受精卵放置在盛有过滤海水的水泥池中培育,水温控制在26 ℃左右,孵化密度20~30 ind/mL,收集健康D形幼虫至20 m3的培育池充气培养,幼虫密度1~3 ind/mL,每天换水2次,根据生长阶段适量投喂等边金藻(Isochrysisgalbana)和小球藻(Chlorellavulgaris),显微观察记录幼虫生长发育情况。当牡蛎进入眼点幼虫期后,进行诱导变态处理。
1.2 单体苗种生产
1.2.1 肾上腺素诱导法 为研究不同浓度肾上腺素对单体牡蛎诱导效果的影响,设置肾上腺素5个浓度梯度(0、10-3、10-4、10-5和10-6mol/L),诱导时间1 h,眼点幼虫密度1 000 ind/mL。为研究肾上腺素不同诱导时间对单体牡蛎诱导效果的影响,设置诱导时间5个梯度(0.5、1.0、3.0、5.0和7.0 h),采用确定的最佳诱导浓度,眼点幼虫密度1 000 ind /mL。为查清不同眼点幼虫密度对单体牡蛎诱导效果的影响,设置幼虫密度4个梯度(100、500、1 000和2 000 ind/mL),采用以上确定的最佳诱导浓度和诱导时间。 处理结束后,海水流水冲洗1 h后,分别置于5 L的聚乙烯桶充气培养,12 h后计算幼虫变态率,观察记录各处理单体稚贝成活率。
1.2.2 先附着后脱基法 实验选用灰色聚乙烯波纹板,筛绢网,黑塑料薄膜,白塑料薄膜,聚丙烯扁条和网衣为附着基,经消毒、浸泡处理后待用。将不同附着基分别适量投放到100 L聚乙烯桶中,幼虫密度约为1 ind/mL,充气培养,以扇贝壳为对照组,每组设3个重复。稚贝一周培养后,用保苗袋转移至海区挂养。当稚贝壳高达到5 000 μm时,敲打或折叠附着基剥离稚贝,获得单体牡蛎。定期观察记录幼虫附着和生长状况,计算采苗率、剥离率和单体率。
剥离率=剥离下稚贝÷附着稚贝×100%;
单体率=剥离下成活稚贝÷投放的眼点幼虫×100%。
1.3 单体苗种生长状况
取变态后3天的单体稚贝为实验材料,经过25天培养,定期随机测量100个单体稚贝壳高,以固着稚贝为对照组。
1.4 统计分析
用单因素方差分析(ANOVA)比较不同处理的诱导效果,并进行Duncan多重比较。统计分析使用SPSS16.0软件,以P< 0.05作为差异显著水平。
2 结果
2.1 肾上腺素诱导幼虫变态
2.1.1 肾上腺素诱导下幼虫的行为 当幼虫受到肾上腺素作用时,快速下沉到烧杯底部,失去游泳能力,肾上腺素浓度越高幼虫下沉的速度越快,比例越大。诱导15~30 min左右,部分幼虫恢复游泳能力,肾上腺素浓度越低,幼虫恢复游泳能力越快;部分幼虫始终在烧杯底部,或者静止,或者用足爬动。
2.1.2 肾上腺素诱导幼虫变态率和稚贝成活率 如图1所示,肾上腺素能够显著诱导熊本牡蛎眼点幼虫不固着变态。经过1 h处理,对照组幼虫变态率为0,显著低于其他实验组(P< 0.05)。不同肾上腺素浓度组幼虫变态率也有显著差异,低浓度组(10-5、10-6mol/L)眼点幼虫变态率显著低于高浓度组(P< 0.05)。当浓度升高到10-4mol/L时,变态率达到最大值,约为(24.66±11.08)%,然而随着浓度继续升高,变态率无显著性变化。肾上腺素对稚贝有毒害作用,高浓度处理,稚贝成活率下降。经过18天培育,10-3mol/L诱导的稚贝成活率显著低于10-6mol/L组(P<0.05)(见表1)。
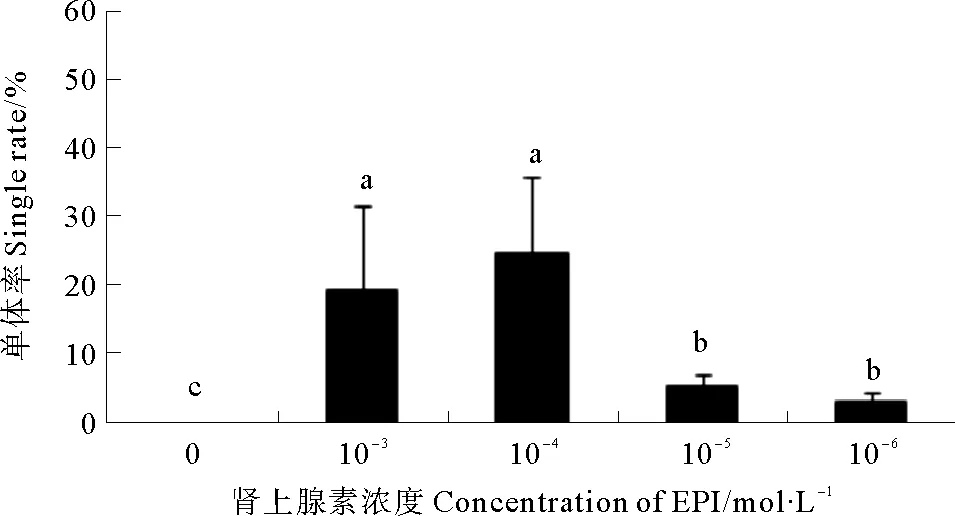
(不同的字母代表差异显著(P<0.05)。Different letters indicate significant differences statistically (P<0.05).)
图1 不同肾上腺素浓度下眼点幼虫的变态率
Fig.1 The metamorphosis rates of the eye-spot larvae in different epinephrine concentrations
肾上腺素诱导时间影响幼虫变态率和成活率。图2是10-4mol/L浓度肾上腺素处理下,诱导时间、幼虫变态率的关系。诱导时间1 h,幼虫变态率为(20.6±8.4)%,显著高于其他时间组;改变诱导时间,不能提高幼虫变态率。诱导时间对稚贝成活率也有影响,诱导3、5 h和7 h时,稚贝成活率显著低于0.5和1 h(P<0.05)(见表1)。

(不同的字母代表差异显著(P< 0.05)。Different letters indicate significant differences statistically (P< 0.05).)
图2 不同诱导时间眼点幼虫的变态率
Fig.2 The metamorphosis rates of the eye-spot larvae in different time conditions
当眼点幼虫密度小于1 000 ind/mL时,幼虫变态率无显著差异,当密度为2 000 ind/mL时,幼虫变态率为3.5%,显著降低(P< 0.05)(见图3)。不同幼虫密度处理组稚贝成活率无显著差异,高密度(2 000 ind/mL)处理下,幼虫变态率显著下降,但稚贝成活率无显著影响(见表1)。

(不同的字母代表差异显著(P< 0.05)。Different letters indicate significant differences statistically (P< 0.05).)
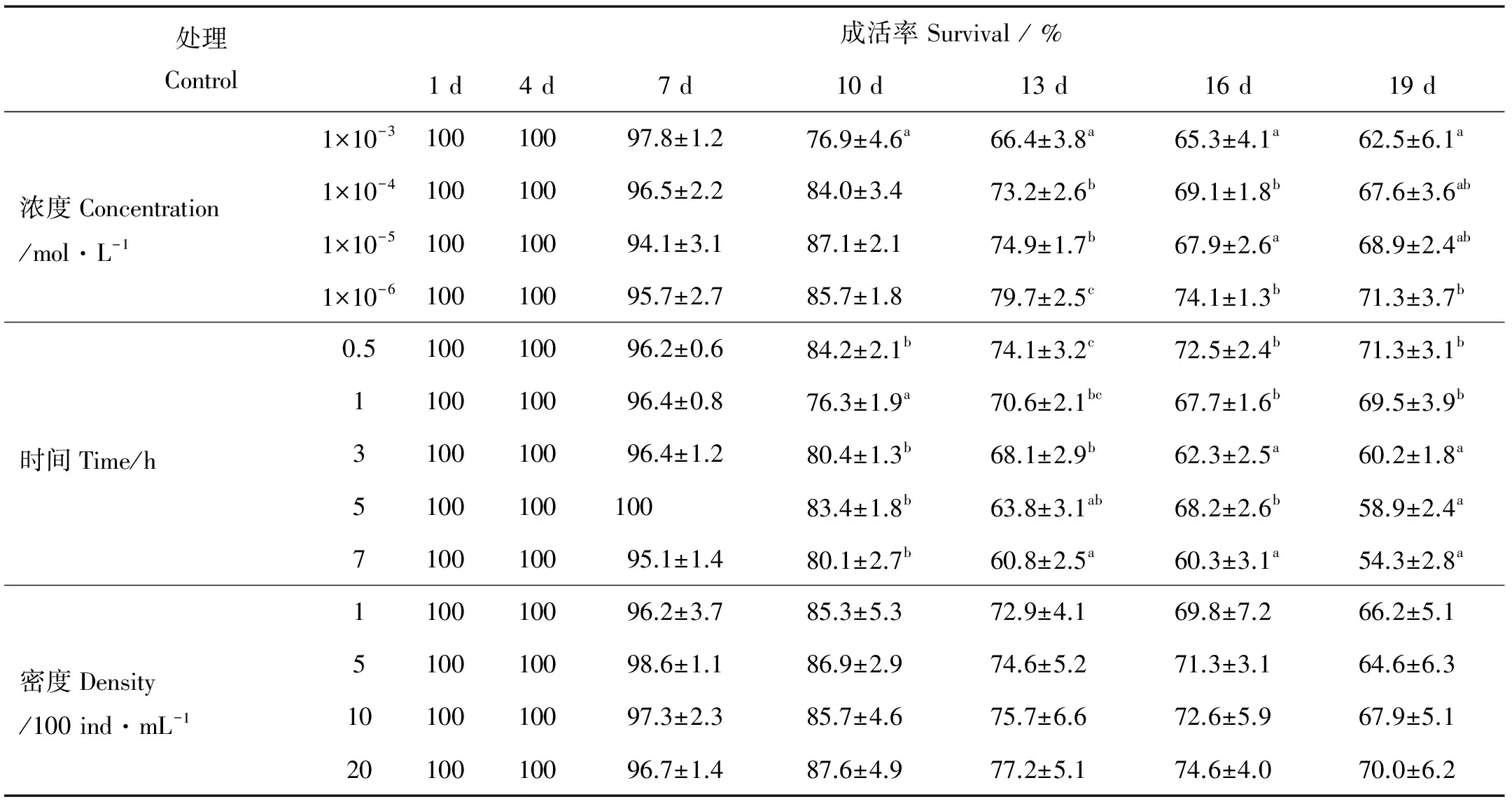
图3 不同密度下眼点幼虫的变态率
注:数字后字母不同表示差异显著(P< 0.05)。
Note: different letters after numercial values showed significant differences(P< 0.05).
2.2 先附着后剥离法
如图4所示,灰色聚乙烯波纹板采苗率为19.4%,采苗率和附着时间与对照组无显著差异,为单体苗种生产应用提供可行性;网衣、聚丙烯扁条和塑料薄膜采苗率显著低于其他实验组和对照组(P< 0.05),最低达到1.2%,不适合生产应用。牡蛎幼虫对附着基颜色具有明显选择性,黑色塑料薄膜采苗率为5.3%,是白色塑料薄膜的2倍。除网衣,其他附着基附着时间和对照组无显著差异(P< 0.05)。

(不同的字母代表差异显著(P< 0.05)。Different letters indicate significant differences statistically (P< 0.05). CPB: 聚乙烯波纹板Corrugated PE board; BCN:筛绢网 Bolting-cloth net; BPF: 黑色塑料薄膜 Black plastic film; WPF: 白色塑料薄膜 White plastic film; PPT: 聚丙烯扁条 Polypropylene packing tape; NR: 网衣Nylon rope; CT: 对照Control.)
图4 不同附着基幼虫的采苗率和附着时间
Fig. 4 The settlement rates and time of the planktonic larvae by different substances
剥离率表示稚贝从附着基剥离的难易程度和对稚贝的机械损伤大小,由稚贝大小和附着基的材料特性共同影响。柔韧、平滑的材料,经敲打或弯折的方式剥离稚贝,操作简单、对稚贝伤害小,剥离率高,波纹板和塑料薄膜稚贝剥离率高达90%以上,显著高于其他材料(P< 0.05);聚丙烯扁条表面有纹路并缺乏柔韧性,剥离稚贝死亡率高,剥离率为(25.0±12.5)%;网衣附着稚贝和附着基生长到一起,需单个剥离,剥离后稚贝死亡率高,剥离率仅为(10.9±5.1)%,显著低于其他材料(P< 0.05)(见图5)。
单体率是采苗率和剥离率的综合指标,表示附着基生产单体牡蛎的能力。聚丙烯扁条和网衣的采苗率和剥离率都很低,单体率显著低于其他实验组(P< 0.05);虽然筛绢网采苗率显著高于塑料薄膜,但其稚贝剥离率低,2种材料单体率两者无显著差异;波纹板作为附着基,具有高采苗率和剥离率,16.7%的单体率,显著高于其他实验组(P< 0.05)(见图6)。

(不同的字母代表差异显著(P<0.05)。Different letters indicate significant differences statistically (P< 0.05). CPB: 聚乙烯波纹板Corrugated PE board; BCN:筛绢网 Bolting-cloth net; BPF: 黑色塑料薄膜Black plastic film; WPF: 白色塑料薄膜White plastic film; PPT: 聚丙烯扁条Polypropylene packing tape; NR: 网衣Nylon rope.)
图5 不同附着基稚贝的剥离率
Fig.5 The stripped rates of juveniles from different substances

(不同的字母代表差异显著(P< 0.05)。Different letters indicate significant differences statistically (P< 0.05). CPB: 聚乙烯波纹板Corrugated PE board; BCN:筛绢网Bolting-cloth net; BPF: 黑色塑料薄膜Black plastic film; WPF: 白色塑料薄膜White plastic film; PPT: 聚丙烯扁条Polypropylene packing tape; NR: 网衣Nylon rope.)
图6 不同附着基幼虫的单体率
Fig. 6 The single rate of cultchless spats by different substances
2.3 单体牡蛎和固着牡蛎生长差异
单体牡蛎和固着牡蛎生长速度分别为60.8、56.6 μm/d,经过25天培养后,2组稚贝生长速度无显著差异(P< 0.05)(见表2)。

表2 固着牡蛎和单体牡蛎生长变化
3 讨论
3.1 肾上腺素诱导法生产熊本牡蛎单体苗种分析
自然环境中,海洋无脊椎动物幼体的附着变态是一个由幼体信号受体接受外界诱导刺激,通过体内信号通路完成附着变态调控的一系列复杂过程[29]。肾上腺素是一种酪氨酸衍生物,对多种贝类幼虫的变态具有诱导作用,对不同种类幼虫,肾上腺素的最佳诱导浓度和处理时间是不同的。因此选择合适的浓度和诱导时间,提高幼虫变态率,是肾上腺素诱导法生产单体牡蛎的关键。本实验结果显示,肾上腺素能够显著诱导熊本牡蛎幼虫不固着变态,最佳诱导浓度为1×10-4mol/L,最佳诱导时间为1 h,改变诱导条件,幼虫单体率有下降的趋势,这与前人研究报道的结果类似,由此可以推测不同种牡蛎可能存在相似的诱导机制。肾上腺素诱导效果在不同牡蛎品种间有差异,已报道的长牡蛎(Crassostreagigas)[9]、美洲牡蛎(Crassotreavirginica)[12]、艾氏牡蛎(Crassostreairedalei)[15]、葡萄牙牡蛎(Crassostreaangulata)[17]单体率分别为90%、65%、59.7%和60.9%。本研究熊本牡蛎单体率为24.7%,显著低于已报道几种牡蛎。除物种差异原因外,幼虫生理状态和处理条件是影响变态率的重要因素。幼虫变态率与诱导处理时机有很大关系,延迟变态时间过长会降低幼虫变态能力[30-31]。张涛[32]用肾上腺素诱导海湾扇贝(Argopectenirradias)幼虫发现,较最佳变态时间推迟2天变态,变态率降低50%。本研究中熊本牡蛎眼点幼虫比率达到95%以上时进行肾上腺素诱导,比最适诱导时间(眼点幼虫比率60%)延迟了5天[19],这可能错过了最佳诱导时间,从而导致熊本牡蛎变态率显著低于其他牡蛎品种。
诱导条件的改变,不仅影响幼虫的变态率,可能对稚贝成活率产生影响。Mehdi S等[33]发现,提高肾上腺素浓度,延长处理时间,珠母贝(Pinctadamargaritifera)幼虫死亡率显著增加。张涛等[34]实验表明,肾上腺素浓度过大或者处理时间过长都会对硬壳蛤(Mercenariamercenaria)幼虫产生毒害作用,变态率降低,死亡率增加。实验结果显示,当肾上腺素浓度超过1×10-4mol/L,诱导时间超过1 h时,熊本牡蛎稚贝成活率显著下降。与其他贝类幼虫相似,肾上腺素对熊本牡蛎幼虫具有毒害作用,因此在利用肾上腺素诱导幼虫变态时,应控制药物浓度和诱导时间在合适的范围,降低幼虫的死亡率。
肾上腺素诱导法,用于熊本牡蛎单体苗种生产,可以高效、快速获得单体苗种,单体牡蛎在稚贝培育期间生长速度无差异[35],在生产应用中具有可行性。但是熊本牡蛎单体稚贝中间培育过程发现:稚贝饵料利用率低,消耗大量饵料;及时筛选小苗和死苗,日常管理难度大;中间培育装置,加大生产成本投入。同时,排放到自然界的肾上腺素,对海洋环境和生物具有潜在污染作用[21],这些都限制了肾上腺素诱导法在国内的推广。
3.2 先固着后脱基法生产熊本牡蛎单体苗种分析
先固着后脱基法是单体牡蛎生产中常用的方法。对熊本牡蛎单体苗种生产所需附着基种类的选择需要综合考虑附着基的成本、实用性、采幼虫附着和稚贝剥离效果等因素。聚丙烯扁条和网衣采苗率低,稚贝和附着基紧密长在一起,剥离后稚贝死亡率高,单体率显著低于其他附着基(P< 0.05)。而塑料薄膜由于表面光滑,稚贝易剥离,单体率显著高于丙烯扁条和网衣(P<0.05)。筛绢网采苗率高,但是附着稚贝与网丝长在一起,难剥离率,单体率与塑料薄膜无显著差异(P> 0.05)。聚乙烯波纹板是贝类和海参苗种生产中常见的附着基,这种附着基在水中不易变形,稳定性好,可保证水体流通顺畅,同时也几乎没有污染,所以采苗效果最好[36]。由于聚乙烯波纹板附着稚贝易剥离,单体率显著高于其他附着基。同时,聚乙烯波纹板取材方便、可重复利用,生产成本低,稚贝中间培育在海上进行,是一种可行的熊本牡蛎单体苗种生产方法。
除柔韧性、表面光滑与否和形状等物理性状,附着基颜色是影响幼虫附着效果的重要因素[37]。本研究利用不同颜色塑料薄膜研究熊本牡蛎幼虫对附着基的颜色选择的偏好,结果发现幼虫对深色附着基具有较强的选择性。这种选择差异可能直接与光照有关,不同颜色的附着基置于水体中后可能会使同一容器内亮度产生差异,而幼虫对光的选择性使不同颜色附着基上的附苗量会有显著差异。Su等[38]评价了附着基颜色对马氏珠母贝(Pinctadamartensi)幼虫附着变态的影响,结果显示深色附着基(红色和蓝色)采苗效果优于浅色附着基(绿色和黄色);高霄龙等[36]发现黑色比绿色和白色采苗器显著吸引毛蚶(Scapharcasubcrenata)幼虫的附着;陈德金等[39]也发现香港巨牡蛎(Crassostreahongkongensis)幼虫在黑色的采苗器采苗率显著高于白色组,这些现象都说明了幼虫对较深颜色附着基的喜爱。杨爱国等[9]和于瑞海等[21]研究长牡蛎单体苗种生产,发现白色聚乙烯波纹板采苗率显著低于对照组扇贝壳。而本实验,灰色聚乙烯波纹板采苗率与对照组扇贝壳无显著差异,这种差异可能是牡蛎幼虫对深色附着基的高选择性所导致。因此,建议生产上使用深色聚乙烯波纹板做附着基,提高采苗率以获得更多单体牡蛎苗种。
4 结语
本实验采用肾上腺素诱导法和先固着后脱基法,研究了熊本牡蛎单体苗种生产技术,为熊本牡蛎工厂化养殖和单体牡蛎生产技术推广提供基础材料。结果显示,肾上腺素诱导法可以高效获得熊本牡蛎单体苗种,但存在稚贝中间培育过程存在饵料消耗大、劳动和生产成本提高、排放的肾上腺素对环境有潜在污染等负面因素,限制了化学诱导法在熊本牡蛎单体苗种生产的应用。以深色聚乙烯波纹板为附着基,采用先固着后脱基法生产熊本牡蛎单体苗种,取材方便,可重复利用,生产成本低,稚贝中间培育过程在海上进行,单体率高,是一种可行的熊本牡蛎单体苗种生产方法。
[1] 肖述, 喻子牛. 养殖牡蛎的选择育种研究与实践 [J]. 水产学报, 2008, 32(2): 287-295.
Xiao Shu, Yu Ziniu. Review of selective breeding research and practice in oyster cultivation [J]. Journal of Fisheries of China, 2008, 32(2): 287-295.
[2] 曾志南, 宁岳. 福建牡蛎养殖业的现状、问题与对策 [J]. 海洋科学, 2011, 35(9): 112-118.
Zeng Zhinan, Ning Yue. History, status and future of oyster culture in Fujian China [J]. Marine Sciences, 2011, 35(9): 112-118.
[3] 王庆志, 李琪, 刘世凯, 等. 长牡蛎成体生长性状的遗传参数估计 [J]. 中国水产科学, 2012, 19(4): 700-706.
Wang Qingzhi, Li Qi, Liu Shikai, et al. Estimates of genetic parameters for growth-related traits in adultCrassostreagigas[J]. Journal of Fishery Sciences of China, 2012, 19(4): 700-706.
[4] 农业部渔业渔政管理局. 中国渔业统计年鉴 [M]. 北京: 中国农业出版社, 2015: 1-52.
Ministry of Agriculture and Fisheries Fishery Administration. China Fishery Statistical Yearbook [M]. Beijing: China Agriculture Press, 2015: 1-52.
[5] Coon S L, Bonar D B, Weiner R M. Induction of settlement and metamorphosis of the Pacific oyster,Crassostreagigas(Thunberg), by L-DOPA and catecholamines [J]. Journal of Experimental Marine Biology and Ecology, 1985, 94(1): 211-221.
[6] Hidu H, Chapman S R, Dean D. Oyster mariculture in subboreal (Maine, United States of America) waters: Cultchless setting and nursery culture of european and american oysters [J]. Journal of Shellfish Research, 1981, 10(1): 57-67.
[7] Dupuy J L, Rivkin S. The development of laboratory techniques for the production of cultch-free spat of the oyster,Crassostreavirginica[J]. Chesapeake Science, 1972, 13(1): 45-52.
[8] 李石磊, 常亚青. 单体牡蛎苗种培育技术研究进展 [J]. 北京水产, 2007, 6: 37-38.
Li Shilei, Chang Yaqing. Single seed oysters breeding technology research progress [J]. Journal of Beijing Fisheries, 2007, 6: 37-38.
[9] 杨爱国, 牛锡端, 沈决奋, 等. 太平洋牡蛎单体苗种生产及养殖技术的研究 [J]. 中国水产科学, 1995, 2(3): 29-35.
Study on cultchless spatand culture techniques of Pacific oysterCrassostreagigas[J]. Journal of Fishery Sciences of China, 1995, 2(3): 29-35.
[10] Laxmilatha P, Surendranathan V G, Svidasan M P, et al. Production and growth of cultchless oyster spat ofCrassostreamadrasensis(Preston) for single oyster culture [J]. Marine Fisheries Information Service, 2011, 207: 8-11.
[11] Hidu H, Chapman S R, Dean D. Oyster mariculture in subboreal (Maine, United States of America) waters: Cultchless setting and nursery culture of European and American oysters[J]. Journal of Shellfish Research, 1981, 5(1): 57-67.
[12] Ogle J T. The growth of cultchlessCrassostreavirginicaspat at biloxi bay, mississippi using different methods of culture [J]. Gulf Research Report, 1989, 8(2): 173-179.
[13] Hadfield M G. Metamorphosis in Marine Molluscan Larvae: An Analysis of Stimulus and Response[M]∥Chia F S, Rice M E eds. Settlement and Metamorphosis of Marine Invertebrate Larvae. New York: Elsevier, 1977: 165-175.
[14] Morse D E, Hooker N, Jensen L, et al. Induction of larval abalone settling and metamorphosis by amino butyric acid and its cogeners from crustose red algae: ii: application to cultivation, seed-production and bioassays; principal causes of mortality and interference [J]. Proceedings of the World Mariculture Society, 1979, 10: 81-91.
[15] Teh C P, Zulfigar Y, Tan S H. Epinephrine and L-DOPA promote larval settlement and metamorphosis of the tropical oyster,Crassostreairedalei(Faustino, 1932): An oyster hatchery perspective [J]. Aquaculture, 2012, 338-341: 260-263.
[16] Grant M N, Meritt D W, Kimmel D G. Chemical Induction of settlement behavior in larvae of the eastern oysterCrassostreavirginica(Gmelin) [J]. Aquaculture, 2013, 402-403: 84-91.
[17] 徐从先, 连建华. 褶牡蛎升温育苗及单体蛎苗生产技术研究 [J]. 齐鲁渔业, 1993, 45(2): 15-18.
Xu Chongxian, Lian Jianhua. Studies on oyster seed-breeding by raising water temperature and technique for cultivating single oyster [J]. Shandong Fisheries, 1993, 45(2): 15-18.
[18] 柯才焕, 李少菁, 李复雪, 等. 僧帽牡蛎幼体附着和变态的诱导 [J]. 水产学报, 2000, 24(3): 229-234.
Ke Caihuan, Li Shaojing, Li Fuxue, et al. Induction of settlement and metamorphosis ofSaccostreacucullatalarvae [J]. Journal of Fisheries of China, 2000, 24(3): 229-234.
[19] 方琦, 林笔水, 方永强. 几种化学物质对两种牡蛎幼虫附着和变态的诱导 [J]. 台湾海峡, 2001, 20(1): 20-26.
Fang Qi, Lin Bishui, Fang Yongqiang. Induction of larval settlement and metamorphosis of teo oystersCrossostreagigasandOstreacucullataby some chemicals [J]. Journal of Oceanography in Taiwan Strait, 2001, 20(1): 20-26.
[20] Searcy-Bernal R, Salas-Garza A E, Flores-Aguilar R A, et al. Simultaneous comparison of methods for settlement and metamorphosis induction in the red abalone (Haliotisrufescens) [J]. Aquaculture, 1992, 105(3): 241-250.
[21] 于瑞海, 王昭萍, 施坤涛, 等. 单体全三倍体太平洋牡蛎育苗技术的研究 [J]. 海洋湖沼通报, 2008(3): 115-120.
Yu Ruihai, Wang Zhaoping, Shi Kuntao, et al. Studies on large-scale culture technique in production of cultchless all-triploid pacific oyster (Crassostreagigas) seeds [J]. Transactions of Oceanology and Limnology, 2008(3): 115-120.
[22] 陈璐. 密鳞牡蛎人工繁育研究 [D]. 青岛: 中国海洋大学, 2010.
Chen Lu. Studies on the Techniques of Artificial Reproduction of the OysterOstreadenselamellosa[D]. Qingdao: Ocean University of China, 2010.
[23] 吕晓燕. 熊本牡蛎人工繁育与长牡蛎单体苗种培育技术研究 [D]. 青岛: 中国海洋大学, 2013.
Lv Xiaoyan. Studies on the Techniques of Artificial Reproduction of theCrassostreasikamaeand Cultivation of the Culthless Spat ofCrassostreagigas[D]. Qingdao: The Ocean University of China, 2013.
[24] 许飞. 小庙洪牡蛎礁巨蛎属牡蛎间生殖隔离研究 [D]. 青岛: 中国科学院海洋研究所, 2009.
Xu Fei. Reproductive Isolations Between Oysters of GenusCrassostreaon the Xiaomiaohong Oyster Reef [D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2009.
[25] Amemiya I. Ecological studies of japanese oysters, with special reference to the salinity of their habitats [J]. Faculty of Agriculture, Tohoku University, 1928, 9: 333-382.
[26] Sekino M. In search of the Kumamoto oysterCrassostreasikamea(Amemiya, 1928) based on molecular markers: is the naturalresource at stake? [J]. Fisheries Science, 2009, 75(4): 819-831.
[27] Robinson A. Gonadal cycle ofCrassostreagigaskumamoto(Thunberg) in yaquina bay, oregon and optimum conditions for broodstock oysters and larval culture [J]. Aquaculture, 1992, 106(1): 89-97.
[28] 王如才, 王昭萍. 海水贝类养殖学 [M]. 青岛: 海洋大学出版社, 2008: 116-176.
Wang Rucai, Wang Zhaoping. Science of Marine Shellfish Culture [M]. Qingdao: Ocean University of China Press, 2008: 116-176.
[29] 杨美圆, 陈海兵, 黄彦超, 等. G-蛋白偶联受体与信号通路对紫贻贝幼体附着变态的调控作用 [J]. 水产学报, 2015, 39(9): 1333-1340.
Yang Meiyuan, Chen haibing, Huang Yanchao, et al. Primary study on the regulation of G-protein coupled receptors and signal pathways in the larval settlement and metamorphosis of the blue musselMytilusgalloprovincialis[J]. Journal of Fisheries of China, 2015, 39(9): 1333-1340.
[30] Coon S L, Fitt W K, Bonar D B. Competence and delay of metamorphosis in the pacific oysterCrassostreagigas[J]. Marine Biology, 1990, 106(3): 379-387.
[31] 张涛, 阙华勇. 延迟变态对海洋无脊椎动物生长发育的影响 [J]. 海洋科学, 2001, 25(6): 28-30.
Zhang Tao, Que Huayong. The effects of delayed metamorphosis on growth and development of invertebrates [J]. Marine Sciences, 2001, 25(6): 28-30.
[32] 张涛. 双壳贝类幼虫变态诱导及其机理研究 [D]. 青岛: 中国科学院海洋研究所, 2000.
Zhang Tao. The Induction and Mechanism of Metamorphosis in Larvae of Bivalve [D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2000.
[33] Doroudi M S, Southgate P C. The effect of chemical cues on settlement behaviour of blacklip pearl oyster (Pinctadamargaritifera) larvae [J]. Aquaculture, 2002, 209(1): 117-124.
[34] 张涛, 杨红生, 周毅, 等. 化学物质对硬壳蛤幼虫变态的诱导 [J]. 海洋科学, 2005, 29(12): 59-67.
Zhang Tao, Yang Hongsheng, Zhou Yi, et al. Induction of metamorphosis of the hard clamMercenariamercenarialarvae by chemical cues [J]. Marine Sciences, 2005, 29(12): 59-67.
[35] 王昭萍, 王如才, 徐从先, 等. 单体褶牡蛎(Crassostreasp.)的研究 [J]. 青岛海洋大学学报, 1992, 22(2):125-132.
Wang Zhaoping, Wang Rucai, Xu Chongxian, et al. Studies on culthless oyster,Crassostreasp [J]. Journal of Ocean University of Qingdao, 1992, 22(2):125-132.
[36] 高霄龙, 李莉, 邱兆星, 等. 不同附着基对毛蚶幼虫附着变态影响的研究[J]. 海洋科学, 2013, 37(8): 61.
Gao Xiaolong, Li Li, Qiu Zhaoxing, et al. The effect of different substrates on bloody clams (Scapharcasubcrenata) larvae settlement and metamorphosis [J]. Marine Sciences, 2013, 37(8): 61.
[37] 梁飞龙, 林伟财, 邓岳文, 等. 换水频率和附着基对大珠母贝育苗效果的影响[J]. 中国农学通报, 2015, 31(29): 33-38.
Liang Feilong, Lin Weicai, Deng Yuewen, et al. Effect of water exchange frequency and artificial substrates on hatchery production ofPinctadamaxi[J]. Chinese Agricutural Science Bulletin, 2015, 31(29): 33-38.
[38] Su Z, Huang L, Yan Y, et al. The effect of different substrates on pearl oysterPinctadamartensii(dunker) larvae settlement [J]. Aquaculture, 2007, 271(1): 377-383.
[39] 陈德金, 肖述, 王文杰, 等. 不同固着基及2种金属离子(K+、Cu2+)对香港巨牡蛎眼点幼虫固着变态影响的研究 [J]. 海洋与湖沼通报, 2014(4): 67-72.
Chen Dejin, Xiao Shu, Wang Wenjie, et al. The influence of eyespots larval settlement and metamorphosis ofCrassostreaHongkongensisusing different kinds of attached substrate and two king of metal Iron (K+and Cu2+) [J]. Transactions of Oceanology and Limnology, 2014(4): 67-72.Establishment of Single Oyster (Crassostrea sikamea) Seeds
责任编辑 朱宝象
WANG Chang-Bo, LI Qi, KONG Ling-Feng, YU Rui-Hai
(The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China)
Drug treatment in combination with epinephrine and fixation-removal method were used to establishing the production technique of single oyster (Crassostreasikamea) seeds. The performance of single seeds production with the method of epinephrine treatment was concentration, time and larval density dependent. We found that 0.1 mmol/L was the best for single oyster seed production; 1 hour treatment was the optimum for single oyster seed production; and the best density was 1000 inds/mL. Gray corrugated polyethylene (PE) board was advent; it was high in settlement rate and easy to operate. It performed significantly better higher than bolting-cloth net, plastic film, nylon rope and polypropylene packing tape (P< 0.05). After cultivating for 25 days, the mean shell height of single seeds and attached spats were (1 953±395) and (1 875±660) μm, respectively. No significant effect on growth speed of single seeds was found (P> 0.05). As the juvenile cultivating of single oyster by drug treatment need special facilities, it not conducive to the promotion of the production technology. The production using the gray corrugated PE board as the attachment base can efficiently produce single oyster seeds.
Crassostreasikamea; single seed; epinephrine; corrugated polyethylene board
泰山学者种业计划专家项目;国家海洋公益性行业科研专项(201305005);山东省科技发展计划项目(2014GHY115002)资助
2016-01-29;
2016-05-23
王昌勃(1988-),男,博士。E-mail: c-b-wang@163.com
** 通讯作者: Email: qili66@ouc.edu.cn
S968.3;S969.23
A
1672-5174(2016)11-136-08
10.16441/j.cnki.hdxb.20160027
王昌勃, 李琪, 孔令锋, 等. 熊本牡蛎单体苗种生产技术研究[J]. 中国海洋大学学报(自然科学版), 2016, 46(11): 136-142,186.
WANG Chang-Bo, LI Qi, KONG Ling-Feng, et al. Establishment of single oyster (Crassostreasikamea) seeds [J]. Periodical of Ocean University of China, 2016, 46(11): 136-142,186.
Supported by Taishan Scholars Seed Industry Experts Program; Special Fund for National Marine in the Public Interest(201305005); Projects of Technology Development Program in Shandong Province(2014GHY115002)
