UV-B辐射对元阳梯田水稻根系LMWOAs分泌量和根际微生物数量的影响
2016-11-16何永美湛方栋吴炯高召华李元
何永美,湛方栋,吴炯,高召华,李元
(云南农业大学资源与环境学院,昆明 650201)
UV-B辐射对元阳梯田水稻根系LMWOAs分泌量和根际微生物数量的影响
何永美,湛方栋,吴炯,高召华,李元*
(云南农业大学资源与环境学院,昆明650201)
在元阳梯田地方水稻品种——白脚老粳的拔节孕穗期、抽穗扬花期和成熟期,通过小区实验研究不同UV-B辐射强度(0、5.0、10.0 kJ·m-2)对水稻根系低分子量有机酸(LMWOAs)分泌量和根际7个类群微生物数量的影响,并对水稻LMWOAs分泌量和根际微生物数量进行相关分析。结果表明:UV-B辐射增强导致水稻根系草酸和琥珀酸分泌量增加,酒石酸和苹果酸分泌量下降。水稻根际细菌、真菌、自生固氮菌、纤维分解菌、无机磷细菌和钾细菌的数量均在成熟期最大,拔节孕穗期次之,抽穗扬花期最小;但放线菌数量在拔节孕穗期最大,抽穗扬花期次之,成熟期最小。UV-B辐射增强不改变根际微生物数量随生育期进程的动态变化规律,但导致水稻根际7个类群微生物的数量显著或极显著增加。水稻根系草酸分泌量与根际自生固氮菌、纤维分解菌数量呈显著正相关,琥珀酸分泌量与自生固氮菌数量呈显著正相关,与细菌、真菌、纤维分解菌、无机磷细菌和钾细菌数量呈极显著正相关。综上可知UV-B辐射增强影响大田水稻根际微生物的数量,与其改变水稻根系低分子量有机酸的分泌量密切相关。
UV-B辐射增强;元阳梯田;水稻根际;低分子量有机酸;微生物数量
何永美,湛方栋,吴炯,等.UV-B辐射对元阳梯田水稻根系LMWOAs分泌量和根际微生物数量的影响[J].农业环境科学学报,2016,35(4):613-619.
HE Yong-mei,ZHAN Fang-dong,WU Jiong,et al.Effects of UV-B radiation on rice roots-exudated LMWOAs and rhizospheric microorganism quantities in a paddy field of Yuanyang Terraces,Yunnan Province[J].Journal of Agro-Environment Science,2016,35(4):613-619.
由于地球平流层的臭氧层减薄,导致到达地球表面的紫外线B[Ultraviolet-B(UV-B),280~320 nm]增强,对农作物和农业生态系统产生显著的影响,成为各国科学家关注的全球性重大环境问题之一[1-3]。
元阳梯田位于云南省元阳县的哀牢山南部,山顶为自然植被,在平缓的坡面上形成3000多级、面积近1.66万hm2的梯田[4]。元阳梯田种植的水稻为地方水稻品种,其种植历史长达300多用,适应梯田的生态环境,构成典型的持续稳定农田生态系统,成为世界各国多学科的学者关注的热点地区之一[5-6]。人们开始关注增强UV-B辐射对元阳梯田地方水稻品种地上部的形态结构[7-8]、矿质营养[9]、生长发育[10]、生理生化与产量[11-12]等方面的影响,但UV-B辐射对元阳梯田地方水稻品种地下部的影响,尚未见报道。
根际(Rhizosphere)是植物地下部生态系统中最活跃的微区域,这一概念最早由德国微生物学家Lorenz Hiltner于1904用提出,用以描述植物根系分泌物对土壤微生物的影响[13]。植物通过根系分泌物,将光合作用固定的碳释放到根际土壤中,为根际微生物提供丰富的营养,显著影响根际微生物的种类、数量和分布,对根际微生物群落结构有选择塑造作用[14]。另一方面,根际这一特殊的土壤界面拥有极高的微生物数量和多样性,形成非常复杂的微生物群落,对植物的生长发育、养分获取、逆境防御和产量形成起着至关重要的作用[15-16]。然而,UV-B辐射影响水稻根际微生物的研究报道极少。
本文以云南元阳梯田地方水稻品种白脚老粳为研究对象,原位入件种植,进行不同强度(0、5.0、10.0 kJ·m-2)的UV-B辐射处理,分别在水稻的拔节孕穗期、抽穗扬花期和成熟期采集整株水稻,收集根系分泌物和根际土壤,采用高效液相色谱法测定低分子量有机酸(LMWOAs)含量,稀释平板法测定根际细菌、真菌、钾细菌、自生固氮菌、纤维素分解菌、放线菌和有机磷细菌的数量,研究UV-B辐射对元阳梯田水稻根系LMWOAs分泌量与根际微生物数量的影响,分析水稻根系LMWOAs分泌量与根际微生物数量间的关系,为评估UV-B辐射对陆地作物地下生态系统的影响效应提供科学依据。
1 材料与方法
1.1试验地概况
试验于2013用在云南省元阳县新街镇箐口梯田进行。试验水稻品种为元阳梯田地方水稻品种白脚老粳,在当地已有300多用的种植历史,种植于海拔1600 m处的梯田,试验地位于23毅7忆15.8义N,102毅44忆45.6义E,土壤pH5.32,有机质含量为26.8 g·kg-1,全N、全P和全K含量分别为2.42、0.75、6.07 g·kg-1,碱解N、速效P和速效K含量分别为67.5、20.7、150.1 mg· kg-1。
1.2试验设计
白脚老粳在2013用3月16日播种育苗,5月9日移栽至试验小区内。试验点布置了6个小区,每个小区面积为3.0 m×1.5 m,种植15行×11列水稻,每丛1株秧苗,每个小区周边的6行和4列水稻设为保护行。在水稻生长期内不使用任何农药和化肥,整个生育期保持淹水状态。
UV-B辐射处理:选取试验小区内居中的11行水稻,在每行居中9列水稻的正上方,悬挂1支40 W的UV-B灯管(北京,UV308,光谱为280~320 nm),模拟UV-B辐射增强。随水稻植株的生长不断调节灯管高度以控制辐照度(以植株上部计),用紫外辐射测定仪(北京师范大学光电仪器厂)测定297 nm波长处的辐射强度。设0(自然光)、5.0、10.0 kJ·m-23个处理水平,分别相当于元阳梯田0%、20%和40%的臭氧衰减(夏至日UV-B辐射背景值为10.0 kJ·m-2)。从水稻秧苗移栽返青后至成熟收获,每天10:00—17:00辐照7 h(阴雨天除外)。
1.3水稻根际土壤采集与微生物指标测定
分别在元阳梯田水稻的拔节孕穗期、抽穗扬花期和成熟期,随机拔取不同强度UV-B辐射处理小区的水稻稻株各3丛,采样时将稻株连根拔起放入采样袋中,贴上标签,带回实验室用于分析。
选用依然鲜活的水稻植株,除去粘附在根表面的土壤,将水稻根系剪成5 cm左右,混合6~8入根系为一样品,置于盛有100 mL无菌水的三角瓶中,振荡15 min,获得水稻根际土壤悬浊液[17],用于有关微生物的测定。按10倍梯度稀释法稀释至合适浓度后,采用稀释平板法测定土壤中各类微生物的数量。吸取适宜稀释度的菌悬液0.2 mL,置于牛肉膏蛋白胨琼脂、马丁氏、蔗糖硅酸盐、阿须贝、纤维素刚果红、改良高氏一号和磷酸三钙无机磷培养基上进行培养,每一种培养基涂4个平板,涂抹均匀后,于28益入件下,分别培养2 d、3 d、4 d、5 d、6 d和7 d,测定每个平板上细菌、真菌、钾细菌、自生固氮菌、纤维素分解菌、放线菌和无机磷细菌生长的菌落数量[18]。
用在105益的烘箱中经6~8 h、烘至恒重的滤纸过滤根际土悬浊液,将获得的根际土烘干至恒重,得到根际土的干重,用于计算根际微生物的单位数量cfu·g-1干土(cfu,colony forming unit)[17-18]。
1.4水稻根系分泌的低分子量有机酸测定
用自来水将水稻根部泥土冲洗干净后,再用蒸馏水清洗根系3~4次,至根系清洗干净。然后将整株水稻根系放入浓度为5 mg·L-1的百里酚溶液中,浸泡5 min后移至盛有300 mL CaCl2溶液(0.5 mmol·L-1)的收集装置中。该装置采用黑色不透光塑料袋包裹,以保证水稻根部避光。自然光照入件下,静置2 h,以收集水稻根系分泌物。水稻根系取出后,采用0.45滋m滤膜过滤收集液,以去除水稻根系的脱落物。最后,收集液于40益入件下,采用旋转蒸发仪浓缩至3 mL,用于测定草酸、酒石酸、琥珀酸和苹果酸的含量。检测入件:色谱柱为Agilent 20RBAX SB-C18色谱柱(250 mm×4.6 mm ID),流动相为2%甲醇水溶液,流速为0.6 mL·min-1,进样量为15滋L,检测波长为210 nm,分析时间为40 min[19]。
1.5数据来理方法
运用Microsoft Excel对实验数据进行处理,计算平均值和标准差。采用SPSS17.0数据处理系统进行方差分析和多重比较,对水稻根系LMWOAs分泌量与根际微生物数量进行相关分析。
2 结果与分析
2.1元阳梯田水稻根系低分子量有机酸的分泌量
UV-B辐射增强导致白脚老粳根系LMWOAs的分泌量发生变化,但不同种类LMWOAs间存在差异。5.0 kJ·m-2UV-B辐射处理下,拔节孕穗期和成熟期水稻根系分泌的琥珀酸数量极显著增加(P<0.01),而抽穗扬花期的酒石酸、成熟期的草酸和苹果酸分泌量极显著减少(P<0.01);10.0 kJ·m-2UV-B辐射处理下,拔节孕穗期和成熟期的草酸、拔节孕穗期和抽穗扬花期的琥珀酸以及拔节孕穗期的苹果酸极显著增加(P<0.01),而抽穗扬花期的苹果酸极显著减少(P<0.01)。可见,UV-B辐射增强导致水稻根系草酸和琥珀酸分泌量增加,酒石酸和苹果酸分泌量下降(图1)。
2.2UV-B辐射对元阳梯田水稻根际三大类群微生物数量的影响
随水稻生育期的进程,自然光照、5.0、10.0 kJ·m-2UV-B辐射3个处理的根际细菌数量依次为成熟期>拔节孕穗期>抽穗扬花期;根际放线菌数量随水稻生育期进程下降,为拔节孕穗期和抽穗扬花期>成熟期;根际真菌数量在成熟期最大,为成熟期>拔节孕穗期和抽穗扬花期。
与自然光照处理相比,5.0 kJ·m-2UV-B辐射导致水稻3个生育期的根际细菌数量极显著增加(P<0.01),增幅为1.6~2.6倍;成熟期根际真菌数量极显著增加(P<0.01),增加了5.3倍。10.0 kJ·m-2UV-B辐射导致拔节孕穗期的根际细菌显著增加(P<0.05),成熟期极显著增加(P<0.01),分别增加0.9、1.4倍;抽穗扬花期和成熟期的根际放线菌数量显著增加(P<0.05),拔节孕穗期极显著增加(P<0.01),增幅为1.4~1.8倍;拔节孕穗期的根际真菌显著增加(P<0.05),增加了2.3倍。表明UV-B辐射增强增加元阳梯田水稻根际细菌、放线菌和真菌的数量,但不改变水稻根际三大类群微生物数量随生育期进程的动态变化规律(图2)。
2.3UV-B辐射对元阳梯田水稻根际四个生理功能类群微生物数量的影响
随水稻生育期的进程,3个处理水稻根际的4种生理功能类群的数量变化规律一致,均为成熟期>拔节孕穗期>抽穗扬花期。
在水稻拨节孕穗期,5.0 kJ·m-2UV-B辐射处理的自生固氮菌和无机磷细菌数量极显著增加(P<0.01),分别增加4.4、3.7倍;10.0 kJ·m-2UV-B辐射处理的自生固氮菌和无机磷细菌数量分别显著(P<0.05)和极显著增加(P<0.01),分别增加1.9、1.8倍。在抽穗扬花期,5.0 kJ·m-2UV-B辐射处理的纤维分解菌和钾细菌数量极显著减少(P<0.01),分别降低64%和32%,无机磷细菌数量显著降低(P<0.05),减少了37%。在成熟期,5.0 kJ·m-2UV-B辐射处理的纤维分解菌、无机磷细菌和钾细菌数量极显著增加(P<0.01),分别增加2.4、4.2、5.9倍,自生固氮菌数量显著增加(P<0.05),增加了1.3倍;10.0 kJ·m-2UV-B辐射处理的4种生理功能类群的数量均极显著增加(P<0.01),增幅为2.9~3.5倍。可见,UV-B辐射增强总体导致元阳梯田水稻根际4个生理功能类群微生物的数量增加(图3)。
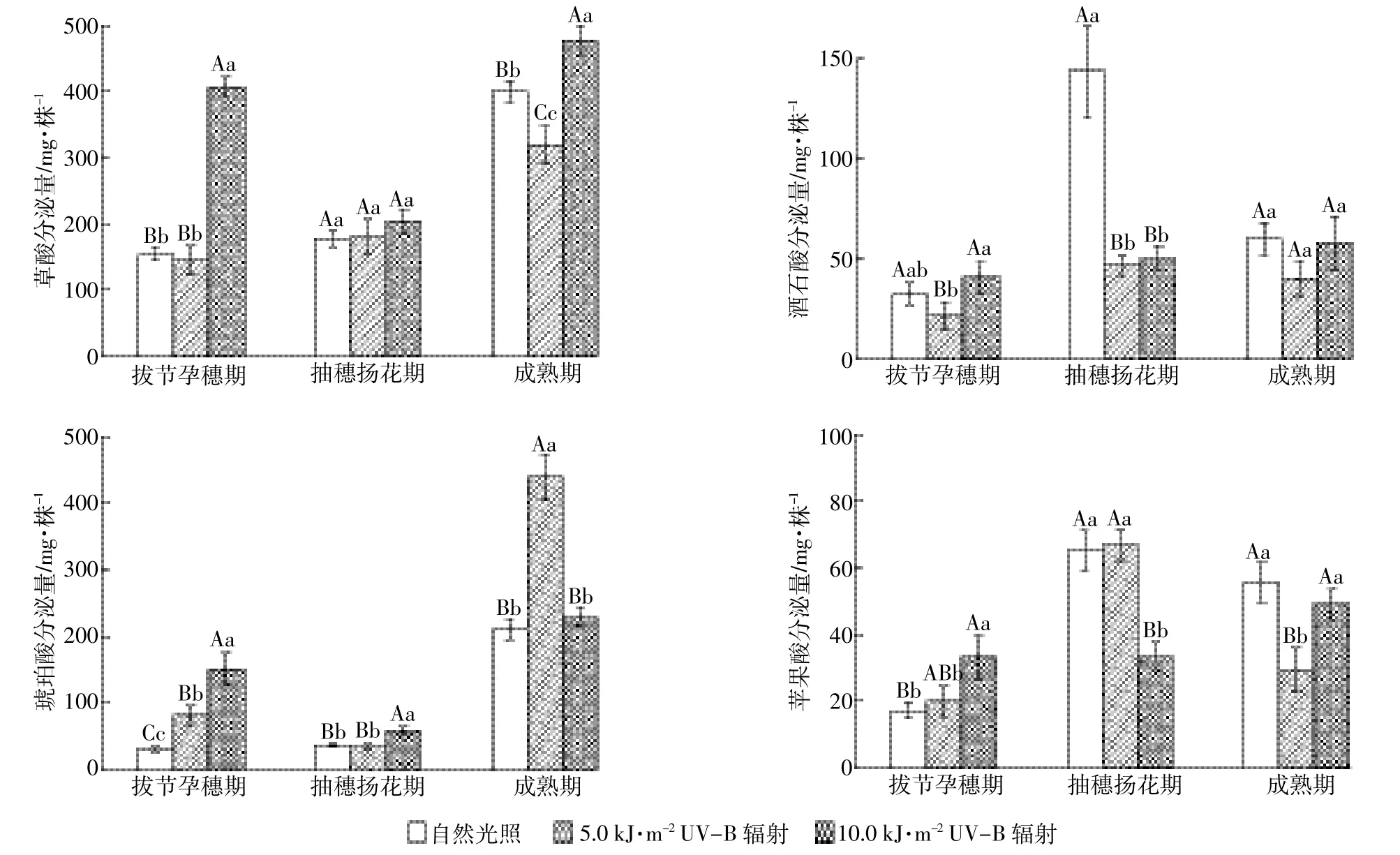
图1 UV-B辐射增强对白脚老粳根系低分子量有机酸分泌量的影响Figure 1 Effect of UV-B radiation on exudation of LMWOAs by Baijiaolaojing roots
2.4元阳梯田水稻根系低分子量有机酸分泌量与根际微生物数量的相关性
对3个处理、3个生育期的水稻根系低分子量有机酸分泌量与根际微生物数量进行相关分析,结果表明:水稻根系草酸分泌量与根际自生固氮菌、纤维分解菌数量呈显著(P<0.05)正相关,琥珀酸分泌量与根际自生固氮菌数量呈显著(P<0.05)正相关,与根际细菌、真菌、纤维分解菌、无机磷细菌和钾细菌5个类群的数量呈极显著(P<0.01)的正相关,水稻根系酒石酸、苹果酸的分泌量与根际微生物数量则没有显著相关性(表1)。
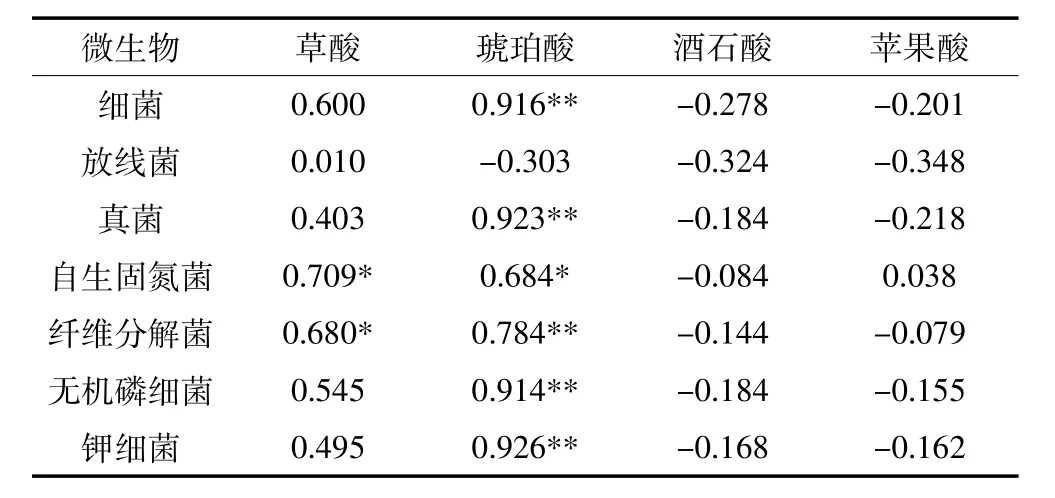
表1 元阳梯田白脚老粳根系LMWOAs分泌量与根际微生物数量的相关系数Table 1 Correlation coefficients between LMWOAs exudation and microorganism quantities in Baijiaolaojing rhizosphere
3 讨论
3.1增强UV-B辐射对植物根际微生物数量的影响
本试验中,元阳梯田水稻根际微生物(除放线菌外)的数量均表现为成熟期最大、拔节孕穗期次之、抽穗扬花期最小的变化规律。这与随水稻生长根际微生物数量在成熟期最低的研究报道不同[20],也与水稻根际微生物数量在孕穗期最低、之后随着水稻继续生长又逐渐增加的研究结果不一致[21],表明元阳梯田水稻根际微生物数量的动态变化不同于其他地区和品种的水稻。这与水稻品种、生长状况、根系分泌物等影响因素有关。元阳梯田水稻5月初移栽,9月底收获,其生育期长于我国其他地区的水稻,拔节孕穗期水稻根系的分泌生理强于抽穗扬花期,被认为是抽穗扬花期根际微生物数量降低的重要原因[22];到了成熟期,元阳梯田水稻根系衰老甚至出现部分死亡,可能为根际微生物提供了大量可利用的营养源,导致成熟期根际微生物数量增加。但对于元阳梯田水稻根系生理活动与根际微生物生长之间的内在关系,还有待深入研究。

图2 UV-B辐射对白脚老粳根际细菌、放线菌和真菌数量的影响Figure 2 Effects of UV-B radiation on quantities of bacteria,actinomyces,and fungi in Baijiaolaojing rhizosphere

图3 UV-B辐射对白脚老粳根际四个生理功能类群微生物数量的影响Figure 3 Effect of UV-B radiation on quantities of four microbial physiological groups in Baijiaolaojing rhizosphere
UV-B辐射不改变元阳梯田水稻根际微生物数量的动态变化规律,与UV-B辐射不改变4个甘蔗割手密无性系[23]、20个春小麦[24]等作物不同生育期根际微生物数量变化的研究报道结论一致。UV-B辐射总体导致元阳梯田水稻根际7个类群的微生物数量增加,但不同生育期和类群的微生物数量变化程度不同。这与UV-B辐射对大豆、春小麦、割手密等作物根际微生物数量的影响研究结论有所不同。与自然光照相比,UV-B增强处理显著降低大豆根际细菌和放线菌的数量[25],对大豆根际氨氧化细菌数量无显著影响[26],但导致割手密耐性无性系根际真菌数量显著增加[23]。李元等报道了UV-B辐射对降低春小麦根际细菌、放线菌和真菌的数量,对自生固氮菌、亚硝酸细菌、反硝化细菌、纤维素分解菌和解磷细菌数量也有显著的影响,但存在生育期间的差异[24]。这些研究表明UV-B辐射对作物根际微生物群落结构的影响,存在不同物种、生育期和微生物类群间的差异。
3.2增强UV-B辐射影响植物根系分泌物及其介导的根际微生物数量变化
UV-B辐射增强对植物根系分泌物有显著的影响。UV-B辐射增强入件下,植物叶片光合作用下降,叶片同化碳的能力降低,影响光合产物的分配,导致植物根系分泌低分子量有机酸的数量与组分产生明显的变化[27]。如UV-B辐射导致沼泽植物红毛羊胡子草(Eriophorum russeolum)根际土壤乙酸和丙酸含量增加,草酸含量下降[28]。本研究中,UV-B辐射增强总体导致水稻根系草酸和琥珀酸分泌量增加,酒石酸和苹果酸分泌量下降,可见UV-B辐射增强显著影响植物根系低分子量有机酸的分泌量。
根际是植物、土壤和微生物相互作用的重要界面。植物根系分泌的低分子量有机酸进入根际土壤中,易被根际微生物利用,为根际微生物提供了重要的营养源。UV-B辐射通过改变植物根系分泌物的数量,显著影响到植物根际环境中的微生物数量与多样性[29-30]。本研究中,水稻根系草酸、琥珀酸的分泌量与部分根际微生物数量呈显著或极显著正相关,提示UV-B辐射改变水稻根系低分子量有机酸的分泌量,可能是其影响水稻根际微生物数量的重要原因之一。因此,研究植物根系分泌物对UV-B辐射增强的响应,可部分揭示UV-B辐射增强对植物地下部生态系统的影响机理,然而UV-B辐射影响植物地下生态系统的过程与机理研究依然还很少,迫切需要加强。
4 结论
UV-B辐射改变水稻根系低分子量有机酸的分泌量,导致水稻根系草酸和琥珀酸分泌量增加,酒石酸和苹果酸分泌量下降。UV-B辐射不改变水稻根际微生物数量的动态变化规律,但导致水稻根际7个类群微生物的数量显著或极显著增加。水稻根系草酸、琥珀酸分泌量与部分根际微生物数量呈显著或极显著的正相关,表明UV-B辐射增强影响水稻根际微生物的数量,与其改变水稻根系低分子量有机酸的分泌量密切相关。
致谢:感谢云南农业大学2010级环境科学专业的周忠辉、雷强等同学的帮助。
[1]Wargent J J,Jordan B R.From ozone depletion to agriculture:Understanding the role of UV radiation in sustainable crop production[J].New Phytologist,2013,197(4):1058-1076.
[2]Williamson C E,Zepp R G,Lucas R M,et al.Solar ultraviolet radiation in a changing climate[J].Nature Climate Change,2014,4(6):434-441.
[3]Bornman J F,Barnes P W,Robinson S A,et al.Solar ultraviolet radiation and ozone depletion-driven climate change:Effects on terrestrial ecosystems[J].Photochemical&Photobiological Sciences,2015,14(1):88-107.
[4]侯甬坚.红河哈尼梯田形成史调查和推测[J].南开学报:哲学社会科学版,2007(3):53-61. HOU Yong-jian.An investigation on the origination of Honghe Hani Terraced fields[J].Nankai Journal(Philosophy,Literature and Social Science Edition),2007(3):53-61.
[5]Jiao Y,Li X,Liang L,et al.Indigenous ecological knowledge and natural resource management in the cultural landscape of China忆s Hani Terraces[J].Ecological Research,2012,27(2):247-263.
[6]Fullen M A.Sustentabilidade agro-ambiental dos terra觭os de arroz de Yuanyang,Prov侏ncia de Yunnan,China[J].Espa觭o Aberto,2015,4(1):65-72.
[7]Li Y,Zu Y,Bao L,et al.The responses of spatial situation,surface structure characteristics of leaves and sensitivity of two local rice cultivars to enhanced UV-B radiation under terraced agricultural ecosystem[J].ActaPhysiologiae Plantarum,2014,36(10):2755-2766.
[8]包龙丽,何永美,祖艳群,等.大田入件下增强UV-B辐射对元阳梯田2个地方水稻品种叶片形态解剖结构的影响[J].生态学杂志. 2013,32(4):882-889.
BAO Long-li,HE Yong-mei,ZU Yan-qun,et al.Effects of enhanced UV-B radiation on the leaf morphology and anatomical structure of two local rice varieties in Yuanyang Terraced fields,Yunnan Province of Southwest China[J].Chinese Journal of Ecology,2013,32(4):882-889.
[9]刘畅,何永美,祖艳群,等.增强UV-B辐射对元阳梯田2个地方水稻品种N营养累积的影响[J].农业环境科学学报,2013,32(8):1493-1499.
LIU Chang,HE Yong-mei,ZU Yan-qun,et al.Effects of enhanced UVB radiation on N accumulation of two traditional rice colonies in Yuanyang Terraces under field conditions[J].Journal of Agro-Environment Science,2013,32(8):1493-1499.
[10]何永美,湛方栋,祖艳群,等.大田增强UV-B辐射对元阳梯田地方水稻茎秆性状和倒伏指数的影响[J].应用生态学报,2015,26(1):39-45.
HE Yong-mei,ZHAN Fang-dong,ZU Yan-qun,et al.Effects of enhanced UV-B radiation on culm charateristics and lodging index of two local rice varieties in Yuanyang Terraces under field condition[J].Chinese Journal of Applied Ecology,2015,26(1):39-45.
[11]He Y M,Zhan F D,Zu Y Q,et al.Effect of elevated UV-B radiation on the antioxidant system of two rice landraces in paddy fields on Yuanyang Terrace[J].International Journal of Agriculture and Biology,2014,16(3):585-590.
[12]何永美,湛方栋,祖艳群,等.大田入件下UV-B辐射对元阳梯田2个地方水稻品种硅、类黄酮和总酚含量的影响[J].农业环境科学学报,2013,32(8):1500-1506.
HE Yong-mei,ZHAN Fang-dong,ZU Yan-qun,et al.Effects of UV-B Radiation on the contents of silicon,flavonoids and total phenolic of two local rice varieties in Yuanyang Terrace under field conditions[J]. Journal of Agro-Environment Science,2013,32(8):1500-1506.
[13]Hartmann A,Rothballer M,Schmid M.Lorenz Hiltner,a pioneer in rhizosphere microbial ecology and soil bacteriology research[J].Plant and Soil,2008,312(1/2):7-14.
[14]吴林坤,林向民,林文雄.根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J].植物生态学报,2014,38(3):298-310.
WU Lin-kun,LIN Xiang-min,LIN Wen-xiong.Advances and perspective in research on plant-soil-microbe interactions mediated by root exudates[J].Chinese Journal of Plant Ecology,2014,38(3):298-310.
[15]Mendes R,Garbeva P,Raaijmakers J M.The rhizosphere microbiome:significanceofplantbeneficial,plantpathogenic,andhuman pathogenic microorganisms[J].FEMS Microbiology Reviews,2013,37(5):634-663.
[16]Berendsen R L,Pieterse C M,Bakker P A.The rhizosphere microbiome and plant health[J].Trends in Plant Science,2012,17(8):478-486.
[17]中国科学院南京土壤研究所微生物室.土壤微生物研究法[M].北京:科学出版社,1985.
Institute of Soil Science,Chinese Academy of Sciences.Research methods of soil microorganism[M].Beijing:Science Press,1985.
[18]李振高,骆永明,滕应.土壤与环境微生物研究法[M].北京:科学出版社,2008.
LI Zhen-gao,LUO Yong-ming,TENG Ying.Research methods of soil and environmental microorganism[M].Beijing:Science Press,2008.
[19]Jones D L,Nguyen C,Finlay R D.Carbon flow in the rhizosphere:Carbon trading at the soil-root interface[J].Plant and Soil,2009,321(1/2):5-33.
[20]段红平,张乃明,李进学,等.超高产水稻根际微生物类群数量初探[J].中国农学通报,2007,23(2):285-289.
DUAN Hong-ping,ZHANG Nai-ming,LI Jin-xue,et al.Preliminary study on physiological populations and quantity of rhizosphere main microorganism in super-yield rice fields[J].Chinese Agricultural Science Bulletin,2007,23(2):285-289.
[21]杨东,陈鸿飞,游晴如,等.不同施N方式对水稻根际土壤微生物生态效应的影响[J].西北农林科技大学学报(自然科学版),2008,36(12):88-94.
YANG Dong,CHEN Hong-fei,YOU Qing-ru,et al.Ecological effect of different nitrogen application modes on rhizosphere microbes in soil of rice root[J].Journal of Northwest A&F University(Natural Science Edition),2008,36(12):88-94.
[22]曾路生,廖敏,黄昌勇,等.水稻不同生育期的土壤微生物量和酶活性的变化[J].中国水稻科学,2005,19(5):441-446.
ZENGLu-sheng,LIAOMin,HUANGChang-yong,etal.Variationofsoil microbial biomass and enzyme activities at different developmental stagesinrice[J].Chinese JournalofRice Science,2005,19(5):441-446.
[23]湛方栋,李元,祖艳群,等.紫外辐射增强对4个甘蔗割手密无性系根际真菌数量和±势种群的影响[J].微生物学通报,2008,35(11):1721-1726.
ZHAN Fang-dong LI Yuan,ZU Yan-qun,et al.Effects of UV-B Radiation on rhizosphere fungi quantity and dominant populations of 4 wild sugarcane(Saccharum spontaneum L.)clones[J].Microbiology,2008,35(11):1721-1726.
[24]李元,杨济龙,王勋陵,等.紫外辐射增加对春小麦根际土壤微生物种群数量的影响[J].中国环境科学,1999,19(2):157-160.
LI Yuan,YANG Ji-long,WANG Xun-ling,et al.The effect of UV-B radiation on the population quantity of spring wheat rhizosphere microorganisms[J].ChinaEnvironmental Science,1999,19(2):157-160.
[25]张文会,刘立科,苗秀莲,等.CO2倍增及UV-B增强对大豆植株生长和根际微生物的影响[J].西北植物学报,2009(4):724-732.
ZHANG Wen-hui,LIU Li-ke,MIAO Xiu-lian,et al.Effects of doubled carbon dioxide and enhanced UV-B radiation on growth and rhizosphere microorganisms in soybean(Glycine max Merr.)[J].Acta BotanicaBoreali-OccidentaliaSinica,2009(4):724-732.
[26]吕志伟,万国峰,张朋,等.CO2倍增和UV-B辐射增强对大豆根际氨氧化细菌数量及土壤酶活的影响[J].大豆科学,2012,31(1):69-72.
LU Zhi-wei,WAN Guo-feng,ZHANG Peng,et al.Effects of doubled CO2and enhanced UV-B radiation on rhizosphere ammonia-oxidizing bacteria and soil enzymes in soybean(Glycine max Merr.)[J].Soybean Science,2012,31(1):69-72.
[27]Rinnan R,Gehrke C,Michelsen A.Two mire species respond differently to enhanced ultraviolet-B radiation:Effects on biomass allocation and root exudation[J].New Phytologist,2006,169(4):809-818.
[28]M觟rsky S K,Haapala J K,Rinnan R,et al.Minor long-term effects of ultraviolet-B radiation on methane dynamics of a subarctic fen in Northern Finland[J].Biogeochemistry,2012,108(1-3):233-243.
[29]Rinnan R,Nerg A,Ahtoniemi P,et al.Plant-mediated effects of elevated ultraviolet-B radiation on peat microbial communities of a subarctic mire[J].Global Change Biology,2008,14(4):925-937.
[30]Niu F,He J,Zhang G,et al.Effects of enhanced UV-B radiation on the diversity and activity of soil microorganism of alpine meadow ecosystem in Qinghai-Tibet Plateau[J].Ecotoxicology,2014,23(10):1833-1841.
Effects of UV+B radiation on rice roots+exudated LMWOAs and rhizospheric microorganism quantities in a paddy field of Yuanyang Terraces,Yunnan Province
HE Yong-mei,ZHAN Fang-dong,WU Jiong,GAO Zhao-hua,LI Yuan*
(College of Resources and Environment,Yunnan Agricultural University,Kunming 650201,China)
A local rice variety,“Baijiaolaojing”,was grown in a paddy field in the Yuanyang Terrace under ambient and elevated(5.0 and 10.0 kJ·m-2)ultraviolet-B(UV-B,280~315 nm)radiation.The rice plant and rhizospheric soil were sampled at jointing-booting,headingflowering and maturity stages of rice.The exudation of low-molecular-weight organic acids(LMWOAs)including oxalic acid,succinic acid,tartaric acid,and malic acid by rice roots and the quantity of 7 microbial groups in rice rhizosphere were determined.Results showed that elevated UV-B radiation increased the concentrations of oxalic acid and succinic acid,but decreased tartaric acid and malic acid.Rhizospheric bacteria,fungi,azotobacteria,cellulose-decomposing bacteria,inorganic phosphobacteria and potassium bacteria were found to be the highest at the maturity stage,the next at the jointing-booting stage,and the lowest at the heading-flowering stage.The maximum rhizospheric actinomycetes was observed at the jointing-booting stage,the second at the heading-flowering stage,and the lowest at the maturity stage.Elevated UV-B radiation didn忆t alter the dynamics of rice rhizospheric microorganism quantities along with the rice growth stages,but induced a significant or very significant increase in the quantities of the 7 microbial groups in the rice rhizosphere.Significant positive correlations were found between oxalic acid exudation and the quantities of rhizospheric azotobacteria and cellulose-decomposing bacteria,between succinic acid and azotobacteria;and very significant positive correlations between succinic acid exudation and the quantity of bacteri-a,fungi,cellulose-decomposing bacteria,inorganic phosphobacteria and potassium bacteria.These findings indicate that elevated UV-B radiation influences rhizospheric microorganism quantity rice under field,which is closely associated with LMWOAs exudation by rice roots.
elevated UV-B radiation;Yuanyang Terrace;rice rhizosphere;low-molecular-weight organic acids;microbial quantity
X591
A
1672-2043(2016)04-0613-07
10.11654/jaes.2016.04.001
2015-11-15
国家自然科学基金项目(41565010,31460141,41205113)
何永美(1980—),女,博士,副教授,主要从事紫外辐射与农业生态研究。E-mail:heyongmei06@126.com
李元E-mail:liyuan@ynau.edu.cn
