纳米CoFe2O4催化光电类Fenton反应降解2,4-二氯酚研究
2016-11-16王现丽吴俊峰郭一飞朱新锋康海彦宋丰明
刘 盼,方 冰,王现丽,吴俊峰,郭一飞,朱新锋,康海彦,宋丰明
(1.郑州大学 化学与分子工程学院,河南 郑州450001;2.河南城建学院 市政与环境工程学院,河南平顶山 467036;3.平顶山市新城清源污水净化有限公司,河南 平顶山 467000)
纳米CoFe2O4催化光电类Fenton反应降解2,4-二氯酚研究
刘 盼1,2,方 冰3,王现丽2,吴俊峰2,郭一飞2,朱新锋2,康海彦2,宋丰明2
(1.郑州大学 化学与分子工程学院,河南 郑州450001;2.河南城建学院 市政与环境工程学院,河南平顶山 467036;3.平顶山市新城清源污水净化有限公司,河南 平顶山 467000)
运用化学法制备CoFe2O4光电非均相催化剂用于降解2,4-二氯酚,并采用TEM、XRF、XRD和BET等技术对制备的催化剂进行表征。结果表明:在0.2 mmol·L-12,4-二氯酚,0.05mol·L-1硫酸钠,外电压-0.8V,pH为3.0,0.067g·L-1CoFe2O4在UV照射条件下,反应180min后,2,4-二氯酚降解率可达到89.6%,COD去除率可达到84.2%。同时,CoFe2O4在重复使用过程中具有较高的稳定性。
光电Fenton;CoFe2O4;2,4-二氯酚
2,4-二氯苯酚主要用于有机物合成、农药除草醚及其衍生物、伊比磷等医用药物的中间体制造,同时用于生产某些甲基化合物的有机物。有关受污染水体中二氯酚的降解方法主要有光催化法[1-3]、生物降解法[4-5]、Fenton法[6-7]以及电催化法等[8-9]。
光电Fenton技术集光、电以及Fenton反应为一体,以提高污染物的去除效果,在UV的照射作用下加快H2O2的分解速度,与此同时能使Fe3+向Fe2+的转化速率加快,从而提高Fenton试剂的氧化性能。另外,UV催化也可以增进有机污染物的光解作用,通过电化学方法使溶解氧还原为H2O2。光电Fenton技术在处理难降解有机污染物方面具有其独特的优势,如光电Fenton技术处理含苯酚[10]、氯贝酸[11]、除草剂2,4-DP[12]等。
类Fenton反应催化剂主要有两大类:氧化物型和负载型,其中氧化物型催化剂包括天然铁矿物、α-三氧化二铁、四氧化三铁、氧化亚铁[13-18]、钒[19-20]、铜[21]、硅[22]等。另一种是以Nafion膜[23]、黏土[24-26]等为载体的负载型催化剂。在处理有机废水试验中,使用非均相类Fenton试验方法可以有效克服传统Fenton处理过程造成的二次污染问题,并且可拓宽均相Fenton反应的pH适用范围。
具有铁氧体结构的复合型氧化物是一种性能独特的无机非金属材料,目前多应用于环境污染治理。本试验以CoFe2O4作为催化剂,在电还原产生H2O2的基础上增加了紫外光照,利用光、电以及Fenton的协同作用,即非均相光电Fenton技术处理2,4-二氯酚。使用共沉淀法制备催化剂CoFe2O4,并对所制备的催化剂进行TEM、XRF、XRD和BET表征。分别从pH、Na2SO4浓度、外电压、CoFe2O4用量以及待降解溶液的初浓度等方面来探究本次试验对2,4-二氯酚的处理效果,并研究分析CoFe2O4的化学稳定性。
1 试验所需试剂及方法
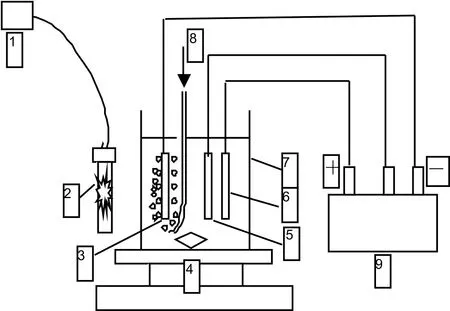
1.外接电源;2.UV;3.工作电极;4.磁力搅拌器;5.参比电极;6.对电极;7.石英杯; 8.曝气;9.工作站图1 试验装置示意图
试验所用试剂:Fe(NO3)3(分析纯),Co(NO3)2(分析纯),浓H2SO4(分析纯)以及NaOH(分析纯)均为国药集团化学试剂有限公司采购。试验用水为蒸馏水。非均相光电类Fenton降解2,4-二氯酚试验装置如图1所示。本次反应在石英烧杯(Φ为90 mm,L为110 mm)中进行,实验过程中所用到的工作电极和对电极分别为石墨电极(L为7 mm,B为mm,H为3 mm)和碳棒电极(Φ为3 mm,H为40 mm)。工作电极具有较大比表面积,易产生H2O2[27-28]。甘汞电极做参比电极。利用15 W的汞灯提供紫外光源(λmax为254 nm)。曝气流量为130 mL·min-1。
配制试验所需浓度的2,4-二氯酚溶液,加入一定量的Na2SO4为溶液提供电解质。用高浓度的碱液或酸液调节溶液pH值。向石英烧杯中加入150 mL待处理溶液及适量的催化剂CoFe2O4。搅拌反应10 min后,打开紫外灯、电化学及曝气装置,同时开始计时。在不同的间隔时间点取样,水样经离心后,取其上清液进行分析测定。
对不同浓度的2,4-二氯酚进行紫外扫描,发现在284 nm处出现了2,4-二氯酚的特征峰(见图2a)。以溶液在284 nm处吸光度A为纵坐标,以相对应的浓度为横坐标作图(见图2b)。可利用紫外可见分光光度计测得2,4-二氯酚在不同时间点处于284 nm处吸光度,通过图2b中的拟合曲线方程计算对应的溶液浓度,最后通过式(1)计算降解率。

(1)
式中:Co表示原降解液的初始浓度(mg·L-1);Ci表示不同反应时间点对应降解液浓度(mg·L-1)。COD测定采用重铬酸钾回流法, Fe3+测定采用分光光度法(邻菲啰啉)[29]。

(a)

(b)
2 CoFe2O4制备及表征
制备CoFe2O4采用化学共沉淀法。首先将装有40 mL蒸馏水的烧杯放置在水浴锅中加热至60 ℃,取0.02 mol Fe(NO3)3和0.01 mol Co(NO3)2溶于烧杯中,60 ℃持续水浴并不断搅拌使其溶解,逐滴加入NaOH(3 mol·L-1)调节pH至13.0,继续搅拌2 h,过滤并多次水洗至溶液显中性。最后将过滤后的残渣100 ℃鼓风干燥12 h,再在600 ℃高温下煅烧3 h后,研磨备用。

(a) TEM图谱

(b) XRF图谱

(c) 不同焙烧温度的XRD图谱
图3a是CoFe2O4透射电镜图谱(TEM)。由图3a可以看出:CoFe2O4的粒径约为20 nm,且分布均匀。另外,测得CoFe2O4比表面积BET为40.3 m2·g-1。为了分析CoFe2O4中Co和Fe的实际比重,对CoFe2O4进行了X射线荧光光谱分析(XRF)(图3b)。结果显示:n(Co)∶n(Fe)为0.34∶0.66,与实际化学式中原子数比值(1∶2)接近,因此化学共沉淀法制备CoFe2O4的方法是适用的。
同时对CoFe2O4进行了X射线衍射分析(XRD)(图3(c))。从图3(c)可以很清晰地看到、100 ℃条件下,样品的吸收峰与卡片峰(卡片号为77-0426)基本一致,说明采用共沉淀法制备CoFe2O4的过程是可行的。
3 试验结果与讨论
3.1 不同反应体系对2,4-二氯酚处理效果比较
比较不同反应体系对2,4-二氯酚降解效果的差别,即:CoFe2O4对2,4-二氯酚的吸附作用、电解作用、紫外作用、光电催化以及非均相光电类Fenton作用(见图4)。试验结果显示:CoFe2O4对2,4-二氯酚降解过程的影响是在短时期内快速完成的,在投加了CoFe2O4的体系中,经过5min作用后,对2,4-二氯酚仅3%的去除效果,延长反应时间,去除效果不变。此外,当外加-0.6V电压时,电解对2,4-二氯酚的降解也几乎没有效果。在UV催化作用下,2,4-二氯酚的去除率也仅有37.9%,但在紫外和电的协同作用下(外电压-0.6V,UV照射),2,4-二氯酚的降解率可达到53.6%。在反应体系中,由于UV的催化作用,将H2O2分解为·OH(见反应2),因此对2,4-二氯酚的处理效果相对比较理性。非均相光电类Fenton体系(外电压-0.6V,UV光照射,0.067g·L-1CoFe2O4),较前面讨论的反应体系,对2,4-二氯酚的去除效果最好,分析原因是催化剂CoFe2O4的加入,加速了H2O2的分解速率,即加快了·OH的产率,最终提高了2,4-二氯酚的降解效率(见反应(2)~(5))。
H2O2+hv→2·OH
(2)
(Fe-OH)2++hv→Fe2++·OH
(3)
Fe(OOCR)2++hv→Fe2++CO2+R
(4)
O2+2H+2e→H2O2
(5)

注:反应体系,CoFe2O4浓度0.067 g·L-1;电解,外电压-0.6 V;光解,UV照射;光电催化体系,-0.6 V,UV照射;非均相光电类Fenton体系,外电压-0.6 V、CoFe2O4浓度0.067 g·L-1、UV照射
图4 不同反应体系对0.2 mM·L-12,4-二氯酚待降解液的处理效果
3.2 不同反应因素对2,4-二氯酚降解效果的影响
(1)pH值。
在2,4-二氯酚的浓度为0.2 mmol·L-1、Na2SO4浓度为0.05 mol·L-1、外电压-0.6 V、CoFe2O4浓度为0.067 g·L-1以及UV照射下,图5a表示2,4-二氯酚的去除率随溶液的初始pH值变化的影响。首先用高浓度的碱液或酸液调节溶液的pH值。由图5a可以看出:当pH为3.0,同等条件下 2,4-二氯酚的去除率达81.7%。这是因为当溶液酸性越强,H+浓度越大,提高了H2O2生成量(反应(5)),最终能生成更多的·OH,因而可以提高2,4-二氯酚降解效率。当继续增大溶液初始pH时,2,4-二氯酚的降解效率较之前明显降低。这是因为当pH值较高时,溶液中 H2O2的生成受到抑制,类Fenton技术不在对溶液的降解起到促进作用,因此,试验中溶液的初始pH确定为3.0。
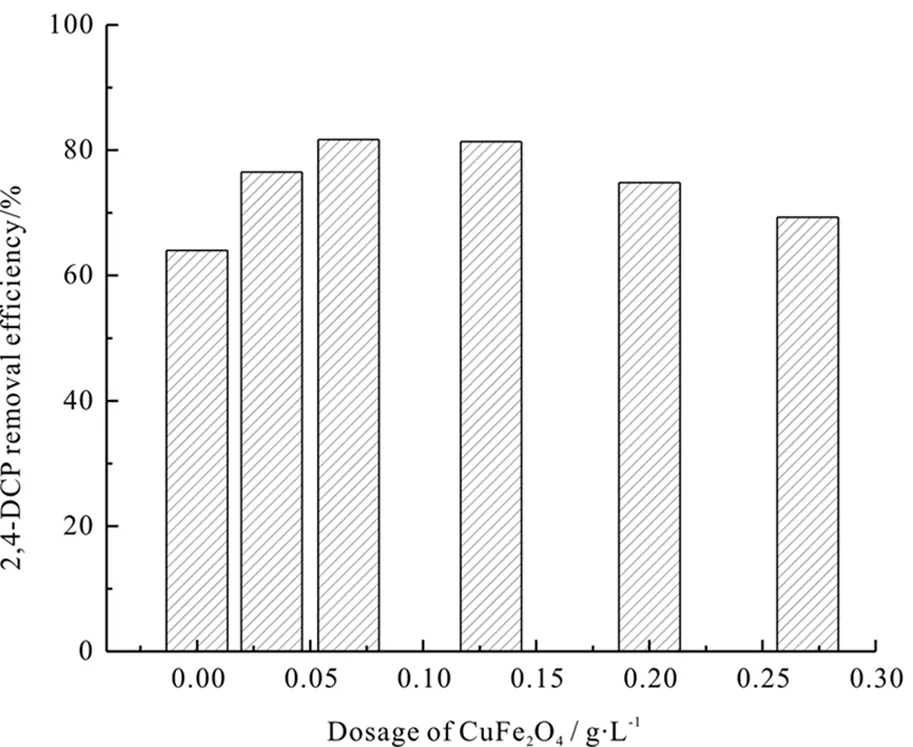
(2)催化剂投加量。
在2,4-二氯酚浓度为0.2 mmol·L-1、外电压-0.6 V、Na2SO4浓度为0.05 mol·L-1、pH为3.0以及UV照射条件下,图5b显示了催化剂的投加量对2,4-二氯酚去除率的影响。当CoFe2O4的投加量为0g·L-1,只有单独的光电催化作用对2,4-二氯酚的去除效果不佳,因为在单独的光电催化体系中·OH(反应2)只能由阴极生成的H2O2在UV作用下分解生成。但当在反应中投加催化剂CoFe2O4时,对2,4-二氯酚的降解效率明显的较之前有所提升。其主要原因是当在体系中投加CoFe2O4后,在催化剂的作用下加速了H2O2分解,有较多的·OH生成,因而提升了2,4-二氯酚的处理效率。当催化剂的投加量超过0.067 g·L-1时,2,4-二氯酚的去除率不升反降。这是因为投加过量的催化剂CoFe2O4溶液浑浊,紫外光的透光率降低。因此,在本实验中催化剂CoFe2O4投加量最终确定为0.067 g·L-1。

(a) pH值
(b)催化剂CoFe2O4投加量

(c)外电压

(d)Na2SO4的浓度
(e)2,4-二氯酚初始浓度
(3)外电压。
在2,4-二氯酚初始浓度为0.2 mmol·L-1、CoFe2O4为0.067 g·L-1、Na2SO4为0.05 mol·L-1、pH为3.0以及UV照射条件下,图5c显示外电压对2,4-二氯酚降解效果的影响。由图5c可以看出,2,4-二氯酚的去除率随着外电压增大的变化大致分为两个阶段,首先当外电压从-0.3 V增大到-0.8 V时,2,4-二氯酚的去除率呈现上升的趋势,这可能是因为外电压增大有利于H2O2的生成,从而提升了2,4-二氯酚的处理效果;但当外电压继续增至-1.1V时,2,4-二氯酚的去除率不升反降,因为体系中的溶解氧得电子生成氢氧根,同时H2O2得到电子生成H2O反应(6),反应(7),体系中H2O2的产率降低,·OH的生成总量也受到了影响,2,4-二氯酚降解率降低。因此,最终确定的最佳外加电压为-0.8 V。
O2+4H++4e→6H2O
(6)
H2O2+2H++2e→2H2O
(7)
(4)电解质浓度。
图5d是2,4-二氯酚的去除率随Na2SO4的浓度变化的影响。当2,4-二氯酚初始浓度0.2 mmol·L-1、外电压-0.8 V、CoFe2O4为0.067 g·L-1、pH 3.0以及UV照射时。由图5d可看出,当Na2SO4浓度由0.01 mol·L-1增至0.05 mol·L-1时,2,4-二氯酚的去除效果随Na2SO4浓度的升高而呈现增大的趋势,这主要是因为电极的反应速度受到溶液中离子浓度的影响。电解质浓度与电极反应速率成正相关,当电解质浓度增大时,阴极产生的H2O2量也在随之加大,从而提高了2,4-二氯酚的降解率。当Na2SO4浓度由0.05 mol·L-1增至0.10 mol·L-1时,2,4-二氯酚的去除率几乎没有太大的变化。可以断定当Na2SO4的浓度在0.05~0.10 mol·L-1时,电极反应速率保持稳定。由此,本次试验Na2SO4的反应浓度最终确定为0.05 mol·L-1。
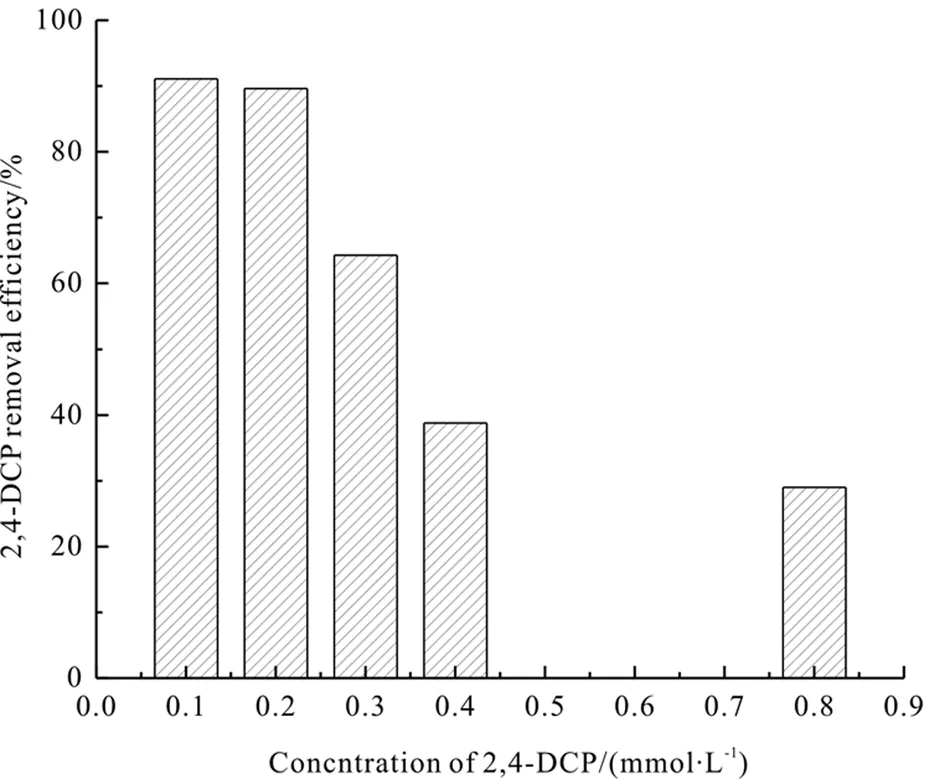
(5)待降解溶液初始浓度。
图5e在外电压-0.8 V、Na2SO4浓度为0.05 mol·L-1、pH 3.0、UV照射及催化剂投加量为0.067 g·L-1条件下,不同初始浓度的待降解溶液(2,4-二氯酚)对其降解效果影响。由图5e可知,当2,4-二氯酚的浓度由0.1 mM·L-1增至0.8 mM·L-1时,2,4-二氯酚的降解率由91.1%降至29%。导致这一结果的原因可能是当增大2,4-二氯酚浓度时,吸附到CoFe2O4表面的2,4-二氯酚的量也随之增多,CoFe2O4催化性能减弱。因此,2,4-二氯酚的初始浓度的大小与其处理效果呈现负相关。
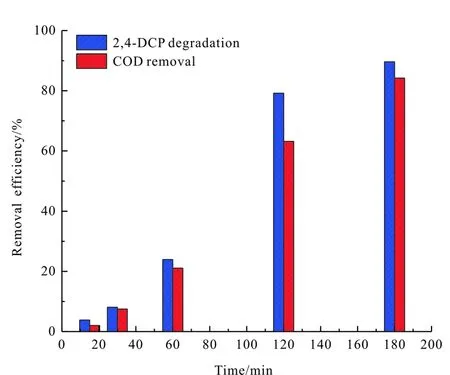
图6 光电类Fenton技术降解2,4-二氯酚过程中COD变化分析
3.3 COD去除分析
COD的分析研究是衡量有机物降解过程中矿化度的一个重要的指标,随着2,4-二氯酚降解,COD去除情况如图6所示。由图6可知,2,4-二氯酚降解率高于COD,180 min后,COD和2,4-二氯酚去除率分别为84.2%和89.6%。由此可知,2,4-二氯酚在降解的过程中,绝大多数量的2,4-二氯酚被降解,并最终以CO2和H2O的形式存在。
3.4 CoFe2O4稳定性分析
催化剂稳定性是衡量污染物降解的一个重要因素。在0.2 mmol·L-12,4-二氯酚,0.05 mol·L-1Na2SO4,外电压-0.8 V,0.067 g·L-1浓度CoFe2O4,pH为3.0,UV照射下,CoFe2O4经过5次循环利用后,结果见图7。从图7中及有关数据显示,整个过程每一次对2,4-二氯酚降解率较上一次有所减小,同时,Fe3+浓度为0.632 mg·L-1,铁的损失为2.0%。这说明影响2,4-二氯酚降解率的降低的原因是CoFe2O4中铁的流失。此外在整个试验体系前后2,4-二氯酚降解率几乎无太大差别,这表明CoFe2O4性能较为稳定。

图7 催化剂重复使用时对2,4-二氯酚的处理效果
14 小结
以纳米CoFe2O4为催化剂,通过非均相光电类Fenton技术使得2,4-二氯酚被有效降解。在最佳反应体系中对2,4-二氯酚的处理率可达到89.6%,并且CoFe2O4可以被多次重复高效利用。本文实验表明,以CoFe2O4为催化剂的非均相光电类Fenton法能有效降解污染物质,本文试验验证了采用非均相光电类Fenton技术可有效的处理难降解污染物。
[1]Liu L,Chen F,Yang F,et al.Photocatalytic degradation of 2,4-dichlorophenol using nanoscale Fe/TiO2[J].Chemical Engineering Journal,2012,181-182:189-195.
[2]Liu H,Xia T,Shon H K,et al.Preparation of titania-containing photocatalysts from metallurgical slag waste and photodegradation of 2,4-dichlorophenol[J].Journal of Industrial and Engineering Chemistry,2011,17(3): 461-467.
[3]Jia J,Zhang S,Wang P,et al.Degradation of high concentration 2,4-dichlorophenol by simultaneous photocatalytic-enzymatic process using TiO2/UV and laccase[J].Journal of Hazardous Materials.2012,205-206:150-155.
[4]Wang S,Liu X,Zhang H,et al.Aerobic granulation for 2,4-dichlorophenol biodegradation in a sequencing batch reactor[J].Chemosphere,2007,69(5): 769-775.
[5]Sponza D T,Uluköy A.Kinetic of carbonaceous substrate in an upflow anaerobic sludge sludge blanket (UASB) reactor treating 2,4-dichlorophenol (2,4-DCP)[J].Journal of Environmental Managementk,2008,86(1): 121-131.
[6]Karci A,Arslan-Alaton I,Olmez-Hanci T,et al.Transformation of 2,4-dichlorophenol by H2O2/UV-C,Fenton and photo-Fenton processes:Oxidation products and toxicity evolution[J].Journal of Photochemistry and Photobiology A:Chemistry,2012,230(1): 65-73.
[7]Xu L,Wang J.Fenton-like degradation of 2,4-dichlorophenol using Fe3O4magnetic nanoparticles[J].Applied Catalysis B:Environmental,2012,123-124:117-126.
[8]Chu Y,Wang W,Wang M.Anodic oxidation process for the degradation of 2,4-dichlorophenol in aqueous solution and the enhancement of biodegradability[J].Journal of Hazardous Materials,2010,180(1-3): 247-252.
[9]Chen J,Wang J,Wu C,et al.Electrocatalytic degradation of 2,4-dichlorophenol by granular graphite electrodes[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2011,379(1-3): 163-168.
[10]Babuponnusami A,Muthukumar K.Advanced oxidation of phenol A comparison between Fenton,electro-Fenton,sono-electro-Fenton and photo-electro-Fenton processes[J].Chemical Engineering Journal.2012,183: 1-9.
[11]Sirés I,Arias C,Cabot P L,et al.Degradation of clofibric acid in acidic aqueous medium by electro-Fenton and photoelectro-Fenton[J].Chemosphere,2007,66(9): 1660-1669.
[12]Brillas E,Baos M,Skoumal M,et al.Degradation of the herbicide 2,4-DP by anodic oxidation,electro-Fenton and photoelectro-Fenton using platinum and boron-doped diamond anodes[J].Chemosphere,2007,68(2):199-209.
[13]Exposito E,Sanchez-Sanchez C M,Montiel V.Mineral iron oxides as iron source in electro-Fenton and photoelectro-fenton mineralization processes[J].Journal of the Electrochemical Society,2007,154(8):E116-E122.
[14]Matta R,Hanna K,Chiron S.Fenton-like oxidation of 2,4,6-trinitrotoluene using different iron minerals[J].Science of The Total Environment,2007,385(1-3):242-251.
[15]Guo L,Chen F,Fan X,et al.S-doped α-Fe2O3as a highly active heterogeneous Fenton-like catalyst towards the degradation of acid orange 7 and phenol[J].Applied Catalysis B:Environmental,2010,96(1-2):162-168.
[16]刘栓,赵小蓉,陈登霞,等.Fe3O4@Graphite电极中性条件下电Fenton降解有机污染物[J].环境化学,2010,29(5):819-824.
[17]杨士建,何宏平,吴大清,等.钛磁铁矿异相Fenton法对亚甲基蓝模拟废水的脱色研究[J].环境化学,2009,28(5):697-701.
[18]张钰,何燕,邹彩琼,等.铁锰矿类Fenton异相光催化降解有毒有机染料[J].环境化学,2010,29(6):1032-1037.
[19]Zhang Y Y,Deng J H,He C,et al.Application of Fe2V4O13as a new multi-metal heterogeneous Fenton-like catalyst for the degradation of organic pollutants[J].Environmental technology,2010,31(2):145-154.
[20]Deng J,Jiang J,Zhang Y,et al.FeVO4as a highly active heterogeneous Fenton-like catalyst towards the degradation of Orange II[J].Applied Catalysis B: Environmental,2008,84(3-4):468-473.
[21]Guimaraes I R,Giroto A,Oliveira L C A,et al.Synthesis and thermal treatment of cu-doped goethite:Oxidation of quinoline through heterogeneous fenton process[J].Applied Catalysis B: Environmental,2009,91(3-4):581-586.
[22]Pham A L,Lee C,Doyle F M,et al.A Silica-Supported Iron Oxide Catalyst Capable of Activating Hydrogen Peroxide at Neutral pH Values[J].Environmental Science & Technology,2009,43(23):8930-8935.
[23]Fernandez J,Bandara J,Lopez A,et al.Efficient photo-assisted Fenton catalysis mediated by Fe irons on Nafion membranes active in the abatement of non-biodegradable azo-dye[J].Chemical Communications,1998,14:1493-1494.
[24]Guélou E,Barrault J,Fournier J,et al.Active iron species in the catalytic wet peroxide oxidation of phenol over pillared clays containing iron[J].Applied Catalysis B: Environmental,2003,44(1):1-8.
[25]Catrinescu C,Teodosiu C,Macoveanu M,et al.Catalytic wet peroxide oxidation of phenol over Fe-exchanged pillared beidellite[J].Water Research,2003,37(5):1154-1160.
[26]杨泼,胡晓斌,陈泓哲,等.树脂负载α-FeOOH异相光Fenton降解水中己烷雌酚[J].环境化学,2012,31(8):1131-1136.
[27]Oturan M A,Pimentel M,Oturan N,et al.Reaction sequence for the mineralization of the short-chain carboxylic acids usually formed upon cleavage of aromatics during electrochemical Fenton treatment[J].J Electrochim Acta,2008,54(2):173-182.
[28]Daneshvar N,Aber S,Vatanpour V,et al.Electro-Fenton treatment of dye solution containing Orange II:Influence of operational parameters[J].Journal of Electroanalytical Chemistry,2008,615(2):165-174.
[29]国家环境保护总局.水和废水监测分析方法第4版[M].北京:中国环境科学出版社,2002.
Research on Heterogeneous Photoelectro-Fenton like process with CoFe2O4Nanoparticles as Catalyst in degradation of 2,4-Dichlorophenol
LIU Pan1,2,FANG Bing3,WANG Xian-li2,WU Jun-feng2,GUO Yi-fei2,ZHU Xin-feng2,KANG Hai-yan2,SONG Feng-ming2
(1.CollegeofChemistryandMolecularEngineering,ZhengzhouUniversity,Zhengzhou450001,China;2.CollegeofMunicipalandEnvironmentalEngineering,HenanUniversityofUrbanConstruction,Pingdingshan467036; 3.PingdingshanQingyuanSewagePurificationCo.,Ltd.,Pingdingshan467000,China.)
The CoFe2O4has been synthesized using a co-precipitation process used as optoelectronic heterogeneous catalysts in the degradation of 2,4-Dichlorophenol.The as-prepared samples have been characterized by transmission electron microscope (TEM),X-ray fluorescence analysis (XRF),X-ray diffraction analysis (XRD) and BET surface area.These results indicate that the removal efficiency is up to 89.6% after 180 min on the optimum condition of 0.2 mM·L-12,4-Dichlorophenol,0.05 mol·L-1Na2SO4,the electrical potential -0.8V,pH=3,0.067g·L-1CoFe2O4and UV irradiation.Furthermore,the results also demonstrated that the CoFe2O4has excellent stability.
photoelectro-Fenton;CoFe2O4;2,4-Dichlorophenol
2016-01-09
河南省教育厅科学技术研究重点项目(14B610012);河南城建学院青年骨干教师资助项目
刘 盼(1989—),女,宁夏固原人,硕士研究生。
吴俊峰(1981—),男,河南焦作人,博士,副教授。
1674-7046(2016)02-0080-08
10.14140/j.cnki.hncjxb.2016.02.015
X703
A
