均匀设计优化超声协同酶法提取平菇多糖工艺
2016-11-15朱彩平胡昌耀
张 晓 朱彩平 邓 红 张 扬 胡昌耀
(陕西师范大学食品工程与营养科学学院,陕西 西安 710119)
均匀设计优化超声协同酶法提取平菇多糖工艺
张 晓 朱彩平 邓 红 张 扬 胡昌耀
(陕西师范大学食品工程与营养科学学院,陕西 西安 710119)
利用均匀设计法对超声波辅助纤维素酶提取平菇多糖的工艺进行优化。选取pH值、提取温度、液料比、加酶量、酶解时间、超声功率及超声时间7个因素进行单因素试验,在单因素试验的基础之上选择各个因素的较优水平,按照U18(95×62)的混合均匀设计进行试验,考察各因素及其交互作用对平菇多糖得率的影响,预测和验证最佳工艺参数。结果表明:超声波辅助纤维素酶提取平菇多糖的最佳工艺为:超声功率120 W,提取温度25 ℃,液料比22∶1 (mL/g),pH 7.5,加酶量0.5%,酶解时间6 min,超声时间69 min。在该条件下,平菇多糖得率为(36.71±0.46)%,该方法提取平菇多糖工艺简单可行,得率高。
平菇;多糖;超声波辅助提取;纤维素酶
多糖(polysaccharides)及其复合物普遍存在于高等动、植物细胞膜及微生物细胞壁中,是由10个以上的单糖通过糖苷键连接形成的含醛基或酮基的天然高分子聚合物,其与蛋白质、核酸、脂类构成了最基本的4类生命物质,对维持生命活动起着至关重要的作用,而且具有抗肿瘤、抗病毒、抗氧化、降血糖、免疫调节等多种生物活性[1-3]。平菇(Pleurotusostreatus)又名侧耳,是广泛栽培的食用菌之一[4]。平菇多糖(PleurotusostreatusPolysaccaride, POP)是从平菇中提取出的一种重要成分,近年来也被证实具有多种生理功效,如增强免疫、抗肿瘤、抗炎、抗氧化、减轻及治疗消化器官溃疡等[5-8]。
目前,平菇多糖的提取方法主要有热水浸提法[9]14、微波法[10]、超声波法[4]和酶法[11]。使用热水浸提法提取平菇多糖,简单易行、成本低廉,但是这种方法需要热水长时间作用,且多糖得率低,此外,大量的提取溶剂也为后续的浓缩过程增加工作量。微波辅助提取可在短时间内迅速提高组织细胞的温度和压力至细胞破裂,使细胞内含物释放至溶剂中,具有提取率高、节能省时的优点[9]2;但是,有试验[12]结果表明,微波辅助提取的多糖提取率、抗氧化特性和相对分子质量均呈现降低趋势,且随着时间的延伸,相对分子质量逐步降低。超声波具有“空化现象”、“机械振动”及“热效应”等特性,可破碎被提取原料的细胞壁,加速目标提取物的溶出并进一步强化溶出成分的扩散,提高破碎速度,从而极大地提高提取效率,节约提取成本,提高得率[13-15]。酶解法具有反应条件温和、不易破坏食用菌多糖立体结构和生物活性、提取率高等优点[16],但是提取时间较长,能量消耗大。由于平菇多糖通常被包裹在平菇细胞壁内,因此本试验拟将超声波法和纤维素酶法两种技术同时应用于平菇多糖的提取,并使用混合水平均匀设计的试验方法,优化超声波辅助纤维素酶提取平菇多糖的工艺,以期获得快速、高效且反应条件温和的提取工艺。
1 材料与方法
1.1 材料
平菇子实体:渭南地区市售。
1.2 试剂
纤维素酶:β-1,4-葡聚糖葡糖苷水解酶9012-54-8,酶活3 000万 U/g,上海蓝季科技发展有限公司;
无水乙醇:分析纯,天津市天力化学试剂有限公司。
1.3 仪器
数显鼓风干燥箱:GZX-9146型,上海博讯实业有限公司医疗设备厂;
摇摆式高速万能粉碎机:DFY-300型,温岭市林大机械有限公司;
分析天平:BS 224 S型,北京赛多利斯仪器系统有限公司;
实验室pH计:PHSJ-3F型,上海仪电科学仪器股份有限公司;
数控超声清洗器:KQ5200DE型,昆山市超声仪器有限公司;
恒温振荡器:THZ-C型,太仓市实验设备厂(苏州培英实验设备有限公司);
电热恒温水浴锅:HH-S4型,北京科伟永兴仪器有限公司;
低速大容量离心机:D.L-4C型,上海安亭科学仪器厂;
循环水式多用真空泵:SHN-III型,郑州长城科工贸有限公司;
旋转蒸发器:RE-52AA型,上海亚荣生化仪器厂。
1.4 试验方法
1.4.1 平菇干粉制备 市售平菇,选取子实体部分,50 ℃烘干,粉碎,过60目筛得干粉,备用。
1.4.2 平菇多糖的提取工艺
平菇干粉→加蒸馏水→调整pH值→超声波处理→酶解→沸水浴灭酶→冷却→离心(4 000 r/min, 20 min)→得上清液,并对沉淀物进行二次提取→合并上清液→在50 ℃下旋蒸浓缩→85%乙醇沉淀→真空抽滤→沉淀→50 ℃干燥至恒重→平菇粗多糖
1.4.3 单因素试验 选择7个因素,即pH值、提取温度、液料比、加酶量、酶解时间、超声功率及超声时间进行单因素试验,以蒸馏水为提取液,分别考察各个单因素对多糖得率的影响。
(1) pH值对平菇多糖得率的影响:设定液料比30∶1 (mL/g)、加酶量2.0%、酶解时间60 min、提取温度55 ℃、超声时间60 min、超声功率180 W,考察pH值(3.0,3.5,4.0,4.5,5.0,5.5,6.0,6.5)对平菇多糖得率的影响。
(2) 提取温度对平菇多糖得率的影响:设定液料比30∶1 (mL/g)、pH值5.0、加酶量2.0%、酶解时间60 min、超声时间60 min、超声功率180 W,考察温度 (15,25,35,45,55,65 ℃)对平菇多糖得率的影响。
(3) 液料比对平菇多糖得率的影响:设定pH值5.0、加酶量2.0%、提取温度35 ℃、酶解时间60 min、超声时间60 min、超声功率180 W,考察液料比(10∶1,20∶1,30∶1,40∶1,50∶1,60∶1,70∶1 mL/g)对平菇多糖得率的影响。
(4) 加酶量对平菇多糖得率的影响:设定pH值5.0、提取温度35 ℃、液料比30∶1 (mL/g)、酶解时间60 min、超声时间60 min、超声功率180 W,考察加酶量(0.1%,0.2%,0.3%,0.4%,0.5%,0.6%,0.7%)对平菇多糖得率的影响。
(5) 酶解时间对平菇多糖得率的影响:设定pH值5.0、提取温度35 ℃、液料比30∶1 (mL/g)、加酶量0.5%、超声时间60 min、超声功率180 W,考察酶解时间(0,5,10,15,20,25,30,35 min)对平菇多糖得率的影响。
(6) 超声功率对平菇多糖得率的影响:设定pH值5.0、提取温度35 ℃、液料比30∶1 (mL/g)、加酶量0.5%、酶解时间10 min、超声时间60 min,考察超声功率(100,120,140,160,180,200 W)对平菇多糖得率的影响。
(7) 超声时间对平菇多糖得率的影响:设定pH值5.0、提取温度35 ℃、液料比30∶1 (mL/g)、加酶量0.5%、酶解时间10 min、超声功率140 W,考察超声时间(5,20,35,50,65,80,95 min)对平菇多糖得率的影响。
1.4.4 均匀设计试验 根据单因素试验结果,进行混合水平均匀设计试验,得出超声波辅助纤维素酶提取平菇多糖的最佳工艺。
1.4.5 平菇多糖的得率 按式(1)进行计算:
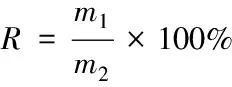
(1)
式中:
R——平菇多糖的得率,%;
m1——平菇粗多糖的质量,g;
m2——平菇干粉的质量,g。
1.4.6 试验统计与分析 使用Excel 2010版对单因素试验进行分析,DPS 12.01版对U18(95×62)混合水平均匀设计试验进行分析处理。
2 结果与分析
2.1 单因素试验
2.1.1 pH值对平菇多糖得率的影响 由图1可知,当pH<5.0时,平菇多糖的得率随着pH值的增大而提高,在pH=5.0时,平菇多糖得率达到最大值,这是因为不同的pH值对所加入的纤维素酶产生了不同的影响,过酸不利于酶活性的发挥,在此变化过程中纤维素酶的活性由弱到强,至5.0时达到其最适酸碱度因而活性最强。当pH>5.0时,平菇多糖的得率随着pH值的增大而减小,是由于过碱的外部环境亦不利于酶活性作用的发挥,外部环境酸碱度逐渐偏离其最适pH值,导致得率逐渐降低。所以,提取液的pH值不能过于偏离本试验所加入纤维素酶的最适酸碱度,否则不利于纤维素酶发挥活性作用分解平菇组织中的纤维素,辅助多糖溶出,导致得率降低。因此,pH值以5.0为宜。
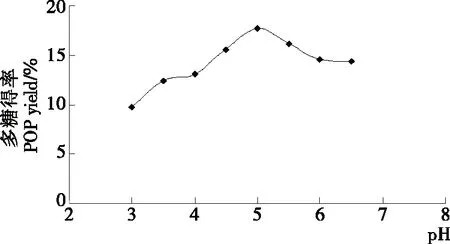
图1 pH值对平菇多糖得率的影响
2.1.2 提取温度对平菇多糖得率的影响 由图2可知,在一定温度范围内,平菇多糖得率随温度的升高而升高,至35 ℃时得率达到最大值。这主要是由于不同的温度对纤维素酶发挥其活性作用产生了不同程度的影响,温度过低,不利于纤维素酶发挥其活性作用;随着温度不断升高至其最适温度,纤维素酶的活性不断增大,而35 ℃基本接近于纤维素酶的最适温度。当提取温度继续升高时,多糖得率逐渐降低,这是由于温度过高也会破坏酶的活性,甚至会导致酶失活。从35 ℃到55 ℃,得率降低比较缓慢,这是因为在此范围内的温度变化对酶的影响较小;而从55 ℃到65 ℃,得率降低趋势明显,这是因为65 ℃已经接近于灭活温度,使酶的活性急剧降低。因此,提取温度以35 ℃为宜。
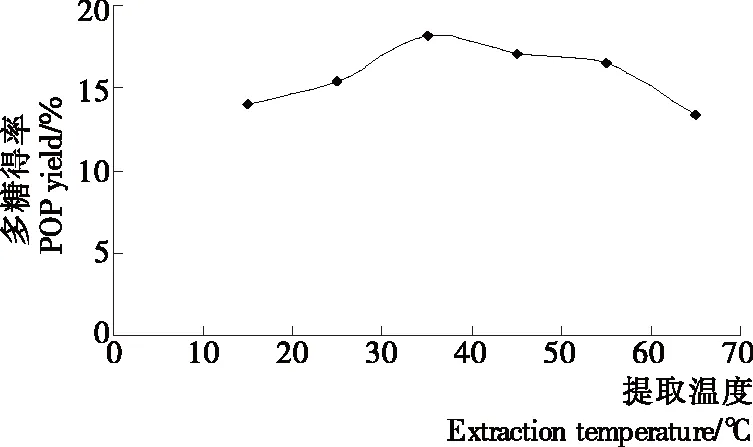
图2 提取温度对平菇多糖得率的影响
2.1.3 液料比对平菇多糖得率的影响 由图3可知,液料比从10∶1 (mL/g)增加到30∶1 (mL/g)时,平菇多糖得率随着提取液比例的增大而增大,当液料比为30∶1 (mL/g)时多糖得率达到最大,这是因为提取液所占比例由小变大时,溶剂与浸提物的接触变得更加充分,能够在相同的时间内溶出更多的水溶性多糖,使得率增大;当液料比达到30∶1 (mL/g)时,多糖溶解基本饱和。之后,随着提取液比例的增大多糖得率减小,由于提取液体积继续变大,会消耗更多的时间和能量,同时也会增加超声波穿透介质(即提取液)粉碎细胞的阻力,使得细胞被粉碎程度下降,从而降低有效成分的得率[3]。因此,液料比以30∶1 (mL/g)为宜。
2.1.4 加酶量对平菇多糖得率的影响 由图4可知,加酶量从0.1%增加至0.5%,平菇多糖得率逐渐增大,至0.5%时多糖得率达到最大值,这是因为纤维素酶可以破坏细胞壁,辅助多糖溶出,具有高效性,随着酶量加大,平菇细胞壁被愈加充分地分解,得率提高,当加酶量达到0.5%时,底物浓度正好饱和,得率最高。加酶量从0.5%增至0.7%,多糖得率逐渐降低,可能是酶的高效性使多糖更加迅速溶出,而溶出的多糖在超声的过程中结构被破坏,以及加酶量过高出现反馈抑制。因此,加酶量以0.5%为宜。
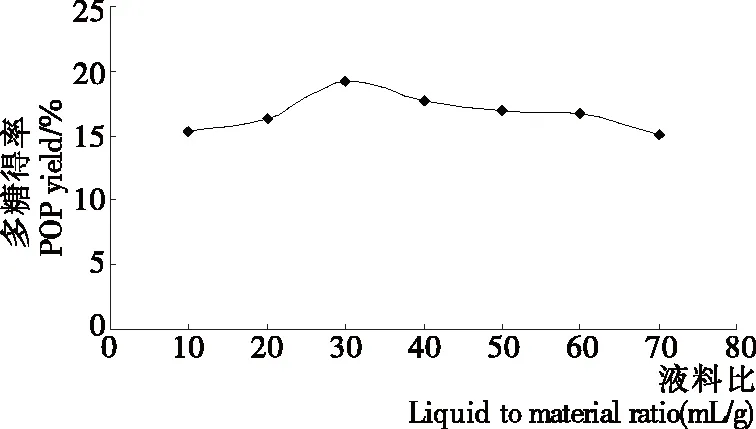
图3 液料比对平菇多糖得率的影响
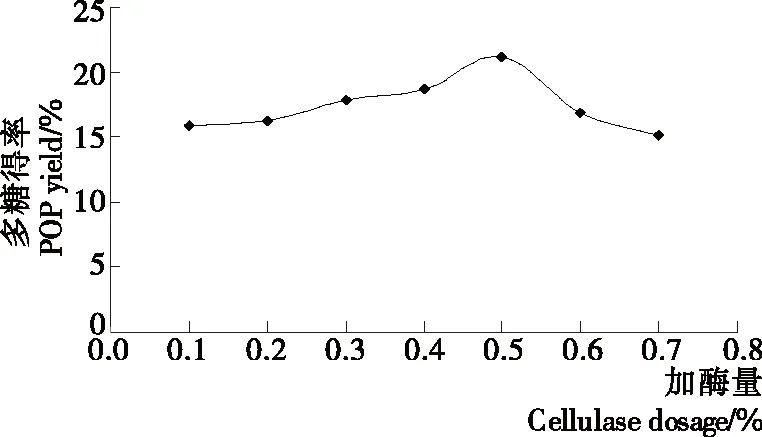
图4 加酶量对平菇多糖得率的影响
2.1.5 酶解时间对平菇多糖得率的影响 由图5可知,随着酶解时间的延长平菇多糖的得率逐渐提高,至10 min时平菇多糖得率最大,原因是随着酶解时间的延长,纤维素酶与平菇细胞壁的作用更加充分,细胞壁被破坏的程度更加彻底,平菇细胞组织内水溶性多糖更容易溶出,得率随之提高;酶解时间延长至10 min时多糖得率达到最大值。之后,平菇多糖得率随着酶解时间的继续延长而逐渐降低,这是由于随着酶解时间的继续延长,已经溶出的部分多糖在超声波机械剪切作用下结构被破坏。因此,酶解时间以10 min为宜。
2.1.6 超声功率对平菇多糖得率的影响 由图6可知,在100~140 W时,平菇多糖得率随超声功率的增大逐渐提高,这是因为随着超声功率的增大,超声波对平菇细胞壁的破坏作用逐渐增强,细胞内水溶性多糖的溶出更加彻底,得率也随之提高;当超声功率达到140 W时,多糖得率达到最大值;而在超声功率从140 W增至200 W的过程中,平菇多糖得率逐渐降低,可能的原因主要有两方面:① 超声功率过大,超声波产生的机械剪切力过强,导致多糖结构遭到破坏;② 当超声功率大于140 W时,超声作用进一步加速了提取液的流动,从而减少了物料在超声场中的有效停留时间,破壁作用也随之减弱[3]。因此,超声功率以140 W为宜。
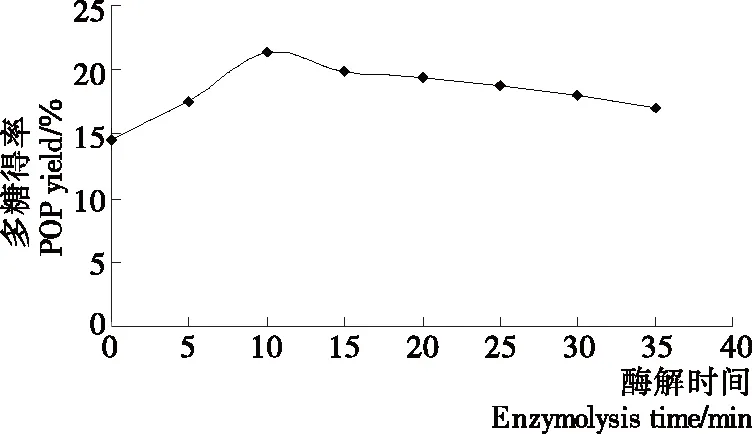
图5 酶解时间对平菇多糖得率的影响
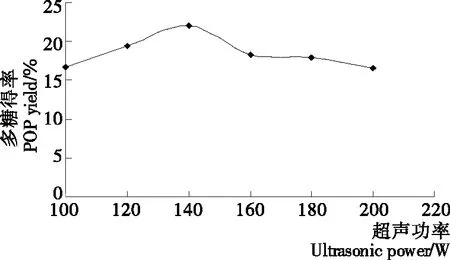
图6 超声功率对平菇多糖得率的影响
2.1.7 超声时间对平菇多糖得率的影响 由图7可知,在一定时间范围内,平菇多糖得率随着超声时间的增大而提高;当超声时间达到50 min时,多糖得率达到最大值;之后,随着超声时间的继续延长,平菇多糖的得率缓慢降低。这是因为刚开始时,提取液中不含多糖,随着超声的进行和超声时间的延长,超声波不断破坏平菇的细胞壁,平菇细胞中的水溶性多糖逐渐溶出,进入提取液中;超声时间为50 min时,细胞内多糖得到相当充分的溶出,多糖得率最大;之后,随着超声时间的继续延长,已经溶出的多糖持续地暴露在超声波产生的机械剪切力之下,部分多糖结构被破坏,所以多糖得率有所下降。因此,超声时间以50 min为宜。
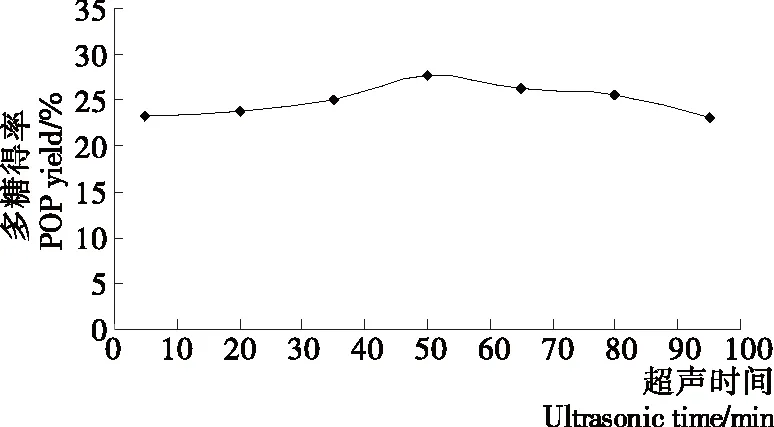
图7 超声时间对平菇多糖得率的影响
2.2 均匀设计试验
2.2.1 均匀设计 根据单因素试验结果,选择超声功率、提取温度、液料比、pH、加酶量、酶解时间及超声时间7个因素的较优水平,按照U18(95×62)设计进行混合水平均匀试验,因素与水平表见表1。
2.2.2 均匀试验结果及分析 采用DPS 12.01数据处理系统优化试验数据点,降低数据点的中心偏差和相关性,从而提高拟合数据的准确度。按照优化之后的数据点,每次提取平菇干粉5.0 g。混合均匀试验结果见表2。
采用DPS 12.01版数据处理系统对试验结果进行分析,并采用多因子及互作项逐步回归的方法对试验模型进行拟合,得拟合方程:
y=-19.423 7-0.522 5X2+6.629 4X4+13.275 2X5+0.935 9X7+0.002 7X1X2-0.027 5X1X5-0.002 4X1X7-0.018 4X2X4+0.010 2X2X5+0.000 8X2X7+0.000 5X3X4-0.805 8X4X5+0.019 6X4X6-0.04X4X7-0.089X5X7-0.003 2X6X7。
(2)
复相关系数R=0.999 999,决定系数R2=0.999 998,剩余标准差SSE=0.001 2,调整相关系数Ra=0.999 983,调整决定系数Ra2=0.999 966。说明所得方程可以较好地拟合平菇多糖提取过程,方程有意义。
由表3可知:提取温度、pH、加酶量及超声时间对平菇多糖得率具有极显著影响;超声功率、液料比和超声时间对得率的影响不显著,超声功率分别与提取温度、加酶量、超声时间的交互作用、液料比与pH的交互作用、酶解时间与超声时间的交互作用对平菇多糖得率的影响均有极显著差异;此外,提取温度分别与pH、加酶量、超声时间的交互作用,pH分别与加酶量、酶解时间、超声时间的交互作用,加酶量与酶解时间的交互作用对得率的影响具有极显著差异。
同时,由DPS 12.01版数据处理系统得到最优因素组合:超声功率107.43 W,提取温度25.38 ℃,液料比22.12∶1 (mL/g),pH值7.5,加酶量0.5%,酶解时间5.13 min,超声时间68.99 min。
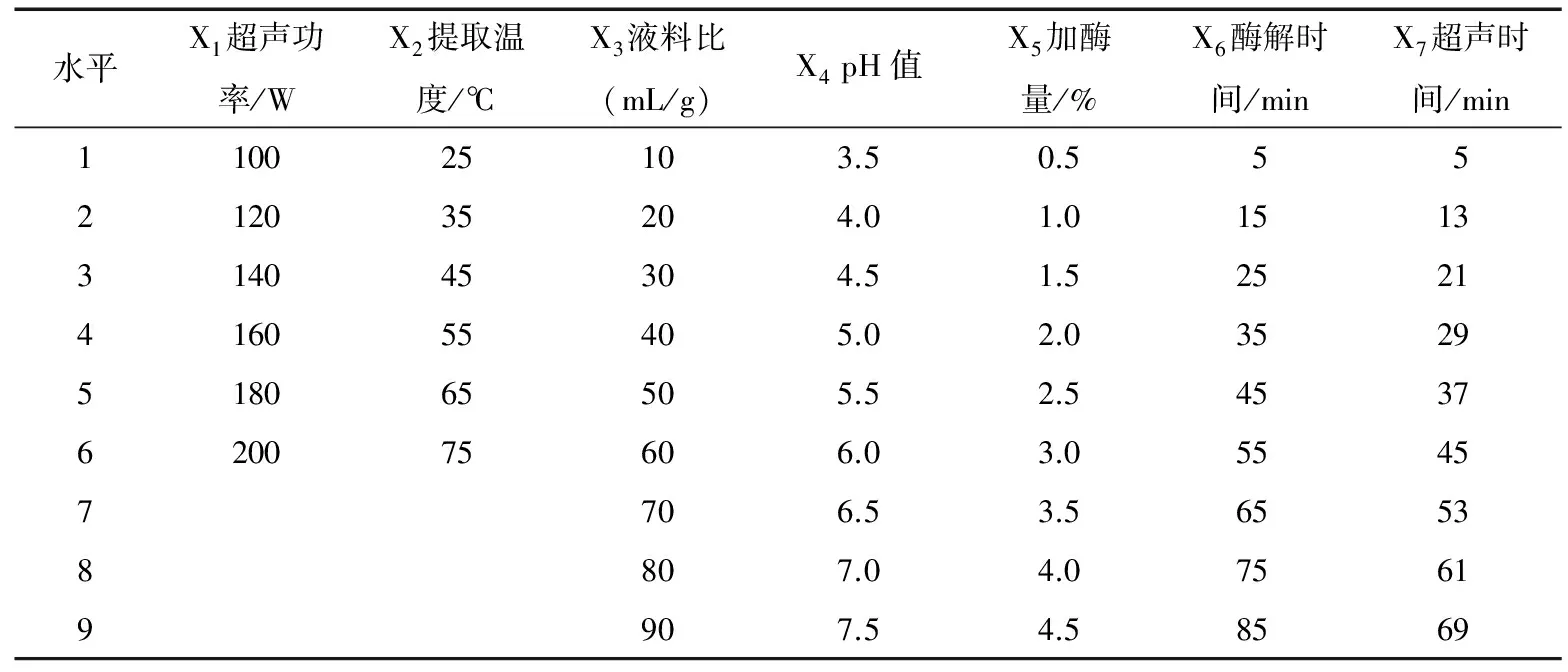
表1 混合水平均匀设计试验因素与水平表
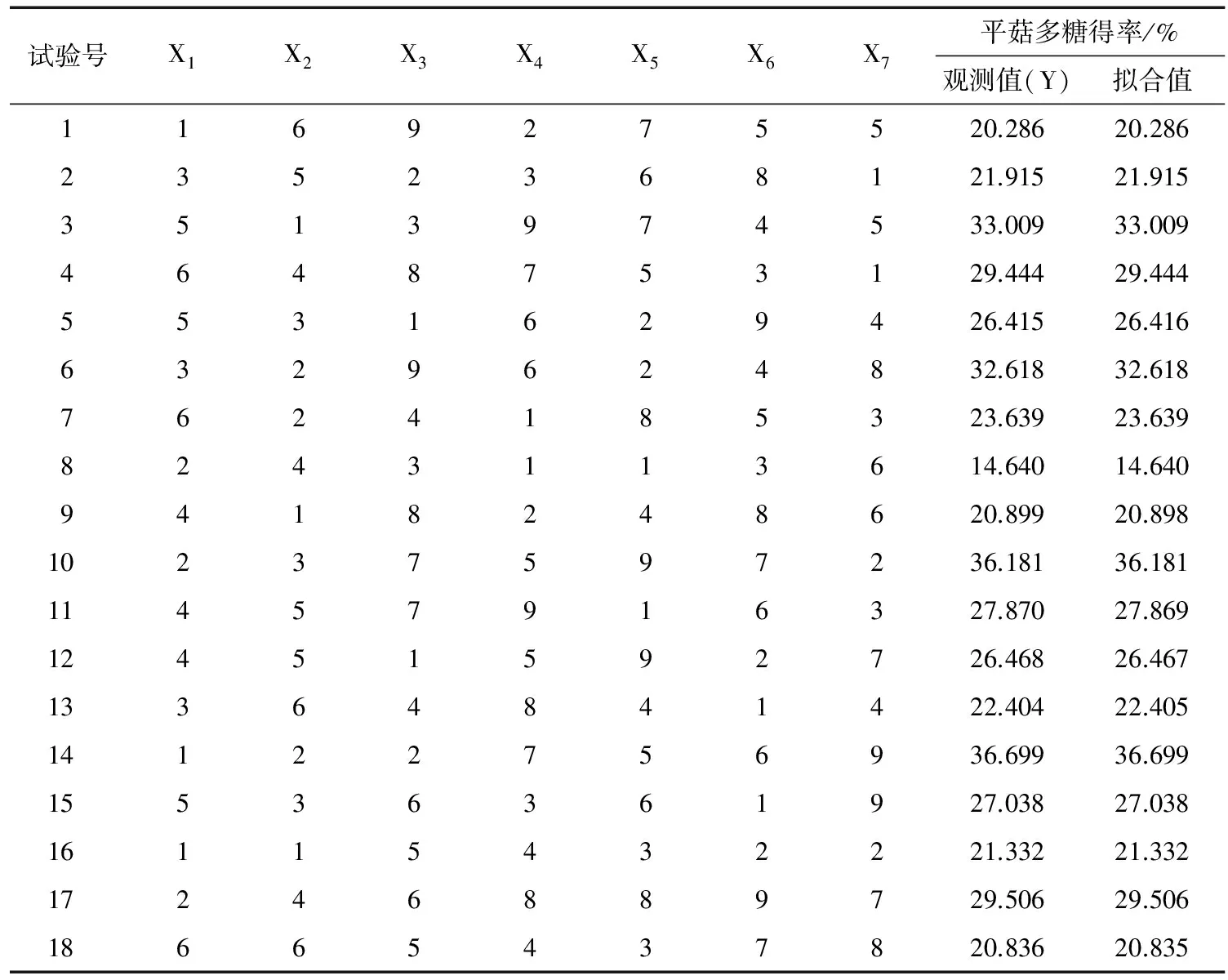
表2 混合水平均匀设计试验方案及试验结果
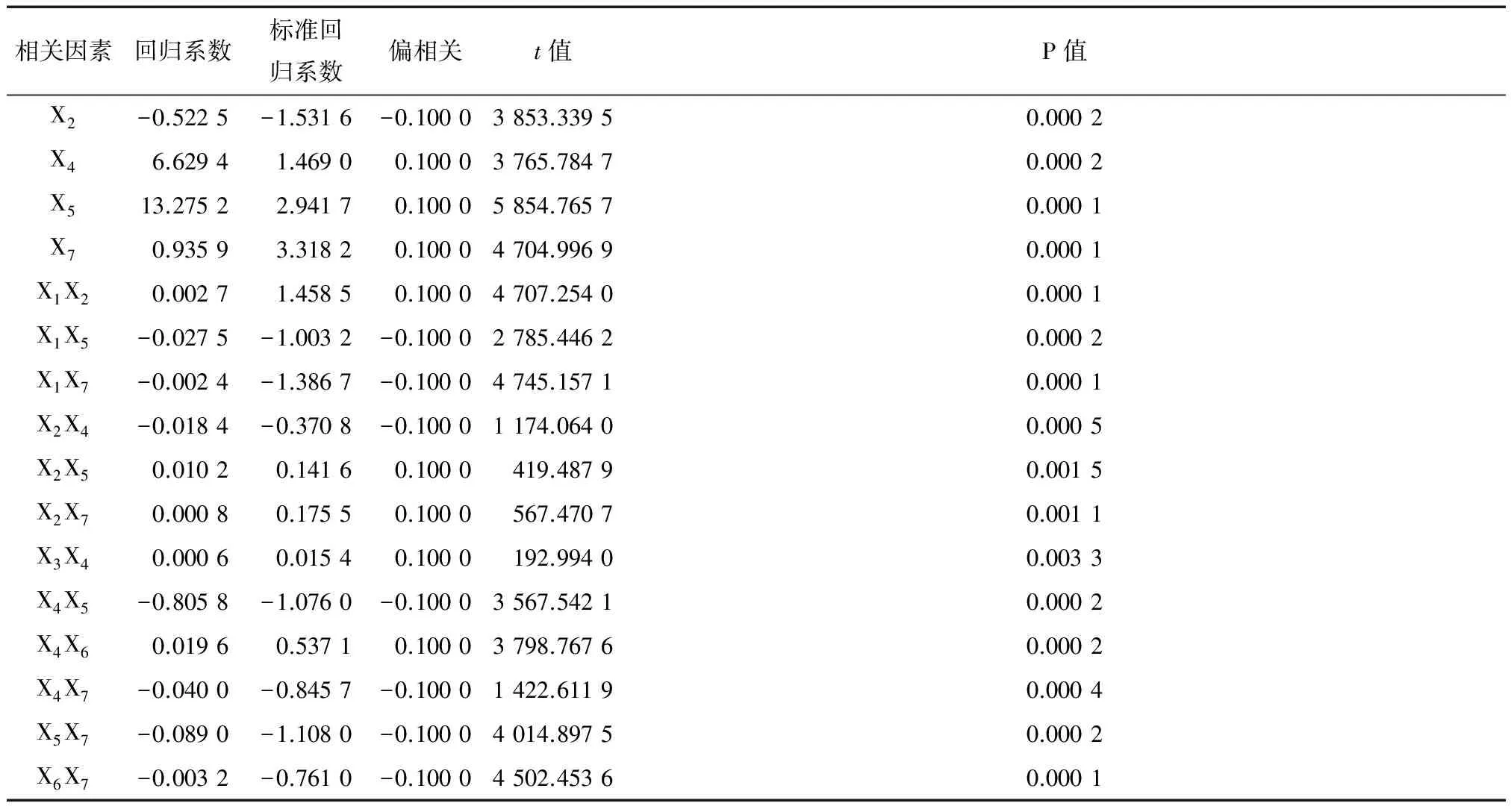
表3 数据模型因素的相关性分析
2.2.3 最佳工艺的确定及验证 以DPS 12.01版数据处理系统给出的最优因素组合为基础,结合单因素试验结果,为方便实际操作将最佳工艺参数调整如下:超声功率120 W,提取温度25 ℃,液料比22∶1 (mL/g),pH 7.5,加酶量0.5%,酶解时间6 min,超声时间69 min。按照如上条件,进行3次验证实验,平菇多糖的得率为(36.71±0.46)%。可知,本试验所得得平菇多糖提取工艺简单可行,得率高。
2.3 不同提取方法的比较
将平菇多糖的不同提取方法进行比较(见表4)可发现,超声波协同酶法提取平菇多糖,得率大幅度提高;提取时间较单纯超声提取和单纯酶法提取稍长,但与热水浸提相比大为缩短;液料比接近其它方法的一半,可大幅减少提取液的消耗,缩短浓缩时间,减少污水排放;提取温度为室温25 ℃,不用加热,可减少能源消耗。由此可见,超声波协同酶法提取平菇多糖,可提高提取得率,减少原料消耗,缩短提取时间,降低能耗。
3 结论
本试验以混合水平均匀试验结果为基础,结合单因素试验结果,得到超声波辅助纤维素酶法提取平菇多糖的最佳工艺条件:超声功率120 W,提取温度25 ℃,液料比22∶1(mL/g),pH 7.5,加酶量0.5%,酶解时间6 min,超声时间69 min,平菇多糖的平均得率为36.71%。与传统方法相比,本试验方法不仅大幅提高了多糖得率,缩短了提取时间,还节能减排,可为平菇多糖的开发利用及其工业化生产提供参考。
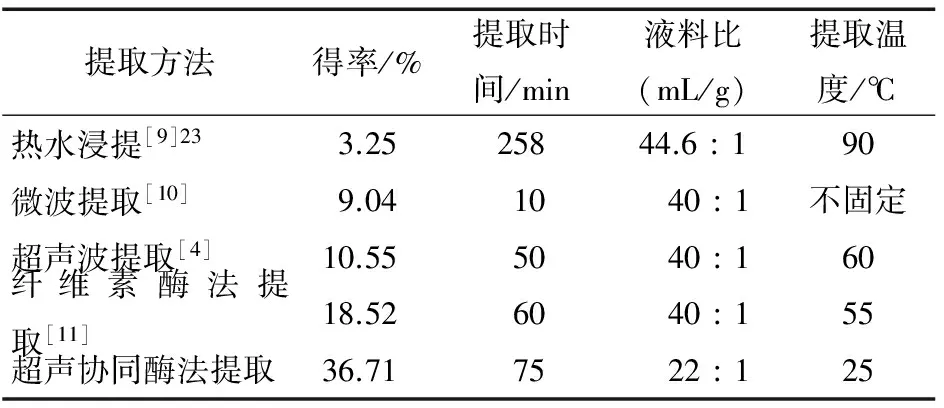
表4 不同提取方法之间的比较
本研究提供了一种平菇多糖超声协同酶法辅助提取的高效方法,但该方法所得平菇多糖的纯化、结构鉴定及其生物活性还有待进一步研究。
[1] LOWE J B, MARTH J D. A genetic approach to Mammalian glycan function[J]. Annual Review of Biochemistry, 2003, 72(1): 643-691.
[2] 林俊, 李萍, 陈靠山. 近5年多糖抗肿瘤活性研究进展[J]. 中国中药杂志, 2013, 38(8): 1 116-1 125.
[3] 薛菁, 吴晓彤, 王颖超, 等. 超声波辅助提取口蘑菌丝体多糖工艺优化[J]. 食品与机械, 2016, 32(1): 172-174.
[4] 朱彩平, 李波. 超声波辅助提取平菇多糖的工艺研究[J]. 中药材, 2009, 32(10): 1 620-1 622.
[5] BAO Xing-feng, WANG Xue-song, DONG Qun, et al. Structural features of immunologically active polysaccharides from Ganoderma lucidum[J]. Phytochemistry, 2002, 59(2): 175-181.
[6] CARBONERO E R, GRACHER A H P, KOMURA D L, et al. Lentinus edodes heterogalactan: Antinociceptive and anti-inflammatory effects[J]. Food Chemistry, 2008, 111(3): 531-537.
[7] WASSER S. Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides[J]. Applied Microbiology & Biotechnology, 2002, 60(3): 258-274.
[8] YANG Qi, HUANG Bo, LI Hui-yan, et al. Gastroprotective activities of a polysaccharide from the fruiting bodies of Pleurotus ostreatus in rats[J]. International Journal of Biological Macromolecules, 2012, 50(5): 1 224-1 228.
[9] 王金玺. 平菇多糖分离纯化、结构表征与修饰及抗氧化性的研究[D]. 扬州: 扬州大学, 2013.
[10] 朱彩平, 高贵田, 李建科, 等. 相应曲面法优化微波辅助提取平菇多糖工艺研究[J]. 食品科学, 2010, 31(4): 68-72.
[11] 朱彩平, 惠乐乐, 柳小林, 等. 酶法提取平菇多糖工艺研究[J]. 中成药, 2011, 33(8): 1 435-1 438.
[12] 常双艳, 蓝炎阳, 王少峰. 多糖提取纯化方法及其生物活性研究进展[J]. 福建热作科技, 2013, 38(4): 34-38.
[13] 王亚飞, 毕红梅. 超声波法提取香菇多糖的研究[J]. 内蒙古科技与经济, 2004(S1): 124-125.
[14] 曹雁平, 刘佐才. 植物成分超声浸取研究现状[J]. 化工进展, 2005, 24(11): 1 249-1 252.
[15] 郭丹钊, 郑威, 马海乐, 等. 超声波辅助提取樟芝菌丝体活性物质的工艺研究[J]. 食品与机械, 2016, 32(1): 158-161, 178.
[16] 张立娟, 于国萍, 周国华. 黑木耳多糖酶法提取条件的研究[J]. 食品研究与开发, 2005, 26(3): 89-91.
Optimization of ultrasonic assisted cellulase extraction process of Pleurotus ostreatus polysaccharide by uniform design
ZHANG XiaoZHUCai-pingDENGHong李 云LIYunZHANGYangHUChang-yao
(CollegeofFoodEngineeringandNutritionalScience,ShaanxiNormalUniversity,Xi’an,Shaanxi710119,China)
The Ultraction-cellulase synergistic extraction process ofpleurotusostreatuspolysaccharide(POP) was optimized by uniform design method. Extraction temperature, pH, solvent/material ratio, cellulase dosage, enzymolysis time, ultrasonic power and ultrasonic time were selected to carry out the single factor tests. According to the experimental results, better levels of these factors were chosen to implement the U18(95×62) mixed uniform design experiment to optimize the technology. The effects of the seven single factors as well as their interactions on the POP yield were investigated. The optimal process parameters were predicted and verified by using regression analysis. The optimal extraction conditions of POP were concluded as follows, i. e. extracting at 25 ℃, solvent/material ratio 22, pH 7.5, using 0.5% cellulase, enzymolyzed for 6 min, and ultrasonically treated for 69 min with 120 W. Under these conditions, the yield of the POP was up to (36.71±0.46) %. This optimized extraction process was feasible and effective.
pleurotus ostreatus; polysaccharide; ultrasonic assisted extraction; cellulase
国家自然科学基金项目(编号:31301598);陕西省自然科学基金项目(编号:2012JQ3014);中央高校基本科研业务费专项资金项目(编号:GK201402042);国家留学基金项目(编号:201406875010)
张晓,女,陕西师范大学在读硕士研究生。
朱彩平(1979-),女,陕西师范大学副教授,博士。
E-mail:zcaiping@snnu.edu.cn
2016-03-28
