地顶孢霉培养物对奶牛粗饲料瘤胃降解参数和微生物区系的影响
2016-11-15张幸怡张广宁王一臻徐宏建张永根
李 洋 张幸怡 张广宁 王一臻 林 聪 徐宏建 姜 鑫 刘 帅 张永根
(东北农业大学动物科学技术学院,哈尔滨150030)
地顶孢霉培养物对奶牛粗饲料瘤胃降解参数和微生物区系的影响
李洋张幸怡张广宁王一臻林聪徐宏建姜鑫刘帅张永根*
(东北农业大学动物科学技术学院,哈尔滨150030)
本试验旨在研究地顶孢霉培养物(ATC)对奶牛粗饲料瘤胃降解参数和微生物区系的影响。试验选用体重650 kg左右、装有永久性瘤胃瘘管的健康荷斯坦奶牛3头,采用3×3拉丁方试验设计分组。对照组饲喂基础饲粮,试验组饲喂在基础饲粮中分别添加15(低剂量组)和30 g/(d·头)ATC的试验饲粮(高剂量组);试验共3期,每期27 d,其中预试期15 d,正试期12 d。测定羊草、玉米青贮、苜蓿的瘤胃降解参数和瘤胃微生物区系的变化。结果表明:1)与对照组相比,高剂量组能够显著提高玉米青贮干物质的有效降解率和慢速降解部分的降解速率(P<0.05);高剂量组羊草、玉米青贮、苜蓿中性洗涤纤维的有效降解率均显著高于其他2组(P<0.05),羊草中性洗涤纤维的慢速降解部分的降解速率和苜蓿中性洗涤纤维的可降解部分含量均显著高于其他2组(P<0.05);与对照组相比,高剂量组显著提高了玉米青贮粗蛋白质的有效降解率和快速降解部分含量(P<0.05),试验组显著提高了苜蓿粗蛋白质的有效降解率(P<0.05),高剂量组显著提高了羊草粗蛋白质的慢速降解部分和可降解部分含量(P<0.05),但并没有提高有效降解率(P>0.05)。2)与对照组相比,高剂量组显著提高了瘤胃中原虫数量及黄色瘤胃球菌、白色瘤胃球菌和普雷沃氏菌的相对含量(P<0.05),试验组显著提高了反刍兽新月单胞菌的相对含量(P<0.05),但高剂量组显著降低了产琥珀酸丝状杆菌的相对含量(P<0.05)。因此,本试验条件下,ATC能够调节奶牛部分瘤胃微生物的菌群数量并提高粗饲料的瘤胃降解率,其中以30 g/(d·头)添加量为宜。
地顶孢霉培养物;奶牛;粗饲料;瘤胃降解率;微生物区系
粗饲料是反刍动物的重要饲料来源,其最主要的营养作用是满足反刍动物对纤维素的需求[1]。瘤胃微生物通过对粗饲料的充分利用来维持自身能量需要,同时,粗饲料经瘤胃微生物发酵产生挥发性脂肪酸,为动物机体供能。此外,粗饲料对维持动物健康,促进反刍动物消化吸收功能,维持瘤胃内环境稳定等都具有重要作用[2]。因此,通过营养或非营养调控等措施提高粗饲料的利用效率,对改善植物资源利用现状,提高奶牛生产性能,乃至缓解我国优质粗饲料短缺的基本国情都具有非常重要的意义。
粗饲料中纤维类物质含量较高且消化率低,导致了反刍动物对粗饲料的充分利用受到了限制。而通过补充营养物质或外源添加剂来调控瘤胃微生物区系的生长,从而促进反刍动物对粗饲料的利用,提高粗饲料的利用率和营养价值被认为是一种行之有效的方法[2-4]。古尼虫草是我国稀有的中药材,其药理成分与冬虫夏草生药相似,具有免疫调节,抗炎镇痛等功效[5-6]。古尼虫草中功能性成分(虫草酸、虫草素和虫草多糖等)使其具有优秀的药理作用,但昂贵的价格限制了其在动物生产中的应用和发展。地顶孢霉培养物(Acremoniumterricolaculture,ATC)是由从古尼虫草分离的地顶孢霉菌经人工发酵而得到的产品,拥有虫草素、虫草酸、多糖、甾醇和氨基酸等功能性成分,可被用于天然古尼虫草的替代物质。据证明,添加地顶孢霉培养物能够提高仔猪增重[7],提高蛋鸭的体重和产蛋率,改善蛋品质[8]。国外也有报道与地顶孢霉培养物具有相同功能性成分的蛹虫草菌丝能够增加瘤胃体外产气量和挥发性脂肪酸产量,提高滤纸纤维素的降解率[9],调节部分瘤胃纤维降解菌数量[10],提高纤维酶活性[11],从而改善瘤胃内环境和发酵状态。以上研究证明,由于功能性成分的相同或类似,地顶孢霉培养物具有调节瘤胃微生物区系的潜力和提高粗饲料的降解率的可能性。但目前,地顶孢霉培养物的添加对反刍动物瘤胃发酵是否有积极作用,尤其对奶牛粗饲料降解以及体内微生物区系的影响效果未见试验报道。本研究通过在装有瘘管的奶牛饲粮中添加地顶孢霉培养物探索其对奶牛常用粗饲料的瘤胃降解参数和微生物区系的影响作用,为开发地顶孢霉培养物为奶牛瘤胃发酵有效调控剂提供参考依据。
1 材料与方法
1.1试验材料
地顶孢霉培养物购自合肥迈可罗生物工程有限公司。地顶孢霉培养物是由古尼虫草中提取的地顶孢霉菌经沙氏葡萄糖琼脂(SDAY)培养基斜面培养、察氏液体培养基培养和发酵罐人工发酵等3级发酵法得到的灭活的虫草类真菌饲料添加剂,含有26.84%粗蛋白质(CP)、5.00%粗纤维(CF)、3.06%粗脂肪(EE)、4.04%粗灰分(ash)和61.06%无氮浸出物(NFE)[干物质(DM)基础]。其中功能性成分含量分别是:虫草酸84.50 g/kg、虫草多糖44.60 g/kg、虫草素0.432 g/kg、甾醇0.597 g/kg、总氨基酸218.1 g/kg。
1.2试验设计
试验采用3×3拉丁方试验设计,选用3头体重600 kg左右,装有永久性瘤胃瘘管的健康荷斯坦奶牛。奶牛自由饮水,每天07:00和19:00饲喂基础饲粮,其组成及营养水平见表1。试验处理包括:对照组,基础饲粮组(不含添加剂);低剂量组,基础饲粮+15 g/(d·头)ATC;高剂量组,基础饲粮+30 g/(d·头)ATC。试验共3期,每期27 d,其中预试期15 d,正试期12 d。在预试期晨饲前,将ATC与100 g左右的基础饲粮进行混合,预先饲喂给奶牛,待奶牛完全采食后,继续饲喂其他基础饲粮,以保证奶牛对ATC的完全采食[12]。
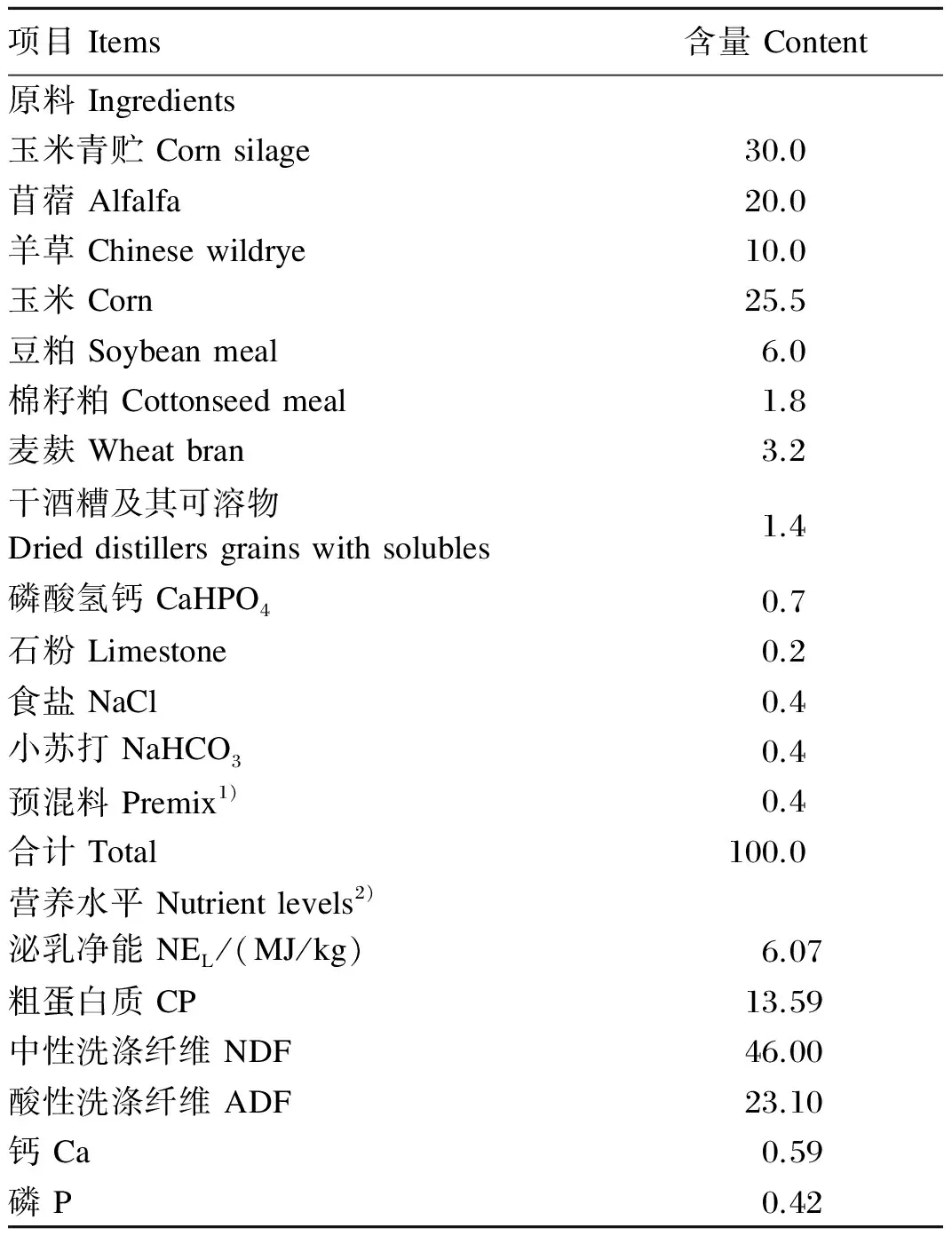
表1 基础饲粮组成及营养水平(干物质基础)
1)预混料为每千克饲粮提供 Premix provided the following per kg of the diet:Mn 3 500 mg,Fe 1 600 mg,Zn 10 000 mg,Cu 1 500 mg,I 120 mg,Se 80 mg,Co 50 mg,VA 800 000 IU,VD 700 000 IU,VE 10 000 IU。
2)泌乳净能为计算值[13],其余均为实测值。NELwas a calculated value[13], while the others were measured values.
1.3试验方法
1.3.1营养水平的测定
根据AOAC(2000)[14]的方法进行干物质(AOAC,930.15)、粗蛋白质(AOAC,976.05)、粗灰分(AOAC,942.05)、钙和磷含量(AOAC,935.13)的测定。粗纤维和粗脂肪含量的测定根据《饲料分析及饲料质量检测技术》[15]。中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量根据Van Soest的方法,采用纤维分析仪(Ankom200,美国安康公司)进行测定[16]。虫草酸、虫草素、虫草多糖和甾醇含量采用高效液相色谱法(高效液相色谱仪型号model-8800,日本HITACHI公司)进行测定[17]。氨基酸含量采用全自动氨基酸分析仪(model-8900,日本HITACHI公司)进行测定。
1.3.2瘤胃降解率的测定
于正试期,采用体内尼龙袋法测定各组对奶牛对3种粗饲料(羊草、玉米青贮、苜蓿)的瘤胃降解率[18],3期各组按相同顺序投放待测粗饲料,确保每期每组都测定3种粗饲料。选择300目尼龙布制成10 cm×20 cm的尼龙袋,准确称取7 g粗饲料样品于尼龙袋内,样本容量与表面积比为17.5 mg/cm2。粗饲料的培养时间分别是0、4、8、12、24、36、48、72 h,每个样本的各时间点尼龙袋的数目依次是2、2、3、4、4、4、6、6和6个(随着时间点的推移,消失率的提高,增加尼龙袋数目,以满足后续样本量的要求),。培养后,将尼龙袋从瘤胃内取出,同0 h尼龙袋一起置于冷水下冲洗终止发酵并洗净瘤胃内容物,洗至水清为止。洗净后,所有尼龙袋在65 ℃下干燥48 h。干燥的样品粉碎过1 mm筛,4 ℃保存待测。
参照Ørskov等[19]提出的瘤胃动力学计算模型计算粗饲料的瘤胃降解率,公式如下:
Y=a+b(1-e-ct)。
式中:Y为尼龙袋在瘤胃中滞留t(h)时间后的饲料某一营养成分的降解率(%);a为快速降解部分(%);b为慢速降解部分(%);c为慢速降解部分的降解速率(%/h)。下式同。
有效降解率的计算公式如下:
ED=a+[b×c/(c+k)]。
式中:ED为有效降解率(%);k为待测饲料的瘤胃外流速度常数(%/h),本试验中粗饲料的k值被假设为0.04%/h[13]。
1.3.3瘤胃原虫计数
在正试期最后2 d,于晨饲后0、2、4、6、8和10 h从瘤胃不同位点采集瘤胃内容物,立即用4层纱布过滤,收集瘤胃液用于瘤胃原虫计数[1]。瘤胃原虫数量的测定采用的是Ogimoto等[20]描述的方法。取0.5 mL瘤胃液加入2 mL甲基绿-甲醛-盐溶液(35%的福尔马林100 mL,氯化钠8.0 g,甲基绿0.6 g,溶于900 mL蒸馏水中)轻轻振荡,混匀。混合后静止5 min,滴入0.3 mm的血球计数板中,通过显微镜确定原虫数量,同一个样品重复3次,结果取平均值。原虫数量计算公式如下:
原虫数量(个/mL)=(A/5)×B×104×C。
式中:A为计数板5个计数方格中的原虫数量;B为计数方格数;C为稀释倍数。
1.3.4瘤胃菌群相对含量的测定
在正试期最后2 d,于晨饲后0、2、4、6、8和10 h于瘤胃内多点收集瘤胃内容物,4层纱布过滤后收集瘤胃液[21-22],用于瘤胃细菌数量的检测。瘤胃液中的总DNA提取采用的是珠磨-十六烷基三甲基溴化铵(CTAB)法[23]。风干后的总DNA溶于TE缓冲液后,于-20 ℃待测。用紫外可见分光光度计测定所提取的总DNA的浓度和纯度,确保OD260 nm与OD280 nm比值在1.6~1.8之间。通过荧光定量PCR的方法对瘤胃液中的总菌、普雷沃氏菌(Prevotella)、黄色瘤胃球菌(Ruminococcusflavefaciens)、白色瘤胃球菌(Ruminococcusalbus)、产琥珀酸丝状杆菌(Fibrobactersuccinogenes)和反刍兽新月单胞菌(Selenomonasruminantium)的相对含量进行检测,引物参考Khafipour等[24]报道的序列,序列见表2。荧光定量PCR所用仪器为ABI 7500型荧光定量PCR仪,Real-time PCR SYBR Green Ⅰ RT-PCR试剂盒购自大连宝生物公司。荧光定量PCR扩增反应程序为:95 ℃变性7 min,55 ℃ 1 min,72 ℃ 3 min,35个循环;72℃延伸7 min。
根据测得的阈值循环(Ct),计算目标菌的相对含量,公式如下:
目标菌相对含量(%)=2-(Ct目标菌-Ct总菌)×100[25]。
1.4数据统计
按照3×3拉丁方试验设计,数据采用SAS 9.1.2软件包中的PROC MIXED程序进行分析。模型如下:
Yijk=μ+Ti+Pj+Ck+Eijk。
式中:Yijk为因变量值;μ为总体平均值;Ti为处理(i=1,2,3);Pj为试验期(j=1,2,3);Ck为试验牛(k=1,2,3);Eijk为残差。P<0.05为差异显著,结果用平均值和标准误(SEM)的形式表示。

表2 荧光定量PCR引物序列
2 结果与分析
2.1地顶孢霉培养物对不同粗饲料干物质瘤胃降解参数的影响
由表3可知,ATC提高了玉米青贮干物质的慢速降解部分的降解速率和有效降解率。与对照组相比,高剂量组的慢速降解部分的降解速率显著升高(P<0.05);对照组和低剂量组的有效降解率间比较差异不显著(P>0.05),但显著低于高剂量组(P<0.05)。ATC对羊草和苜蓿的干物质瘤胃降解参数没有显著影响(P>0.05)。
2.2地顶孢霉培养物对不同粗饲料NDF瘤胃降解参数的影响
由表4可知,ATC提高了羊草、玉米青贮和苜蓿NDF的有效降解率。高剂量组NDF的有效降解率显著高于对照组和低剂量组(P<0.05),而对照组和低剂量组间差异不显著(P>0.05)。与对照组相比,高剂量组显著提高了羊草的慢速降解部分降解速率和苜蓿的可降解部分含量(P<0.05)。ATC对3种粗饲料的其他瘤胃降解参数没有显著影响(P>0.05)。
2.3地顶孢霉培养物对不同粗饲料粗蛋白质瘤胃降解参数的影响
由表5可知,ATC提高了玉米青贮和苜蓿粗蛋白质的有效降解率、玉米青贮粗蛋白质的快速降解部分含量、苜蓿粗蛋白质的慢速降解部分的降解速率。高剂量组玉米青贮的粗蛋白质有效降解率显著高于另外2组(P<0.05),但另外2组间差异不显著(P>0.05)。苜蓿的粗蛋白质有效降解率,3组间差异均显著(P<0.05),对照组最低,高剂量组最高。与对照组相比,高剂量组的羊草粗蛋白质的慢速降解部分和可降解部分含量均显著高于其他组(P<0.05),低剂量组的慢速降解部分含量最低,且显著低于其他组(P<0.05)。高剂量组玉米青贮粗蛋白质的快速降解部分含量显著高于对照组和低剂量组(P<0.05),且这2组间差异不显著(P>0.05)。低剂量组苜蓿粗蛋白质的慢速降解部分的降解速率显著高于其他2组(P<0.05),且其他2组间差异不显著(P>0.05)。
2.4地顶孢霉培养物对瘤胃微生物区系的影响
由表6可知,ATC提高了瘤胃中原虫数量以及黄色瘤胃球菌、白色瘤胃球菌、普雷沃氏菌和反刍兽新月单胞菌的相对含量,降低了产琥珀酸丝状杆菌相对含量。高剂量组的瘤胃中原虫数量显著高于其他2组(P<0.05),但其他2组间差异不显著(P>0.05)。高剂量组瘤胃中黄色瘤胃球菌、白色瘤胃球菌、普雷沃氏菌的相对含量显著高于其他2组(P<0.05),反刍兽新月单胞菌相对含量显著高于对照组(P<0.05),产琥珀酸丝状杆菌的相对含量显著低于对照组(P<0.05)。低剂量组的反刍兽新月单胞菌的相对含量也显著高于对照组(P<0.05),且与高剂量组差异不显著(P>0.05)。
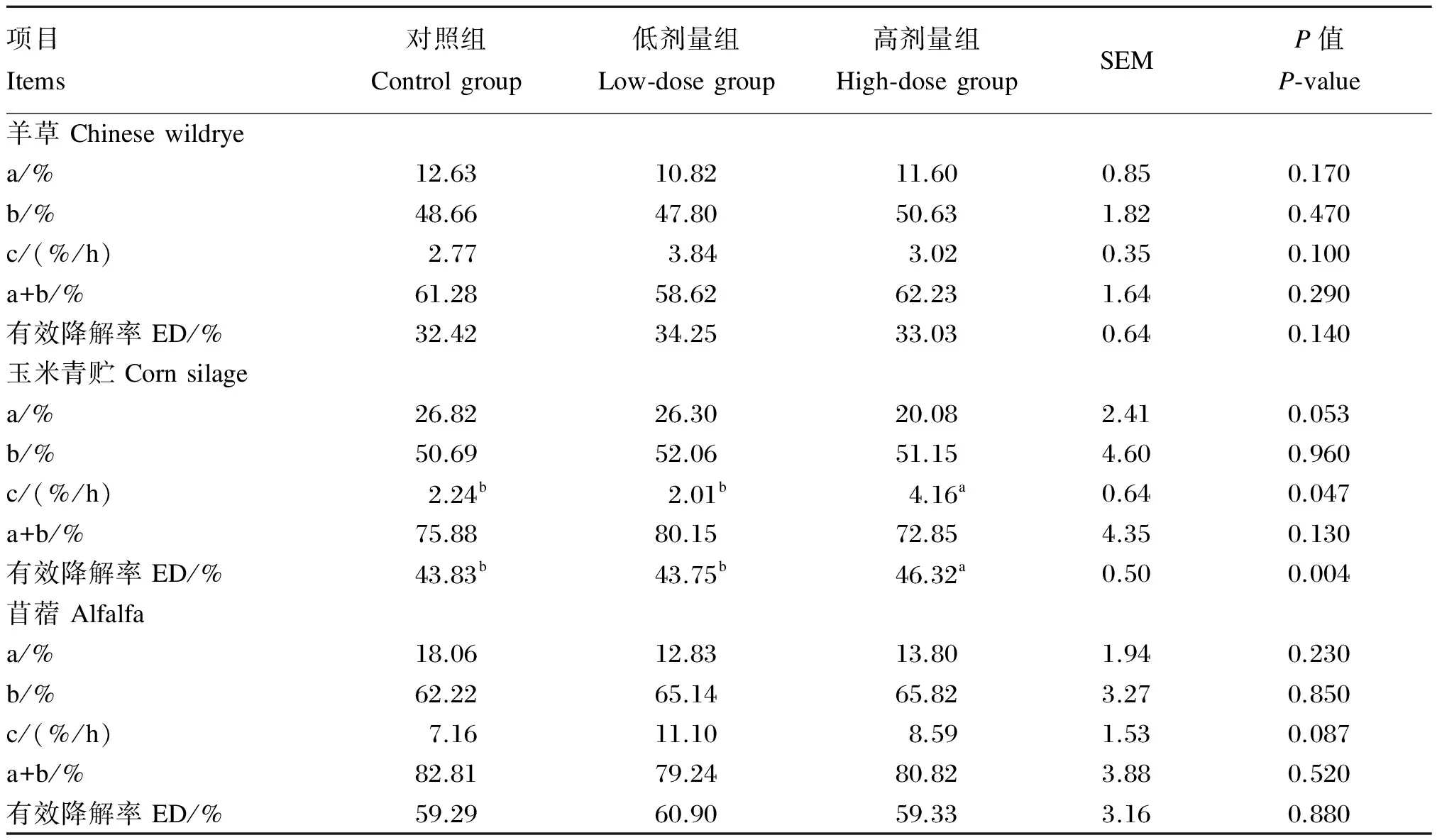
表3 地顶孢霉培养物对不同粗饲料干物质瘤胃降解参数的影响
a为快速降解部分,b为慢速降解部分,c为慢速降解部分的降解速率,a+b为可降解部分。同行数据肩标不同小写字母表示差异显著(P<0.05),相同或无字母表示差异不显著(P>0.05)。下表同。
a was the fraction of immediately degraded, b was the fraction of slowly degraded, c was degradation rate of fraction of slowly degraded, and a+b was the degradable fraction. Values in the same row with different small letter superscripts mean significant difference (P<0.05), and with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
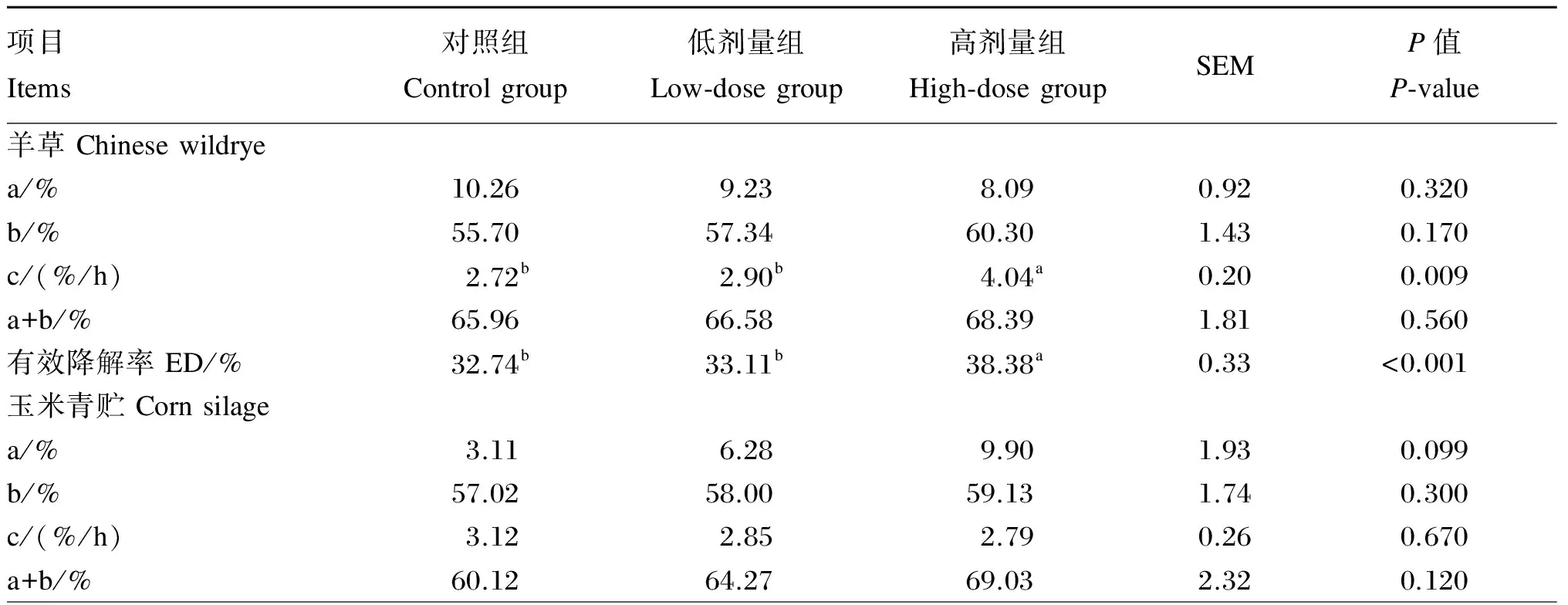
表4 地顶孢霉培养物对不同粗饲料中性洗涤纤维瘤胃降解参数的影响
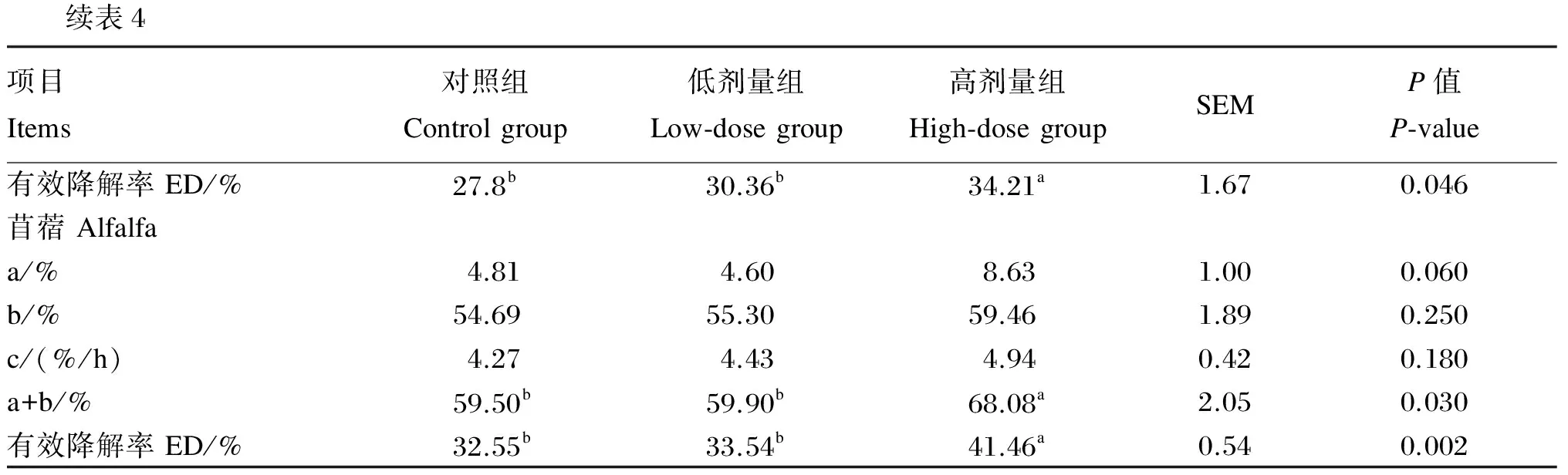
续表4项目Items对照组Controlgroup低剂量组Low⁃dosegroup高剂量组High⁃dosegroupSEMP值P⁃value有效降解率ED/%27.8b30.36b34.21a1.670.046苜蓿Alfalfaa/%4.814.608.631.000.060b/%54.6955.3059.461.890.250c/(%/h)4.274.434.940.420.180a+b/%59.50b59.90b68.08a2.050.030有效降解率ED/%32.55b33.54b41.46a0.540.002

表5 地顶孢霉培养物对不同饲料粗蛋白质瘤胃降解参数的影响
3 讨 论
3.1地顶孢霉培养物对粗饲料瘤胃降解参数的影响
干物质瘤胃降解率是影响奶牛干物质采食量和评定饲料营养价值的一个重要因素,它能够反映饲料在瘤胃内的利用程度[26-27],主要包括碳水化合物、蛋白质、脂肪和矿物质等物质的降解。本试验中,ATC提高了玉米青贮干物质的有效降解率和慢速降解部分的降解速率,可能与瘤胃内微生物数量和菌群作用有关。张立霞等[28]和胡静等[1]指出瘤胃微生物对底物的附着能力和微生物数量的增加对饲粮的降解速率和降解程度十分重要。本试验中,ATC增加了瘤胃内原虫的数量,也提高了部分纤维降解菌(白色瘤胃球菌和黄色瘤胃球菌)和非纤维降解菌(普雷沃氏菌和反刍兽新月单胞菌)的相对含量,使得瘤胃微生物的降解作用增强,增殖所需的骨架原料和能量来源增加,从而促进了饲粮干物质和其他营养成分的消化和利用[29]。

表6 地顶孢霉培养物对瘤胃微生物区系的影响
饲料中不溶于中性洗涤剂的物质是NDF,是植物细胞壁的重要组成成分,主要包括纤维素、半纤维素、木质素、硅酸盐以及细胞壁间的蛋白质。改善瘤胃发酵功能有益于提高饲料营养物质的瘤胃降解率[30]。本试验中,高剂量组中3种粗饲料NDF的瘤胃有效降解率和羊草NDF的慢速降解部分的降解速率以及苜蓿NDF的可降解部分含量均得到显著提高,可能是由于ATC改善了奶牛瘤胃内环境。Yeo等[9]通过体外发酵试验发现蛹虫草菌丝能够显著提高体外产气量和挥发性脂肪酸产量,有效改善了瘤胃内环境,并提高了体外纤维素滤纸的降解率,与本试验结果相似。黄色瘤胃球菌、白色瘤胃球菌和产琥珀酸丝状杆菌是主要的3种纤维降解菌。ATC的添加虽然降低了产琥珀酸丝状杆菌的相对含量,但是提高了黄色瘤胃球菌和白色瘤胃球菌的相对含量,同时,原虫的数量也得到显著提高。原虫能够产生纤维素酶,将饲料纤维消化降解,并产生挥发性脂肪酸。原虫裂解纤维素,然后通过吞噬纤维素,在纤维素酶的作用下将其降解成单糖,为动物机体供能[31]。原虫能够降解总纤维量超过30%,Coleman[32]也认为,原虫是瘤胃纤维降解的主要酶源,瘤胃去原虫后,绵羊瘤胃纤维素降解率降低50%。因此,本试验中,高剂量组的原虫数量的提高也是导致粗饲料NDF有效降解率提高的重要原因。
饲料蛋白质在瘤胃中的降解情况主要取决于其发酵的难易程度和在瘤胃内的滞留时间[33]。本试验中,高剂量组中具有蛋白质降解作用的普雷沃氏菌和反刍兽新月单胞菌的相对含量均显著增加。普雷沃氏菌是广泛存在于瘤胃且数量最多的一类细菌。其中,栖瘤胃普雷沃氏菌被认为是数量最多的蛋白质降解菌,在不同比例的精粗饲粮条件下反刍动物都会存在该属的蛋白质降解菌株,在饲料蛋白质降解中发挥重要作用[34]。反刍兽新月单胞菌除了在调节乳酸代谢、降低乳酸积累中有重要作用,还是重要的蛋白质降解菌。原虫也是蛋白质降解过程中的积极参与者,其降解不溶性蛋白质的能力和蛋白质降解酶的活性都要高于细菌[35]。因此,本试验中,瘤胃蛋白质降解菌和原虫的共同作用使得高剂量组中玉米青贮和苜蓿粗蛋白的有效降解率得到显著提高。同时,瘤胃微生物对饲料粗蛋白质的降解速率和降解程度也有积极影响,使得羊草和青贮的慢速降解部分、可降解部分和快速降解部分得到显著提高。ATC为粗饲料的蛋白质降解创造了良好的发酵环境,使得发酵程度更高,降解率更高。
3.2地顶孢霉培养物对瘤胃微生物区系的影响
瘤胃内的微生物主要包括瘤胃细菌、原虫和真菌等。对于反刍动物来说,粗饲料的消化利用与瘤胃微生物的数量和组成有着十分密切的关系[1]。瘤胃微生物将粗饲料中的纤维类物质降解,从而转化为反刍动物自身必不可少的营养物质[36]。同时,瘤胃内原虫数量的多少对饲粮纤维和蛋白质的降解也具有重要意义[31-32]。本试验中,添加ATC增加了部分纤维降解菌和其他瘤胃细菌和原虫的数量,但降低了产琥珀酸丝状杆菌的相对含量。前人研究报道了拥有相同功能性成分(虫草素)的虫草菌丝和某些次级代谢产物同样具有抑制产琥珀酸丝状杆菌的生长的作用[10,37],机制尚不清楚。但这一结果十分重要,它证明了ATC能够调节瘤胃内某些纤维降解菌和非纤维降解菌的数量,从而为ATC改变粗饲料各营养成分瘤胃有效降解率提供合理的解释。已有报道证明,虫草类物质及其功能性成分具有增加益生菌数量的潜力[38],而对肠道有害菌也有选择性的生长抑制作用[39-40]。Yeo等[11]也通过体外发酵试验证明了,蛹虫草菌丝能够增加瘤胃内总细菌数量、纤维降解菌数量和纤维酶活性。因此,可以推测ATC能够刺激部分瘤胃细菌和原虫的生长,从而提高饲粮蛋白质和碳水化合物的进一步降解,来提高饲料在瘤胃内的降解率。但ATC对瘤胃微生物发挥作用的具体原因还有待进一步研究。
4 结 论
本试验条件下,地顶孢霉培养物能够调节部分瘤胃微生物的菌群数量并提高粗饲料的瘤胃降解率,其中以30 g/(d·头)添加量为宜。
[1]胡静,于子洋,朱亚骏,等.果寡糖对奶山羊瘤胃微生物区系及常用粗饲料瘤胃降解率的影响[J].动物营养学报,2014,26(7):1988-1995.
[2]祁茹,赵军,孙建凤,等.提高反刍动物粗饲料利用率的营养措施[J].中国奶牛,2011(13):33-37.
[3]杨璐玲,孙国强.提高粗饲料营养价值的技术措施[J].中国奶牛,2012(20):30-34.
[4]孙利娜,李贺,郜希君,等.提高反刍动物对粗纤维消化率的营养调控措施[J].饲料博览,2011(9):23-26.
[5]梁宗琦.我国虫草属真菌研究开发的现状及思考[J].食用菌学报,2001,8(2):53-62.
[6]肖建辉,方宁,肖瑜,等.古尼拟青霉胞外多糖的免疫抑制活性[J].中药材,2004,27(3):192-195.
[7]魏建忠,张玮,李郁,等.地顶孢霉培养物对保育仔猪生产性能及免疫水平的影响[J].中国畜牧兽医,2009,36(2):33-35.
[8]孙汉巨,李晓祥,丁琦,等.虫草饲料添加剂对蛋鸭生产性能及鸭蛋品质的影响[J].安徽农业科学,2011,39(6):3618-3620,3626.
[9]YEO J M,LEE S J,LEE S M,et al.Effects ofCordycepsmilitarismycelia oninvitrorumen microbial fermentation[J].Asian-Australasian Journal of Animal Sciences,2009,22(2):201-205.
[10]KIM W Y,HANIGAN M D,LEE S J,et al.Effects ofCordycepsmilitarison the growth of rumen microorganisms andinvitrorumen fermentation with respect to methane emissions[J].Journal of Dairy Science,2014,97(11):7065-7075.
[11]YEO J M,LEE S J,SHIN S H,et al.Effects ofCordycepsmilitarismycelia on fibrolytic enzyme activities and microbial populationsinvitro[J].Asian-Australasian Journal of Animal Sciences,2011,24(3):364-368.
[12]SUN P,WANG J Q,DENG L F.Effects ofBacillussubtilisnatto on milk production,rumen fermentation and ruminal microbiome of dairy cows[J].Animal,2013,7(2):216-222.
[13]NRC.Nutrient requirements of dairy cattle[S].7th ed.Washington,D.C.:National Academic Science,2001.
[14]AOAC.Official Methods of analysis of the association of official analytical chemists[S].17th ed.Arlington:Association of Official Analytical Chemist,2000.
[15]李洋,王明君,李仲玉,等.不同比例的湿玉米纤维饲料对奶牛瘤胃降解规律与表观消化率的影响[J].中国畜牧杂志,2015,51(7):54-59.
[16]VAN SOEST P J,ROBERTSON J B,LEWIS B A.Methods for dietary fiber,neutral detergent fiber,and nonstarch polysaccharides in relation to animal nutrition[J].Journal of Dairy Science,1991,74(10):3583-3597.
[17]CHANG C Y,LUE M Y,PAN T M.Determination of adenosine,cordycepin and ergosterol contents in cultivatedAntrodiacamphorataby HPLC method[J].Journal of Food and Drug Analysis,2005,13(4):338-342.
[18]YU P,CHRISTENSEN D A,MCKINNON J J.Comparison of the national research council-2001 model with the Dutch system (DVE/OEB) in the prediction of nutrient supply to dairy cows from forages[J].Journal of Dairy Science,2003,86(6):2178-2192.
[19]ØRSKOV E R,MCDONALD I.The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage[J].The Journal of Agricultural Science,1979,92(2):499-503.
[20]OGIMOTO K,IMAI S.Atlas of rumen microbiology[M].Tokyo:Japan Scientific Society Press,1981.
[21]GHORBANI G R,MORGAVI D P,BEAUCHEMIN K A,et al.Effects of bacterial direct-fed microbials on ruminal fermentation,blood variables,and the microbial populations of feedlot cattle[J].Journal of Animal Science,2002,80(7):1977-1985.
[22]ZHANG Y L,LIU Q,WANG C,et al.Effects of supplementation of Simmental steers with 2-methylbutyrate on rumen microflora,enzyme activities and methane production[J].Animal Feed Science and Technology,2015,199:84-92.
[23]YU Z,MORRISON M.Improved extraction of PCR-quality community DNA from digesta and fecal samples[J].BioTechniques,2004,36(5):808-812.
[24]KHAFIPOUR E,LI S C,PLAIZIER J C,et al.Rumen microbiome composition determined using two nutritional models of subacute ruminal acidosis[J].Applied and Environmental Microbiology,2009,75(22):7115-7124.
[25]辛杭书,段春宇,张永根,等.饲粮中添加海南霉素对奶牛瘤胃微生物区系的影响[J].动物营养学报,2012,24(11):2249-2256.
[26]夏科,姚庆,李富国,等.奶牛常用粗饲料的瘤胃降解规律[J].动物营养学报,2012,24(4):769-777.
[27]林英庭,祁茹,王利华,等.外源寡糖对山羊瘤胃液酶活及粗饲料瘤胃降解率的影响[J].动物营养学报,2014,26(12):3616-3624.
[28]张立霞,屠焰,李艳玲,等.不同微生物菌株及其组合处理对玉米秸秆瘤胃降解率的影响[J].动物营养学报,2014,26(8):2433-2444.
[29]刘兵,瞿明仁,张学峰,等.瘤胃灌注大豆寡糖对绵羊消化道内营养物质流通与消化的影响[J].畜牧兽医学报,2008,39(7):915-922.
[30]张学峰.外源寡糖在绵羊消化道内的降解、转化、利用和流通规律及其对瘤胃微生物区系、免疫和营养物质消化影响的研究[D].博士学位论文.呼和浩特:内蒙古农业大学,2007.
[31]郭冬生,夏维福,彭小兰,等.瘤胃原虫的生理作用及驱除原虫的研究[J].饲料研究,2006(8):42-45.
[32]COLEMAN G S.The distribution of carboxymethylcellulase between fractions taken from the rumens of sheep containing no protozoa or one of five different protozoal populations[J].The Journal of Agricultural Science,1986,106(1):121-127.
[33]刁其玉,屠焰.奶牛常用饲料蛋白质在瘤胃的降解参数[J].乳业科学与技术,2005,27(2):70-74.
[34]冯仰廉.反刍动物营养[M].北京:科学出版社,2004.
[35]NOLAN J V.Implications of protozoa and fungi for the protein nutrition of ruminants-invited review[C]//Proceedings of OECD/UNE international symposium.Armidale:OECD,1989.
[36]MULLINS C R,MAMEDOVA L K,CARPENTER A J,et al.Analysis of rumen microbial populations in lactating dairy cattle fed diets varying in carbohydrate profiles andSaccharomycescerevisiaefermentation product[J].Journal of Dairy Science,2013,96(9):5872-5881.
[37]WANG Y X,ALEXANDER T W,MCALLISTER T A.Invitroeffects of phlorotannins fromAscophyllumnodosum(brown seaweed) on rumen bacterial populations and fermentation[J].Journal of the Science of Food and Agriculture,2009,89(13):2252-2260.
[38]KOH J H,SUH H J,AHN T S.Hot-water extract from mycelia ofCordycepssinensisas a substitute for antibiotic growth promoters[J].Biotechnology Letters,2003,25(7):585-590.
[39]AHN Y J,PARK S J,LEE S G,et al.Cordycepin:selective growth inhibitor derived from liquid culture ofCordycepsmilitarisagainst clostridium spp.[J].Journal of Agricultural and Food Chemistry,2000,48(7):2744-2748.
[40]YEON S H,KIM J R,AHN Y J.Comparison of growth-inhibiting activities ofCordycepsmilitarisandPaecilomycesjaponicacultured onBombyxmoripupae towards human gastrointestinal bacteria[J].Journal of the Science of Food and Agriculture,2006,87(1):54-59.
(责任编辑王智航)
Effects ofAcremoniumterricolaCulture on Ruminal Degradation Parameters of Roughages and Microflora of Dairy Cows
LI YangZHANG XingyiZHANG GuangningWANG YizhenLIN CongXU HongjianJIANG XinLIU ShuaiZHANG Yonggen*
(College of Animal Science and Technology, Northeast Agricultural University, Harbin 150030, China)
This experiment was conducted to study the effects ofAcremoniumterricolaculture (ATC) on ruminal degradation parameters of roughages and microflora of dairy cows. Three ruminally cannulated multiparous Holstein cows averaging 650 kg of body weight were used in a 3×3 Latin square design. Dairy cows in different groups were fed basal diets supplemented with 0 (control group), 15 (low-dose group) and 30 g/(d·cow) ATC (high-dose group), respectively; The experiment consisted of 3 periods with 27 days per period, and each period consisted of a 15-day pre-test period and 12-day test period. The changes of ruminal degradation parameters of Chinese wildrye, corn silage and alfalfa hay, and ruminal microflora were determined. The results showed as follows: 1) compared with control group, effective degradability and degradation rate of fraction of slowly degraded of dry matter of corn silage in high-dose group were significantly increased (P<0.05); effective degradability of neutral detergent fiber of three kinds of roughages in high-dose group was significantly higher than that of the other groups (P<0.05), and degradation rate of fraction of slowly degraded of neutral detergent fiber of Chinese wildrye and degradable fraction content of neutral detergent fiber of alfalfa hay in high-dose group were significantly higher than those of the other groups (P<0.05); compared with control group, effective degradability and the content of fraction of immediately degraded of crude protein of corn silage in high-dose group were significantly increased (P<0.05), effective degradability of crude protein of alfalfa hay in test groups was significantly increased (P<0.05); the contents of fraction of immediately degraded and degradable fraction of Chinese wildrye in high-dose group were significantly increased (P<0.05), but effective degradability was not affected (P>0.05). 2) Compared with control group, ruminal protozoal population and the relative contents ofRuminococcusflavefaciens,RuminococcusalbusandPrevotellain high-dose group were significantly increased (P<0.05), and the relative content ofSelenomonasruminantiumin test groups was significantly increased (P<0.05), however, the relative content ofFibrobactersuccinogenesin high-dose group was significantly decreased (P<0.05). Therefore, under the conditions in the present study, ATC may adjust contents of certain rumen microbes and improve degradability of roughages of dairy cows, and the suitable recruitment is 30 g/(d·cow).[ChineseJournalofAnimalNutrition, 2016, 28(10):3238-3247]
Acremoniumterricolaculture; dairy cow; roughage; rumen degradability; microflora
, professor, E-mail: zhangyonggen@sina.com
10.3969/j.issn.1006-267x.2016.10.027
2016-03-28
国家奶牛产业技术体系(CARS-37)
李洋(1989—),男,黑龙江肇东人,博士研究生,从事反刍动物生产的研究。E-mail: 446190229@qq.com
张永根,教授,博士生导师,E-mail: zhangyonggen@sina.com
S823;S816.7
A
1006-267X(2016)10-3238-10
