替米考星水溶性粉在家兔体内的药动学研究
2016-11-15宋丽莉孙朋超黄维维赵永星
宋丽莉,孙朋超,黄维维,梁 倩,赵永星
(郑州大学药学院,河南 郑州 450001)
替米考星水溶性粉在家兔体内的药动学研究
宋丽莉,孙朋超,黄维维,梁倩,赵永星
(郑州大学药学院,河南 郑州 450001)
为了考察替米考星水溶性粉在家兔体内的药动学特征,本试验分别给受试家兔灌服替米考星、替米考星肠溶微丸、替米考星水溶性粉,以12.5 mg/kg体重剂量给药,采用HPLC方法分析不同时间点受试家兔血浆中替米考星的药物浓度。试验结果显示,新研制的20%替米考星水溶性粉经口服后,药物在家兔体内可被快速吸收达到较高的血药浓度0.413±0.148 μg/mL,血药浓度-时间曲线下的面积(AUC)为4.334±0.620 μg/mL·h,相对生物利用度(F)达到86.99%,说明替米考星水溶性粉经口服后的生物利用度较高,有利于致病菌细菌的抑制或杀灭。
替米考星水溶性粉;药动学;家兔
替米考星(tilmicosin)是由英国Elanco公司基于泰乐菌素合成的大环内酯类抗生素,因其对畜禽疾病疗效佳而被广泛应用。临床上,替米考星主要用于防治牛、羊、猪、鸡等动物由细菌和支原体感染引起的疾病,如肺炎、乳房炎、猪气喘病、鸡慢性呼吸道疾病等[1]。据研究报道,已研制替米考星制剂有纳米乳[2]、微球[3-6]、注射剂[7]等。但因其水溶性差,导致在给药剂量下难以达到有效治疗浓度。为增加替米考星的水溶性,提高其生物利用度,本试验将替米考星制备成水溶性粉,并比较替米考星、替米考星肠溶微丸和替米考星水溶性粉在家兔体内的药动学特征,为家畜合理的给药提供科学依据。
1 材料与方法
1.1仪器和试剂仪器设备:LC-1200高效液相色谱仪(美国Agilent公司);固相萃取真空管装置(美国Waters公司);pH计(上海楚柏实验室设备有限公司);SPE柱(美国Agilent公司);LG16-B高速离心机(北京雷勃尔医疗器械有限公司);GL-88B型旋涡混合器(海门市其林贝尔仪器制造有限公司)。
药物和试剂:替米考星(山东鲁抗医药股份有限公司);替米考星肠溶微丸(自制)替米考星可溶性粉(自制);乙腈(色谱纯,天津市四有精细化学品有限公司);四氢呋喃(色谱纯,天津市四有精细化学品有限公司);二丁胺(色谱纯,天津市科密欧化学试剂有限公司)。
1.2试验动物18只健康家兔,体质量约(2± 0.5)kg,雌雄各半,将家兔饲养于单独的代谢笼中,自由饮水,试验开始前及试验过程中饲喂不含任何抗生素的全价饲料,每天定时给料2次。试验前标记,逐只称质量并记录,连续饲喂3周以适应养殖环境。
1.3试验方法
1.3.1试验方案试验分为3组,每组6只家兔,给药剂量为12.5 mg/kg体重,灌服给药。第1组为20%替米考星;第2组为自制20%替米考星肠溶微丸;第3组为新研制的20%替米考星水溶性粉。给药前采血,给药后分别在0.08、0.25、0.5、1.0、2.0、3.0、4.0、6.0、8.0、12.0、24.0、48.0、72.0 h和96.0 h耳缘静脉采血,每次采血量1.0 mL。血液置于含有肝素的聚丙烯离心管中,3 500 r/min离心10 min,吸取上层血浆置于聚丙烯离心管中,密封,避光,-20℃保存备用。
1.3.2血浆样品处理与检测用固相萃取法处理样品。将SPE柱置于固相萃取真空管装置上,加入5 mL甲醇活化柱子后用5 mL水平衡SPE柱。精确量取血浆样品0.5 mL上样,让样品通过SPE柱,调整真空泵的压力使流速为约每秒1滴,5 mL纯水和5 mL乙腈-水(体积比为35∶65)分别洗涤。溶液从SPE柱流出后,将真空泵的压力调小,让SPE柱在真空下干燥至少5 min,然后用2.5 mL洗脱液洗脱于刻度试管中,30℃水浴中氮气吹至近干。用流动相溶解定容至100 μL,涡旋30 s,静置15 min,0.22 μm针筒式滤膜过滤后取50 μL进行HPLC分析[8-9]。
1.4HPLC测定替米考星血药浓度方法建立
1.4.1色谱条件参考文献[10]方法,并调整如下:紫外检测器,检测波长为280 nm;色谱柱为Agilent,ODS反相色谱柱(4.6 mm×250 mm,5 μm);流动相乙腈-四氢呋喃-缓冲液-水(体积比为11∶5.5∶4.5∶79,pH值2.5);流速1.0 mL/min,进样量50 μL。
1.4.2标准曲线的建立用流动相将替米考星标准储备液分别稀释成0.025、0.05、0.1、0.2、0.5、1.0、2.0、5.0 μg/mL和10.0 μg/mL的标准工作溶液,按1.2.2项下方法处理样品后,各取50 μL进行HPLC分析。以浓度为横坐标,峰面积(顺式和反式异构体的峰面积之和)为纵坐标,绘制标准曲线。
1.4.3检测限和定量限的检测取空白血浆,加入标准储备液,采用倍比稀释成浓度为0.05、0.025、0.0125 μg/mL的血浆样品。按1.2.2项下方法进行样品处理,测定色谱系统的基线噪音值,按信号强度与噪声强度比(S/N)为3作为检测限(LOD),S/N=10为定量限(LOQ)。
1.4.4添加回收率和精密度测定取空白血浆0.5 mL,添加一定体积的储备液,使血浆中药物浓度为0.05、0.50 μg/mL和5.00 μg/mL,按1.2.2项下样品处理方法后进行HPLC测定,一日内每个浓度取3个平行样品,分别测定并计算回收率和日内变异系数。
1.5数据处理与分析药时数据采用药代动力学程序软件进行曲线拟合,采用PKSolver软件以非房室模型求算药动学参数。根据各剂型的AUC计算相对生物利用度,评价制剂的等效性。
2 试验结果
2.1线性范围、定量限和检测限替米考星血浆浓度在0.025~10.0 μg/mL范围内,替米考星峰面积(顺式和反式异构体的峰面积之和)与浓度呈线性相关,得到其回归方程是y=300.99x-21.623(R2=0.9992)。空白血浆样品添加标样,倍比稀释及处理后,测得血浆中替米考星浓度的LOQ和LOD分别为0.025 μg/mL和0.0125 μg/mL。
2.2回收率和变异系数空白血浆样品添加标样浓度分别在0.025、0.5、10.0 μg/mL时,替米考星血浆绝对回收率均高于65.0%,变异系数小于10%。结果表明,试验所用的血浆处理方法和检测方法可靠,重复性好,回收率和变异系数都达到了化学药物药代动力学试验指导原则的要求,能满足用于替米考星在动物血浆中的检测。
2.3血药浓度及药代动力学参数三组受试家兔灌服给药后,其药代动力学参数和血药浓度经时变化结果见表1和图1。替米考星对照组、微丸组和水溶性粉组的平均半衰期(t1/2)和体内滞留时间(MRT)分别为34.746 h和46.343 h、26.632 h和33.097 h、23.516 h和29.580 h,对照组制剂的半衰期和平均滞留时间均显著高于微丸组和水溶性粉组,相比水溶性粉组为最低。对照组、微丸组和水溶性粉组的平均血药峰浓度分别为0.386 μg/mL、0.390 μg/mL和0.413 μg/mL,水溶性粉组的峰浓度显著高于其他2组。然后8 h后对照组的血药浓度均显著高于水溶性粉组,微丸组与水溶性粉组相似。
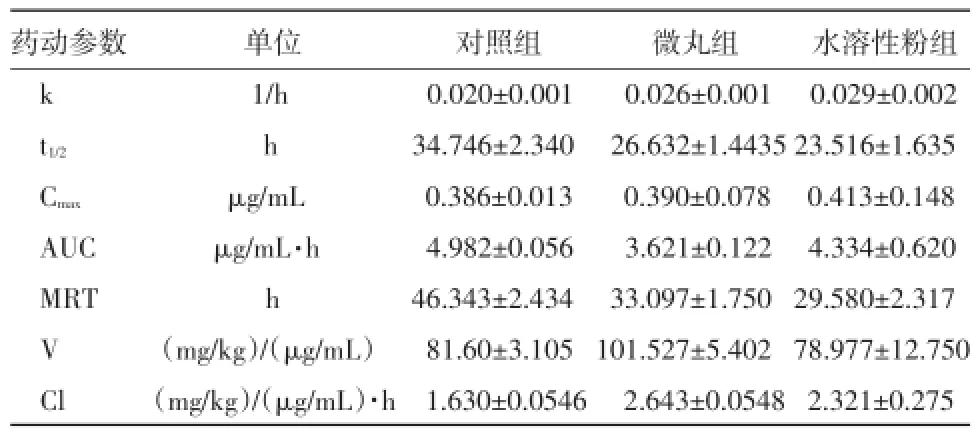
表1 家兔口服替米考星制剂后药动学参数

图1 家兔口服替米考星制剂后血浆药物浓度经时曲线
2.4生物等效性评价根据相对生物利用度(F)公式可计算出替米考星水溶性粉和肠溶微丸的相对生物利用度(与对照组相比)分别为86.99%和72.68%。
3 讨论
替米考星作为家畜用药,常以内服和皮下注射两种途径给药,用于动物因敏感菌引起的感染性疾病。目前对替米考星在家兔体内的药代动力学研究得较少,本试验制备了替米考星水溶性粉,溶解度达到100 mg/mL,并进行了替米考星、替米考星肠溶微丸和替米考星水溶性粉在家兔体内的药动学比较研究。研究结果表明,替米考星水溶性粉与其他剂型的药动学参数有一定的差别,可能与制剂处方及剂型有关。
替米考星以12.5 mg/kg体重剂量灌服给药,家兔给药后替米考星的血药浓度检测96 h,由于水溶性粉96 h和72 h时的血药浓度已降到最低检测(0.0125 μg/mL)以下,因此药代动力学分析建立在48 h[11]。血浆药物浓度经时曲线形状表明,水溶性粉组经口服后,药物在家兔体内吸收、分布很快,消除较为缓慢,该药代动力学特征与家兔口服替米考星后体内药代动力学特征相似[12]。
替米考星、肠溶微丸和水溶性粉t1/2和MRT分别为34.746 h和46.343 h、26.632 h和33.097 h、23.516 h和29.580 h,水溶性粉作用时间较其他两组相对较短,但水溶性粉在家兔体内可被快速吸收达到较高的血药浓度,有利于致病菌细菌的抑制或杀灭。此外,水溶性粉组的AUC和Cmax大于微丸组,说明水溶性粉组能够长时间维持有效浓度,提高治疗效果。替米考星水溶性粉和微丸的相对生物利用度(与对照组相比)分别为86.99%和72.68%,表明了替米考星水溶性粉与对照制剂生物等效,替米考星水溶性粉口服后,生物利用度较高。
本试验中,对照组、微丸组和水溶性粉组中的每只家兔都经过完整的采样周期,每个时间点的血药浓度由一组内6只家兔的平均血药浓度得到,这样消除了一组数据间的个体差异性,保证了试验结果的科学性。
[1]王煊,马志强,王忠仁.动物专用抗菌药-替米考星的简介[J].养殖技术顾问,2012(04):241.
[2]李向辉,欧阳五庆,杨雪峰,等.替米考星纳米乳的制备及其质量评价[J].西北农林科技大学学报(自然科学版),2009(04):42-46.
[3]远立国,鲍杰,李成明,等.替米考星肺靶向微球的研制[J].中国兽医科学,2008(12):1093-1097.
[4]杨黎燕,余丽丽,牛秀明.替米考星交联淀粉载药微球的制备研究[J].应用化工,2012(02):217-220.
[5]肖飞,陈翠兰,张永丹,等.磷酸替米考星缓释微球的制备工艺研究[J].畜牧与兽医,2012(02):58-60.
[6]韩萌萌,李沙沙,孙朋超,等.替米考星肠溶微丸的制备及其评价[J].中国兽药杂志,2014(02):34-38.
[7]任志宏.复方替米考星注射液的研制药效学研究[D].杨凌:西北农林科技大学,2013.
[8]沈向荣,苏亚楠,刘彩,等.磷酸替米考星在猪体内的药代动力学研究[J].南京农业大学学报,2013(05):120-124.
[9]Dimitrova D,Кatsarov V,Dimitrov D,et al.Tsoneva.Pharmacokinetics of tilmicosin after oral application of Pulmotil G 200-premix in pigs[J].AGRICULTURAL SCIENCE AND TECHNOLOGY,2011;3(4):318-322.
[10]刘德金,刘爱玲,刘桂兰,等.检测替米考星含量的高效液相色谱法改良[J].南京农业大学学报,2011(03):135-139.
[11]Shen J,Li C,Jiang H,et al.Pharmacokinetics of tilmicosin after oral administration in swine[J].American journal of veterinary research,2005,66(6):1071,1074.
[12]Gallina G,Lucatello L,Drigo I,et al.Kinetics and intrapulmonary disposition of tilmicosin after single and repeated oral bolus administrations to rabbits[J].Veterinary research communications,2010,34 Suppl 1:S69-72.
S859.79
B
0529-6005(2016)09-0105-02
2015-06-24
宋丽莉(1990-),女,硕士,从事药物制剂与新型给药系统研究,E-mail:songlilia315@126.com
赵永星,E-mail:a315lab@163.com
