番石榴叶中广寄生苷和番石榴苷的降糖作用
2016-11-14欧阳文朱晓艾陈雪香叶淑敏
欧阳文,朱晓艾,苏 磊,陈雪香,叶淑敏,曹 庸,
(1.湖南中医药大学药学院,湖南 长沙 410208;2.华南农业大学食品学院,广东 广州 510642)
番石榴叶中广寄生苷和番石榴苷的降糖作用
欧阳文1,朱晓艾2,苏 磊1,陈雪香2,叶淑敏1,曹 庸2,*
(1.湖南中医药大学药学院,湖南 长沙 410208;2.华南农业大学食品学院,广东 广州 510642)
目的:研究番石榴叶、广寄生苷和番石榴苷的降糖活性和相关性。方法:采用反相高效液相色谱法测定不同月份番石榴叶中番石榴苷和广寄生苷的含量;建立降糖脂肪细胞模型,测定不同季节番石榴叶提取物的降糖活性;给药干预后,测定细胞培养液中游离脂肪酸的含量,采用Western blotting法测定脂肪细胞膜葡萄糖转运蛋白4(glucose transporter 4,GLUT4)表达。结果:6ü9月份番石榴叶中番石榴苷和广寄生苷的含量较高,同时6ü9月份番石榴叶的降糖活性也最好,降糖活性与化合物含量存在正相关性。番石榴叶提取物、番石榴苷和广寄生苷均能显著促进脂肪细胞膜上GLUT4蛋白的表达;番石榴叶提取物、番石榴苷和广寄生苷均能显著抑制游离脂肪酸的释放,降糖活性和抑制脂肪分解也存在正相关性。结论:番石榴苷和广寄生苷两种黄酮苷类化合物是番石榴叶降糖、抑制游离脂肪酸释放的主要活性物质基础。
番石榴叶;番石榴苷;广寄生苷;降糖活性;葡萄糖转运蛋白4;游离脂肪酸
番石榴(Psidium guajava Linn.)为桃金娘科(Myrtaceae)番石榴属果树[1]。因具有降糖、抗氧化、止血、抗菌、抗病毒等多种药用功效,番石榴不仅是一种食物,更作为一种民间医药,在全世界亚热带地区被广泛使用[2]。番石榴叶含有多种类型的化学成分,目前已经报道的有鞣质、黄酮、三萜、多糖、挥发油、倍半萜、杂萜醛类等[3-4]。
番石榴叶的降糖效果已被国内外学者广为接受,大量的科学研究亦证明其无毒副作用。在日本,特定保健用食品(Food for Specified Health Uses,FOSHU)已有批准作为防治2型糖尿病的含番石榴提取物的番石榴茶上市[5]。Mukhtar等[6]证明250 mg/kg的番石榴叶水提物对四氧嘧啶诱导的糖尿病小鼠具有显著的降血糖作用,但对正常小鼠的血糖水平无明显改变。Ojewole[7]发现番石榴叶水提物不仅可降低链脲佐菌素诱导的高血糖小鼠血糖水平,还可使Dahl盐敏感小鼠的血压和心率降低。马山等[8]证明番石榴叶水煎剂可使各组大鼠空腹血糖(fasting blood glucose,FBG)水平降低,空腹胰岛素(fasting insulin,FINS)水平下降,胰岛素敏感指数(insulin sensitivity index,ISI)升高,与模型组比较有显著差异。王波等[9]研究表明攀枝花地区野生番石榴叶水提物、65%和95%乙醇提取物对葡萄糖性、肾上腺素性和链脲佐菌素性高血糖小鼠的降血糖效率分别为36.3%、33.5%和31.3%。Hsieh等[10]研究发现番石榴叶能抑制低密度脂蛋白(low density lipoprotein,LDL)的糖基化,对于由糖基化所引起的各种糖尿病并发症如心血管疾病和神经病变都能起到很好的治疗效果。Oh等[11]发现通过给不同年龄的 Leprdb/Leprdb小鼠腹腔注射10 mg/kg的番石榴叶甲醇提取物,呈现显著的降血糖效果,其机制可能在于番石榴叶甲醇提取物显著抑制了蛋白酪氨酸磷酸酶-1B(protein tyrosine phosphatase-1B,PTP-1B)的活性,而PTP-1B是导致胰岛素抵抗和肥胖的关键环节。
近些年来,科研者不再满足于粗提取物水平的研究,进而对番石榴确切的降糖物质基础及作用机制进行了深入研究。王婧茹等[12]报道番石榴叶总三萜能显著降低2型糖尿病大鼠的血糖和血脂水平,明显改善糖尿病动物的糖脂代谢紊乱,升高血清胰岛素水平,提高胰岛素敏感指数;其作用机制可能与增加过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPARγ)蛋白的表达有关。蔡丹昭等[13]以链脲佐菌素性高血糖小鼠为模型,观察番石榴叶总黄酮对高血糖小鼠血糖、血脂水平的影响,比较给药前后小鼠体质量及心脏、肝脏、肾脏和胰腺的脏器指数变化,发现番石榴叶总黄酮能降低链脲佐菌素性高血糖小鼠的血糖水平。吴建中等[14]报道番石榴多糖能够显著降低糖尿病小鼠血糖水平,提高其抗氧化能力。Wang Hui等[15]通过活性跟踪分离纯化,发现番石榴叶提取物中槲皮素、山奈酚和杨梅酮对α-麦芽糖酶和α-淀粉酶具有很强的抑制效果。魏明[16]发现番石榴叶三萜化合物PGL-15能促进3T3-L1前脂肪细胞分化,显著增加细胞葡萄糖消耗量和抑制游离脂肪酸的产生,并能显著增加细胞内PPARγ及葡萄糖转运蛋白4(glucose transporter 4,GLUT4)mRNA的表达。Eidenberger等[17]报道番石榴叶醇提取物分离得到的黄酮苷类化合物具有显著的抑制血糖平衡关键酶二肽基肽酶的活性,是番石榴具有降糖活性的物质基础。
本研究团队通过建立以葡萄糖消耗为特征的脂肪细胞模型,采用活性追踪模式对番石榴叶降糖活性物质基础进行了系统的分离纯化研究,初步证明番石榴叶降糖活性物质基础主要为番石榴苷和广寄生苷两个化合物[18-19],在此基础上,本实验拟进一步研究这两种化合物的降糖活性,并考察其与番石榴叶降糖作用的相关性,为番石榴叶降糖功能提取物的开发研究提供依据。
1 材料与方法
1.1 材料、试剂与动物
番石榴叶,采自广东省茂名市林业局,原植物经湖南吉首大学廖博儒教授鉴定为桃金娘科番石榴属植物,植物标本现存于华南农业大学食品学院天然活性物工程技术研究中心。番石榴苷和广寄生苷结晶为自制,面积归一化法测定结果表明两者纯度均大于99%。
葡萄糖测定试剂盒 广州科方生物技术有限公司;游离脂肪酸测定试剂盒 北京普利来基因技术有限公司;Ⅰ型胶原酶 美国Sigma公司;去酚红Hanks缓冲液、青霉素-链霉素双抗 杭州吉诺生物医药技术有限公司;肾上腺素 日本TCI化成工业株式会社;胎牛血清 杭州四季青生物工程材料有限公司;兔抗GLUT4多克隆抗体、羊抗兔IgG 武汉博士德生物工程有限公司;硝酸纤维素膜 广州威佳科技有限公司;乙腈(色谱纯) 德国Merck公司;水为超纯水,其他试剂均为分析纯。
SPF级雄性Sprague-Dawley(SD)大鼠,体质量120~150 g,购自南方医科大学实验动物中心,许可证号为SCXK(粤)2011-0015。
1.2 仪器与设备
LC-20AT高效液相色谱仪 日本岛津公司;万分之一电子天平 梅特勒-托利多仪器有限公司;酶标仪美国PE公司;SW-CJ-2FD超净工作台 苏州净化设备有限公司;TC-2323二氧化碳培养箱 美国Sheldon公司;移液器(各种规格)、电泳仪、转印仪 美国伯乐公司;5417R高速冷冻离心机 德国Eppendorf公司。
1.3 方法
1.3.1 不同月份番石榴叶中番石榴苷和广寄生苷含量测定
1.3.1.1 反相高效液相色谱条件
色谱柱:岛津Shim-pack VP-ODS C18柱(150 mmh4.6 mm,5 μm);流动相:水-乙腈(82∶18,V/V);紫外检测波长:257 nm;柱温:30 ℃;流速:1 mL/min,进样体积:10 μL。
1.3.1.2 对照品溶液的制备
精密称取3.9 mg番石榴苷,溶解定容于25 mL容量瓶中,加色谱甲醇溶解,过0.45 µm微孔滤膜,即得0.156 mg/mL的番石榴苷对照品溶液;精密称取4.3 mg广寄生苷,溶解定容于25 mL容量瓶中,加色谱甲醇溶解,过0.45 μm微孔滤膜,即得0.172 mg/mL的广寄生苷对照品溶液。
1.3.1.3 样品溶液的制备
精密称取10 g番石榴叶,以10 倍体积50%乙醇回流提取3 次,60 ℃减压浓缩,定容至100 mL容量瓶中。过0.45 µm微孔滤膜,取续滤液作为样品溶液。
1.3.1.4 线性关系考察
分别精密吸取番石榴苷对照品和广寄生苷对照品溶液1、2、4、6、8、20 μL,注入液相色谱仪,按1.3.1.1节的色谱条件测定峰面积,以进样量为横坐标,番石榴苷对照品和广寄生苷对照品峰面积值为纵坐标,绘制标准曲线。
1.3.1.5 精密度实验
精密吸取番石榴苷对照品和广寄生苷对照品溶液10 μL,按照1.3.1.1节的色谱条件测定,重复进样5 次。
1.3.1.6 重复性实验
分别取同一批番石榴叶粉末5 份,按1.3.1.3节方法操作,按1.3.1.1节的色谱条件进行测定。
1.3.1.7 稳定性实验
取同一份样品溶液,室温条件下放置,分别于0、2、4、6、8 h测定峰面积值。
1.3.1.8 加样回收率实验
精密称取6 份已知含量的3月份番石榴叶粉10.0 g左右,分别按照1∶1(m/m)比例加入自制番石榴苷、广寄生苷对照品,按照1.3.1.3节方法制备供试品,取10 μL进样分析,测定并计算回收率。
1.3.2 不同月份番石榴叶乙醇提取物降糖活性测定
1.3.2.1 脂肪细胞的分离纯化
[20]略作修改:大鼠脱颈处死,乙醇浴后无菌开腹。取附睾外层脂肪组织,Hanks缓冲液漂洗两次并剔除附带血管,再剪碎至体积约1 mm3,加入适量0.1% Ⅰ型胶原酶溶液37 ℃水浴消化1.5 h后,2~3 倍体积的胎牛血清终止消化。将细胞悬液1 200 r/min离心10 min,弃下层溶液,上层脂肪细胞同法加Hanks缓冲液洗涤细胞两次,通过细胞计数板,加入Hanks液调节细胞浓度。
1.3.2.2 大鼠脂肪细胞降糖模型
参考文献[21]略作修改:在96 孔板中建立200 µL反应体系:100 µL 2h106个/mL的细胞悬液、30 μL葡萄糖溶液(质量浓度1 mg/mL)、30 μL胎牛血清、40 µL样品溶液。在此模型中用体积分数0.1%二甲基亚砜(dimethyl sulfoxide,DMSO)Hanks缓冲液作对照组,胰岛素为阳性对照组。200 µL反应体系培养30 min后,每孔加入终浓度为10–5mol/L的肾上腺素,继续培养3 h后,冰浴终止反应。然后每孔精密吸取2 μL上清液,采用微量葡萄糖氧化酶法[22]显色,在酶标仪上505 nm波长处读数,测定并计算各孔葡萄糖浓度,通过建立工作曲线,并和对照组比较计算各样品葡萄糖的消耗量,由此评价番石榴叶乙醇提取物或两种化合物摄取葡萄糖的能力,具体计算公式如下。
葡萄糖摄取水平/(mmol/L)= cctrl-ccompound
式中:cctrl为对照组的葡萄糖浓度/(mmol/L);ccompound为样品或分离得到的有效成分经过3 h培养后残留培养基中的葡萄糖浓度/(mmol/L)。
1.3.2.3 供试样品的制备与降糖活性测定
将不同月份的番石榴叶粉碎成粗粉,10 倍体积50%乙醇回流提取3 次,每次1 h,提取液60 ℃减压浓缩、冷冻干燥,用体积分数0.5% DMSO配制成1.2 mg/mL的溶液进行降糖活性检测。
1.3.3 Western blotting法分析GLUT4表达水平
1.3.3.1 膜蛋白的提取与定量
在脂肪细胞模型上,各种药物干预后(广寄生苷、番石榴苷与番石榴叶乙醇提取物质量浓度均为100 µg/mL,胰岛素浓度为8 nmol/L),采用Hanks缓冲液漂洗脂肪细胞3 次,收集脂肪细胞,参考文献[23]制备脂肪细胞的膜蛋白:药物干预后细胞用TES缓冲液反复洗涤3 次,每孔加入200 μL TES缓冲液,小心将细胞刮出,重复样品合并,放入EP管,在冰上采用玻璃匀浆器匀浆,1 000hg离心,去掉沉淀,上清液再16 000hg、4 ℃离心20 min,收集沉淀,TES缓冲液溶解,-70 ℃保存即为粗膜蛋白溶液,采用Bradford法(考马斯亮蓝法)检测其蛋白质浓度。
1.3.3.2 电泳、转膜、杂交和显色
在细胞膜蛋白样品中加入等体积的2×十二烷基硫酸钠(sodium dodecyl sulfate,SDS)凝胶上样缓冲液,煮沸10 min,用微量加样器上样。60 μg等份的各组膜蛋白溶液,采用质量分数10% SDS-聚丙烯酰胺凝胶电泳进行分离,在150 V电压条件下,转至硝酸纤维素膜(nitrocellulose,NC)膜120 min,NC膜先用封闭液(5%脱脂奶粉配制的TBST溶液)封闭1 h,然后以TBST溶液洗4 次,每次10 min,杂一抗兔抗GLUT4多克隆抗体溶液中(用抗体稀释液1∶130(V/V)稀释)4 ℃孵育过夜,37 ℃缓摇1.5 h,取出后洗膜3 次,洗涤步骤同上。把NC膜浸于辣根过氧化物酶标记的羊抗兔IgG中(用抗体稀释液1∶2 000(V/V)稀释),37 ℃缓摇1.5 h,取出膜后同上方法洗涤3 次。将NC膜置于DAB底物液中显色反应5 min,弃去反应液,用水冲洗膜,终止反应,观察结果。应用IMAGE J图像分析软件对NC膜上的条带进行灰度值比较分析。
1.3.4 抑制游离脂肪酸释放活性测定
1.3.4.1 游离脂肪酸标准曲线的建立
精确称取16.4 mg棕榈酸标准品,溶于游离脂肪酸抽提液中,配制为终体积1 mL、终浓度64 mmol/L的溶液,-20 ℃保存。制备标准曲线时,用抽提液将64 mmol/L标准品稀释为3.2、1.6、0.8、0.4、0.2、0.1 mmol/L,按照试剂盒说明书方法,分别加入铜试剂和显色剂进行操作(标准品的空白对照为对应抽提液),在550 nm波长处比色。
1.3.4.2 样品中游离脂肪酸含量测定
建立细胞活性检测模型,各种药物干预后,细胞液经过培养和冰浴终止反应,取50 μL细胞液(样品空白对照为对应的培养液),加入抽提液150 μL和铜试剂50 μL,振荡2 min,室温静置10 min后,4 ℃条件下12 000 r/min离心5 min,取80 μL上层清液置于96 孔酶标板,加入150 μL显色剂,振荡5 s,室温静置5 min,在550 nm波长处比色。代入标准曲线方程测定游离脂肪酸的含量。
1.4 数据统计
2 结果与分析
2.1 反相高效液相色谱分析结果
2.1.1 供试品反相高效液相色谱纯度分析

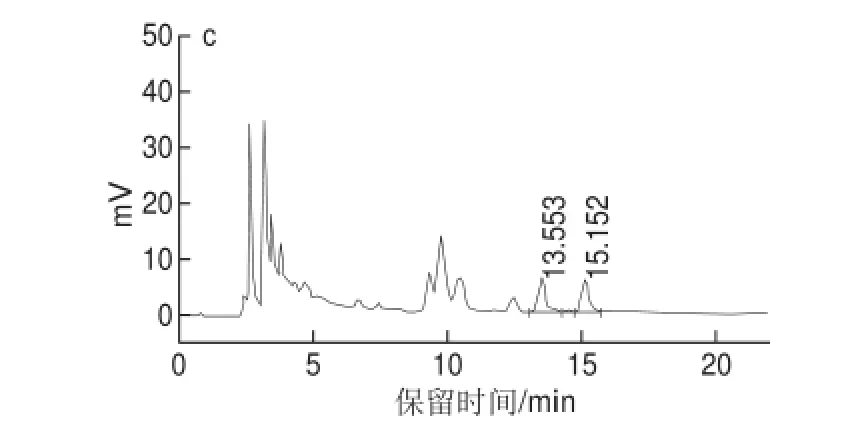
图1 番石榴苷(a)、广寄生苷(b)、番石榴叶乙醇提取物(c)反相高效液相色谱图Fig.1 HPLC profiles of guaijaver (a), avicularin (b) and guava leaf ethanol extract (c)
由图1可知,本实验室自制的番石榴苷和广寄生苷化合物纯度高,番石榴叶乙醇提取物中两种化合物分离度好,即可采用反相高效液相色谱法对两种化合物进行准确的含量分析。
2.1.2 线性关系结果
以进样量为横坐标,番石榴苷对照品和广寄生苷对照品峰面积值为纵坐标,绘制标准曲线,结果表明,番石榴苷在0.156~3.12 µg范围内线性良好,线性回归方程为y=22.532 0x+0.369 5(R2=0.999 2)。广寄生苷在0.172~3.44 µg范围内线性良好,线性回归方程为y= 22.242 0x-0.433 5(R2=0.999 5)。
2.1.3 精密度实验结果
精密吸取番石榴苷对照品和广寄生苷对照品溶液10 μL,按照1.3.1.1节的色谱条件测定,重复进样5 次,相对标准偏差(relative standard deviation,RSD)分别为1.35%和1.12%,表明此方法的精密度高。
2.1.4 重复性实验结果
分别取同一批番石榴提取液,按1.3.1.1节的色谱条件进行测定,测得番石榴苷和广寄生苷峰面积值的RSD分别为1.76%和1.09%,说明方法的重现性好。
2.1.5 稳定性实验结果
取同一份样品溶液,分别于室温条件下放置0、2、4、6、8 h后测定峰面积值,结果表明,番石榴苷标准品和广寄生苷标准品在8 h内稳定性良好,RSD分别为1.93%和0.93%。
2.1.6 回收率实验结果
表1 广寄生苷、番石榴苷加样回收率实验结果()Table 1 Results of recovery tests (

表1 广寄生苷、番石榴苷加样回收率实验结果()Table 1 Results of recovery tests (
实验次数称样量/g原有量/mg 加入量/mg 实测量/mg 回收率/% 平均回收率/%(RSD/%)番石榴苷广寄生苷番石榴苷广寄生苷番石榴苷广寄生苷番石榴苷广寄生苷 番石榴苷 广寄生苷1 9.69210.26411.853 10.02312.012 20.356 23.058 100.68 93.28 2 9.81710.39612.006 10.79112.084 21.093 23.971 99.12 99.01 3 9.98510.57412.212 10.60512.045 21.796 23.670 105.81 95.13 4 9.71610.28911.883 10.37812.099 20.400 23.711 97.42 97.76 5 9.80110.37911.987 10.29912.109 20.701 24.315 100.22 101.81 6 9.55310.11711.683 10.24512.073 20.521 22.843 101.55 92.44 100. 81(2.83)96.57(3.59)
由表1可知,番石榴苷平均回收率为100.81%,RSD为2.83%;广寄生苷平均回收率为96.57%,RSD为3.59%。说明可通过该方法准确测定材料中两种化合物的含量。
2.1.7 不同月份番石榴叶中番石榴苷和广寄生苷含量
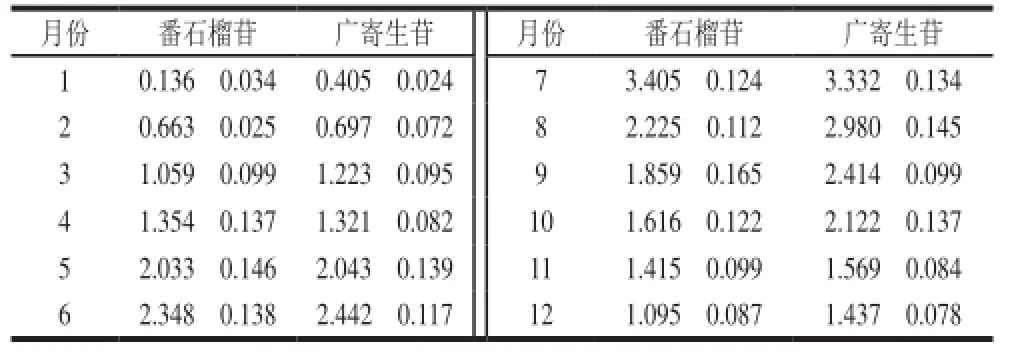
表2 不同月份的番石榴叶中广寄生苷和番石榴苷含量Table 2 Guaijaverin and avicularin contents in guava leaves in different months mg/g
由表2可知,番石榴苷和广寄生苷在不同月份番石榴叶中含量差异较大,主要表现为在温度较高的月份含量高,温度较低的月份含量偏低,两种化合物均在7月份的番石榴叶中含量达到最高,分别为(3.405f0.124)、(3.332f0.134) mg/g,含量最低均在1月份,分别为(0.136f0.034)、(0.405f0.024) mg/g。另外,番石榴苷在5ü8月份、广寄生苷在5ü10月份的番石榴叶中含量均超过了2 mg/g。
2.2 不同月份番石榴叶乙醇提取物降糖活性
2.2.1 葡萄糖标准曲线
利用血糖测定试剂盒和酶标仪检测细胞培养液中葡萄糖浓度。标准品浓度和吸光度之间线性回归方程为y=0.034 8x-0.013 3(R2=0.999)。以上结果说明可通过比色测定吸光度从而准确计算出细胞培养液中的葡萄糖浓度。
2.2.2 番石榴叶乙醇提取物、广寄生苷和番石榴苷的降糖活性
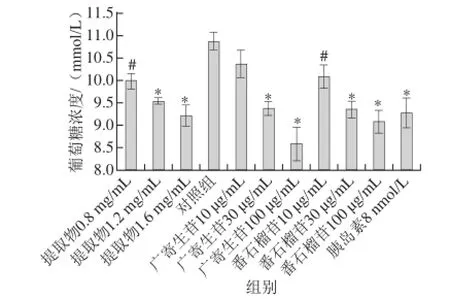
图2 番石榴叶乙醇提取物、番石榴苷和广寄生苷的降糖活性Fig.2 Hypoglycemic activity of guava leaf ethanol extract, guaijaverin and avicularin
以大鼠脂肪细胞为模型,观察番石榴叶50%乙醇提取物、广寄生苷和番石榴苷(以8 nmol/L胰岛素为阳性对照)的降糖效果,结果见图2。对照组葡萄糖浓度为(10.87f0.19) mmol/L,相比之下,8 nmol/L的胰岛素能够极显著促进葡萄糖的摄取(P<0.01),同时番石榴叶50%乙醇提取物组、广寄生苷组和番石榴苷组均可剂量依赖性地促进葡萄糖摄取。100 µg/mL番石榴苷组和广寄生苷组葡萄糖浓度分别为(9.07f0.25)、(8.57f0.38) mmol/L。以上结果说明,该模型能够用于评价物质是否具有降糖效果,同时番石榴叶50%乙醇提取物、番石榴苷和广寄生苷均具有良好的降糖效果。
2.2.3 不同月份番石榴叶乙醇提取物降糖活性
采集2012年全年的番石榴叶,经50%乙醇提取,用脂肪细胞活性检测模型对质量浓度为1.2 mg/mL的各月份样品进行降血糖活性分析。
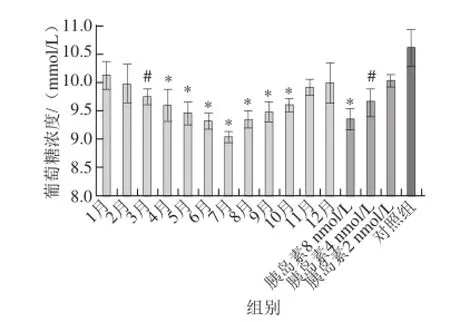
图3 不同月份番石榴叶乙醇提取物降糖活性Fig.3 Hypoglycemic activity of ethanol extracts of guava leaves in different months
如图3所示,在2012年全年的番石榴叶乙醇提取物中,以7月份的番石榴叶乙醇提取物的降糖效果最强,1月份的最弱。而6ü9月份番石榴叶乙醇提取物均可使细胞液中的葡萄糖浓度维持在较低水平。此外,1ü4月份的番石榴叶乙醇提取物降糖量呈现明显的增加趋势,9ü12月份表现为降糖量递减变化趋势。所以,2012年全年的番石榴叶乙醇提取物所对应的葡萄糖摄取水平表现为一个开口向下的抛物线。进一步将葡萄糖摄取水平与不同月份番石榴苷和广寄生苷两种化合物总含量比较,结果见图4。两种化合物总含量在不同月份的变化中亦表现为一个开口向下的抛物线,与葡萄糖摄取能力的变化趋势基本一致,这说明在脂肪细胞模型中,番石榴叶乙醇提取物的降糖能力和两种化合物总含量紧密相关,即番石榴苷和广寄生苷两种化合物总含量越高,则降糖效果越好,这充分说明番石榴苷和广寄生苷是番石榴叶的主要降糖物质基础。
2.3 Western blotting结果
细胞对葡萄糖的摄取量关键在于细胞外膜上GLUT4的数量,为研究各处理因素对GLUT4水平的影响,采用蛋白质免疫印迹分析法检测GLUT4的表达水平。如图5所示,对照组GLUT4灰度值最低,广寄生苷组GLUT4灰度值最高,为对照组的3.44 倍;其次是番石榴苷组,为对照组的2.85 倍;胰岛素组和番石榴叶50%乙醇提取物组的GLUT4灰度值分别为对照组的2.64、1.90 倍。
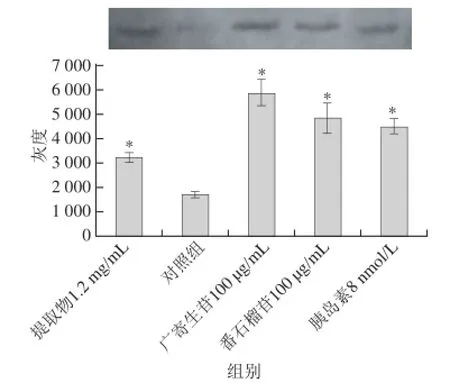
图5 各组大鼠脂肪细胞GLUT4蛋白质印迹灰度值Fig.5 GLUT4 expression on fat cell membrane treated by avicularin or guaijaverin
结合图2结果,分析番石榴叶50%乙醇提取物、广寄生苷和番石榴苷以及8 nmol/L胰岛素这4 组中葡萄糖摄取量和GLUT4含量的关系,结果见图6。GLUT4含量越高,细胞对葡萄糖摄取量越多,两者之间表现出明显的正相关性。

图6 不同样品作用下细胞摄取葡萄糖水平和GLUT4含量的关系Fig.6 Relationship between glucose-uptake level and GLUT4 expression
2.4 抑制游离脂肪酸释放活性
2.4.1 游离脂肪酸标准曲线
以棕榈酸为标准品,采用游离脂肪酸试剂盒和酶标仪检测细胞培养液中游离脂肪酸浓度。棕榈酸标准品浓度和吸光度之间线性回归方程为y=0.598 3x+0.238 6(R2=0.999 1)。这说明可通过比色测定吸光度来准确计算出细胞培养液中的游离脂肪酸浓度。
2.4.2 番石榴叶乙醇提取物、广寄生苷和番石榴抑制游离脂肪酸释放活性
将番石榴叶50%乙醇提取物、广寄生苷和番石榴苷干预后的细胞培养液进行检测分析,各组游离脂肪酸浓度如图7所示。
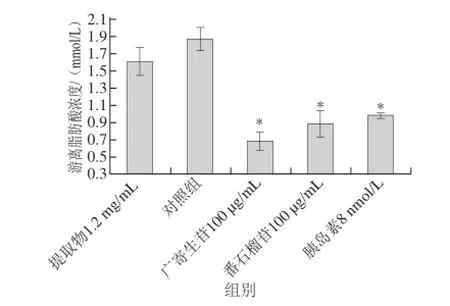
图7 脂肪细胞培养液中游离脂肪酸含量比较Fig.7 FFA content in the culture supernatant of fat cells
广寄生苷组细胞培养液中游离脂肪酸含量最低,为(0.69f0.11) mmol/L,其次是番石榴苷组,为(0.89f0.15) mmol/L,8 nmol/L胰岛素处理后细胞培养液中游离脂肪酸含量为(0.99f0.02) mmol/L;而番石榴叶50%乙醇提取物组培养液中游离脂肪酸含量较高,为(1.61f0.16) mmol/L,接近对照组的(1.87f0.13) mmol/L。可能是由于番石榴叶50%乙醇提取物中有效成分的作用浓度较低,因此其抑制效果较弱。
结合各组样品的降糖实验结果,以对照组葡萄糖和游离脂肪酸含量为基准值0,对各组细胞葡萄糖摄取活性和抑制游离脂肪酸释放活性之间的关系进行分析,结果见图8,除番石榴叶乙醇提取物组外,其余各组的糖脂代谢呈现出相似的趋势,即葡萄糖摄取活性和抑制游离脂肪释放活性趋势一致。
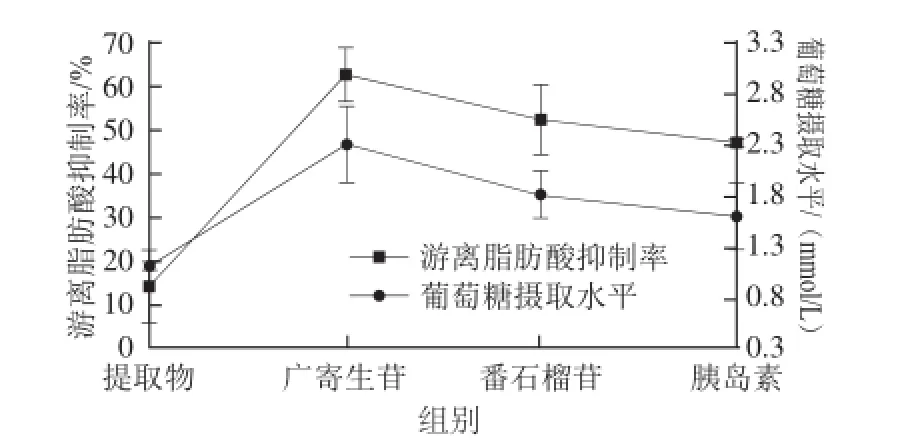
图8 样品对细胞摄取葡萄糖活性和抑制游离脂肪酸释放的效果分析Fig.8 Relationship between glucose-uptake level and percent inhibition of FFA release
3 结论与讨论
本实验采用反相高效液相色谱法测定番石榴叶中番石榴苷和广寄生苷两种化合物的含量,采用大鼠脂肪细胞模型对番石榴叶乙醇提取物、两种主要黄酮苷——番石榴苷和广寄生苷进行了降糖、抑制游离脂肪酸活性的研究,结果表明:1)番石榴苷和广寄生苷在不同月份番石榴叶中含量差异较大,以6ü9月份的番石榴叶中含量较高,最高在7月份,番石榴苷和广寄生苷含量分别为(3.405f0.124)、(3.332f0.134) mg/g;2)不同月份番石榴叶提取物降糖效果差异较大,以6ü9月份效果较好,最佳的是7月份的番石榴叶提取物,此时葡萄糖摄取量为(1.58f0.09) mmol/L。同时不同月份番石榴叶乙醇提取物降糖效果与广寄生苷和番石榴苷含量成正相关;3)番石榴苷和广寄生苷均能显著促进GLUT4蛋白在脂肪细胞中的表达,从而起到降糖效果,且GLUT4蛋白的表达量与葡萄糖摄取量成正相关;4)番石榴苷和广寄生苷均能显著抑制大鼠脂肪细胞游离脂肪酸的释放,且降糖活性与抑制游离脂肪的释放活性成正相关。
游离脂肪酸升高(脂毒性)导致的胰岛素抵抗已经成为当前该领域的研究热点。游离脂肪酸的增多将导致细胞内丝/苏氨酸激酶活性的增强,进而导致胰岛素受体底物(insulin receptor substrate,IRS)-1、IRS-2的丝/苏氨酸残基磷酸化,降低胰岛素受体后信号通路,影响磷脂酰-3激酶(phosphatidylinositol 3-kinase,PI3K)的活化,结果使葡萄糖转运蛋白(GLUT)的活力及细胞内其他胰岛素信号逐渐消失,从而发生胰岛素抵抗[24]。易屏等[25]研究证实,游离脂肪酸可抑制胰岛素刺激的葡萄糖转运,其机制在于抑制IRS-1和PI3K蛋白的表达,但对GLUT4蛋白表达却无影响,由此可见,游离脂肪酸对糖代谢作用在于影响胰岛素介导的信号转导,抑制GLUT4向细胞膜的迁移。本研究结果表明,番石榴苷和广寄生苷可促进GLUT4向脂肪细胞膜的迁移,其可能机制在于这两种化合物能抑制游离脂肪酸释放,避免了高浓度游离脂肪酸对胰岛素信号转导的损伤。
番石榴叶的降血糖效果已得到了充分的肯定,具有较高的药用价值,且原料来源丰富、成本较低,具有广泛的应用前景。本研究在初步确定番石榴苷和广寄生苷为番石榴叶降糖活性物质基础上,进一步围绕物质基础展开研究,在含量和降糖活性关系、GLUT4蛋白表达和抑制游离脂肪酸释放层面上,进一步证实了番石榴叶的降糖活性物质主要来自番石榴苷和广寄生苷这两种黄酮苷,本研究结果为番石榴叶的进一步开发和利用打下了坚实的基础。番石榴树生长所处的气温、光照、雨量等气候环境使番石榴叶的内质生化成分包括各种功能活性化合物等会发生较大变化。在中国广东地区,一般春季是在3ü5月,夏季是在6ü10月,秋季是11月,冬季是在12ü2月。从本研究结果来看,7月份番石榴叶降糖活性最高,6ü9月份这4 个月的番石榴叶活性基本持平,这可能与其活性物质在光合作用和呼吸作用的合成和分解的强度差值达到最大有关。冬季气温低,且光照时间短、光照强度弱,导致番石榴叶体内各种活性组分的合成能力降低,这可能是11ü2月份的番石榴叶降糖能力最差的原因。
参考文献:
[1] 陈介. 中国植物志[M]. 北京: 科学出版社, 1984, 53(1): 123.
[2] GUTIERRZ R M, MITCHELL S, SOLIS R V. Psidium guajava: a review of its traditional uses, phytochemistry and pharmacology[J]. Journal of Ethnopharmacology, 2008, 117(1): 1-27. DOI:10.1016/ j.jep.2008.01.025.
[3] 邵萌, 范春林, 王英, 等. 番石榴叶的化学成分及药理活性研究进展[J]. 天然产物研究与开发, 2009, 21(3): 525-528. DOI:10.3969/ j.issn.1001-6880.2009.03.038.
[4] 吴艳, 曲玮, 梁敬钰. 番石榴叶的研究进展[J]. 海峡药学, 2013, 25(12): 14-19.
[5] YORIKO D, KOUJI M. Anti-hyperglycemic and anti-hyperlipidemic effects of guava leaf extract[J]. Nutrition & Metabolism, 2010, 7(1): 9-17. DOI:10.1186/1743-7075-7-9.
[6] MUKHTAR H M, ANSARI S H, ALI M. Effect of water extract of Psidium guajava leaves on alloxan-induced diabetic rats[J]. Pharmazie, 2004, 59(9): 734-735.
[7] OJEWOLE J. Hypoglycemic and hypotensive effects of Psidium guajava Linn. (Myrtaceae) leaf aqueous extract[J]. Methods and Findings in Experimental and Clinical Pharmacology, 2005, 27(10): 689-695. DOI:10.1358/mf.2005.27.10.948917.
[8] 马山, 崔荣军, 郭尚福. 番石榴叶对2型糖尿病大鼠血糖的影响[J].牡丹江医学院学报, 2007, 28(6): 20-22.
[9] 王波, 刘衡川, 鞠长燕. 攀枝花地区野生番石榴叶不同提取物降血糖作用研究[J]. 四川大学学报(医学版), 2005, 36(6): 858-861.
[10] HSIEH C L, LIN Y C, KO W S, et al. Inhibitory effect of some selected nutraceutic herbs on LDL glycation induced by glucose and glyoxal[J]. Journal of Ethnopharmacology, 2005, 102(3): 357-363. DOI:10.1016/j.jep.2005.06.044.
[11] OH W K, LEE C H, LEE M S, et al. Antidiabetic effects of extracts from Psidium guajava[J]. Journal of Ethnopharmacology, 2005, 96(3): 411-415. DOI:10.1016/j.jep.2004.09.041.
[12] 王婧茹, 赵晶晶, 叶春玲, 等. 番石榴叶总三萜对2型糖尿病大鼠的降血糖和血脂作用[J]. 中国病理生理杂志, 2012, 28(6): 1109-1113. DOI:10.3969/j.issn.1000-4718.2012.06.027.
[13] 蔡丹昭, 刘华钢, 陈洪涛, 等. 番石榴叶总黄酮对实验性糖尿病小鼠血糖水平的影响[J]. 生命科学研究, 2009, 13(1): 34-37.
[14] 吴建中, 欧仕益, 陈静番, 等. 番石榴多糖对糖尿病小鼠的血糖及抗氧化能力的影响[J]. 中成药, 2007, 29(5): 668-671. DOI:10.3969/ j.issn.1001-1528.2007.05.013.
[15] WANG H, DU Y J, SONG H C. α-Glucosidase and α-amylase inhibitory activities of guava leaves[J]. Food Chemistry, 2010, 123(1): 6-13. DOI:10.1016/j.foodchem.2010.03.088.
[16] 魏明. 番石榴叶三萜化合物(PGL-15)对3T3-L1脂肪细胞分化及糖脂代谢的影响及其作用机制[D]. 广州: 暨南大学, 2010: 10-22.
[17] EIDENBERGER T, SELG M, KRENNHUBER K. Inhibition of dipeptidyl peptidase activity by flavonol glycosides of guava (Psidium guajava L.): a key to the beneficial effects of guava in type II diabetes mellitus[J]. Fitoterapia, 2013, 89: 74-79. DOI:10.1016/ j.fitote.2013.05.015.
[18] 邵祥辉. 番石榴叶降血糖成分分离、结构鉴定及机理研究[D]. 广州: 华南农业大学, 2011: 31-57.
[19] 欧阳文, 朱晓艾, 邵祥辉, 等. 番石榴叶乙酸乙酯萃取物化学成分研究[J]. 食品科学, 2014, 35(15): 30-37. DOI:10.7506/spkx1002-6630-201415007.
[20] RODBELL M. Metabolism of isolated fat cells I. effects of hormones on glucose metabolism and lipolysis[J]. Journal of Biological Chemistry, 1964, 239(2): 375-380.
[21] NISHIDE M, YOSHIKAWA Y, YOSHIKAWA E U, et al. Insulinomimetic Zn(II) complexes as evaluated by both glucoseuptake activity and inhibition of free fatty acids release in isolated rat adipocytes[J]. Chemical & Pharmaceutical Bulletin, 2008, 56(8): 1181-1183. DOI:10.1248/cpb.56.1181.
[22] 杨桂枝, 高小平, 晏菊芳, 等. GOD-POD法微量化测定方法的建立及其在3T3-L1脂肪细胞和HepG2细胞糖摄取中的应用[J]. 四川解剖学杂志, 2003, 11(1): 12-15.
[23] JACOBS D B, MOOKERJEE B K, JUNG C Y. Furosemide inhibits glucose transport in isolated rat adipocytes via direct inactivation of carrier proteins[J]. Journal of Clinical Investigation, 1984, 74: 1679-1685. DOI:10.1172/JCI111584.
[24] SHULMAN G I. Cellular mechanisms of insulin resistance[J]. Journal of Clinical Investigation, 2000, 106(2): 171-176. DOI:10.1172/ JCI10583.
[25] 易屏, 陆付耳, 陈广, 等. 游离脂肪酸诱导3T3-L1脂肪细胞胰岛素抵抗的分子机制[J]. 中国糖尿病杂志, 2008, 16(4): 221-224.
Hypoglycemic Activity of Avicularin and Guaijaverin in Guava Leaves
OUYANG Wen1, ZHU Xiaoai2, SU Lei1, CHEN Xuexiang2, YE Shumin1, CAO Yong2,*
(1. School of Pharmacy, Hunan University of Chinese Medicine, Changsha 410208, China;2. College of Food Science, South China Agricultural University, Guangzhou 510642, China)
Objective: To study the hypoglycemic activity of avicularin and guaijaverin in guava leaves. Methods: Reversedphase high performance liquid chromatography (RP-HPLC) was used to determine the content of avicularin and guaijaverin in guava leaves in different months of the year. The fat cell model was established to evaluate hypoglycemic activity of the ethanol extract of guava leaves, avicularin and guaijaverin respectively. Western blotting was used to analyze GLUT4 expression on the fat cell membrane. Free fatty acids as another index were also determined using a fatty acid kit. Results:The contents of guaijaverin and avicularin in guava leaves showed great difference in different months, and guava leaves had higher contents and hypoglycemic activity both between June and September. The guava leaf extract, guajava and avicularin could all significantly promote GLUT4 protein expression on the fat cell membrane and significantly inhibit the release of free fatty acids. Conclusion: Guaijaverin and avicularin are the major bioactive components in guava leaves with hypoglycemic activity and inhibitory capacity against free fatty acid release.
guava leaves; guaijaverin; avicularin; hypoglycemic activity; glucose transporter 4 (GLUT4); free fatty acid
10.7506/spkx1002-6630-201607031
TS201.2
A
1002-6630(2016)07-0168-07
欧阳文, 朱晓艾, 苏磊, 等. 番石榴叶中广寄生苷和番石榴苷的降糖作用[J]. 食品科学, 2016, 37(7): 168-174.
DOI:10.7506/spkx1002-6630-201607031. http://www.spkx.net.cn
OUYANG Wen, ZHU Xiaoai, SU Lei, et al. Hypoglycemic activity of avicularin and guaijaverin in guava leaves[J]. Food Science, 2016, 37(7): 168-174. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201607031. http://www.spkx.net.cn
2015-05-15
国家自然科学基金青年科学基金项目(31201321);湖南省教育厅优秀青年基金项目(13B084);湖南省“中药学”重点学科建设项目(湘教通[2011] 76号);湖南中医药大学中药化学教学团队项目(TD-007)
欧阳文(1981—),男,讲师,博士,研究方向为天然产物化学。E-mail:oyw810225@126.com
*通信作者:曹庸(1966—),男,教授,博士,研究方向为天然活性物质。E-mail:caoyong2181@scau.edu.cn
