蝗虫微孢子虫套式PCR检测方法的建立及应用
2016-11-14扈鸿霞马宇轩王艳红李占武
扈鸿霞,马宇轩,王艳红,林 峻,李占武,季 荣
蝗虫微孢子虫套式PCR检测方法的建立及应用
扈鸿霞1,马宇轩1,王艳红2,林 峻3,李占武2,季 荣1
(1新疆师范大学生命科学学院/新疆特殊环境物种多样性应用与调控实验室/中亚区域跨境有害生物联合控制国际研究中心,乌鲁木齐 830054;2新疆哈密地区蝗虫鼠害预测预报防治站,新疆哈密 839000;3新疆维吾尔自治区蝗虫鼠害预测预报防治中心站,乌鲁木齐 830046)
【目的】建立一种灵敏、快捷的检测蝗虫微孢子虫()的套式PCR方法,为运用微孢子虫防治蝗虫提供技术支持。【方法】以GenBank数据库中公布的保守性高的微孢子虫小核糖体亚单位RNA为目的基因,采用PrimerSelect软件设计两对特异的套式PCR引物-F1/-R1和.-F2/-R2,将微孢子虫液用0.2 mol·L-1KOH处理后得到的发芽液作为模板进行PCR扩增,建立以-F1/-R1为外侧引物、.-F2/-R2为内侧引物的套式PCR,扩增产为分别为298和242 bp。对引物浓度、退火温度及循环数进行优化,建立套式PCR方法,以此方法对梯度稀释的微孢子虫液进行灵敏性检测,并对采自哈密地区巴里坤北山的蝗虫样品进行检测。同时对提取的微孢子虫液进行传统的显微镜检测,并比较两种方法的灵敏度。【结果】 建立了蝗虫微孢子虫的套式PCR快速特异性检测方法,优化后的PCR反应体系均为20 μL:Buffer(10×)2.0 μL, dNTPs(10 mmol·L-1)0.3 μL,Taq DNA酶(250 U)0.3 μL,上、下游引物(10 μmol·L-1)各0.3 μL,微孢子虫发芽液(第2轮以第1轮产物10×稀释液为模板)1 μL,加水补充至20 μL;PCR反应程序为:94℃预变性3 min;94℃变性30 s,第1轮60℃退火(第2轮62℃退火)30 s,72℃延伸20 s,共35个循环;72℃延伸10 min,10℃保存。灵敏度试验显示,检测的微孢子虫数量可以达到12.2个孢子/µL(DNA量为1.07 pg·μL-1)。应用建立的套式PCR方法,对采自新疆哈密地区巴里坤北山的240头蝗虫样品进行了微孢子虫检测,检测结果为23.3%的阳性,而显微镜检测结果阳性仅为3.8%。【结论】 研究建立的套式PCR方法能够快速特异地检测蝗虫微孢子虫的感染,为蝗虫微孢子虫致病性研究及田间应用提供了技术支持。
蝗虫微孢子虫;套式PCR;检测
0 引言
【研究意义】蝗虫是威胁农牧业生产的重要害虫,目前对蝗虫控制主要依赖化学防治方法,给环境造成了严重污染。积极探索有效的生物治蝗技术,是当前国内外蝗灾综合治理的发展趋势。20世纪80年代,微孢子虫被作为控制蝗虫的生物制剂[1],现在已有121种直翅目昆虫能够感染蝗虫微孢子虫()[2]。蝗虫感染微孢子虫的早期阶段很难从蝗虫的临床症状观察出来。因此,喷洒微孢子虫制剂后,定期对蝗虫进行微孢子虫感染率检测,分析其扩散传播情况,掌握其流行动态等十分必要。【前人研究进展】蝗虫微孢子虫作为主要感染蝗虫脂肪体的脂肪细胞,因其具有垂直和水平传播能力、致病力温和、在宿主体内能够大量产生孢子和孢子在0℃以下长期保存等优点,已成为一种非常有效的蝗虫生物杀虫剂[3-4]。中国部分蝗区实施了微孢子虫生物治蝗措施,并取得了良好的效果[5-7]。目前微孢子虫的检测方法主要有显微镜检测技术、免疫学检测技术以及PCR检测技术[8]。传统的显微镜检测技术,操作繁琐,灵敏度差,容易带来主观误差;由于微孢子虫表面具有多抗原决定簇,假阳性比例较高,导致免疫学检测技术难以推广应用[9]。应用PCR方法检测微孢子虫的报道较多[10-12],与传统的显微镜法比较,PCR法更加灵敏和快捷[13]。如对家蚕微孢子虫()的检测灵敏度可达到102—104/mL[14]。套式PCR(nested-PCR)是一种建立在普通聚合酶链反应PCR基础上的核酸检测技术,使用内、外两对PCR引物对有限的目的基因进行扩增,经过两轮PCR扩增,能够很大程度地增加灵敏性和特异性,已应用于多种病原体和基因的检测[15],但在蝗虫微孢子虫的检测应用上未见报道。【本研究切入点】传统的显微镜检测方法对蝗虫微孢子虫检测中,不仅费时耗力,而且灵敏度低,人为因素影响检测结果,假阴性现象普遍存在。因此,建立一种更为方便快捷的检测技术,是科学研究与生产实践中的迫切需求。【拟解决的关键问题】根据微孢子小亚单位核糖体RNA基因(SSrRNA)中保守的区域序列设计了两对特异性的套式PCR引物,并进行应用评价,以期建立一种用于检测蝗虫微孢子的敏感性高,快捷可靠的检测方法,为蝗虫微孢子虫感染监测提供技术支持。
1 材料与方法
试验于2015年3月至2016年4月在中亚区域跨境有害生物联合控制国际研究中心实验室完成。
1.1 材料与试剂
1.1.1 材料 供试用飞蝗()虫卵和蝗虫微孢子虫浓缩液均由中国农业大学农业部生物防治重点开放实验室提供。将蝗卵置于人工气候箱中孵化、饲养,条件为温度(26±2)℃,相对湿度50%,光周期14L﹕10D。孵出后饲养供试验所用。
1.1.2 试剂 TaqDNA聚合酶、dNTPs、DL2000 marker购自大连宝生物工程有限公司;Goldviewer购自上海赛百盛基因技术有限公司;琼脂糖为Biowest公司原装;其他常规试剂均为分析纯产品。
1.2 仪器与设备
Mastercyclerpros梯度PCR仪和5430R台式高速冷冻离心机(德国Eppendorf公司产品);BIO-RAD Gel Doc XR+凝胶成像分体系统(美国BIO-RAD公司产品);NanoDrop2000(美国Thermo公司产品)。
1.3 方法
1.3.1 微孢子虫发芽液的制备 微孢子虫粗提液的制备参考丁晓宇等[16]的方法,将感染微孢子虫的蝗虫制成微孢子虫粗提液。蝗虫微孢子虫发芽处理参照何永强等[17]的方法,取0.5 mL蝗虫微孢子虫粗提悬浮液,5 000 r/min离心5 min,离心后弃上清,保留孢子,同时加入0.2 mol·L-1KOH 0.25 mL,充分混合,27℃诱导1 h后5 000 r/min离心5 min,去除诱导液,加入pH 7.4的PBS缓冲液0.5 mL重悬,25℃放置30 min,使孢子充分发芽。将上述发芽后的悬液5 000 r/min离心5 min,去除PBS,加入TE缓冲液0.5 mL悬浮,作为蝗虫微孢子虫的发芽液,直接供PCR作为模板使用。
1.3.2 引物设计 在GenBank数据库中下载小孢子虫属的SSUrRNA序列,通过序列比对后,利用PrimerSelect软件,在序列保守区域设计两对套式PCR引物(表1),由上海生工生物技术有限公司合成。

表1 PCR扩增引物
1.3.3 套式PCR条件的优化 两次PCR反应体系均为20 μL:Buffer(10×)2.0 μL,dNTPs(10 mmol·L-1)0.3 μL,Taq DNA酶(250 U)0.3 μL,上、下游引物(10 μmol·L-1)各0.3 μL,微孢子虫发芽液(或者第1轮产物稀释液)1 μL,加水补充到20 μL。第2轮PCR以第1轮PCR产物10倍倍比稀释为模版。PCR反应程序:94℃预变性3 min;94℃变性30 s,第1轮50—62℃优化退火温度(第2轮50—62℃优化退火温度)30 s,72℃延伸20 s,共30个循环;72℃延伸10 min,4℃保存。用胶回收试剂盒对PCR产物进行纯化,并与p-MD18T载体连接,转化入DH5感受态细胞,PCR检测后选取阳性克隆送上海生物工程有限公司测序。
1.3.4 灵敏度试验 将1×109个孢子/mL微孢子虫原液进行10倍梯度稀释作为母液(1×108个孢子/mL)使用,然后依次进行2倍梯度稀释,共21个稀释度。按照上述方法提取DNA后,从每个稀释度各取1 µL作为模板进行第1次PCR扩增(20 µl反应体系),然后进行第2次套式PCR扩增,最后通过1%的琼脂糖凝胶电泳检测该套式PCR反应体系的敏感性。
1.3.5 田间样品检测从新疆哈密地区巴里坤北山采
集的240份蝗虫样本,单头置于研钵中,加入1 mL蒸馏水研磨后过滤,制得微孢子虫粗提液。按照1.3.1方法发芽后,作为PCR模版,采用优化过的套式PCR检测方法进行扩增,结果经凝胶电泳分析。同时对样品进行常规的显微镜镜检,统计并比较这两种方法的检测结果。
2 结果
2.1 套式PCR退火温度优化及最终反应体系建立
两轮PCR退火温度分别在50、52、54、56、58、60和62℃下电泳结果如图1。结果表明,第1轮PCR最佳退火温度为60℃,第2轮PCR最佳退火温度为62℃。套式PCR最终反应体系为Buffer(10×)2.0 μL,dNTPs(10 mmol·L-1)0.3 μL,Taq DNA酶(250 U)0.3 μL,上、下游引物(10 μmol·L-1)各0.3 μL,微孢子虫发芽液(或者第1轮产物稀释液)1 μL,加水补充到20 μL。第2轮PCR以第1轮PCR产物10倍倍比稀释为模版。PCR反应程序为94℃ 3 min;94℃ 30 s、60℃(第2轮62℃)30 s、72℃ 20 s,30个循环。PCR第1轮产物扩增片段为298 bp,经克隆测序后Blast分析表明,序列与GenBank中公布的山松甲虫()微孢子虫(登录号:GQ337704)、玉米螟()微孢子虫(登录号:NFU26532)等小亚单位核糖体RNA序列同源性分别为99%和99.7%;PCR第2轮产物片段为242 bp(图2)。
2.2 灵敏度检测
将1×109孢子/mL微孢子虫原液进行10倍梯度稀释作为母液(DNA量为8.8 ng·µL-1)使用,然后依次进行2倍梯度稀释,共21个稀释度。从每个稀释液各取1 µL作为模板进行套式PCR扩增。结果表明,套式PCR的第1次扩增可检测到微孢子虫为781.25个孢子/µL(DNA量为27.5 pg·µL-1)(图2),将第1次PCR产物作为模板进行套式PCR的第2次扩增后,在对原液进行81 920倍稀释后仍可扩增出清晰的目的片段(图2),此模板微孢子虫含量为12.2个孢子/µL(DNA量为1.07 pg·µL-1)。

A:第1轮PCR The first round PCR;B:第2轮PCR The second round PCR;1—7:分别为50、52、54、56、58、60和62℃退火温度扩增的条带 Amplified bands of the PCR annealing temperature of 50, 52, 54, 56, 58, 60 and 62℃, respectively;M:DL-2000 Marker

M:DL-2000 marker;1—21:分别为1﹕21—1﹕221倍稀释1﹕21-1﹕221 dilution, respectively;“-”:阴性对照Negative control
2.3 田间蝗虫微孢子虫检测
利用建立的套式PCR方法对哈密地区巴里坤北山的240头蝗虫进行检测,同时建立阴、阳性对照,检测结果56头扩增出了242 bp的条带,为阳性,184头为阴性(图3),阳性率为23.3%。与显微镜检测结果进行比较,显微镜检测结果阳性为9头,阳性率为3.8%。套式PCR方法与显微镜观察方法中,检测每头平均耗时分别为5和24 min(表2)。
3 讨论
21世纪以来,化学防控蝗虫的方法已逐步被生物防治方法替代[18]。早在20世纪80年代,新疆就有用微孢子虫防治草原蝗虫的报道[19]。蝗虫感染微孢子虫后常呈亚致病性状态,是一种慢性的隐性感染,因此对于草原蝗虫是否感染微孢子虫进行长期监测具有重要意义。
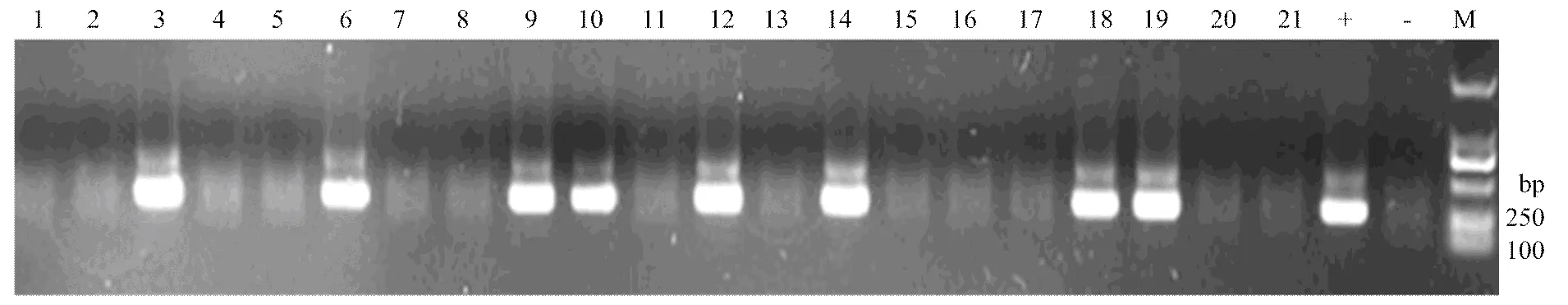
M:DL-2000 DNA Marker;1—21:检测样品Tested samples;+:阳性对照positive control;-:阴性对照negative control
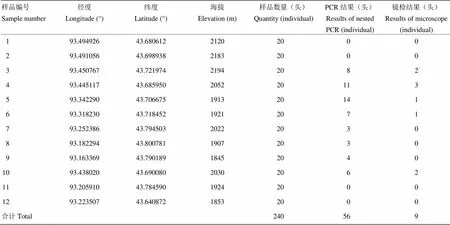
表2 哈密地区巴里坤北山蝗虫微孢子虫检测结果
PCR作为近年发展起来的一种特异性扩增方法,因其具有快速、特异、灵敏和简便的优点被广泛地运用于检测家蚕微孢子虫病[20]。而套式PCR方法相对于普通PCR具有准确和高敏感性等优点,已被广泛运用到动植物病毒的检测等很多领域[21-24]。
在本研究中,第1轮PCR扩增可检测到781.25个孢子/µL,如果采用传统的显微镜检测法,在血球计数板中央的25方格计数区中,样品体积为0.1 µL,相当于有78.125个微孢子,敏感性并没有优于显微镜检法。但经过第2轮PCR扩增后,可检测微孢子虫含量为12.207个孢子/µL,相当于显微镜检法中的视野中仅有1.22个微孢子虫,灵敏度明显高于传统的检测方法。在对哈密地区巴里坤北山蝗虫微孢子虫的检测中,套式PCR方法的检出率高于显微镜观察检出率;其次,建立的套式PCR方法可以避免人员技术熟练因素造成的误差,适合快速、大规模的流行病学调查。利用建立的蝗虫微孢子虫套式PCR方法对不同微孢子虫浓度感染的蝗虫进行检测,均扩增出了目的条带,具有良好的应用前景。
本研究参考何永强等[17]的方法,直接取蝗虫微孢子虫的发芽液作为PCR的模板,简便快捷,重复性好。引物设计则选择了在同属(柞蚕微孢子属等)具有高度保守性的微孢子虫SSrRNA基因序列核糖体RNA为模板[25-28],选取该区域设计两对特异性引物进行微孢子虫的检测和鉴定,测序结果表明PCR产物为特异性扩增。这充分验证了PCR方法的可靠性及小亚单位核糖体RNA序列的高度保守性。
4 结论
建立的套式PCR方法具有快速、灵敏、特异性强的应用价值。该方法可用于蝗虫微孢子虫的快速检测,为蝗虫微孢子虫流行动态监测提供了新的有效方法,建议推广使用。
References:
[1] Lomer C J, Bateman R P, Johnson D L, Langewald J, Thomas M. Biological control of locusts and grasshoppers.,2001, 46: 667-702.
[2] Tounou A K, Kooyman C, Douro-Kpindou O K, Poehling H M. Interaction betweenandvar., two pathogens of the desert locust,under laboratory conditions., 2008, 97(3): 203-210.
[3] Lange C, Azzaro F G. New case of long-term persistence of(Microsporidia) in melanopline grasshoppers (Orthoptera: Acrididae: Melanoplinae) of Argentina., 2008, 99(3): 357-359.
[4] Plischuk S, Bardi C J, Lange C E. Spore loads of(Microspoidia) in heavily infected grasshoppers (Orthoptera: Acridoidea) of the Argentine Pampas and Patagonia., 2013, 114(1): 89-91.
[5] 蔡德江, 李鹏, 石旺鹏. 蝗虫微孢子虫与卡死克互补应用对海南蝗虫的控制作用. 热带农业科学, 2008, 28(2): 21-24.
Cai D J, Li P, Shi W P. Effects of complementary application ofand cascade on locusts and grasshoppers in Hainan., 2008, 28(2): 21-24. (in Chinese)
[6] 蒋湘, 石旺鹏. 蝗虫微孢子虫对青海省天峻县草原蝗虫的持续控制作用. 黑龙江畜牧兽医, 2003(2): 52-53.
Jiang X, Shi W P. Continuous control ofto grasshopper of tianjun county of qinghai province., 2003(2): 52-53. (in Chinese)
[7] 任程, 蒋湘, 石旺鹏. 蝗虫微孢子虫防治青藏高原蝗虫对主要天敌种群数量的影响. 黑龙江畜牧兽医, 2004(4): 11-13.
Ren C, Jiang X, Shi W P. Effect offor controlling grasshopper on natural enemy in the grassland., 2004(4): 11-13. (in Chinese)
[8] 王永宾, 刘吉平. 微孢子虫检测技术的研究进展. 中国寄生虫学与寄生虫病杂志, 2009, 27(2): 161-166.
Wang Y B, Liu J P. Research progress on the technology of microsporidian detection., 2009, 27(2): 161-166. (in Chinese)
[9] Franzen C, Müller A. Molecular techniques for detection, species differentiation, and phylogenetic analysis of microsporidia., 1999, 12(2): 243-285.
[10] Blaker E A, Strange J P, James R R, Monroy F P, Cobb N S. PCR reveals high prevalence of non/low sporulating(microsporidia) infections in bumblebees () in Northern Arizona., 2014, 123: 25-33.
[11] Joseph J, Sharma S, Murthy S I, Krishna P V, Garg P, Nutheti R, Kenneth J, Balasubramanian D. Microsporidial keratitis in India: 16S rRNA gene-based PCR assay for diagnosis and species identification of microsporidia in clinical samples., 2006, 47(10): 4468-4473.
[12] Valencakova A, Balent P, Ravaszova P, Horak A, Obornik M, Halanova M, Malcekova B, Novotny F, Goldova M. Molecular identification and genotyping of Microsporidia in selected hosts., 2012, 110(2): 689-693.
[13] Milks M L, Sokolova Y Y, Isakova I A, Fuxa J R, Mitchell F, Snowden K F, Vinson S B. Comparative effectiveness of light-microscopic techniques and PCR in detecting(Microsporidia) infections in red imported fire ants ()., 2004, 51(2): 187-191.
[14] 刘吉平, 曹阳, Smith J E, 徐兴耀. 模拟感染家蚕微粒子病的PCR分子诊断技术研究. 中国农业科学, 2004, 37(12): 1925-1931.
Liu J P, Cao Y, Smith J E, Xu X Y. Studies on the application of PCR molecular diagnosis to silkworms with simulated pebrine disease., 2004, 37(12): 1925-1931. (in Chinese)
[15] Fallahi S, Seyyed Tabaei S J, Pournia Y, Zebardast N, Kazemi B. Comparison of loop-mediated isothermal amplification (LAMP) and nested-PCR assay targeting the RE and B1 gene for detection ofin blood samples of children with leukaemia., 2014, 79(3): 347-354.
[16] 丁晓宇, 张龙. 蝗虫微孢子虫与绿僵菌协调使用对东亚飞蝗的毒力测定. 北京农学院学报, 2009, 24(1): 9-14.
Ding X Y, Zhang L. Virulence ofandagainst the nymphs of., 2009, 24(1): 9-14. (in Chinese)
[17] 何永强, 吴姗, 鲁兴萌, 邱海洪, 帅江冰, 张晓峰, 王素华, 徐国群, 李光才, 董强. 不同DNA抽提方法对普通PCR和实时荧光定量PCR方法检测家蚕微孢子虫的影响. 昆虫学报, 2011, 54(11): 1329-1334.
He Y Q, Wu S, Lu X M, Qiu H H, Shuai J B, Zhang X F, Wang S H, Xu G Q, Li G C, Dong Q. Influence of DNA extraction methods on detection ofby traditional PCR and real-time PCR methods., 2011, 54(11): 1329-1334. (in Chinese)
[18] 洪军, 杜桂林, 王广君. 我国草原蝗虫发生与防治现状分析. 草地学报, 2014, 22(5): 929-934.
Hong J, Du G L, Wang G J. The occurring and control situation of grasshopper in the grassland of China., 2014, 22(5): 929-934. (in Chinese)
[19] 王丽英, 严毓骅, 董雁军, 林志亮. 蝗虫微孢子虫对东亚飞蝗及蒙、新草原蝗虫的感染试验. 北京农业大学学报, 1987, 13(4): 459-462.
Wang L Y, Yan Y H, Dong Y J, Lin Z L. Observations of a microsporidian parasitecanning in the oriental migratory locust ((Meyen)) and other hosts from inner Mongolia and Xinjiang., 1987, 13(4): 459-462. (in Chinese)
[20] 邱宝利, 徐兴耀, 牟志美, 周鹏. 核酸分子杂交技术鉴别和检测家蚕微孢子虫的研究. 山东农业大学学报 (自然科学版), 2002, 33(1): 14-18.
Qiu B L, Xu X Y, Mu Z M, Zhou P. Identification and detection ofnaegeli by nucleic acid hybridization., 2002, 33(1): 14-18. (in Chinese)
[21] 吴嫒琼, 谢芝勋, 胡庭俊, 谢丽基, 罗思思, 邓显文, 谢志勤, 黄莉, 黄娇玲, 曾婷婷. H4亚型禽流感病毒套式RT-PCR检测方法的建立. 动物医学进展, 2015, 36(2): 11-15.
WU A Q, Xie Z X, Hu T J, Xie L J, Luo S S, Deng X W, Xie Z Q, Huang L, Huang J l, Zeng T T. Establishment of nested RT-PCR for detection of H4 subtype of., 2015, 36(2): 11-15. (in Chinese)
[22] 王婧, 毕阳, 朱艳, 韩舜愈, 祝霞, 盛文军, 李敏. 巢式PCR快速检测西瓜细菌性果斑病菌. 中国农业科学, 2014, 47(2): 284-291.
Wang J, Bi Y, Zhu Y, Han S Y, Zhu X, ShenG W J, Li M. Nested-PCR rapidly detectesubsp.from watermelon seeds., 2014, 47(2): 284-291. (in Chinese)
[23] Uppal B, Singh O, Chadha S, Jha A K. A comparison of nested PCR assay with conventional techniques for diagnosis of intestinal cryptosporidiosis in AIDS cases from northern India., 2014, 2014: Article ID 706105.
[24] 高文辉, 白昌明, 蔡生力, 王崇明. 基于牡蛎疱疹病毒DNA聚合酶基因的巢式PCR检测方法的建立及应用. 水产学报, 2016, 40(3): 326-333.
Gao W H, Bai C M, Cai S L, Wang C M. The development and application of nested PCR detection method for Ostreid herpesvirus-1 based on DNA polymerase gene., 2016, 40(3): 326-333. (in Chinese)
[25] 王见杨, 黄可威, 陆长德. 家蚕微粒子病原虫 ()小亚基核糖体RNA全基因的克隆及其二级结构的构建. 昆虫学报, 2002, 45(3): 290-295.
Wang J Y, Huang K W, Lu C D. Analyses of small subunit ribosomal RNA sequence of the microsporidium,and its secondary structure., 2002, 45(3): 290-295. (in Chinese)
[26] 王林玲, 陈克平, 姚勤, 高贵田, 赵远. 柞蚕微孢子核糖体基因和转录间隔区的序列及系统进化分析. 中国农业科学, 2006, 39(8): 1674-1679.
Wang L L, Chen K P, Yao Q, Gao G T, Zhao Y. The sequence and phylogenetic analysis of the ribosomal RNA gene and the ITS region of., 2006, 39(8): 1674-1679. (in Chinese)
[27] Stentiford G D, Bateman K S, Feist S W, Chambers E, Stone D M. Plastic parasites: extreme dimorphism creates a taxonomic conundrum in the phylum Microsporidia., 2013, 43(5): 339-352.
[28] Gillett A K, Ploeg R, O'Donoghue P J, Chapman P A, Webb R I, Flint M, Mills P C. Ultrastructural and molecular characterisation of an-like microsporidian in Australian sea snakes (Hydrophiinae)., 2016, 11(3): e0150724.
(责任编辑 岳梅)
Establishment and Application of Nested-PCR Method for Detection of
HU Hong-xia1, MA Yu-xuan1, WANG Yan-hong2, LIN Jun3, LI Zhan-wu2, JI Rong1
(1College of Life Sciences, Xinjiang Normal University/Key Laboratory of Conservation Biology and Management for Xinjiang Special Species/International Research Center for Cross-border Pest Management in Central Asia, Urumqi 830054;2Xinjiang Hami Locust and Rat Plagues Forecast Station, Hami 839000, Xinjiang;3The Locust and Rat Plagues Forecast Center of Xinjiang Uygur Autonomous Region, Urumqi 830046)
【Objective】The objective of this study is to develop a rapid, sensitive and specific nested-PCR method for detection ofand provide effective means for the monitoring of locusts and biological control. 【Method】According to the sequence of small subunit ribosomal RNA genes ofpublished in GenBank, two pairs of primers were designed and synthesized (-F1/-R1 and.-F2/-R2), and a series of assays (involving concentrations of primer pairs, Tm value and the number of cycling) were conducted to optimize the nested-PCR.treated with 0.2 mol·L-1KOH were used as template for nested-PCR.-F1 and-R1 were employed as the initial primers for the first amplification, which generated a 298 bp product, and.-F2 and-R2 as the secondary primers for the final amplification, which generated a 242 bp fragment. Analytical sensitivity and reproducibility were assessed, respectively. The nested-PCR method was used to detect a series of dilution ofsuspension, and to test thesuspension derived from Barkol Bei mountain in Hami region. At the same time, thesuspension was extracted and detected with the traditional microscope, and then the sensitivity of two methods was compared. 【Result】The nested PCR was established. The optimal parameters for the nested PCR reaction were performed in standard mixtures of 20 μL containing 2.0 μL of Buffer (10×), 0.3 μL of dNTPs (10 mmol·L-1), 0.3 μL of Taq DNA polymerase (250 U), 0.3 μL of each primer (10 μmol·L-1), 1 μL of DNA template (or the diluent of the first-round product was then diluted 10-fold with water) and 15.8 μL of double distilled water. Each PCR run was carried out in a thermal cycler. The conditions of the amplification were as follows: 1 cycle at 94℃ for 3 min, 35 cycles at 94℃ for 30 s, 60℃ (62℃ at secondary PCR) for 30 s, and 72℃ for 20 s and then 1 cycle at 72℃ for 10 min, with a final hold at 10℃. The result of two rounds PCR showed that the nested PCR assay could detect 12.2 spores/µL (1.07 pg DNA). A total of 240 locust samples from Bei mountain in Hami region were analyzed by nested PCR and microscope testing, respectively, the results showed that the positive detection rate was 23.3% and 3.8%, respectively. 【Conclusion】 The nested PCR mothed established in this study is more sensitivity than traditional microscope detection method. As well as, this assay can avoid human error, and more suitable for rapid and large-scale infection intensity survey.
; nested polymerase chain reaction; detection
2016-05-16;接受日期:2016-08-02
新疆维吾尔自治区自然科学基金面上项目(2014211A042)
联系方式:扈鸿霞,E-mail:huhongxia111@126.com。通信作者季荣,E-mail:jirong@xjnu.edu.cn。通信作者李占武,E-mail:lizhanwu2016@126.com
