意大利蜜蜂蜂王与工蜂幼虫甲基供体S-腺苷甲硫氨酸合成与代谢的差异
2016-11-14王红芳胥保华
王 丽,王红芳,胥保华
意大利蜜蜂蜂王与工蜂幼虫甲基供体S-腺苷甲硫氨酸合成与代谢的差异
王 丽,王红芳,胥保华
(山东农业大学动物科技学院,山东泰安 271018)
【目的】研究意大利蜜蜂()蜂王与工蜂幼虫甲基供体S-腺苷甲硫氨酸(S-adenosylmethionine, SAM)合成与代谢的差异,为探索DNA甲基化与蜜蜂级型分化的关系提供理论依据。【方法】试验选用890只1日龄雌性蜂幼虫,分别来自5群姐妹蜂王群。其中445只进行人工育王(89只/群);剩余445只培育成工蜂(89只/群)。取3、4、5日龄蜂王和工蜂幼虫,测定其体内SAM合成与代谢关键酶基因表达和酶活性的差异。【结果】蜂王幼虫SAM含量随日龄的增加变化不显著(>0.05);工蜂幼虫SAM含量随日龄增加呈上升趋势(<0.05)。蜂王幼虫基因表达量随日龄增加呈梯度下降的趋势(<0.01),而工蜂幼虫表达随日龄变化不显著(>0.05);3日龄与4日龄时,蜂王幼虫表达量显著高于工蜂(<0.05),5日龄时,工蜂幼虫表达量显著高于蜂王(<0.05)。与表达在两级型间差异不显著(>0.05),其中蜂王幼虫表达随日龄增加无显著变化(>0.05),但其酶活性呈下降趋势(<0.05);工蜂幼虫表达随日龄增加呈下降趋势(>0.05),其酶活性呈上升趋势(<0.01),其中3日龄与4日龄时,蜂王幼虫Dnmt1酶活性显著高于工蜂幼虫(<0.05),而5日龄时,工蜂幼虫Dnmt1酶活性显著高于蜂王幼虫(<0.05)。蜂王表达量随日龄增加呈下降趋势(<0.05),工蜂幼虫表达随日龄增加变化不显著(>0.05);蜂王幼虫Dnmt3酶活性随日龄变化不显著(>0.05),工蜂幼虫Dnmt3酶活性随日龄变化显著(<0.05),但蜂王幼虫Dnmt3酶活性在3、4、5日龄均显著高于工蜂幼虫(<0.01)。【结论】3—5日龄意大利蜜蜂蜂王幼虫与工蜂幼虫体内活性甲基供体SAM的合成与代谢存在差异。在4日龄之前,蜂王幼虫SAM的合成比工蜂活跃,4日龄之后,工蜂幼虫的SAM合成与蜂王幼虫相近;在4日龄之前,SAM参与DNA维持甲基化的代谢过程,蜂王幼虫比工蜂活跃,4日龄之后,工蜂幼虫比蜂王幼虫活跃;在3—5日龄,SAM参与DNA从头甲基化的代谢活性,蜂王幼虫始终不低于工蜂幼虫。
意大利蜜蜂;蜂王幼虫;工蜂幼虫;甲基供体;合成;代谢
0 引言
【研究意义】蜜蜂的级型分化是蜜蜂生物学领域的研究热点,近年来研究表明DNA甲基化是影响蜜蜂级型分化的重要分子机制[1],S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)是DNA甲基化的直接甲基供体。探究意大利蜜蜂()蜂王与工蜂幼虫甲基供体SAM合成与代谢的差异,对丰富蜜蜂级型分化理论具有重要意义。【前人研究进展】蜂群中具有生育能力的蜂王和不具生育能力的工蜂是雌性蜜蜂的两种级型[2]。所谓“蜜蜂的级型分化”就是指具有相同遗传物质的二倍体受精卵,在幼虫期不同食物及生存空间等条件的诱导下发育成表型差异巨大的蜂王和工蜂的过程。由此可见,蜂王与工蜂这种表型的差异并不是遗传物质造成,而是差别饲喂的结果。早在1955年就有科学家提出食物成分差异决定蜜蜂级型分化的观点[3],目前研究较多的影响级型分化的营养成分主要包括糖分[4-6]、王浆主蛋白1[7]、10-羟基癸烯酸[8-10]、MicroRNA[11-12]等。研究证实环境因子(如食物等)可借助于表观遗传机制改变基因表达而调控个体发育及疾病发生[13-15],这种环境与基因之间的互作机制在蜜蜂中普遍存在[16-17]。表观遗传机制包括DNA甲基化、非编码RNA调控、组蛋白修饰、遗传印记和X染色体失活等[18],已有研究证实DNA甲基化是蜜蜂级型分化的主要机制[1]。DNA甲基化是在不改变基因组序列的前提下,通过DNA的甲基化修饰调控基因表达的表观遗传现象[19]。SAM是DNA甲基化的直接活性甲基供体。在动物体内,L-蛋氨酸在ATP参与的情况下由S-腺苷甲硫氨酸合成酶(S-adenosylmethionine synthetase,SAMS)催化合成了SAM,SAM又在DNA甲基转移酶(DNA methyltransferase,Dnmt)的催化下将活性甲基从SAM上转移到胞嘧啶上,使其转变为5-甲基胞嘧啶,从而完成DNA的甲基化[20]。蜜蜂具有3种DNA甲基转移酶:2种Dnmt1、1种Dnmt2和1种Dnmt3[21-22]。研究发现,DNA甲基化水平差异主要发生在幼虫4日龄前后,当幼虫发育到4日龄后,蜂王幼虫甲基化水平下降,工蜂幼虫甲基化水平继续上升[23],也有研究认为3.5日龄是幼虫级型分化的关键时期,大于4日龄的工蜂幼虫不可能再发育成蜂王[24]。【本研究切入点】DNA甲基化作为影响蜜蜂级型分化的重要机制,大部分的研究更关注两级型间基因组甲基化的差异,蜂王与工蜂甲基供体是否存在差异至今未见报道。【拟解决的关键问题】通过比较蜂王幼虫与工蜂幼虫体内甲基供体SAM的含量、基因表达、基因表达与酶活性,确定意大利蜜蜂蜂王与工蜂幼虫甲基供体SAM合成与代谢的差异,为探究蜜蜂级型分化机理提供理论依据。
1 材料与方法
试验于2015年在山东农业大学动物科技学院蜜蜂实验基地进行。
1.1 供试昆虫
意大利蜜蜂蜂王与工蜂幼虫。
1.2 主要试剂与仪器
昆虫DNA甲基转移酶1(Dnmt1)酶联免疫分析试剂盒(BYE97147,艾伦生物公司)、昆虫DNA甲基转移酶3(Dnmt3)酶联免疫分析试剂盒(BYE97151,艾伦生物公司)、昆虫S-腺苷甲硫氨酸(SAM)酶联免疫分析试剂盒(BYE97165,艾伦生物公司);总蛋白定量测试盒(A045-2,南京建成生物科技有限公司);RNA提取试剂盒(Total RNA kitⅡ,R6934-01);反转录试剂盒(Transcriptor First Stand cDNA Synthesis Kit,Roche,04897030001,Roche);荧光定量试剂盒(FastStart Universal SYBR Green Master(Rox),04913914001,Roche);高压灭菌锅(日本SANYO公司);ELx808超级酶标仪(Gene基因有限公司);7500 Real-Time荧光定量PCR仪(ABI公司);5810R台式冷冻离心机(日本日立公司、Eppendorf公司);UV-2450紫外分光光度计(日本岛津公司)。全自动样品快速研磨仪(Tissuelyser-24)(上海净信科技)。
1.3 试验处理
选取5群健康、群势相同、有继箱、处于产卵高峰期且哺育能力较强的姐妹蜂群作为试验蜂群。先在蜂群继箱内放置一张空的巢脾24 h,以待工蜂清理干净巢房供蜂王产卵用;将继箱内的空巢脾放于蜂王产卵控制器内,并将蜂王转移至该巢脾上,关好产卵控制器以迫使蜂王在空脾产卵,24 h后释放蜂王于巢箱内的蜂脾上,并从产卵控制器中取出产卵脾放到该群继箱内,待虫卵孵化为1日龄的幼虫时,进行移虫育王,每群随机选取89只1日龄的幼虫移入人工王台,共培育蜂王幼虫445只。原幼虫脾标记好放回原群继箱内,让其朝着工蜂级型自然发育。每群分别于3、4、5日龄取蜂王和工蜂幼虫各10—30只,每个样品5个重复(每群作为一个重复),为获得足够多的样品以满足下述研究的需要,以上试验处理可重复操作。
1.4 测定指标
1.4.1 样本处理 提取3、4、5日龄蜂王和工蜂幼虫样品总mRNA,反转录试剂盒立即反转为cDNA,cDNA样品储存于-80℃冰箱内,用于测定蜜蜂幼虫相关基因的表达水平。
取3、4、5日龄意大利蜜蜂蜂王和工蜂幼虫加入PBS(W﹕V=1﹕100),于4℃条件下进行匀浆,匀浆液4℃条件下3 000 r/min离心20 min后取上清,上清液用于测定蜜蜂幼虫虫体蛋白浓度、SAM含量以及甲基转移酶1(Dnmt1)和甲基转移酶3(Dnmt3)的酶活性。
1.4.2 蜂王与工蜂幼虫虫体总蛋白浓度的测定 取3、4、5日龄蜂王和工蜂幼虫1%的组织匀浆,采用南京建成公司的A045-2总蛋白定量测试盒测定幼虫体蛋白浓度,每个处理5个重复,每个样品重复测定3次。
1.4.3 蜂王幼虫与工蜂幼虫体内活性甲基供体SAM含量测定 取3、4、5日龄蜂王幼虫与工蜂幼虫1%的组织匀浆,每个处理5个重复,采用艾伦生物公司的BYE97165昆虫S-腺苷甲硫氨酸酶连免疫分析试剂盒检测蜂王幼虫与工蜂幼虫体内甲基供体SAM含量(用虫体总蛋白含量校正)。
1.4.4 蜂王幼虫与工蜂幼虫体内Dnmt1和Dnmt3酶活性测定 取3、4、5日龄蜂王幼虫与工蜂幼虫1%的组织匀浆,每个处理5个重复,采用艾伦生物公司的BYE97147昆虫DNA Dnmt1酶联免疫分析试剂盒和BYE97151昆虫DNA Dnmt3酶联免疫分析试剂盒测定Dnmt1和Dnmt3的酶活性(Dnmt1和Dnmt3酶活性均用虫体总蛋白浓度校正)。
1.4.5 蜂王幼虫与工蜂幼虫体内、、基因表达量 按照(Total RNA kitⅡ,R6934-01)方法提取样品总mRNA,采用Transcriptor First Strand cDNA Synthesis Kit(Roche,大连)反转录试剂盒将提取的RNA样品立即反转录为cDNA,反转录步骤如下:体系混匀后,25℃反应10 min,55℃反应30 min,85℃灭活5 min,4℃终止反应,1个循环。调节样品cDNA浓度于相同水平后,-20℃保存备用。荧光定量PCR取2 µl cDNA(2倍稀释)加入到180 µl荧光定量体系中,按照荧光定量试剂盒FastStart Universal SYBR Green Master(Rox)(Roche,大连)操作指南,用real time-PCR仪检测目的基因相对表达量。目的基因引物设计参考序列来自于NCBI数据库,以为内参,委托生工生物科技(上海)股份有限公司设计并合成引物,引物序列如表1所示。

表1 基因引物序列
1.5 数据分析
数据采用SAS 9.2软件进行因素方差分析(Factorial ANOVA)和邓肯氏法(Duncan)多重比较,结果表示为平均值±标准差。<0.05表示差异显著。
2 结果
2.1 蜂王幼虫与工蜂幼虫体内SAM含量及表达量
在3—5日龄期间,蜂王幼虫体内的SAM含量随日龄的增加变化不显著(>0.05),总体呈先下降后回升的趋势;工蜂幼虫SAM含量呈显著上升趋势(<0.05)。3日龄时,蜂王幼虫SAM含量显著高于工蜂幼虫(<0.05)。相比于3日龄,4日龄时蜂王幼虫SAM含量与工蜂幼虫呈现相近的水平(>0.05);5日龄时,工蜂幼虫SAM含量出现显著上升(<0.05),且上升到与蜂王幼虫SAM含量相同的水平(图1)。
蜂王幼虫表达量随日龄增加呈梯度下降的趋势(<0.01);工蜂幼虫表达量在3、4、5日龄间差异不显著(>0.05);其中3日龄与4日龄时,蜂王幼虫表达量显著高于工蜂幼虫(<0.05),5日龄时,工蜂幼虫表达量显著高于蜂王幼虫(<0.05)(图2)。
2.2 蜂王幼虫与工蜂幼虫体内表达量及Dnmt1酶活性
蜂王幼虫与工蜂幼虫体内表达在两级型间差异不显著(>0.05);其中蜂王幼虫表达量随日龄增加无显著变化(>0.05),工蜂幼虫表达量随日龄增加呈下降趋势(>0.05)(图3)。

图1 3、4、5日龄蜂王幼虫与工蜂幼虫体内SAM含量

图3 3、4、5日龄蜂王幼虫与工蜂幼虫体内Dnmt1a表达量
蜂王幼虫Dnmt1酶活性随日龄增加呈下降趋势(<0.05),而工蜂幼虫呈上升趋势(<0.01),其中3日龄与4日龄时,蜂王幼虫Dnmt1酶活性显著高于工蜂幼虫(<0.05),而5日龄时工蜂幼虫Dnmt1酶活性显著高于蜂王幼虫(<0.05)(图4)。
2.3 蜂王幼虫与工蜂幼虫体内Dnmt3酶活及表达量
在3—5日龄,表达量在两级型间差异均不显著(>0.05),但其在蜂王幼虫和工蜂幼虫中的变化趋势不同。蜂王幼虫表达量随日龄增加呈下降趋势(<0.05),其中5日龄蜂王幼虫表达量显著低于3日龄的蜂王幼虫(<0.05),但与4日龄蜂王幼虫差异不显著(>0.05)。工蜂幼虫表达随日龄增加变化不显著(>0.05),4日龄后到5日龄表达量明显高于蜂王幼虫(图5)。
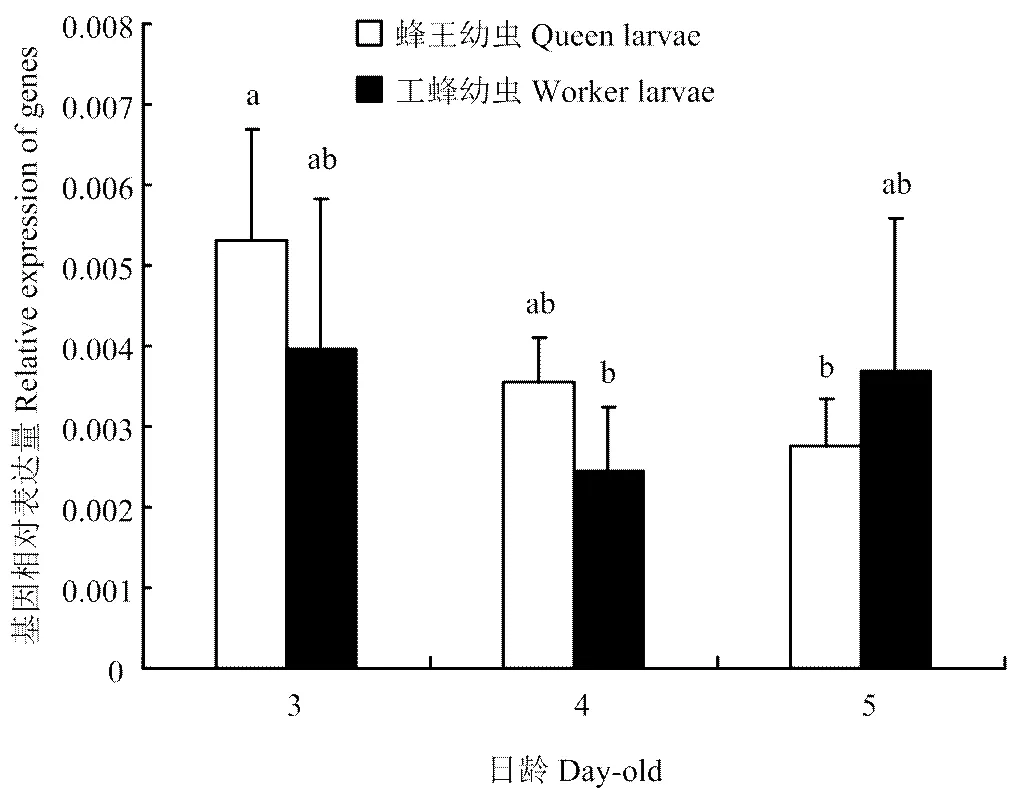
图5 3、4、5日龄蜂王幼虫与工蜂幼虫体内Dnmt3表达量
蜂王幼虫Dnmt3酶活性随日龄变化不显著(>0.05);但工蜂幼虫Dnmt3的酶活性在各日龄间存在差异,其中5日龄工蜂幼虫Dnmt3酶活性显著高于4日龄的工蜂幼虫(<0.05),其余各日龄间差异不显著(>0.05);两级型间的比较发现, 3—5日龄蜂王幼虫Dnmt3酶活性均显著高于工蜂幼虫(<0.01)(图6)。
3 讨论
3.1 蜂王与工蜂幼虫SAM的合成
研究表明,在3—5日龄时,蜂王幼虫和工蜂幼虫体SAM水平及表达量存在差异,SAMS作为催化SAM合成的关键酶,其基因表达量在两级型中的变化趋势与SAM并不相同,可见的表达虽然对SAM的生成具有调节作用,但并不是决定幼虫体内SAM水平的唯一关键因素。在有能量参与的条件下,SAMS能催化蛋氨酸生成SAM,由此推测,蜂王与工蜂幼虫体内的SAM含量不仅与SAMS相关,可能与合成原料——蛋氨酸也密切相关。蛋氨酸在动物体内呈现多功能性,在提高免疫力、改善抗氧化能力、解毒以及提供甲基等方面均发挥了相应作用[25]。蛋氨酸由于其结构特点(携带甲基)而成为动物体内重要的甲基来源,在体内通过S-腺苷蛋氨酸合成酶(SAMS)的作用转化成S-腺苷蛋氨酸(SAM)后为机体反应提供甲基,参与体内的甲基化反应。研究证实DNA甲基化是蜜蜂级型分化的主要机制,该甲基化过程可能通过改变蜜蜂基因组的可变剪接位点调节了基因的表达[26],最终实现表型可塑。Elango等[27]研究了蜜蜂全基因组水平的甲基化并检测了蜜蜂级型特异性表达的基因,发现级型特异性基因倾向于GpG二核苷酸含量高的基因,而大量研究证实富含GpG的DNA片段更易发生甲基化[28-29],这进一步证明了DNA甲基化与蜜蜂级型分化密切相关。因此,SAM作为DNA甲基化的直接甲基供体,对蜜蜂的级型分化具有非常重要的作用。同时,合成SAM的食物原料——蛋氨酸也可能是影响蜜蜂级型分化的潜在营养素,然而,蛋氨酸在蜜蜂级型分化中的作用仍需进一步证实。
3.2 蜂王与工蜂幼虫Dnmt1和Dnmt3的酶活性及其基因表达
蜜蜂具有3种DNA甲基转移酶:2种Dnmt1,负责DNA甲基化的维持,即DNA复制过程中新合成链的甲基化;1种Dnmt2,负责非CpG甲基化;1种Dnmt3,负责DNA的从头甲基化[19-20]。大量研究证实Dnmt1和Dnmt3参与了蜜蜂的级型分化。研究发现Dnmt1对蜜蜂的级型分化具有重要的作用[19]。也有研究表明Dnmt3参与DNA的从头甲基化,通过抑制表达,可以影响蜜蜂幼虫后天的发育[9],随着雌性蜜蜂个体内Dnmt3酶活性的降低和表达量的下降,幼虫体内基因甲基化水平也会下降,幼虫会朝着蜂王方向发展[30]。本研究结果显示,3—5日龄期间蜂王幼虫表达量并无显著变化,其酶活性却呈下降趋势,且下降转折点在围4日龄期。这说明在3—5日龄期间,Dnmt1在蜂王幼虫中的功能逐渐减弱。而工蜂幼虫表达量呈逐渐下降趋势,酶活性呈上升趋势,上升转折点亦在围4日龄期,基因表达量的下调与酶活性的上调彼此抵消可能会使3—5日龄期间工蜂幼虫Dnmt1的作用效果处于相对稳定的状态。因为Dnmt1主要参与蜜蜂基因组DNA复制过程中新合成链的甲基化,即维持甲基化,所以笔者认为在3—5日龄期间,蜂王幼虫SAM参与DNA维持甲基化的代谢过程逐渐减弱,但工蜂幼虫可能不变,且4日龄是变化的转折点。同时本研究中关于Dnmt3的结果显示,3—5日龄期间,蜂王幼虫表达量呈下降趋势,其酶活性却无显著变化,但酶活性始终高于工蜂幼虫。然而工蜂幼虫表达量与酶活性均无显著变化,表明此段时间Dnmt3在蜂王幼虫中的作用效果逐渐减弱,但在工蜂幼虫中相对稳定。Dnmt3是负责DNA从头甲基化的主要酶,因此,笔者认为在3—5日龄期间,蜂王幼虫SAM参与DNA从头甲基化的代谢过程逐渐减弱,工蜂幼虫维持不变,但该代谢过程在蜂王幼虫并未减弱到低于工蜂幼虫的程度。
4 结论
3—5日龄意大利蜜蜂蜂王幼虫与工蜂幼虫体内活性甲基供体SAM的合成与代谢存在差异。4日龄前蜂王幼虫SAM的合成比工蜂活跃,4日龄后工蜂幼虫的SAM合成与蜂王幼虫相近;4日龄前SAM参与DNA维持甲基化的代谢过程,蜂王幼虫比工蜂活跃,4日龄后工蜂幼虫比蜂王幼虫活跃;在3—5日龄期间,蜂王幼虫SAM参与DNA从头甲基化的代谢过程逐渐减弱,工蜂幼虫维持不变,但该代谢过程在蜂王幼虫体内始终不低于工蜂幼虫。
References:
[1] Kucharski R, Maleszka J, Foret S, Maleszka R. Nutritional control of reproductive status in honeybees via DNA methylation., 2008, 319(5871): 1827-1830.
[2] 沈芳, 殷玲, 刘振国, 沈杰, 吉挺. 蜜蜂级型分化研究的进展. 中国农学通报, 2013, 29(32): 1-5.
Shen F, Yin L, Liu Z G, Shen J, Ji T. The research progress of bee caste differentiation., 2013, 29(32): 1-5. (in Chinese)
[3] Weaver N. Rearing of honeybee larvae on royal jelly in the laboratory., 1955, 121(3145): 509-510.
[4] Asencot M, Lensky Y. The effect of sugars and juvenile hormone on the differentiation of the female honeybee larvae (L.) to queens., 1976, 18(7): 693-699.
[5] Asencot M, Lensky Y. The effect of soluble sugars in stored royal jelly on the differentiation of female honeybee (L.) larvae to queens., 1988, 18(2): 127-133.
[6] Kaftanoglu O, Linksvayer T A, Page R E. Rearing honey bees,, in vitro 1: effects of sugar concentrations on survival and development., 2011, 11: 96.
[7] Kamakura M. Royalactin induces queen differentiation in honeybees., 2011, 473(7348): 478-483.
[8] Barker S A, Foster A B, Lamb D C. Biological origin and configuration of 10-hydroxy-2-decenoic acid., 1959, 184(Suppl. 9): 634.
[9] Kucharski R, Maleszka J, Foret S, Maleszka R. Nutritional control of reproductive status in honeybees via DNA methylation., 2008, 319(5871): 1827-1830.
[10] Spannhoff A, Kim Y K, Raynal N J, Gharibyan V, Su M B, Zhou Y Y, Li J, Castellano S, Sbardella G, Issa J P, Bedford M T. Histone deacetylase inhibitor activity in royal jelly might facilitate caste switching in bees., 2011, 12(3): 238-243.
[11] Shi Y Y, Wu X B, Huang Z Y, Wang Z L, Yan W Y, Zeng Z J. Epigenetic modification of gene expression in honey bees by heterospecific gland secretions., 2012, 7(8): e43727.
[12] Guo X, Su S, Skogerboe G, Dai S, Li W, Li Z, Liu F, Ni R, Guo Y, Chen S, Zhang S, Chen R. Recipe for a busy bee: microRNAs in honey bee caste determination., 2013, 8(12): e81661.
[13] Melampy R M, Willis E R. Respiratory metabolism during larval and pupal development of the female honeybee (L.)., 1939, 12(3): 302-311.
[14] Jaenisch R, Bird A. Epigenetic regulation of gene expression: how the genome integrates intrinsic and environmental signals., 2003, 33: 245-254.
[15] Vercelli D. Genetics, epigenetics, and the environment: switching, buffering, releasing., 2004, 113(3): 381-386.
[16] Feil R. Environmental and nutritional effects on the epigenetic regulation of genes., 2006, 600(1/2): 46-57.
[17] Maleszka R. Epigenetic integration of environmental and genomic signals in honey bees: the critical interplay of nutritional, brain and reproductive networks., 2008, 3(4): 188-192.
[18] 董玉玮, 侯进慧, 朱必才, 李培青, 庞永红. 表观遗传学的相关概念和研究进展. 生物学杂志, 2005, 22(1): 1-3.
Dong Y W, Hou J H, Zhu B C, LI P Q, PANG Y H. Concepts related to epigenetics and their advances., 2005, 22(1): 1-3. (in Chinese)
[19] Wu C T, Morris J R. Genes, genetics and epigenetics: a correspondence., 2001, 293(5532): 1103-1105.
[20] Vanyushin B F. DNA methylation and epigenetics., 2006, 42(9): 985-997.
[21] Wang Y, Jorda M, Jones P L, Maleszka R, Ling X, Robertson H M, Mizzen C A, Peinado M A, Robinson G E. Functional CpG methylation system in a social insect., 2006, 314(5799): 645-647.
[22] Schaefer M, Lyko F. DNA methylation with a sting: an active DNA methylation system in the honeybee., 2007, 29(3): 208-211.
[23] Shi Y Y, Yan W Y, Huang Z Y, Wang Z L, Wu X B, Zeng Z J. Genomewide analysis indicates that queen larvae have lower methylation levels in the honey bee ()., 2013, 100(2): 193-197.
[24] Weaver N. Physiology of caste determination., 1966, 11(1): 79-102.
[25] 王丽, 王红芳, 胥保华. 蜜蜂的蛋氨酸营养. 蜜蜂杂志, 2015(11): 6-9.
Wang L, Wang H F, Xu B H. Methionine nutrition of bees., 2015(11): 6-9. (in Chinese)
[26] Flores K, Wolschin F, Corneveaux J J, Allen A N, Huentelman M J, Amdam G V. Genome-wide association between DNA methylation and alternative splicing in an invertebrate., 2012, 13: 480.
[27] Elango N, Hunt B G, Goodisman M A, Yi S V. DNA methylation is widespread and associated with differential gene expression in castes of the honeybee,., 2009, 106(27): 11206-11211.
[28] Wang Y, Leung F C. In silico prediction of two classes of honeybee genes with CpG deficiency or CpG enrichment and sorting according to gene ontology classes., 2009, 68(6): 700-705.
[29] Lyko F, Foret S, Kucharski R, Wolf S, Falckenhayn C, Maleszka R. The honey bee epigenomes: differential methylation of brain DNA in queens and workers., 2010, 8(11): e1000506.
[30] 石元元, 曾志将, 吴小波, 颜伟玉, 王子龙. 人工注射Dnmt3 siRNA对意大利蜜蜂雌蜂发育的影响. 昆虫学报, 2011, 54(3): 272-278.
Shi Y Y, Zeng Z J, Wu X B, Yan W Y, Wang Z L. Effects of artificial injection of Dnmt3 siRNA on the development of female of the Italian honeybee,., 2011, 54(3): 272-278. (in Chinese)
(责任编辑 岳梅)
Differences of Methyl donor S-adenosylmethionine Synthesis and Metabolism betweenQueen Bee Larvae and Worker Bee Larvae
Wangli, Wang Hong-fang, Xu Bao-hua
(College of Animal Science and Technology, Shandong Agricultural University, Tai’an 271018, Shandong)
【Objective】The objective of this study is to research the differences of synthesis and metabolism of the methyl donor S-adenosylmethionine (SAM) betweenqueen bee and worker bee larvae, so as to provide a theoretical basis for the study of DNA methylation and caste differentiation. 【Method】A total of 890 1-day-old female bee larvae selected from 5 colonies of sister queen group, respectively. Among the 890 larvae, 445 larvae were bred to the king (89 in each colony) and the other 445 larvae were put in the original group so that they can develop toward the worker caste naturally (89 in each colony). The 3-, 4- and 5-day-old queen bee and worker bee larvae were taken to measure the differences of gene expression and enzyme activities of the key enzymes of SAM biosynthesis and metabolism.【Result】The content of SAM in queen bee larvae didn’t change significantly with the increased days of age (>0.05). The SAM content of worker bee larvae increased with the increase of days (<0.05). The gene expression ofin queen bee larvae showed a gradient descent trend with increasing age (<0.01); but the gene expression ofin worker bee larvae did not change significantly with the increase of days of age (>0.05). The gene expression ofin queen bee larva was higher than worker bee larvae at 3- and 4-day-old obviously (<0.05), but the gene expression ofin worker bee larva was higher than queen bee larvae obviously at 5-day-old (<0.05). The gene expression ofwas not different significantly between the two types (>0.05). The gene expression ofin queen bee larvae showed no significant change with the increase of days of age (>0.05), but the enzyme activity of Dnmt1 in queen bee larvae decreased with the increase of days of age (<0.05). The gene expression ofwas decreased with the increase of days of age in worker bee larvae (>0.05), but the enzyme activity of Dnmt1 showed a rising trend (<0.01). The enzyme activity of Dnmt1 in queen bee larvae was higher than the worker bee larvae significantly at 3-, 4-day-old (<0.05), but the enzyme activity of Dnmt1 in worker bee larvae was higher than the queen bee larvae significantly at 5-day-old (<0.05). The gene expression of<0.05), the gene expression of>0.05). The enzyme activity of Dnmt3 changed in queen bee larva was not significant with the increased days of age (>0.05), the enzyme activity of Dnmt3 changed significantly in worker bee larvae with the increased days of age (<0.05), but the enzyme activity of Dnmt3 in queen bee larvae were higher significantly than that of worker bee larvae at 3-, 4- and 5-day-old (<0.01). 【Conclusion】There were some differences of the methyl donor (SAM) synthesis and metabolism between queen bee larvae and worker bee larvae at 3-, 4- and 5-day-old. Synthesis of SAM in queen bee larvae was more active than the worker bee larvae before 4-day-old and close to worker bee larvae after 4-day-old. The metabolism process of SAM participating in DNA maintenance methylation in queen bee larvae were more active than worker bee larvae before 4-day-old, but lower than worker bee larvae after 4-day-old. The metabolism process of SAM participating in de novo methylation of DNA in queen bee larva was not lower than worker bee larvae from 3- to 5-day-old.
;queen larvae; worker larvae; methyl donor; synthesis; metabolize
2016-05-13;接受日期:2016-06-24
国家现代农业产业技术体系建设专项(CARS-45)、山东省农业良种工程项目“优质高产蜜蜂及蚕桑新品种培育”(2014-2016)
联系方式:王丽,E-mail:18265486057@163.com。通信作者胥保华,E-mail:bhxu@sdau.edu.cn
