植物乳杆菌C88联合人参多糖的免疫调节作用
2016-11-12刘春红王晓慧段翠翠赵玉娟牛春华李盛钰长春大学特殊教育学院吉林长春300吉林省农业科学院农产品加工研究所吉林长春30033
刘春红,王晓慧,高 磊,段翠翠,赵玉娟,牛春华,栾 畅,李盛钰,*(.长春大学特殊教育学院,吉林 长春 300;.吉林省农业科学院农产品加工研究所,吉林 长春 30033)
植物乳杆菌C88联合人参多糖的免疫调节作用
刘春红1,王晓慧2,高 磊2,段翠翠2,赵玉娟2,牛春华2,栾 畅2,李盛钰1,*
(1.长春大学特殊教育学院,吉林 长春 130022;2.吉林省农业科学院农产品加工研究所,吉林 长春 130033)
以环磷酰胺诱导昆明小鼠建立免疫抑制模型后,分别给其灌胃人参多糖、人参多糖联合植物乳杆菌(Lactobacillus plantarum)C88。实验结束后,采用酶联免疫吸附实验检测了小鼠血清中的白细胞介素-2(interleukin-2,IL-2)、白细胞介素-4(interleukin-4,IL-4)、白细胞介素-10(interleukin-10,IL-10)、干扰素-γ(interferon-γ,IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、免疫球蛋白G(immunoglobulin G,IgG),并利用碳廓清法检测了小鼠吞噬细胞吞噬能力,评价了人参多糖(water-soluble ginseng polysaccharides,WGPA)联合植物乳杆菌C88的体内免疫调节作用。结果表明WGPA联合益生菌C88可明显增强免疫抑制小鼠吞噬细胞的吞噬能力和迟发型超敏反应,显著上调血清中IL-2、IL-4、IFN-γ、TNF-α、IgG水平,下调IL-10水平,并呈现剂量依赖性,且联合用药组的作用明显强于人参多糖WGPA单独用药组。综上所述,植物乳杆菌C88联合人参多糖可以发挥一定的免疫调节作用。
植物乳杆菌;人参多糖;益生元;免疫调节
刘春红, 王晓慧, 高磊, 等. 植物乳杆菌C88联合人参多糖的免疫调节作用[J]. 食品科学, 2016, 37(11): 202-207. DOI:10.7506/spkx1002-6630-201611035. http://www.spkx.net.cn
LIU Chunhong, WANG Xiaohui, GAO Lei, et al. Immunomodulatory effects of ginseng polysaccharides combined with Lactobacillus plantarum C88[J]. Food Science, 2016, 37(11): 202-207. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201611035. http://www.spkx.net.cn
益生元(prebiotic)是指一些不被宿主消化吸收却可选择性地促进机体体内双歧杆菌、乳杆菌等益生菌的代谢和增殖,从而改善宿主健康的物质[1]。由于益生元不能被人体分解、吸收和利用,通过消化道到达结肠后,有的能被结肠菌群分解和利用,而促进结肠菌群的生长,在改善肠道微生态、促进脂质、蛋白质与矿物类代谢方面具有重要意义[2-3]。近年来的研究发现,一些产胞外多糖的乳酸菌在发酵末期,自身产生的多糖能够被菌株降解或作为碳源被菌株利用[4-7]。另外,Ramnani等[8]研究结果也证明,低分子质量的琼脂多糖和海藻多糖能明显促进肠道双歧杆菌的生长,并能显著提高短链脂肪酸的产量。台湾金线莲(Anoectochilus formosanus)水溶性、非消化性多糖能降低实验大鼠盲肠pH值,增强钙吸收能力及肠道双歧杆菌数量,具有明显的益生元作用[9]。硬粒小麦可溶性膳食纤维多糖能够促进植物乳杆菌(Lactobacillus plantarum)L12的生长[10]。上述研究结果表明,一些非消化性的多糖具有明显的益生元作用,益生元多糖能够促进肠道益生菌的生长,抑制有害微生物的种类和数量,使肠道菌群向有利于宿主健康的方向转化,是对机体健康起推动作用的一类生物活性物质。
人参(Panax ginseng C. A. Meyer)是我国名贵中药,多糖是人参重要的生物活性成分之一,已有文献报道人参多糖具有调节免疫、抗肿瘤、抗黏附、抗氧化、降血糖等活性[11-13]。自Ovodov等[14]首次报道人参多糖以来,许多研究致力于人参多糖的分离纯化、结构分析和功能活性等方面。人参多糖主要由类淀粉样多糖和人参果胶组成,类淀粉样多糖主要为含3-分支的α-D-(1,6)-葡聚糖和含6-分支的α-D-(1,4)-葡聚糖,而人参果胶主要由半乳糖醛酸、葡萄糖醛酸和阿拉伯糖组成的酸性杂多糖。课题前期研究通过体外发酵实验证实了人参多糖具有显著的体外增殖乳酸菌和发酵产酸的益生作用,显示出人参多糖的潜在益生元功能。目前国内外对人参多糖益生元作用的研究才刚刚起步,本研究拟以人参多糖和从传统发酵食品中筛选所得的优良益生性乳杆菌菌株为研究对象,通过体外实验方法评价人参多糖对乳杆菌的益生元活性,进一步检测了人参多糖联合植物乳杆菌共同作用时的免疫调节作用。
1 材料与方法
1.1 材料、培养基与试剂
人参多糖(water-soluble ginseng polysaccharides,WGPA),参考Zhang Xu等[15]。植物乳杆菌(Lactobacillus plantarum)C88分离自内蒙古传统发酵奶豆腐,是1株具有优良功能特性和发酵特性的益生菌株[16-19]。该菌株在含体积分数20%甘油的MRS培养基中,-80 ℃冻存。使用前接种于优化的MRS液体培养基,37 ℃ 条件下连续活化3 次[20]。
优化MRS培养基(g):果糖10、葡萄糖20、大豆蛋白胨26.7、酵母浸粉13.3、柠檬酸钠5、无水乙酸钠5、磷酸氢二钾2、硫酸镁0.2、硫酸锰0.05,吐温-80 1 mL,定容至1 L。115 ℃高压灭菌20 min。
小鼠血清白细胞介素-2(interleukin-2,IL-2)、白细胞介素-4(interleukin-4,IL-4)、白细胞介素-10(interleukin-10,IL-10)、干扰素-γ(interferon-γ,IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、免疫球蛋白G(immunoglobulin G,IgG)酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)检测试剂盒 北京方程生物科技有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
电子天平 上海佑科仪器仪表有限公司;电热恒温培养箱 上海一恒科学仪器有限公司;酶标仪 美国BioTek公司;分析天平 德国Sartorius公司。
1.3 方法
1.3.1 动物分组及处理
无特定病原体(specific pathogen free,SPF)级雄性ICR小鼠(18~22 g),购自长春市亿斯实验动物技术有限责任公司,动物许可证号:SCXK(吉)-2011-0004。实验室条件下,20 ℃,12 h昼/夜循环,自由进食进水,适应性喂养1 周。小鼠随机分为6 组,每组15 只,分别为正常对照组、模型组、WGPA 100 mg/(kg•d)(以体质量计,下同)、100 mg/(kg•d)WGPA+108CFU/mL C88低剂量组、100 mg/(kg•d)WGPA +109CFU/mL C88中剂量组,100 mg/(kg•d)WGPA +1010CFU/mL C88高剂量组。除正常对照组外,其余各组实验动物于实验1~3 d腹腔注射环磷酰胺80 mg/(kg•d),建立免疫抑制模型。于实验4~21 d分别灌胃给予不同剂量的各样品。末次给药24 h后称质量,摘眼球取血,37 ℃放置1 h,4 ℃放置1 h,4 ℃2 800 r/min离心10 min,制备血清,-20 ℃保存。取血后解剖分离胸腺、脾脏、肝脏、肾脏及心脏并称取质量,脏器指数计算公式如下[21]。
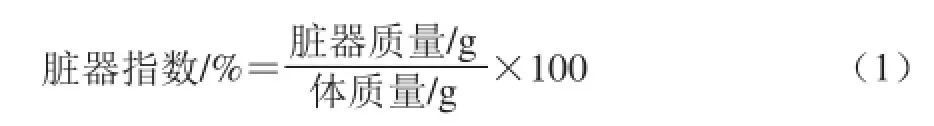
1.3.2 吞噬细胞吞噬指数的测定
末次给药24 h后,小鼠称质量,尾静脉注射印度墨汁(1∶4稀释),按0.05 mL/10 g注射剂量,注射后立即计时,分别于2、10 min时眼静脉丛取血30 μL,血液样本与3 mL 0.1 g/100 mL Na2CO3混匀,600 nm波长处测定光密度值(OD),3mL 0.1 g/100 mL Na2CO3作空白,取血完毕后立即处死小鼠,分离肝、脾,吞噬指数(a)计算公式如下。


式中:a为每单位组织吞噬细胞指数;K为吞噬速率;m1为小鼠体质量/g;m2为小鼠肝质量/g;m3为脾质量/g;OD1为2 min时测定的光密度值;OD2为10 min时测定的光密度值。
1.3.3 迟发型超敏反应(delayed type hypersensitivity,DTH)的测定
试剂配制:体积分数为1%的2,4-二硝基氟苯(2,4-dinitrofluorobenzene,DNFB)20 mg,将预先配好的丙酮橄榄油溶液(丙酮与橄榄油体积比1∶1),各1 mL倒入小瓶内,盖好并封口,混匀后即可使用,现配现用。脱毛剂配制:硫化钡10 g、淀粉2 g,加水至100 mL,混匀后即用。
测定方法:小鼠造模后于给药第13天用脱毛剂对小鼠腹部进行去毛处理,面积约2 cm×2 cm,次日以1% DNFB 30 μL涂于小鼠腹部脱毛处致敏,次日强化,于致敏第4天(给药第18天)小鼠右耳两侧均匀涂以1% DNFB 20 μL,丙酮橄榄油溶剂涂于小鼠左耳两侧,于攻击24 h后处死小鼠,剪下两耳,称质量,按下公式计算耳肿胀率。

1.3.4 生化指标的检测
获取血液样本制备血清后,利用ELISA针对性检测试剂盒测定血清中IL-2、IL-4、IL-10、IFN-γ、TNF-α、IgG的活性。
1.4 数据分析
采用SPSS 17.0软件利用方差分析完成统计处理。结果以±s表示;不同剂量组间与模型组的采用方差分析比较,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 对免疫抑制小鼠脏器指数的影响
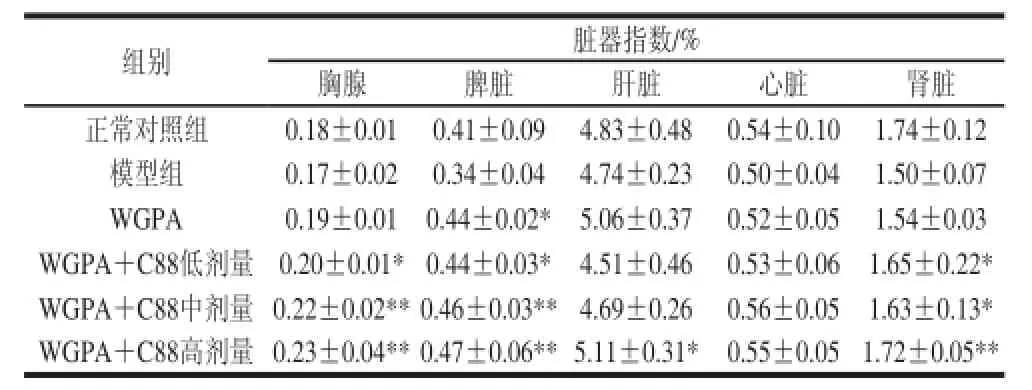
表1 WGPA联合益生菌植物乳杆菌C88对免疫抑制小鼠脏器指数的影响Table 1 Effect of WGPA combined withL. plantarum indices in CY-induced micee
胸腺及脾脏属于重要的免疫器官,胸腺及脾脏指数可以指明机体的免疫功能及预后情况。由表1可知,人参多糖WGPA联合植物乳杆菌C88对衰老小鼠脏器指数的影响,结果表明模型组小鼠各脏器指数与正常对照组相比均有所降低。人参多糖联合植物乳杆菌C88低、中、高剂量组小鼠胸腺指数明显增加,且差异显著,具有一定的剂量依赖性;单独WGPA组胸腺指数增加不明显。WGPA给药组及不同剂量的联合用药组小鼠与模型组相比脾脏指数均明显增加。人参多糖联合益生菌C88高量组小鼠肾脏指数明显增加。另外,人参多糖联合益生菌给药组小鼠胸腺、脾脏、心脏,肝脏指数均高于多糖单独给药组。表明人参多糖联合益生菌C88可明显改善环磷酰胺诱导的免疫抑制小鼠的免疫器官指数。
2.2 对免疫抑制小鼠巨噬细胞吞噬指数的影响
利用碳清除实验检测不同样品对免疫抑制小鼠巨噬细胞吞噬活性的影响,结果如图1所示,模型组小鼠吞噬指数a与正常对照组相比均明显下降,且差异显著,表明免疫抑制小鼠造模成功。与模型组相比,人参多糖WGPA联合益生菌C88中,高剂量组吞噬指数明显高于模型对照组(P<0.05或P<0.01),且具有剂量依赖性。当高剂量组WGPA 100 mg/kg与C88 1010CFU/mL联合用药时,小鼠吞噬细胞吞噬指数可恢复到正常小鼠水平。同时由结果可知,人参多糖联合益生菌共同用药作用结果强于多糖单独用药。因此人参多糖联合益生菌可增强免疫抑制小鼠的吞噬细胞的吞噬能力,达到增强免疫的效果。
2.3 对免疫抑制小鼠迟发型超敏反应的影响
DNFB所致小鼠耳廓迟发型超敏反应属于典型的Ⅳ型变态反应模型,是由抗原诱导的一种细胞性免疫应答,作为迟发型超敏反应模型广泛用于药物实验。由图2可知,模型组小鼠耳肿胀度与正常组小鼠相比明显下降,表明环磷酰胺降低小鼠迟发型超敏反应的模型成功。与模型组小鼠相比,不同给药组小鼠耳肿胀度均明显增加,且WGPA联合益生菌C88不同剂量给药组对小鼠耳肿胀度的影响具有剂量依赖性,联合用药高剂量组小鼠耳肿胀率均高于多糖单独用药。当高剂量组WGPA 100 mg/(kg·d)与C88 1010CFU/mL联合使用时,免疫抑制小鼠迟发型超敏反应结果与正常对照组小鼠相当,耳肿胀率为3.5%。
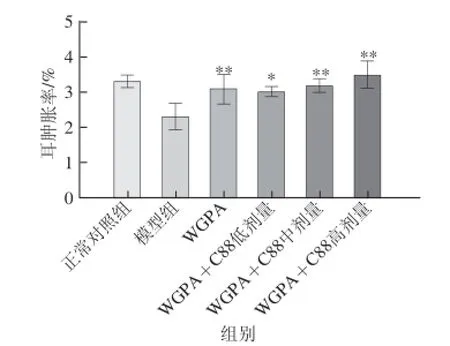
图2 WGPA联合益生菌C88对免疫抑制小鼠耳肿胀率的影响Fig. 2 Effect of WGPA combined with L. plantarum C88 on ear swelling in CY-treated mice
2.4 对免疫抑制小鼠血清免疫指标的影响
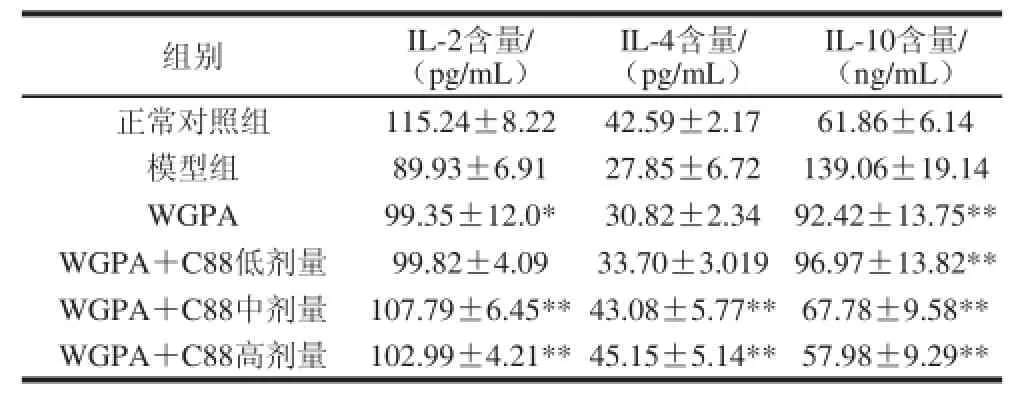
表2 WGPA联合益生菌C88对免疫抑制小鼠血清IL-2、IL-4及IL-1100的影响Table 2 Effect of WGPA combined withL. plantaarruumm C88 on serum cytokine levels in CY-treated mice
模型组小鼠血清IL-2和IL-4与正常对照组相比含量明显下降,IL-10含量明显增加,表明环磷酰胺诱导的免疫抑制模型造模成功。结果如表2所示,WGPA联合益生菌C88中、高剂量组免疫抑制小鼠血清IL-2含量与模型组小鼠相比明显增加,差异显著或极显著(P<0.05或P<0.01)。与模型组相比,WGPA联合益生菌C88中、高剂量组免疫抑制小鼠血清IL-4含量显著增加(P<0.01),且与正常组相当,分别可达43.08、45.15 pg/mL。人参多糖组及人参多糖联合益生菌C88低、中、高剂量免疫抑制小鼠血清IL-10含量与模型组小鼠相比含量明显降低,且差异极显著(P<0.01),当用药质量浓度为高剂量,人参多糖100 mg/(kg·d)联合C88 1010CFU/mL时,小鼠血清IL-10质量浓度可恢复至正常小鼠水平,为57.98 pg/mL。
WGPA联合益生菌C88对免疫抑制小鼠血清IFN-γ、TNF-α及IgG质量浓度的影响如表3所示,由结果可知模型组小鼠血清IFN-γ、TNF-α及IgG质量浓度与正常组小鼠相比均明显下降。各用药组免疫抑制小鼠血清IFN-γ质量浓度与模型组相比含量明显增加,WGPA单独给药组与联合用药低剂量给药组小鼠血清IFN-γ质量浓度呈增加趋势,分别为168.18 pg/mL和177.25 pg/mL,中、高剂量组IFN-γ质量浓度均高于正常组小鼠和多糖单独用药组。与模型组相比,WGPA组免疫抑制小鼠血清TNF-α质量浓度明显上升,且差异显著(P<0.05)。WGPA联合益生菌C88低、中、高剂量组小鼠血清TNF-α质量浓度与模型组相比差异极显著(P<0.01),高剂量组T NF-α含量恢复值与正常对照组大致相当,质量浓度可达268.65 pg/mL。对于环磷酰胺诱导的小鼠血清IgG含量的降低,WGPA单独用药组及不同剂量的联合用药组均可使IgG的含量有不同程度的恢复,差异显著或极显著(P<0.05或P<0.01)。另外,WGPA联合益生菌C88低、中、高剂量组对免疫抑制小鼠血清IgG的影响具有剂量依赖性,分别为564.54、623.96、716.62 ng/mL。由此表明人参多糖联合益生菌对环磷酰胺所致免疫功能的抑制有一定的改善作用,且作用活性强于WGPA单独用药组。
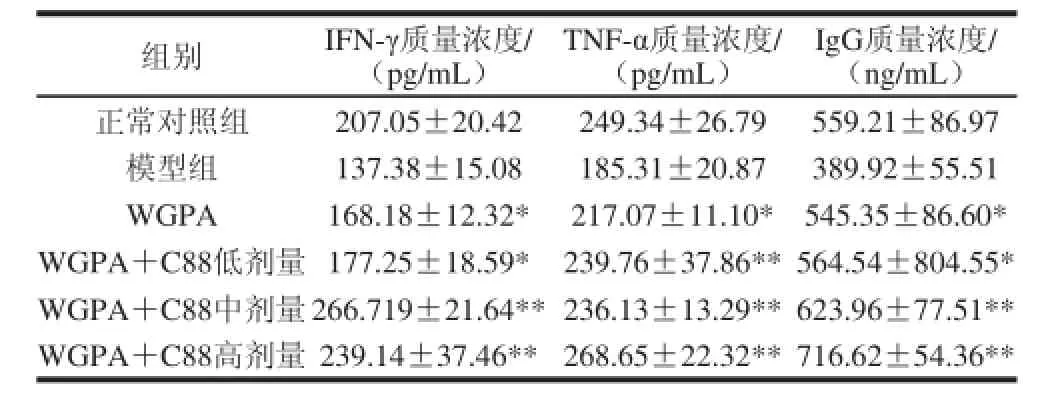
表3 WGPA联合益生菌C88 对免疫抑制小鼠血清IFN-γ、TTNNFF--α及IIggGG质量浓度的影响Table 3 Effect of WGPA combined withL. plantarum TTNNFF--α and IgG levels in serum of CY-treated mice
3 讨 论
碳粒廓清实验是一种最常用于检测巨噬细胞吞噬能力的检测方法,通过测定血液中碳粒的消失速率反映巨噬细胞系统吞噬异物的能力,从而评价机体的非特异性免疫功能。本研究采用碳粒廓清实验检测WGPA联合植物乳杆菌C88对机体单核-巨噬细胞吞噬能力的影响,结果显示人参多糖联合植物乳杆菌C88可显著提高免疫抑制小鼠的吞噬指数,且作用效果明显高于单独人参多糖WGPA组,即人参多糖联合植物乳杆菌C88可提高免疫抑制小鼠巨噬细胞的吞噬能力,从而增强机体的非特异性免疫功能。
DTH由效应T细胞介导,属于细胞免疫反应。本研究利用DNFB诱导迟发型超敏反应模型,其原理是机体接触到小分子抗原DNFB后会产生特异性致敏淋巴细胞,当有相应的过敏原接触皮肤后致敏淋巴细胞会释放出多种因子引发以单个核细胞浸润为主的炎症反应。有研究表明多糖可拮抗环磷酰胺导致的DTH减弱,使小鼠耳肿胀率恢复正常。本研究结果表明WGPA联合植物乳杆菌C88可明显增强免疫抑制小鼠迟发型超敏反应,并与正常组小鼠水平相当。因为DTH的发生与效应T细胞、巨噬细胞及其产生的细胞因子或细胞毒性介质有关,所以WGPA联合植物乳杆菌C88可能通过增强T细胞向效应细胞转化及增强巨噬细胞的活性来发挥对环磷酰胺诱导的免疫抑制小鼠迟发型超敏反应的促进作用。由此证明WGPA联合植物乳杆菌C88可增强小鼠的细胞免疫作用。另外,联合用药中、高剂量组作用效果明显高于多糖单独用药组。
研究结果发现联合用药组作用效果明显高于WGPA单独用药组,且小鼠血清IL-2、IL-4、IFN-γ、TNF-α含量较环磷酰胺免疫抑制组小鼠明显升高,并具有剂量依赖性。表明人参多糖联合植物乳杆菌C88可促进免疫细胞的增殖及分化,调节Th1/Th2细胞因子的释放从而增强免疫功能。已有类似的报道证明碳水化合物与益生菌联合用药对于增强机体免疫具有更好地作用效果,Zhang Qin等[22]将枯草芽孢杆菌与低聚果糖为研究对象,分别检测了两者分别单独用药或联合用药对海参免疫功能的影响,证明两者对于增强机体免疫功能方面存在协同作用的效果。IL-10可扰乱Th1细胞 因子的释放,同时影响不用类型免疫细胞的增殖及分化[23]。已有研究表明多糖对于抑制IL-10的分泌起着重要作用[24]。本实验结果表明人参多糖联合植物乳杆菌C88低、中、高剂量组均可明显降低免疫抑制小鼠血清IL-10的含量,当联合用药为高剂量组时,IL-10含量可恢复至正常小鼠水平,其作用效果明显强于WGPA单独用药组。IgG、IgA、IgM是主要的免疫球蛋白,参与补体激活、调理作用及毒素的中和等。越来越多的研究表明多糖可通过促进IgG、IgA、IgM的产生来加强体液免疫[25]。本研究结果显示人参多糖联合植物乳杆菌C88或人参多糖单独用药组均可明显提高免疫抑制小鼠血清IgG的含量,联合用药中、高剂量组小鼠血清IgG水平可恢复至正常小鼠水平,表明WGPA联合植物乳杆菌C88可增强体液免疫。因此通过对免疫抑制小鼠血清免疫指标的检测可知,人参多糖联合植物乳杆菌C88增强免疫抑制小鼠的细胞免疫和体液免疫。
综上所述,人参多糖联合植物乳杆菌C88可通过增强免疫抑制小鼠的免疫器官指数、巨噬细胞的吞噬指数、迟发型超敏反应及改善免疫抑制小鼠血清免疫指标,从而从非特异性免疫,细胞免疫及体液免疫三方面起到增强免疫抑制小鼠免疫功能的作用,另外,WGPA联合植物乳杆菌C88免疫增强效果明显高于人参多糖单独给药组,两者可能存在叠加或协同的免疫效果。
[1] CHERIE J Z, GLENN R G. An overview of probiotics, prebiotics and synbiotics in the functional food concept: perspectives and future strategies[J]. International Dairy Journal, 1998, 8(5/6): 473-479. DOI:10.1016/S0958-6946(98)00071-5.
[2] SAAD N, DELATTRE C, URDACI M, et al. An overview of the last advances in probiotic and prebiotic fi eld[J]. LWT-Food Science and Technology, 2013, 50(1): 1-16. DOI:10.1016/j.lwt.2012.05.014.
[3] AL-SHERAJI S H, ISMAIL A, MANAP M Y, et al. Prebiotics as f unctional foods: a review[J]. Journal of Functional Foods, 2013, 5(4): 1542-1553. DOI:10.1016/j.jff.2013.08.009.
[4] SYNYTSYA A, MICKOVA K, SYNYTSYA A, et al. Glucans from fruit bodies of cultivated mushrooms Pleurotus ostreatus and Pleurotus eryngii: structure and potential prebiotic activity[J]. Carbohydrate Polymers, 2009, 76(4): 548-556. DOI:10.1016/j.carbpol.2008.11.021.
[5] PHAM P L, DUPONT I, ROY D, et al. Production of exopolysaccharide by Lactobacillus rhamnosus R and analysis of its enzymatic degradation during prolonged fermentation[J]. Appllied Environmental Microbiology, 2000, 66(6): 2302-2310. DOI:10.1128/ AEM.66.6.2302-2310.2000.
[6] HONGPATTARAKERE T, CHERNTONG N, WICHIENCHOT S, et al. In vitro prebiotic evaluation of exopolysaccharides produced by marine isolated lactic acid bacteria[J]. Carbohydrate Polymers, 2012, 87(1): 846-852. DOI:10.1016/j.carbpol.2011.08.085.
[7] SALAZAR N, GUEIMONDE M, HERNANDEZ-BARRANCO A M, et al. Exopolysaccharides produced by intestinal Bifidobacterium strains act as fermentable substrates for human intestinal bacteria[J]. Applied and Environmental Microbiology, 2008, 74(15): 4737-4745. DOI:10.1128/AEM.00325-08.
[8] RAMNANI P, CHITARRARI R, TUOHY K, et al. In vitro fermentat ion and prebiotic potential of novel low molecular weight polysaccharides derived from agar and alginate seaweeds[J]. Anaerobe, 2012, 18(1): 1-6. DOI:10.1016/j.anaerobe.2011.08.003.
[9] YANG L C, LIN W C, LU T J. Characterization and prebiotic activity of aqueous extract and indigestible polysaccharide from Anoectochilus formosanus[J]. Journal of Agricultural Food Chemistry, 2012, 60(35): 8590-8599. DOI:10.1021/jf3018832.
[10] MAROTTI I, BREGOLA V, ALOISIO I, et al. Prebiotic effect of soluble fibres from modern and old durum-type wheat varieties on Lactobacillus and Bifidobacterium strains[J]. Journal of the Science of Food and Agriculture, 2012, 92(10): 2133-2140. DOI:10.1002/ jsfa.5597.
[11] LEE J H, SHIM J S, LEE J S, et al. Pectin-like acidic polysaccharide from Panax ginseng with selective antiadhesive activity against pathogenic bacteria[J]. Carbohydrate Research, 2008, 341(9): 1154-1163. DOI:10.1016/j.carres.2006.03.032.
[12] SUN Y. Structure and biological activities of the polysaccharides from the leaves, roots and fruits of Panax ginseng C. A. Meyer: an overview[J]. Carbohydrate Polymers, 2011, 85(3): 490-499. DOI:10.1016/j.carbpol.2011.03.033.
[13] WANG J, LI S, CHEN Y, et al. Anti-fatigue activity of the watersoluble polysaccharides isolated from Panax ginseng C. A. Meyer[J]. Journal of Ethnopharmacology, 2010, 130(2): 421-423. DOI:10.1016/ j.jep.2010.05.027.
[14] OVODOV Y S, SOLOEVA T F. Polysaccharides of Panax ginseng[J]. Khimiya Prirodnykh Soedinenii, 1966, 2(5): 299-303. DOI:10.1007/ BF00566981.
[15] ZHANG X, YU L, BI H T, et al. Polysaccharides of Panax ginseng[J]. Carbohydrate Polymers, 2009, 77(3): 544-552. DOI:10.1007/ BF00566981.
[16] ZHANG L, LIU C, LI D, et al. Antioxidant activity of an exopolysaccharide isolated from Lactobacillus plantarum C88[J]. International Journal of Biological Macromolecules, 2013, 54(1): 270-275. DOI:10.1016/j.ijbiomac.2012.12.037.
[17] LI S, ZHAO Y, ZHANG L, et al. Antioxidant activity of Lactobacillus plantarum strains isolated from traditional Chinese fermented foods[J]. Food Chemistry, 2012, 135(3): 1914-1919. DOI:10.1016/ j.foodchem.2012.06.048.
[18] 黄丽. 植物乳杆菌C88的抗氧化作用及安全性评价[D]. 长春: 东北师范大学, 2012: 19-24.
[19] 于志会, 张雪, 李盛钰, 等. 植物乳杆菌C88发酵乳对高脂血症小鼠降胆固醇的作用[J]. 中国乳品工业, 2013, 41(8): 17-19. DOI:10.3969/j.issn.1001-2230.2013.08.004.
[20] 栾畅. 植物乳杆菌Sc52联合牛蒡低聚果糖对2型糖尿病的治疗作用[D].长春: 吉林农业大学, 2015: 12-13.
[21] 沙爱龙, 吴瑛, 盛海燕, 等. 昆仑雪菊黄酮对衰老模型小鼠脑及脏器指数的影响[J]. 动物医学进展, 2013, 34(7): 66-68. DOI:10.3969/ j.issn.1007-5038.2013.07.014.
[22] ZHANG Q, MA H M, MAI K S, et al. Interaction of dietary Bacillus subtilis and fructooligosaccharide on the growth performance, nonspecific immunity of sea cucumber, Apostichopus japonicus[J]. Fish Shellfish Immunology, 2010, 29(2): 204-211. DOI:10.1016/ j.fsi.2010.03.009.
[23] WILLIAMS L M, RICCHETTI G, SARMA U, et al. Interleukin-10 suppression of myeloid cell activation a continuing puzzle[J]. Immunology, 2004, 113(3): 281-292. DOI:10.1111/j.1365-2567.2004.01988.
[24] CHEN J R, YANG Z Q, HU T J, et al. Immunomodulatory activity in vitro and in vivo of polysaccharide from Potentilla anserine[J]. Fitoterapia, 2010, 81(8): 1117-1124. DOI:10.1016/ j.fi tote.2010.07.009.
[25] YANG X M, YU W, LIU W M, et al. Antioxidant and immunity activity of water extract and crude polysaccharide from Ficus carica L. fruit[J]. Plant Foods for Human Nutrition, 2009, 64(2): 167-173. DOI:10.1007/s11130-009-0120-5.
Immunomodulatory Effects of Ginseng Polysaccharides Combined with Lactobacillus plantarum C88
LIU Chunhong1, WANG Xiaohui2, GAO Lei2, DUAN Cuicui2, ZHAO Yujuan2, NIU Chunhua2, LUAN Chang2, LI Shengyu1,*
(1. Special Education College, Changchun University, Changchun 130022, China; 2. Institute of Agro-Food Technology, Jilin Provincial Academy of Agricultural Sciences, Changchun 130033, China)
In this study, a mouse model of cyclophosphamide (CY)-induced immunosuppression was used to evaluate the immunomodulatory effects of water-soluble ginseng polysaccharides (WGPA) combined with Lactobacillus plantarum C88. The mice was administered with WGPA alone and combined with L. plantarum C 88 by gavage, respectively. The serum levels of interleukin-2 (IL-2), interleukin-4 (IL-4), interleuk in-10 (IL-10), interferon-γ (IFN-γ), tumor necrosis factor-α (TNF-α) and immunoglobulin G (IgG) in mice were measured by enzyme-linked immunosorbent assay. The p hagocytic index of pha gocytes was also examined by carbon clearance test. The results showed that WGPA combined with Lactobacillus plantarum C88 could signifi cantly enhance the phagocytic capacity of phagocytes. IL-2, IL-4, IFN-γ, TNF-α and IgG levels were signifi cantly increased, whereas IL-10 level was signifi cantly decreased in a dose-dependent manner. In addition, the immunomodul atory effect of the combined treatment was signifi cantly stronger than that of WGPA alone. In conclusion, WGPA combined with L. plantarum C88 has certain immunomodulatory effects.
Lactobacillus plantarum; ginseng polysaccharides; prebiotic; immunomodulatory activity
10.7506/spkx1002-6630-201611035
TS202.1
A
2015-08-28
国家现代农业(奶牛)产业技术体系建设专项(CARS-37);吉林省世行贷款农产品质量安全项目(2011-Y35);吉林省农业科技创新工程优秀创新团队项目(c42070302)
刘春红(1976—),女,硕士研究生,研究方向为功能食品研究与开发。E-mail:lisy720@163.com
*通信作者:李盛钰(1977—),男,副研究员,博士,研究方向为发酵食品及乳品加工。E-mail:lisy720@126.com
