猕猴桃果胶纯化及分子结构信息解析
2016-11-12顾晓俊金邦荃陈晓楠刘春泉南京师范大学金陵女子学院江苏南京0097南京师范大学分析测试中心江苏南京0097江苏省农业科学院农产品加工研究所江苏南京004
顾晓俊,金邦荃,*,陈晓楠,李 意,刘春泉(.南京师范大学金陵女子学院,江苏 南京 0097;.南京师范大学分析测试中心,江苏 南京 0097;.江苏省农业科学院农产品加工研究所,江苏 南京 004)
猕猴桃果胶纯化及分子结构信息解析
顾晓俊1,金邦荃1,*,陈晓楠1,李 意2,刘春泉3
(1.南京师范大学金陵女子学院,江苏 南京 210097;2.南京师范大学分析测试中心,江苏 南京 210097;3.江苏省农业科学院农产品加工研究所,江苏 南京 210014)
猕猴桃果胶来源量大,纯化后可用于食品制造。解读和求证它的分子结构信息,为其生物学功能提供理论依据。本研究将猕猴桃果胶经DEAE-Cellulose 52阴离子交换柱纯化,采用高效液相凝胶渗透色谱及高效液相离子色谱、紫外光谱和红外光谱等现代技术,解析猕猴桃精制果胶组分、分子质量、碳链一级结构和高级结构官能团。结果表明,猕猴桃果胶至少包括3 个组分,其中酸性果胶1(AP-A1)分子质量524.31 kD,占84.8%,是猕猴桃果胶的主要成分;而中性果胶(AP-N)和酸性果胶2(AP-A2)分子质量仅为281.89 kD和273.88 kD。结构解析,AP-A1主要由D-半乳糖和D-木糖聚合而成,指纹区显示其碳链是由吡喃糖以α-糖苷键连接,且特征区同时存在C=O和对称、非对称—COO基团,属于典型大分子果胶结构;而AP-N和AP-A2组分中无C=O结构,且碳链中同时兼备α或β-糖苷键,属于非典型果胶低聚多糖结构。
纯化;分子质量;多糖组分;结构域;猕猴桃果胶
顾晓俊, 金邦荃, 陈晓楠, 等. 猕猴桃果胶纯化及分子结构信息解析[J]. 食品科学, 2016, 37(11): 47-51. DOI:10.7506/ spkx1002-6630-201611009. http://www.spkx.net.cn
GU Xiaojun, JIN Bangquan, CHEN Xiaonan, et al. Purifi cation and structural elucidation of kiwifrut pectin[J]. Food Science, 2016, 37(11): 47-51. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201611009. http://www.spkx.net.cn
随着中国食品加工业的快速发展,大量果蔬残渣废弃,一是工业成本高,二是环境污染。为此,近年来许多科学家试图采用各种方法,从果蔬废弃物中制备出高附加值的工业或食品原辅料,以期提高食品加工业效益[1]。
多年研究发现,猕猴桃(Actinidia)加工废弃的皮渣中含有丰富的可溶性膳食纤维-果胶(soluble dietary fi berpectin,SDF-P)[2-4],具有理想的食品和营养工业利用价值[5]。它的吸附性和胶黏性不但能作为食品增稠剂和稳定剂,应用于多种食品制造;而且可作为营养补充剂,改善肠道健康,吸附剩余能量、脂肪和糖等而具有减肥、降糖和降脂等功能[5-7]。
对猕猴桃SDF-P生物学功能的初步了解始于本课题组近5 a的研究,该SDF-P显著增加小鼠肠蠕动和排便功能,有效改善其肠道健康[6-7],但对它的功能与结构之间的关系所知甚少。因此,本实验希望从猕猴桃SDF-P分子结构信息的角度,解读其生物学功能的本质,以期为研发新型功能食品提供理论依据。
1 材料与方法
1.1 材料与试剂
猕猴桃粗果胶细粉 南京师范大学金陵女子学院功能性食品实验室自备。
DEAE-Cellulose 52 英国Whatman公司;咔唑(化学纯) 国药集团化学试剂有限公司;无水乙醇、三氟乙酸、甲醇(均为分析纯) 上海化学试剂有限公司;浓硫酸(分析纯) 上海中试化工总公司;氢氧化钠、氯化钠、盐酸(分析纯) 南京化学试剂有限公司。
1.2 仪器与设备
CXG-1电脑恒温层析柜、Model DBS-100电脑全自动部分收集器、HL-2恒流泵、TH-1000A梯度混合器上海青浦沪西仪器厂;BioTek ELX808酶标仪 上海东风电讯仪器厂;HH-6数显恒温水浴锅 金坛市富华仪器有限公司;FL-60冷冻干燥机 上海粉体机械有限公司;Nexus670红外光谱仪 美国尼高力公司;HP1100高效液相色谱仪 美国Agilent公司;HGC-12A氮吹仪南京科捷分析仪器有限公司;UV-6100A紫外分光光度计上海元析仪器有限公司。
1.3 方法
1.3.1 果胶纯化
采用DEAE-Cellulose 52阴离子交换柱对猕猴桃粗果胶进行纯化,用NaCl溶液进行梯度洗脱,自动收集器收集洗脱液,并以咔唑比色法跟踪检测。将洗脱峰膜透析除盐,冷冻干燥后获精制果胶[8-9]。
柱层析条件:层析柱(1.6 cm×40 cm,50 μm);柱温25 ℃;上样质量浓度5 mg/mL,上样量4 mL; 0~0.5 mol/L NaCl梯度洗脱;洗脱速率1 mL/min;4~6 min/管收集洗脱液。
1.3.2 果胶紫外(ultraviolet,UV)光谱鉴定
以D-半乳糖醛酸(D-galacturonic acid,D-GA)标准品为参照,经200~600 nm全程紫外扫描,检测1 mg/mL猕猴桃SDF-P中D-GA含量[10-11]。
1.3.3 果胶分子质量
以不同分子质量葡聚糖为标准品,利用高效液相凝胶渗透色谱(high performance gel permeation chromatography,HPGPC)测定果胶分子质量[12-13]。HPGPC条件:TSK-gel G-4000PWxl凝胶色谱柱(7.8 mm×300 mm,10 μm);RID示差检测器;漂移管温度35 ℃;流动相:双蒸水;流速:0.6 mL/min;相对湿度:55%。
标准曲线:配制1 000、500、40 kD和10 kD的标准葡聚糖溶液,质量浓度为2 mg/mL。分别取2 mL过0.45 μm膜,离心后吸取10 μL上清液进样。以各分子质量葡聚糖出峰时间为横坐标(X),并以分子质量对数为纵坐标(Y),建立标准曲线回归方程:Y=-0.255 7X+5.115 5(R2=0.992 7)。
参照标准曲线比对猕猴桃纯果胶出峰时间和峰面积,计算出猕猴桃果胶分子质量。
1.3.4 果胶组分
采用离子示差高效液相离子色谱法(high performance liquid ion chromatography,HPLC-ion)进行猕猴桃果胶组分鉴别,并以2 mg/mL D-葡萄糖、2 mg/mL L-鼠李糖、2 mg/mL D-半乳糖和6 mg/mL D-木糖单糖为标准品进行比对[14-15]。
取4 mg果胶于安培瓶中,加入2 mL 2 mol/L的三氟乙酸(trifluoroacetic acid,TFA)封管,100 ℃水浴8 h,冷却至室温,利用氮吹仪吹干,再加入1 mL甲醇吹干(重复3 次),最终加入2 mL蒸馏水稀释,经0.45 μm膜过滤后进样检测。HPLC-ion条件:色谱柱(4.6 mm×250 mm,5 μm);RID检测器;柱温:50 ℃;流动相:乙腈-双蒸水(80∶20,V/V);流速:1 mL/min。
1.3.5 果胶分子高级结构
采用压片法,1 g果胶与100 g溴化钾粉末混合并研磨,抽气5~10 min,于压片机压制3 mm厚度片状,后在400~4 000 cm-1范围内进行红外光谱扫描,获得果胶分子结构[16-18]。
2 结果与分析
2.1 果胶的分离纯化与鉴定
2.1.1 分离纯化结果
由图1可知,经DEAE-Cellulose 52柱层析分离纯化,得到3 个尖锐洗脱峰,且三者峰型较为对称。将第1洗脱峰命名为猕猴桃中性果胶(Actinidia pectin-neutral,AP-N,15~18 管),再将NaCl洗脱的第2、3洗脱峰分别命名为猕猴桃酸性果胶1(Actinidia pectin-acid 1,AP-A1,48~56 管)和酸性果胶2(Actinidia pectinacid 2,AP-A2,68~72 管)。经透析、冷冻干燥后,AP-N、AP-A1和AP-A2的得率分别为5.3%、84.8%和9.9%,表明AP-A1是猕猴桃纯果胶主成分。
以洗脱管数为横坐标,NaCl浓度为纵坐标,得到NaCl梯度洗脱曲线,见图1。经计算,AP-A1组分的最佳洗脱浓度为0.2 mol/L NaCl,AP-A2组分的最佳洗脱浓度约为0.3 mol/L NaCl。
DEAE-Cellulose 52是常用的阴离子交换剂,其离子交换基团排列疏散且呈弱碱性,对大分子物质吸附较弱,可用中性盐溶液将大分子糖洗脱下来,便于收集[14,18]。本研究采用0~0.5 mol/L NaCl梯度洗脱果胶;再经截留分子质量为5 000~14 000 D的透析袋透析,除去精制果胶中剩余盐分,使果胶纯度更高。纯化后果胶冻干粉,以备其分子质量和高级结构研究。
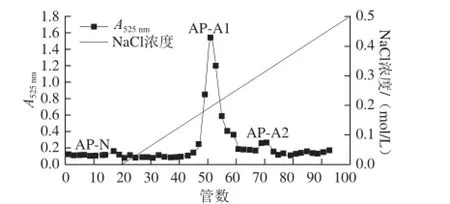
图1 猕猴桃果胶DEAE-Cellulose 52洗脱曲线Fig. 1 Elution curve of kiwifruit pectin on DEAE-Cellulose 52 column
2.1.2 猕猴桃精制果胶纯度的紫外鉴定
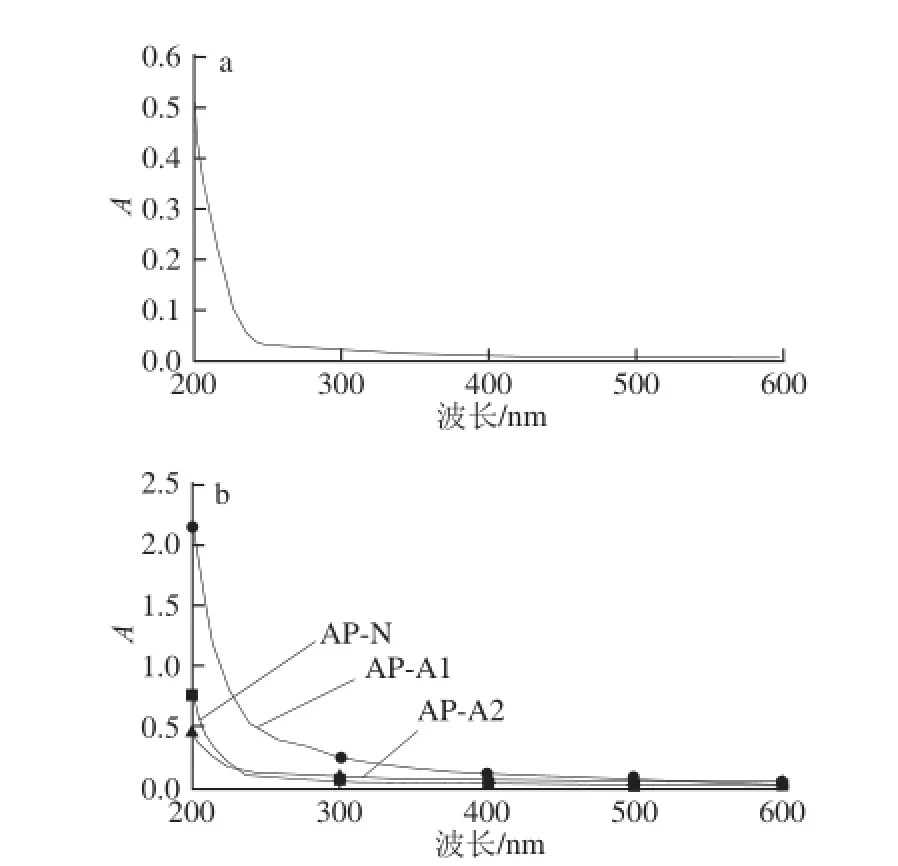
图2 2 D-GA(a)与3 种猕猴桃果胶组分(b)的紫外扫描光谱Fig. 2 UV spectra of D-GA (a) and 3 components (b) from kiwifruit pectin
由图2可知,经UV全程扫描,猕猴桃精制果胶的AP-N、AP-A1和AP-A2组分与D-GA的UV光谱十分相似,未见到有蛋白质、核酸和多肽等特征峰出现,表明所获得的精制果胶不含蛋白质、核酸和多肽等杂质,纯度高。UV是近年研究和鉴定大分子有机化合物的重要手段,可根据不同物质的UV特征光谱区域来加以区分和鉴别。众所周知,果胶或植物多糖在紫外光区无特征吸收波长,而蛋白质、核酸和多肽的特征波长处于紫外光区,分别于280、260 nm和215 nm[8,10,19]。采用UV光谱扫描,初步推断出本研究制备的猕猴桃精制果胶的纯化度高。
2.2 果胶组分与分子质量分析
2.2.1 猕猴桃精制果胶分子质量

图3 猕猴桃果胶AP-N(a)、AP-A1(b)、AP-A2(c)3 个组分的HPGPC色谱Fig. 3 HPGPC chromatograms of 3 components from kiwifruit pectin
由HPGPC解析出猕猴桃精制果胶5 个组分并得到它们的分子质量。如图3所示,主成分为AP-A1,仅在9.37 min呈现一尖锐单峰,其分子质量524.31 kD,推测为一种酸性果胶多糖。AP-N在10.42 min和16.69 min出现第2个组分,分别命名为AP-NⅠ和AP-NⅡ,前者分子质量281.89 kD,推测为中性果胶多糖;后者分子质量7.06 kD,且小于10 kD,推测为小分子质量多糖。AP-A2分别在10.47 min和16.67 min呈现2 个峰,前者分子质量273.88 kD,推测为分子质量小于AP-A1的酸性果胶多糖;而后者分子质量7.13 kD,推测为小分子质量多糖。比较AP-N 和AP-A2的分子质量及出峰时间,尽管AP-NⅠ和AP-A2Ⅰ十分接近,但洗脱条件和洗脱峰位置不同;而AP-NⅡ和AP-A2Ⅱ在分子质量和出峰时间十分接近,均可能是纯化过程中剥离的近似小分子多糖。
不同植物源获得的果胶分子质量有很大差异,多为大分子多聚糖,分子质量在50~300 kD之间[20-21]。人们分别研究了胡萝卜果胶和马铃薯果胶的分子质量,发现胡萝卜果胶分子质量高达1 750.63 kD;而马铃薯果胶分子质量仅为41.16 kD,是一种低聚果胶[11]。本研究中的猕猴桃果胶3 个组分多糖分子质量介于上述胡萝卜和马铃薯果胶之间,由273.88 kD和281.89 kD低聚多糖和524.31 kD高聚多糖组成,并含有少量低聚糖。
2.2.2 AP-A1组分鉴定
将猕猴桃果胶主成分AP-A1 TFA水解,进行HPLC-ion组分鉴定,并以4 种单糖作为标准品,进行AP-A1组分解析。由图4、5可知,AP-A1水解后有2 个组分,出峰时间分别在7.24 min和10.43 min。与4 种标准单糖出峰时间比对,其AP-A1Ⅰ对应的是D-木糖,AP-A1Ⅱ对应的是D-半乳糖。根据半峰宽计算,得到D-木糖和D-半乳糖相对含量,分别是2.69 mg/mL和8.23 mg/mL,二者比值为1∶3.1,推算出D-木糖占AP-A1总量的1/4,而D-半乳糖占AP-A1总量的3/4,表明AP-A1是由D-半乳糖与D-木糖共同形成的杂多糖聚合物。

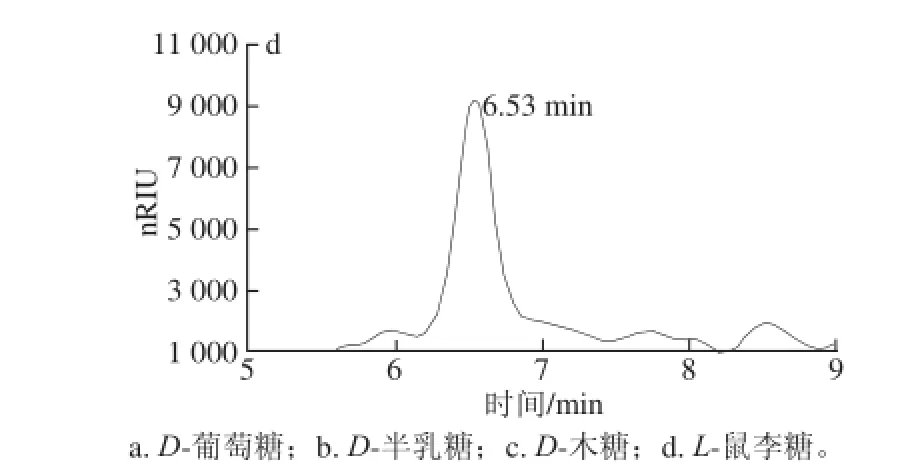
图4 4 种单糖标准品的HPLC-ion色谱Fig. 4 HPLC-ion chromatograms of standard monosaccharides
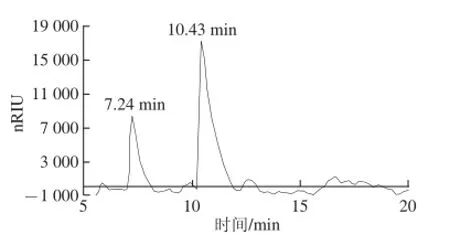
图5 AP-A1的HPLC-ion色谱Fig. 5 HPLC-ion chromatogram of AP-A1
2.3 猕猴桃精制果胶高级结构解析
采用Nexus 670红外光谱仪对果胶的AP-N、AP-A1和AP-A2组分进行红外扫描,获得红外光谱分析,从3 种果胶组分的官能团特征和二级结构特征[22]分别进行解析。
2.3.1 特征频率区

图6 AP-N(a)、AP-A1(b)和AP-A2(c)的红外光谱分析Fig. 6 IR spectra of AP-N (a), AP-A1(b) and AP-A2 (c)
由图6可知,AP-N、AP-A1和AP-A2在4 000~1 300 cm-1特征频率区的3 430~3 452 cm-1呈现下降的O—H强烈伸缩振动曲线,在2 921~2 939 cm-1处表现出C—H中等强度的伸缩振动。
由图6b可知,AP-A1果胶主成分包含1 751 cm-1伸缩振动,是由C=O共振所产生,该双键基团为乙酰基或醛基;且在1 616 cm-1出现羧基(—COO-)的非对称共振和1 423 cm-1和1 369 cm-1的—COO-对称共振,三者共同构成了果胶中糖醛酸的特征结构。由此指认AP-A1主成分是果胶,且由于为NaCl中性盐所洗脱,故归属于酸性果胶。
由图6a、c可知,AP-N和AP-A2红外图谱中没有C=O伸缩共振,但具备1 643 cm-1和1 635 cm-1的—COO-非对称共振,并具备1 432 cm-1和1 415 cm-1的—COO-对称共振,故推测该2 种组分为非典型果胶结构。
2.3.2 指纹区
红外光谱指纹区位于1 300~400 cm-1范围,主要解读果胶或多糖糖苷键的分子构象[23]。
AP-N分别在1 265 cm-1和1 074 cm-1区域表达C—O或C—H或C—C伸缩共振,由C—C提示为该物质中存在大分子糖C骨架,而C—H和C—O可能是糖的侧链所产生的振动;906 cm-1和873 cm-1表示为β-糖苷键,而821 cm-1和784 cm-1为α-糖苷键(图6a)。
AP-A1仅在1 245 cm-1呈现一个C—O或C—H或C—C伸缩共振,被解读为C骨架结构和C—O键及C—H键的共振。1 110、1 064 cm-1和1 020 cm-1处产生3 处吸收峰,被解读为吡喃糖苷(pyranose)。当吡喃糖中C1与C5的羟基(—OH)或醛基(—C=O)缩合形成六元环,即六碳糖,是葡萄糖、甘露糖、半乳糖等己糖的前体[24]。HPLC-ion和紫外鉴定中都曾指出,AP-A1主要是由D-半乳糖缩合组成。当吡喃糖中C1与C4形成五元环,可形成木糖、核糖、阿拉伯糖等戊糖[25]。前文2.2节曾指出AP-A1含有D-木糖成分。因此,红外图谱中的吡喃糖苷为进一步解读出AP-A1果胶是由D-半乳糖和D-木糖缩合而成的大分子聚合物。进一步由AP-A1分子中的α-糖苷键,产生827 cm-1伸缩共振,表明AP-A1仅具备α-糖苷键(图6b)。
AP-A2在1 143 cm-1呈现与AP-A1相似的伸缩共振,故提示AP-A2中具备基本的大分子糖的C骨架。在881 cm-1有β-糖苷键伸缩共振,而无α-糖苷键伸缩振动(图6c)。
3 结 论
经纯化,分别得到5.3% AP-N、84.8% AP-A1和9.9% AP-A2这3 种果胶组分,其中AP-A1为主要成分;3 种果胶组分分子质量分别是281.89、524.31 kD和273.88 kD,其中AP-N和AP-A2还分别包含7.06 kD和7.13 kD低分子糖类。
色谱和光谱解析,AP-A1在特征区同时存在C=O和对称、非对称—COO基团,而且在指纹区以吡喃糖和α-糖苷键的形式存在,故被解读为由D-半乳糖和D-木糖聚合而成的果胶大分子,归属于典型果胶结构特征。而AP-N与AP-A2碳链同时兼备α-或β-糖苷键,且在特征频率区缺乏C=O官能团,推测二者属于非典型果胶低聚多糖。
综上所述,猕猴桃中的主成分AP-A1属经典果胶结构,可用作食品工业中稳定剂和增稠剂的新资源;而AP-N与AP-A2为非典型结构果胶,可作为膳食纤维补充剂的功能食品新资源。
[1] 徐小彪, 张秋明. 中国猕猴桃种质资源的研究与利用[J]. 植物学通报, 2004, 20(6): 648-655. DOI:10.3969/j.issn.1674-3466.2003.06.002.
[2] 赵莎莎, 姚晓丽, 吴旻丹, 等. 酶法提取猕猴桃皮和渣中果胶的工艺研究[J]. 安徽农业科学, 2011, 39(12): 7097-7100.
[3] 顾晓俊, 金邦荃, 赵莎莎, 等. 三联法制备猕猴桃皮中果胶的工艺优化[J]. 食品科技, 2013, 38(10): 88-91.
[4] 赵莎莎, 金邦荃, 顾晓俊, 等. 三联法制备猕猴桃果肉中果胶的工艺研究[J]. 南京师范大学学报(工程技术版), 2013, 13(2): 81-86.
[5] 吴旻丹, 陈瑜, 金邦荃. 猕猴桃提取物促进小鼠离体肠段运动的初探[J]. 食品工业科技, 2011, 32(1): 78-80.
[6] 顾晓俊, 刘琛, 金邦荃, 等. 猕猴桃增进肠蠕动的功效成份破析[J].南京师范大学学报(工程技术版), 2014, 14(2): 86-90. DOI:10.3969/ j.issn.1672-1292.2014.02.015.
[7] 黄诚, 周长春, 李伟. 猕猴桃的营养保健功能与开发利用研究[J]. 食品科技, 2007, 32(4): 51-55.
[8] MOHNEN D. Pectin structure and biosynthesis[J]. Current Opinion in Plant Biology, 2008, 11(3): 266-277. DOI:10.1016/j.pbi.2008.03.006.
[9] PELLOUX J, RUSTERUCCI C, MELLEROWICZ E J. New insights into pectin methylesterase structure and function[J]. Trends in Plant Science, 2007, 12(6): 267-277. DOI:10.1016/j.tplants.2007.04.001.
[10] 赵晓坤. 紫外吸收光谱在有机化合物结构解析中的应用[J]. 内蒙古石油化工, 2007(11): 171-173.
[11] 万建华, 顾正彪, 洪雁. 马铃薯渣果胶多糖分离纯化及结构初探[J].安徽农业科学, 2008, 36(19): 7970-7973.
[12] 潘松, 刘长江, 梁爽. 软枣猕猴桃多糖的分离与纯化及其分子质量的测定[J]. 食品科学, 2012, 33(15): 66-70.
[13] 鲁慧芳, 丁长河, 侯丽芬, 等. 苹果渣中果胶提取条件及其分子质量的测定研究[J]. 食品与发酵工业, 2007, 33(6): 154-157. DOI:10.3321/j.issn:0253-990X.2007.06.039.
[14] 刘贺, 郭晓飞, 刘俊山, 等. 大豆果胶类多糖组成特性及空间结构的初步解析[J]. 中国粮油学报, 2012, 27(12): 12-16. DOI:10.3969/ j.issn.1003-0174.2012.12.003.
[15] 商澎, 曹之宪. 当归多糖组分的高效液相色分析[J]. 中国药学杂志, 2000, 35(5): 332-335.
[16] 清源, 余梦瑶, 罗霞, 等. 毛木耳子实体中活性多糖APPⅡA的分离纯化与结构初探[J]. 菌物学报, 2009, 28(6): 813-818.
[17] KAČURÁKOVA M, CAPEK P, SASINKOVA V, et al. FT-IR study of plant cell wall model compounds: pectic polysaccharides and hemicelluloses[J]. Carbohydrate Polymers, 2000, 43(2): 195-203. DOI:10.1016/S0144-8617(00)00151-X.
[18] MANRIQUE G D, LAJOLO F M. FT-IR spectroscopy as a tool for measuring degree of methyl esterification in pectins isolated from ripening papaya fruit[J]. Postharvest Biology and Technology, 2002, 25(1): 99-107. DOI:10.1016/S0925-5214(01)00160-0.
[19] KAMNEV A A, COLINA M, RODRIGUEZ J. Comparative spectroscopic characterization of different pectins and their sources[J]. Food Hydrocolloids, 1998, 12(3): 263-271. DOI:10.1016/S0268-005X(98)00014-9.
[20] 周裔彬, 汪东风, 宛晓春, 等. 茶多糖的纯化及结构分析[J]. 化学通报, 2008, 71(9): 691-695.
[21] 张俐娜, 张平义, 李翔, 等. 香菇多糖的成分及其分子量研究[J].高等学校化学学报, 1998, 19(9): 1513-1517. DOI:10.3321/ j.issn:0251-0790.1998.09.026.
[22] 牟世芬, 刘克纳. 离子色谱方法及应用[M]. 北京: 化学工业出版社, 2000: 234-235.
[23] ZHANG Y J, ZHANG L X, YANG J F, et al. Structure analysis of water-soluble polysaccharide CPPS 3, isolated from Codonopsis pilosula[J]. Fitoterapia, 2010, 81(3): 157-161. DOI:10.1016/ j.fi tote.2009.08.011.
[24] YALPANI M. Polysaccharides: syntheses, modifi cations and structure/ property relations[M]. New York: Elsevier, 2013: 408-461.
[25] 张雅楠, 黄军根, 聂少平, 等. 三种常见糖类产生呋喃的影响因素研究[J]. 食品工业科技, 2012, 33(20): 98-100.
Purifi cation and Structural Elucidation of Kiwifrut Pectin
GU Xiaojun1, JIN Bangquan1,*, CHEN Xiaonan1, LI Yi2, LIU Chunquan3
(1. Ginling College, Nanjing Normal University, Nanjing 210097, China; 2. Analysis and Testing Center, Nanjing Normal University, Nanjing 210097, China; 3. Institute of Agricultural Products Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
Kiwifruits are a rich source of pectin, and purified kiwifruit pectin can be used a food ingredient. In this research, structural characteristics of the pectin molecule were interpreted and confirmed aiming to offer a theoretical basis for the study of its biofunctions. After kiwifruit pectin was purifi ed by DEAE-Cellulose 52 anion exchange column chromatography, its components, molecular weight, primary structure and domains were identified by high performance gel permeation chromatography (HPGPC), high performance liquid chromatography (HPLC), ultraviolet spectroscopy and infrared spectroscopy. The results showed that kiwifruit pectin contained at least three components, neutral pectin (AP-N), acidic pectin 1 (AP-A1) and 2 (AP-A2). AP-A1 was the major component with a molecular weight of 524.31 kD, accounting for 84.8%. Based on structural analysis, AP-A1 was a polymer of D-galactose and D-xylose. Its carbon chain was composed of pyranose with α-glycosidic linkage in the fi ngerprint area. In the characteristic region, there were C=O groups, symmetric and asymmetric -COO groups. Because of these special structure and domains, AP-A1 was assigned to typical macromolecular pectin. AP-N and AP-A2 were the minor components with molecular weights of 281.89 and 273.88 kD, respectively. Their carbon chains were linked by α or β-glycosidic bond without C=O groups. For these reasons, the structures of AP-N and AP-A2 were assigned to atypical pectin polysaccharide.
purifi cation; molecular weight; polysaccharide components; structural domain; kiwifruit pectin
10.7506/spkx1002-6630-201611009
TS207.3
A
2015-07-13
公益性行业(农业)科研专项(201503142-5);2011年江苏省现代农业技术创新项目(CX(11)2067-1)
顾晓俊(1990—),女,硕士研究生,研究方向为功能食品及新资源。E-mail:983731671@qq.com
*通信作者:金邦荃(1956—),女,教授,博士,研究方向为功能食品。E-mail:jinbangquan@njnu.edu.cn
