B与S共掺杂锐钛矿相TiO2的制备与性能研究*
2016-11-12靳映霞高洪林柳清菊
杨 荣,靳映霞,高洪林,柳清菊
(云南大学 云南省微纳材料与技术重点实验室,昆明 650091)
B与S共掺杂锐钛矿相TiO2的制备与性能研究*
杨 荣,靳映霞,高洪林,柳清菊
(云南大学 云南省微纳材料与技术重点实验室,昆明 650091)
以钛酸四丁酯、硫脲和硼酸为原料,采用溶胶-水热法制备了B-S-TiO2光催化剂。通过TG-DTA、XRD、FT-IR、UV-Vis、PL等手段对样品进行表征和分析,研究了不同热处理温度对共掺杂B-S-TiO2光催化剂晶体特性的影响。以亚甲基蓝(MB)作为目标降解物,研究了不同热处理温度下系列样品在可见光激发下的光催化性能。结果表明,B和S的共掺可以抑制样品由锐钛矿相向金红石相的转变,限制晶粒的生长,拓宽TiO2的光谱响应范围至可见光区,减小了光生电子-空穴对的复合几率。当n(B)∶n(TiO2)=1∶25,n(S)∶n(TiO2)=1∶50,热处理温度为450 ℃时,B-S-TiO2样品在发光范围为可见光的普通日光灯下5 h内对亚甲基蓝的降解率达92.52%,显著高于同等实验条件下P25的降解率(60.74%)。
TiO2;共掺杂;可见光;光催化
0 引 言
TiO2因其具有光催化活性高、化学稳定性好、氧化还原性强、清洁无毒和成本低等优点作为光催化剂被用于降解有机物以来,其禁带宽度宽和光生载流子寿命短的缺点凸显[1],严重制约了TiO2的应用。因此研究人员致力于寻找有效可行的方法以减小TiO2的禁带宽度,并提高其对可见光的吸收[2]。在众多改性TiO2的方法中,离子掺杂改性因性能相对稳定、改性效果好而受到广泛关注[3]。
研究人员利用第一性原理研究发现离子掺杂可影响TiO2的电子结构,并且有效改善TiO2的光催化性能[4]。实验也证明非金属离子的掺杂在避免TiO2晶格被破坏的同时能从窄化禁带宽度[5]、提供杂化能级[6]和引入氧缺陷[7]3个方面提高TiO2光催化性能,并且不会影响其在紫外光区的催化活性。众多掺杂改性非金属中,N掺杂通过N-2p轨道与TiO2价带顶的O-2p轨道杂化,使得TiO2的价带上移,能有效将TiO2的光吸收带边红移至可见光区[8-9]。C掺杂主要是在TiO2的禁带中引入杂质能级,起到减小禁带宽度的作用[10]。S离子可以以不同的价态(S2-,S4+和S6+)进入TiO2体系形成不同的键合形式,且S阳离子和S阴离子进入TiO2对其可见光吸收的影响机理不同,因此S离子的掺杂相对而言比较复杂[11]。通常制备TiO2工艺中环境条件不同会导致S以不同价态形式进入,早期的理论计算显示S阳离子的掺杂能有效窄化TiO2的禁带宽度[12],而后期理论计算显示S的掺杂使S-3p轨道在TiO2的价带顶部形成的杂质态可能是导致吸收边界红移的原因[13]。B掺杂与S掺杂相似,B离子可以以阴离子、阳离子或间隙位置的形式进入TiO2[14-15]。而研究人员对B离子以不同位置替换(B替换O,B替换Ti或间隙)所形成的机理出现争论[16-17]。有文章认为,B替换O或者B替换Ti的方式实现掺杂,都会因为B-2p轨道与Ti-3d轨道形成耦合效应,在TiO2的导带底引入杂质态,使掺杂的催化剂的导带底下移[18]。
所以,不同非金属离子的掺杂,由于各物质自身物理化学性质的差异,导致对TiO2产生影响的机理不同。我们期望找到一种能对可见光响应、且有效提高光生载流子分离的方法。根据本课题组的理论计算[19]可知, B与S共掺后使得TiO2的能带整体下移,费米能级由原来的价带附近移动至导带附近,而B-2p轨道、S-3p轨道、Ti-3d轨道和O-2p轨道杂化导致价带宽化,使得TiO2的禁带宽度变窄,将有利于TiO2光催化性能的提高。基于此,本文通过实验研究,获得具有良好的可见光响应的B-S-TiO2光催化剂的制备工艺。
本文采用溶胶-水热法制备了B-S-TiO2光催化剂,通过TG-DTA、XRD、FT-IR、UV-Vis及PL分析,研究了热处理温度对B-S-TiO2光催化性能的影响。
1 实 验
1.1 B-S-TiO2光催化剂的制备
在60 ℃水浴搅拌条件下,将3 mL自制水解抑制剂加入到75 mL蒸馏水中形成溶液A,充分混合后将5 mL钛酸四丁酯缓慢加入溶液A中,利用稀硝酸调节溶液的pH值到2~3得到溶液B。称取一定量的SC(NH2)2和H3BO3加入溶液B中,持续搅拌直至形成透明的淡黄色溶胶。将溶胶静置陈化12 h后倒入高压反应釜中,拧紧,放入烘箱中保温一定时间,冷却、干燥、热处理、研磨后得到B-S-TiO2光催化剂。本实验中,B和S的掺杂量固定为n(B)∶n(Ti)=1∶25,n(S)∶n(Ti)=1∶50。
1.2 光催化剂的表征分析
用德国NETZSCH STA 409 PG/PC型热重分析仪分析 B-S-TiO2催化剂的反应中间体的晶型转变温度;以TTRⅢ型转靶X射线衍射仪对所得样品进行物相分析,CuKα靶,管电压为40 kV,管电流为150 mA,扫描速度为1°/min,扫描范围为10~90 ℃;以FTS-40型FT-IR光谱仪分析样品的红外光谱;以UV-4100型分光光度计测定样品的紫外-可见漫反射光谱;以FL4500型荧光分光光度计测定样品的荧光光谱。
1.3 光催化活性研究
实验以亚甲基蓝(MB) 作为目标降解物,取0.2 g所制备的粉体样品与50 mL的10 mg/L的MB溶液通过磁力搅拌进行混合,黑暗条件下搅拌0.5 h,达到吸附-脱附平衡后取样,取4 mL溶液,再将混合溶液置于功率为30 W的普通日光灯下进行光催化反应,每隔1 h取样一次,每次取样量为4 mL,将所取样品在离心机中以3 500 r/min离心40 min,取上清液,后用722N型分光光度计测定MB溶液在波长664 nm 处的吸光度值。根据朗伯-比尔定律,溶液的吸光度与浓度成正比,因此可用吸光度代替浓度计算降解率,以此为MB溶液的降解率。利用以下公式计算出MB溶液的降解率η
其中,A0为样品达到吸附-脱附平衡后MB溶液的初始吸光度;At为反应经过时间t后MB溶液的吸光度。
2 结果与讨论
2.1 差热分析
将未烧结的B-S-TiO2前驱物粉末于空气气氛中进行TG-DTA分析,升温速率10 ℃/min,结果如图1所示。样品温度测试范围是25~800 ℃,经历了4个失重过程,其中25~146 ℃为①阶段失重3.494%(质量分数),146~275 ℃为②阶段失重2.658%(质量分数),275~611 ℃为③阶段有2.926%(质量分数)的失重,611~800 ℃为④阶段失重1.104%(质量分数)。4个不同的失重阶段表明掺杂TiO2由于温度升高而产生的脱水、脱酯、中间产物分解和掺入的B和S脱出TiO2晶格的过程。阶段①伴随明显放热的快速失重过程可归因于样品中水分的脱失。此后,在135和170 ℃分别出现弱的放热和吸热峰并伴随少量的失重,这说明该阶段可能发生着缓慢有机物分解[20];与纯TiO2类似,在130~600 ℃区间内样品的失重达到5.5%,这是因为样品中残留有机物的裂解和中间产物的分解造成的[21- 22]。对于纯TiO2,370 ℃开始即出现较缓和的放热,表明此时已经开始出现了TiO2由锐钛矿相向金红石相的转变。而B-S共掺杂后,TiO2相变的热吸收温度提高到了399 ℃,说明B-S共掺杂抑制了TiO2的相变。此外,在249.5 ℃出现了一个较明显的放热,这可能是由于B和S与TiO2间形成化合键。值得注意的是,共掺杂样品在600 ℃后存在1.1%(质量分数)的失重,这说明掺杂的B和S不够稳定,在高温下能从晶格中逸出形成B2O3或者SO2。另一方面,掺杂样品的相变完成温度比纯TiO2的低,且吸热峰强度更弱,表明B和S的析出降低了TiO2的相变温度和相变所需能量,促进相变。
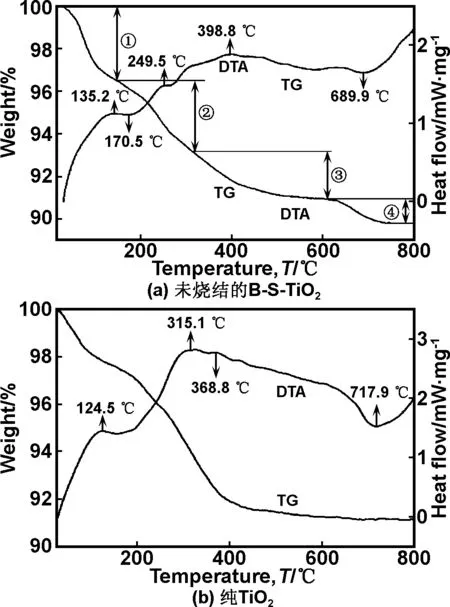
图1 未烧结的B-S-TiO2和纯TiO2样品的差热-热重分析图
2.2 XRD分析
图2为制备的B-S-TiO2经不同温度热处理后的XRD图谱以及450 ℃热处理的纯TiO2的XRD图谱。从图2中可以看出除400 ℃制备样品为单一锐钛矿相,其它样品均为锐钛矿相与金红石相并存。因掺杂样品中B和S的含量很少,在图谱中没有发现B和S的特征衍射峰。
不同温度下B-S-TiO2系列样品中,400~550 ℃,晶粒生长速度缓慢,晶相转变速度更慢,可能是因为TiO2晶格内和晶界上B和S的存在,阻碍了晶体向外界的质量和能量的传输,因此会产生类似于“钉扎现象”阻碍 TiO2颗粒的生长[23]。当温度升高至600 ℃时,分布在晶格内的B2O3和SO2获得足够的能量脱离TiO2晶格,抑制作用明显减弱,晶粒尺寸迅速长大,相变速度提高,650 ℃时,已经有85%锐钛矿相转变为金红石相。
从图1中可以看出,经450 ℃热处理的纯TiO2中金红石相含量明显多于450 ℃热处理的B-S-TiO2样品。说明B和S共掺杂对TiO2晶相转变有一定的抑制作用。

图2 不同温度热处理的B-S-TiO2及450 ℃热处理的纯TiO2样品的 XRD 谱图
表1为根据 Quantitative公式和Scherrer公式计算的不同温度下B-S-TiO2系列样品和450 ℃热处理的纯TiO2样品的平均晶粒尺寸和晶胞参数表。通过计算可知,经 450 ℃热处理后 B-S-TiO2的平均晶粒尺寸为10.49 nm,而相同条件下制备的纯TiO2的平均晶粒尺寸为15.79 nm,说明在相同的热处理温度下,B和S共掺杂可以抑制 TiO2晶粒的长大。表1数据显示,所有掺杂样品在c轴方向均出现压缩现象。

表1 不同温度热处理的B-S-TiO2及450 ℃热处理的纯TiO2样品的晶格常数及平均晶粒尺寸
B离子半径为0.088 nm,S离子半径为0.104 nm,与Ti(离子半径0.1448 nm)和O(离子半径0.074 nm)相比,只有B和S替换Ti位进入晶格才有可能出现压缩的现象。根据杨[24]和Finazzi[25]的理论计算,我们推测掺杂的B是以间隙形式进入TiO2晶胞。至于S离子,根据本课题组的计算[19],结合实际退火实验条件为富氧条件,我们推测S是以S4+形式进入TiO2晶格。由于S—O的键长比Ti—O键长短,因此产生压缩。从锐钛矿相晶格参数来看,a轴变化不大,c轴为逐渐从压缩状态变为接近标准锐钛矿相TiO2的参数值,这说明随着温度的增加,晶胞在逐渐膨胀,晶粒尺寸也随着热处理温度的增加而长大,逐渐转变为高温稳定相金红石相。
2.3 红外光谱
图3为450 ℃下热处理的B-S-TiO2、S-TiO2、B-TiO2以及纯TiO2的FT-IR光谱图。对比图3的四条曲线发现,S-TiO2曲线中振动峰在相应位置能与B-S-TiO2曲线的振动峰吻合,说明S单掺杂TiO2时所形成的离子形式与共掺所形成的离子形式一致。四条曲线中1 000 cm-1以下的吸收峰均为TiO2晶体和表面Ti—O键伸缩振动和弯曲振动引起的,是TiO2晶体的特征振动峰。3 390 cm-1附近的吸收峰是由表面羟基O—H的伸缩振动引起的,与TiO2表面吸附水有关[26],2 354 cm-1处的吸收峰为TiO2的特征吸收峰,1 640 cm-1处的吸收峰为TiO2表面的物理吸附水的弯曲振动峰,TiO2表面吸附水的—OH在光照下可捕获h+生成具有高氧化能力的羟基自由基·OH,有利于光催化反应的进行[26]。S-TiO2和B-S-TiO2样品在1 038和1 133 cm-1处有吸收峰,1 133 cm-1处的吸收峰对应于物理吸附SO2,而1 038 cm-1处的吸收峰是由Ti—O—S键的振动引起的[27],这也验证了晶格分析中S以阳离子的形式进入TiO2晶格的猜测是正确的。B-TiO2和B-S-TiO2样品存在不同的吸收峰。B-TiO2曲线中在1 390和1 330 cm-1左右位置形成的吸收峰在文献[29]中所提为Ti-O-B振动峰。而B-S-TiO2样品曲线显示为1 403和1 201 cm-1存在吸收峰,其中1 201 cm-1为B2O3上形成的B—O键弯曲振动峰[28],而1 403 cm-1为Ti-O-B振动峰[29]。B-TiO2和B-S-TiO2样品FT-IR曲线中Ti-O-B吸收峰位的变化说明B-S的共掺会使B逸出TiO2,形成B2O3。
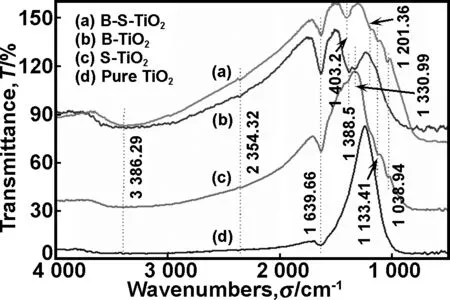
图3 B-S-TiO2,B-TiO2,S-TiO2以及纯TiO2的FT-IR光谱图
图4为经过不同温度热处理的B-S-TiO2样品的FT-IR光谱图。随着热处理温度的升高,从图4可以看出,所有特征峰强度均减弱,1 403 cm-1处的Ti-O-B振动峰逐渐减弱,进入TiO2晶格的硼离子获得能量,逸出TiO2晶格,而1 201 cm-1处的B2O3的B—O键弯曲振动峰逐渐消失,说明随着热处理温度的升高,掺入TiO2晶格的硼离子逐渐减少,不足以形成B2O3。随着热处理温度的升高,1 128 cm-1处的物理吸附SO2特征峰也逐渐消失,而1 038 cm-1处的Ti—O—S键的振动吸收峰也逐渐消失, 当烧结温度为600 ℃时,掺入TiO2晶格的物理吸附SO2和阳离子掺杂S4+获得足够多的能量逸出晶格,晶格缺陷急剧减少,掺杂离子的抑制作用显著降低,晶体自修复生长,平均晶粒尺寸迅速增大。
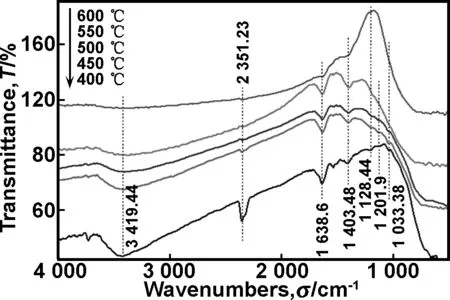
图4 不同温度热处理的B-S-TiO2样品的FT-IR光谱图
2.4 紫外-可见漫反射光谱
图5为经过不同温度热处理后的B-S-TiO2样品及P25的UV-Vis光谱图。从图5中可以看出,共掺杂后的样品与P25相比,在可见光区都有明显吸收,而且吸收带边均发生了一定程度的红移。随着热处理温度的增加,样品吸收带边红移程度先保持不变后增加,热处理温度为650 ℃时,样品的吸收带边红移程度最大,较P25红移约35 nm,因为其金红石含量最多;热处理温度为450 ℃时,样品在可见光区的吸收最强。根据本课题组的理论计算[19],B和S共掺杂后,使TiO2光催化剂的S-3p轨道、B-2p轨道和O-2p轨道杂化,使价带宽化上移,禁带宽度减小,有利于实现TiO2光催化剂对可见光的吸收,说明掺杂能够有效拓宽TiO2光催化剂对可见光的响应范围。

图5 不同温度热处理的B-S-TiO2样品及P25的UV-Vis光谱图
2.5 荧光光谱分析
图6为经过不同温度热处理的B-S-TiO2样品及P25的PL谱图。从图6中可看出B-S-TiO2样品与P25的PL光谱线型和特征峰位置基本一样,表明B和S的共掺杂没有引起新的发光现象。随着温度的升高,荧光强度先降低后增强,这是由于随着热处理温度的升高,样品中出现外部为金红石薄层而内部为锐钛矿型的包覆结构,金红石相与锐钛矿相费米能级不同,在两相界面间能产生Schottky势垒,可促进电子及空穴的转移、分离并迁移到催化剂的表面[31];而当温度较高时,掺杂进入TiO2晶格的物质可能会逸出晶格,而且金红石相含量显著增加,导致晶体缺陷减少,空位增加,空位有可能成为光生载流子的复合中心,不利于光生载流子的传输。晶粒也明显长大,电子、空穴向表面迁移的路程加长,其复合几率增加。450 ℃热处理样品的荧光强度最低,说明该温度下B和S共掺能更有效抑制光生电子-空穴对的复合。
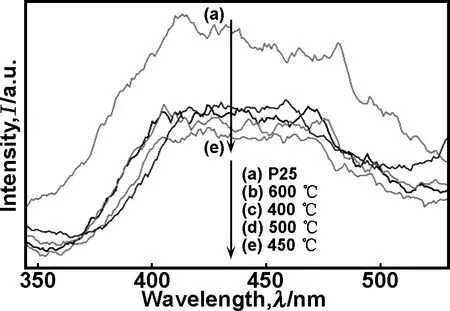
图6 P25和不同温度热处理的B-S-TiO2样品的PL谱图
2.6 光催化性能
图7为经过不同温度热处理制备的B-S-TiO2样品及P25对亚甲基蓝(MB)的光催化降解效果图。
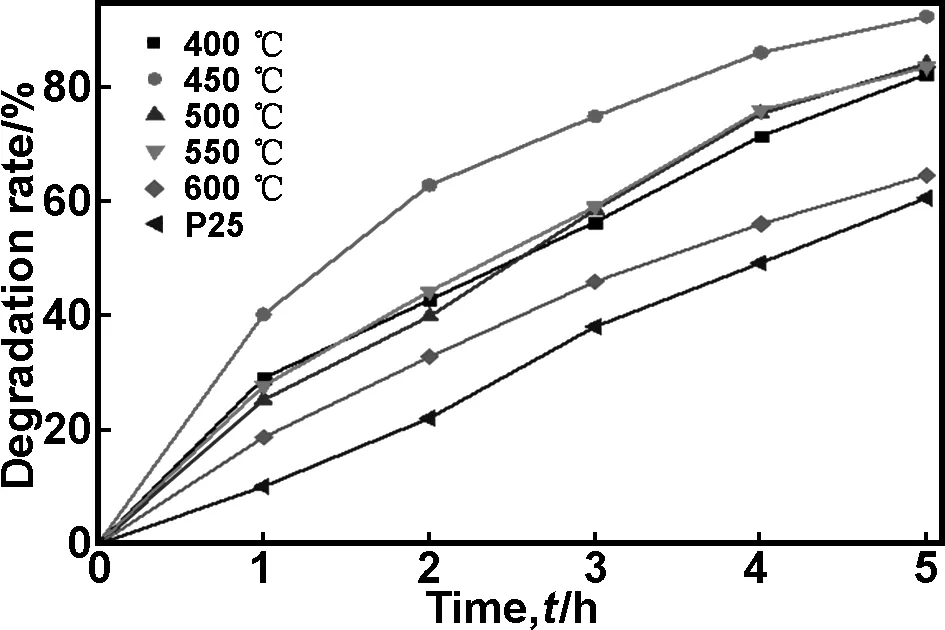
图7 不同温度热处理的B-S-TiO2样品对MB的光降解曲线
从图7中可以看出450 ℃热处理的样品在普通日光灯下5h 内对 MB 的降解率达到92.52%, 明显高于 P25(同等实验条件下60.74%) 及同等条件下制备的其它样品对 MB 的降解率,由XRD分析可知450 ℃热处理的样品平均晶粒尺寸小,比表面积大,光生载流子扩散至催化剂表面的路程短,电子与空穴复合几率较小,电荷分离效果较好,能够有更多的光生载流子迁移至催化剂表面参与氧化还原反应,所以催化活性最高。当温度达到600 ℃时,晶粒尺寸明显增大,比表面积急剧减小,表面吸附的羟基数量减少,使得光催化活性降低。
3 结 论
通过溶胶-水热法制备了B-S-TiO2光催化剂。研究发现,B和S分别以阳离子B3+和S4+的形式间隙存在于TiO2晶格中。B和S的共掺杂阻止了TiO2晶相转变,同时有效抑制了TiO2晶粒的长大。B和S的共掺杂能够减小TiO2的禁带宽度,降低光生电子-空穴对的复合,使TiO2吸收光谱带边红移至可见光区,提高了TiO2的光催化活性。当n(B)∶n(TiO2)=1∶25,n(S)∶n(TiO2)=1∶50,450 ℃焙烧4 h实验条件下样品的光催化性能最佳,在普通日光灯下5 h内对MB的降解率为92.52%,明显高于在同等实验条件下P25对MB的降解率(60.74%)。
[1] Zhang D. Enhanced photocatalytic activity for titanium dioxide by co-modification with copper and iron[J]. Transition Metal Chemistry, 2010, 35(8):933-938.
[2] Kumar S G, Devi L G. Review on modified TiO2photocatalysis under UV/visible light: selected results and related mechanisms on interfacial charge carrier transfer dynamics[J]. The Journal of Physical Chemistry A, 2011, 115(46): 13211-13241.
[3] Yang K, Dai Y, Huang B. Review of the structural stability, electronic and magnetic properties of nonmetal-doped TiO2from first-principles calculations[J]. arXiv Preprint arXiv:1202.5651, 2012.
[4] Zhao Zongyan, Liu Qingju, Zhu Zhongqi, et al. Effects of S doping on electronic structures and photocatalytic properties of anatase TiO2[J]. Acta Physica Sinica-Chinese Edition, 2008,57(6): 3760-3768.
赵宗彦, 柳清菊, 朱忠其, 等. S掺杂对锐钛矿相TiO2电子结构与光催化性能的影响[J]. 物理学报, 2008,57(6): 3760-3768.
[5] Im J S, Yun S M, Lee Y S. Investigation of multielemental catalysts based on decreasing the band gap of titania for enhanced visible light photocatalysis[J]. Journal of Colloid and Interface Science, 2009, 336(1): 183-188.
[6] Yaghoubi H, Li Z, Chen Y, et al. Toward a visible light-driven photocatalyst: the effect of midgap-states-induced energy gap of undoped TiO2nanoparticles[J]. ACS Catalysis, 2014, 5(1): 327-335.
[7] Ma J, Wu H, Liu Y, et al. Photocatalytic removal of NOxover visible light responsive oxygen-deficient TiO2[J]. The Journal of Physical Chemistry C, 2014, 118(14): 7434-7441.
[8] Livraghi S, Paganini M C, Giamello E, et al. Origin of photoactivity of nitrogen-doped titanium dioxide under visible light[J]. J Am Chem Soc, 2006, 128 (49):15666-15671.
[9] Yang G D, Jiang Z, Shi H H, et al. Preparation of highly visible-light active N-doped TiO2photocatalyst[J]. Journal of Materials Chemistry, 2010, 20(25):5301-5309.
[10] Dong F, Guo S, Wang H Q, et al. Enhancement of the visible light photocatalytic activity of C-doped TiO2nano materials prepared by a green synthetic approach[J]. The Journal of Physical Chemistry C, 2011, 115(27):13285-13292.
[11] Ohno T, Akiyoshi M, Umebayashi T, et al. Preparation of S-doped TiO2photocatalysts and their photocatalytic activities under visible light[J]. Applied Catalysis A: General, 2004, 265(1):115-121.
[12] Sathish M, Sankaran M, Viswanathan B, et al. DFT studies on anionic hetero atom (N or/and S) substitution in TiO2[J]. Indian Journal of Chemistry Section A, 2007, 46(6): 895.
[13] Tian F H, Liu C B. DFT description on electronic structure and optical absorption properties of anionic S-doped anatase TiO2[J]. The Journal of Physical Chemistry B, 2006, 110(36):17866-17871.
[14] Zaleska A, Grabowska E, Sobczak J W, et al. Photocatalytic activity of boron-modified TiO2under visible light: the effect of boron content, calcination temperature and TiO2matrix[J]. Applied Catalysis B: Environmental, 2009, 89(3):469-475.
[15] Chen D M, Yang D, Wang Q, et al. Effects of boron doping on photocatalytic activity and microstructure of titanium dioxide nanoparticles[J]. Industrial and Engineering Chemistry Research, 2006, 45(12):4110-4116.
[16] Finazzi E, Di Valentin C, Pacchioni G. Boron-doped anatase TiO2: pure and hybrid DFT calculations[J]. The Journal of Physical Chemistry C, 2008, 113(1):220-228.
[17] Chen D M, Yang D, Wang Q, et al. Effects of boron doping on photocatalytic activity and microstructure of titanium dioxide nanoparticles[J]. Industrial and Engineering Chemistry Research, 2006, 45(12):4110-4116.
[18] Yang K, Dai Y, Huang B. Origin of the photoactivity in boron-doped anatase and rutile TiO2calculated from first principles[J]. Physical Review B, 2007, 76(19):195201.
[19] Liu Q L, Zhao Z Y, Liu Q J. Synergistic effects of nonmetal co-doping with sulfur in anatase TiO2: a DFT+U study[J]. Physical Chemistry Chemical Physics, 2015(17):3426-3434.
[20] Na Wei, Zhu Zhongqi, Zhang Jin, et al. Study on properties of the anatase nano-TiO2sol [J]. Journal of Functional Materials, 2007, 37(11):1822-1824.
纳 薇, 朱忠其, 张 谨,等. 锐钛矿型纳米TiO2溶胶的性能研究[J]. 功能材料, 2007, 37(11):1822-1824.
[21] Wu Y, Xing M, Zhang J, et al. Effective visible light-active boron and carbon modified TiO2photocatalyst for degradation of organic pollutant[J]. Applied Catalysis B: Environmental, 2010, 97(1):182-189.
[22] Wang X, Blackford M, Prince K, et al. Preparation of boron-doped porous titania networks containing gold nanoparticles with enhanced visible-light photocatalytic activity [J]. ACS Applied Materials & Interfaces, 2012, 4(1):476-482.
[23] Wu Jing, Gao Pan, Zhu Zhongqi, et al. Preparation and properties of praseodymium and nitrogen co-doped nano-titanium dioxide photocatalyst[J]. The Chinese Journal of Nonferrous Metals, 2015, 21(6):1480-1484.
吴 晶, 高 攀, 朱忠其, 等. 镨和氮共掺杂纳米TiO2光催化剂的制备与性能[J]. 中国有色金属学报, 2015, 21(6):1480-1484.
[24] Yang K, Dai Y, Huang B. Origin of the photoactivity in boron-doped anatase and rutile TiO2calculated from first principles[J]. Physical Review B, 2007, 76(19):195201.
[25] Finazzi E, Di Valentin C, Pacchioni G. Boron-doped anatase TiO2: pure and hybrid DFT calculations[J]. The Journal of Physical Chemistry C, 2008, 113(1):220-228.
[26] Wei F Y, Ni L S, Cui P. Preparation and characterization of N-S-codoped TiO2photocatalyst and its photocatalytic activity[J]. Journal of Hazardous Materials, 2008, 156(1):135-140.
[27] Yang G D, Yan Z F, Xiao T C. Low-temperature solvothermal synthesis of visible-light-responsive S-doped TiO2nanocrystal[J]. Applied Surface Science, 2012, 258(8):4016-4022.
[28] Alejandro A, Maria J S, Clara J, et al. Evaluation of sol-gel TiO2photocatalysts modified with carbon or boron compounds and crystallized in nitrogen or air atmospheres[J]. Chemical Engineering Journal, 2015, 277:11-20.
[29] Chen D M, Yang D, Wang Q, et al. Effects of boron doping on photocatalytic activity and microstructure of titanium dioxide nanoparticles[J]. Industrial & Engineering Chemistry Research, 2006, 45(12):4110-4116.
[30] Gao Wei, Wu Fengqing, Luo Zhen, et al. Studies on the relationship between the crystal form of TiO2and its photocatalyzing degradation efficiency[J]. Chemical Journal of Chinese Uuniversity, 2001, 22(4):660-662.
高 伟, 吴凤清, 罗 臻, 等. TiO2晶型与光催化活性关系的研究[J]. 高等学校化学学报, 2001, 22(4):660-662.
Study on preparation and properties of TiO2codoped with Boron and Sulfur
YANG Rong, JIN Yingxia, GAO Honglin, LIU Qingju
(Yunnan Key Laboratory for Micro/Nano Materials & Technology, Yunnan University,Kunming 650091, China)
B-S-TiO2photocatalysts were synthesized by sol-hydrothermal method using tetrabutyl titanate, thiourea and boric acid as precursors and characterized by TG-DTA, XRD, FT-IR, UV-Vis and PL methods. The influences of different heat treated temperatures on properties were studied. The photocatalytic activity of B-S-TiO2photocatalysts was investigated by measuring the degradation rate of methylene-blue (MB) under visible light irradiation. The results show that B, S codoping can not only inhabit the phase transition of anatase to rutile, restrain the growth of the grain but also broaden the absorption region to visible light and inhibit the recombination of the photo-generated electrons and holes. The photocatalytic activity of the sample with molar ratio ofn(B)∶n(TiO2)=1∶25,n(S)∶n(TiO2)=1∶50 and calcinated temperature of 450 ℃ was the best under the irradiation of fluorescent light, it was 92.52% within 5 hours and significantly higher than that of Degussa P25(60.74%) under the same experimental conditions.
TiO2; codoping; visible light; photocatalytic
1001-9731(2016)10-10142-06
国家高技术研究发展计划(863计划)资助项目(2015AA034601);国家自然科学基金资助项目(51262030)
2015-11-10
2016-06-14 通讯作者:柳清菊,E-mail: qjliu@ynu.edu.cn
杨 荣 (1991-),女,在读硕士,师承柳淸菊教授,从事TiO2光催化材料研究。
TQ426.2
A
10.3969/j.issn.1001-9731.2016.10.026
