苯乳酸的微生物合成及分离研究进展
2016-11-12倪正关今韬沈绍传贠军贤
倪正,关今韬,沈绍传,贠军贤
(浙江工业大学化学工程学院,绿色化学合成技术国家重点实验室培育基地,浙江 杭州 310032)
苯乳酸的微生物合成及分离研究进展
倪正,关今韬,沈绍传,贠军贤
(浙江工业大学化学工程学院,绿色化学合成技术国家重点实验室培育基地,浙江 杭州 310032)
苯乳酸是一种高值有机酸和新型的天然防腐剂,可由乳酸菌等多种微生物代谢产生。苯乳酸有着较为宽广的抑菌谱,对大多数革兰氏阳性、阴性菌和真菌都有明显的抑菌作用,不仅作为天然抑菌剂可替代化学合成的防腐剂,而且可经聚合反应合成聚苯乳酸新型高分子材料,作为聚乳酸高分子的替代物。因此,苯乳酸在化工、制药、生物、材料和食品等领域有广阔的应用前景。本文从苯乳酸抑菌特性、微生物菌株、转化合成、代谢途径及下游分离纯化等方面,简述了其生物转化合成和分离的研究现状。微生物菌株是苯乳酸合成的关键,基因工程菌的转化能力虽然高效,但构建工程菌较复杂;从自然环境中筛选安全优良的菌株,可以简化转化合成过程,提高转化率和料液中苯乳酸的浓度;苯乳酸的分离纯化还处于实验室的规模,有待进一步探索以达到工业化的要求。
苯乳酸;生物合成;发酵;分离;微生物菌株
苯乳酸(phenyllactic acid,PLA),也称作2-羟基-3-苯基丙酸,是一种天然存在的抑菌物质。它是一种手性分子,有L-PLA和D-PLA两种存在的手性形式,如图1所示。
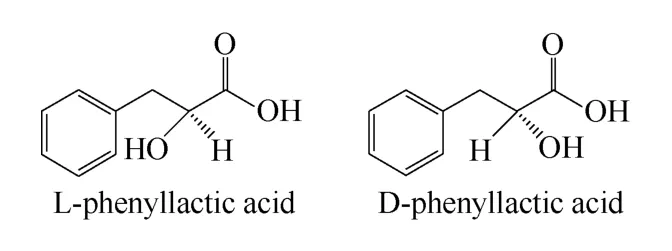
图1 苯乳酸的两种对映异构体
苯乳酸的分子式为C9H10O3,相对分子质量为166.17,其性质稳定,熔点为121~125℃;苯乳酸在水中溶解度较好,并且其在水溶液中有较好的热稳定性。
苯乳酸可由多种微生物代谢产生,是菌体在代谢途径中一个副产物[1-3]。苯乳酸不仅作为天然抑菌剂,可以替代化学合成的防腐剂,在食品和药品的保存与防腐方面具有重要应用,而且还可以通过聚合反应将其合成为聚苯乳酸新型高分子材料,作为一种潜在的聚乳酸替代物[4],可以广泛应用于制药工程、组织工程和高分子材料等领域。
苯乳酸的制备方法主要有化学合成法和微生物转化法。由于化学合成法存在耗能较大、副产物较多,需要采用毒性较大的溶剂,环境污染问题比较突出[5-9],限制了其规模化工业应用。近几年,国内外学者对苯乳酸的研究已转向微生物合成和转化方法,成为当前的主要发展方向。但是,由于菌株和下游提取分离技术的限制,现有微生物转化合成苯乳酸的产率不高,发酵液或转化液中苯乳酸的分离不易,尚不能满足工业化制备生产的要求。因此,提高苯乳酸单位时间内的产率和纯度,是急需解决的关键问题。本文从苯乳酸的抑菌作用、菌株、代谢途径及下游分离等方面,对苯乳酸的研究情况进行综述。
1 苯乳酸的抑菌作用及微生物菌株
1.1抑菌作用
苯乳酸具有较广的抑菌谱,能够有效抑制真菌及细菌的感染,特别对致病菌都有着较好的抑制作用[1-3]。由于苯乳酸的天然属性和无毒性,在食品行业和药品保藏等领域,都有重要的应用前景。
1998年,DIEULEVEUX等[1-2]第一次报道了苯乳酸可以抑制李斯特菌(Listeria)的生长,发现在固体和液体培养基中李斯特菌的生长繁殖会受到白地霉菌的抑制作用。经超滤、离心分配色谱、薄层层析、凝胶过滤、高效液相色谱等分离纯化手段,以及液相色谱-质谱、红外光谱、核磁共振和旋光度测定等鉴定方法研究发现,这种抑制作用是因为苯乳酸和吲哚乙酸的存在而发生的,而且在抑制细菌效果中,D-苯乳酸的抑制作用比L-苯乳酸的明显,苯乳酸的抑制作用比吲哚乙酸明显。
2000年,LAVERMICOCCA等[3]从面包团发酵中分离出了能够有效抑制真菌的植物乳杆菌(Lactobacillus plantarum)21B菌株,该菌株能有效抑制霉菌,例如:曲霉属的赭曲霉(Aspergillus ochraceus)、土曲霉(A.terreus)、黄曲霉(A. favus)等以及青霉属的产黄青霉(P. chrysogenum)、桔青霉(P. citrinum)等。
2001年,MAGNUSSON等[10]研究了棒状乳杆菌亚种(Lactobacillus coryniformis subsp.)Si3菌株发酵液的抑菌作用及抑菌谱,发现其对烟曲霉(Aspergillus fumigatus)、构巢曲霉(A. nidulans)、娄地青霉(Penicillium roqueforti)、冻土毛霉(Mucor hiemalis)、黄色蠕形霉(Talaromyces flavus)、梨孢镰刀菌(Fusarium poae)、禾谷镰刀菌(F. graminearum)、黄色镰刀菌(F. culmorum)等都有明显的抑制效果。用离子交换色谱和凝胶色谱对菌株产物进行分析,得出该复杂抑菌物质的分子量为3000左右,并在之后的研究中还鉴定出苯乳酸[11]。
2002年,STRÖM等[12]从牧草青贮中分离出了一种能够抑制丝状真菌和酵母生长的菌株,命名为植物乳杆菌MiLAB 393,在该菌株的产物中分离出了3中具有抑菌效果的物质,分别为苯乳酸、环(苯丙氨酰-脯氨酰)及环(L-苯丙氨酰-反式-4-羟基-L-脯氨酸),其中苯乳酸左旋与右旋的比例为9∶1。
2003年,MAGNUSSON等[11]从不同环境中分离1200多株菌株,以烟曲霉为目标菌体,对各个菌株的抑菌能力进行了研究,其中约10%的菌株具有抑菌能力,约4%的菌株有着较强的抑菌能力。在其实验中,抑菌能力较强和中等的菌株有37株,抑菌能力低或者没有抑菌能力的菌株有5株。对有抑菌能力的菌株进行了研究,通过核磁共振光谱和质谱鉴定,其中在棒状乳杆菌亚种Si3和植物乳杆菌MiLAB 393菌株的产物中,分离鉴定出环(苯丙氨酰-脯氨酰)和苯乳酸。LAVERMICOCCA等[13]从烘焙面包、面粉和谷物中筛选出了23株真菌,试验在含有苯乳酸的培养基中的生长情况。以培养菌株娄地青霉IBT18687为例,未加苯乳酸的空白培养基为参照,在对比培养基中添加不同浓度的苯乳酸。经培养72h后,显微镜观察到空白培养基中长满了菌丝;在添加了3.75mg/mL苯乳酸的培养基中,观察到有一小部分正在萌发的分生孢子,说明苯乳酸对菌体生长产生了抑制作用;而当苯乳酸浓度为5mg/mL时,观测不到菌体及分生孢子的存在,说明在此苯乳酸浓度条件下,IBT18687菌体的生长完全受到抑制。
2007年,LIND等[14]研究了来自5种不同类型的乳酸菌分泌物对烟曲霉菌和胶红酵母的抑制效果,从培养基上清液中取样测试,经高效液相色谱、光谱检测出苯乳酸的存在。
2008年,SCHWENNINGER等[15]在研究固定化双菌植物乳杆菌SM20和詹氏丙酸杆菌(Propionibacterium jensenii)SM11混合发酵过程中,发现发酵的上清液对铁红假丝酵母和胶红酵母有明显的抑制作用,在发酵上清液中检测到了丙酸、乙酸、乳酸以及苯乳酸等其他物质,推断这些物质在抑菌的作用中有着协同作用。
2012年,WANG等[16]从乳酒中分离了植物乳杆菌株IMAU10014,该菌株能够抑制植物病原真菌的生长。在发酵上清液中,提取到了苯乳酸和苯乙酸两种物质,并经进一步试验发现,苯乳酸和苯乙酸对苹果炭疽病菌(Glomerella cingulate)、葡萄孢菌(Botrytis cinerea)、掘氏疫霉(Phytophthora drechsleri Tucker)、桔青霉、状青霉(Penicillium digitatum)以及尖孢镰刀菌(Fusarium oxysporum)都有着明显的抑制效果。
2014年,ZAVALETA等[17]以4种霉菌[葡萄孢菌(Botrytis cinerea)、胶孢炭疽菌(Colletotrichum gloeosporioides)、扩展青霉(Penicillium expansum)、黄曲霉]为样本,试验了13株乳酸菌[5株干酪乳杆菌(Lactobacillus casei),2株鼠李糖乳杆菌(Lactobacillus rhamnosus),2株发酵乳杆菌(Lactobacillus fermentum),1株嗜酸乳杆菌(Lactobacillus acidophilus),1株植物乳杆菌,1株清酒乳杆菌(Lactobacillus sakei),1株罗伊氏乳杆菌(Lactobacillus reuteri species)]对其的抑制作用。实验中发现乳酸菌的发酵上清液对这4种霉菌有着不同程度的抑制作用,霉菌的生长抑制率范围为2.65%~66.82%之间,并且对发酵上清液进行灭菌处理(121℃,20min)后,抑菌效果依然存在,然而将发酵上清液用NaOH调pH至6.5后抑菌效果有所降低。经研究发现,此实验中除菌株植物乳杆菌NRRL B-4496和嗜酸乳杆菌ATCC-4495以外,其他乳酸菌株都会分泌苯乳酸。
1.2代谢产物含苯乳酸的微生物菌株
苯乳酸可以由多种乳酸菌自分泌产生,苯乳酸是乳酸菌代谢过程中的副产物,会在培养乳酸菌的过程中,分泌到培养基中。有关微生物自产苯乳酸的报道,最早由DIEULEVEUX等[1]研究发现并提出,该研究中发现苯乳酸对包括单核细胞增多性李斯特氏菌有明显的抑制作用,在白地霉菌发酵液中检测到苯乳酸。有关微生物菌种自产苯乳酸的报道见表1[1,3,18-22]。

表1 有关代谢产物含苯乳酸的微生物菌种
1.3利用微生物催化转化底物合成苯乳酸
通过对菌体进行一定的处理或改造,菌体利用苯丙氨酸或者苯丙酮酸为底物,在特定条件下转化合成苯乳酸,在其他报道中,有实验证明菌体可以利用牛皮纸浆、高粱渣滓等有机质为底物,在发酵过程中产生苯乳酸[23-24]。目前能够用于合成苯乳酸的菌体有许多种类,以乳酸菌为主,其他还有利用基因工程进行改造后的工程菌等,许多学者都进行了生物转化合成苯乳酸的研究,主要有李兴峰、刘凤丽、沐万孟、RODRÍGUEZ、KAWAGUCHI、ZHENG和朱银龙等[4,19,23-38]报道的有关微生物利用底物生物转化合成苯乳酸的主要研究见表2。
另外,通过改变底物浓度、培养条件、转化条件及培养基种类,经试验设计和转化合成优化,可进一步提高苯乳酸的产率。对乳酸菌体中的酶系进行提取纯化,研究具体酶系的组成,然后直接利用酶系进行转化也是十分直接有效的方法[39-41]。
但总体来看,现有的野生菌株自产苯乳酸的浓度都很低,远不能达到工业生产的要求。利用基因工程手段对菌株进行改造,可以大大提高苯乳酸的产率和发酵液中苯乳酸的浓度。但是,基因工程菌在规模化应用中尚有一些限制,例如菌株的稳定性以及生态安全性。

表2 有关利用底物转化产苯乳酸的报道
2 乳酸菌代谢合成苯乳酸的途径
苯乳酸是乳酸菌在代谢过程中的副产物,乳酸菌利用苯丙氨酸或苯丙酮酸为底物,转化合成苯乳酸有两种基本路径:其一为苯丙氨酸转化为苯丙酮酸,再转化为苯乳酸;其二为苯丙酮酸直接转化为苯乳酸[42-45]。
POOLMAN[46]研究了乳酸菌体重的代谢途径,对菌体中包含ATP能量代谢、离子协同运输、异种交换和基因转移过程的糖代谢进行了研究。VERMEULEN等[47]以旧金山乳杆菌(Lactobacillus sanfranciscensis)DSM 20451和植物乳杆菌TMW1.468为模板菌株,研究了苯丙氨酸转化为苯乳酸的代谢过程中多肽和其他底物的影响,对苯丙氨酸、苯丙酮酸及苯乳酸等在乳酸菌体内的代谢过程进行了详细的分析。LI等[48]对从泡菜中筛选而得的乳酸菌代谢途径进行了研究,实验表明,在底物中添加苯丙氨酸能够有效提高苯乳酸的产量。ZHENG等[36]筛选出一株嗜温凝结芽孢杆菌(Bacillus coagulans)SDM以苯丙酮酸为底物转化合成苯乳酸该实验中还对该菌体中葡萄糖代谢及苯丙酮酸合成苯乳酸途径做了研究。同时,JOHANNINGSMEIER等[49]研究了发酵青贮过程中布氏乳杆菌(Lactobacillus buchneri)LA1147的代谢途径,详细描述了代谢物。综上所得,在乳酸菌菌体内,能量代谢和苯乳酸的代谢途径归纳如图2。从现有文献来看,微生物中苯乳酸的代谢途径比较复杂,涉及的酶系多,目前的研究工作尚处于初始阶段,仍有不少问题都没有阐明。如何进行代谢流的优化和控制,以获得更高的产率和产量,是下一步需要研究的重要方向。

图2 乳酸菌中EMP、TCA以及苯丙氨酸、苯丙酮酸和苯乳酸的代谢途径[45-49]
3 苯乳酸的分离
2000年,LAVERMICOCCA等[3]对植物乳杆菌21B培养液进行处理,得到细胞滤液,分别使用己烷(pH 2.0)、三氯甲烷(pH 3.6)、乙酸乙酯(pH 10.0)和丁醇对滤液进行萃取。实验结果表明,乙酸乙酯萃取液具有最高的抑菌能力,说明乙酸乙酯能够很好的将苯乳酸从发酵液中萃取出来。使用200mL乙酸乙酯对200mL pH值为3.6的细胞滤液萃取4次,并同时结合干燥和减压蒸发的方法得到萃取原液。通过薄层层析对萃取原液进行分离,经气相色谱和质谱分析,鉴定出苯乳酸。
2003年,MAGNUSSON等[10-11]用C18柱对具有抑菌作用的植物乳杆菌MiLAB 006、戊糖片球菌016和024、清酒乳杆菌091以及棒状乳杆菌Si3的培养上清液进行固相萃取,再用高效液相色谱对萃取相进行分析,从中检测到苯乳酸。
2004年,VALERIO等[18]使用乙酸乙酯对10mL细胞上清液进行萃取,然后通过旋转蒸发,最后得到在MRS培养基和SM培养基中苯乳酸的回收率分别为97%±2%和88%±1.8%。李德茂等[50]使用区带毛线管电泳拆分对苯乳酸手性分离的条件进行了探索。在实验中考察了环糊精浓度和种类、所用缓冲液的pH、分离时的电压、分离时的温度对苯乳酸手性分离的影响。结果表明,羟丙基-β-环糊精(HP-β-CD)为最佳的手性选择剂,该环糊精中羟丙基上的羟基受到的约束力较其他羟基弱,且对苯乳酸的手性碳原子有着很好的结合能力。其他分离条件:0.03mol/L HP-β-CD,磷酸电泳缓冲液浓度为0.1mol/L,分离时的电压和温度分别为26kV和25℃,在此条件下苯乳酸的手性分离度为1.51,达到了良好的分离效果。
2008年,陈超[51]先用硫酸铝对苯乳酸发酵液进行预处理,然后考察不同苯乳酸分离手段对分离发酵液中苯乳酸的影响,所用到的方法有离子交换树脂、膜分离以及溶剂萃取等。经实验发现,采用乙酸乙酯溶剂萃取效果较好,经正交设计实验优化萃取条件,得到的萃取工艺为溶剂的相比为3∶1,pH为1.0,萃取次数为4次,在该萃取工艺下苯乳酸固形物含量达88.12%,回收率为92.61%。还研究了4种不同活性炭对发酵液的吸附脱色效果,通过单因素实验和正交设计实验,得到最佳吸附脱色条件:活性炭添加量为1.5%,发酵液初始pH为6.5,脱色温度为90℃,脱色时间30min。在此条件下苯乳酸的回收率达88.58%。
2011年,THINH[52]对苯乳酸的分离和纯化方法进行了试验探索,研究中考察了6种不同大孔树脂的吸附量和解吸量,结果表明,301树脂的性能最优。苯乳酸发酵液经预处理后,以301树脂作为介质进行层析分离,当树脂吸附饱和后,用HCl进行洗脱。再对洗脱液中的苯乳酸进行萃取,最后旋转蒸发结晶,得到苯乳酸的回收率为87.31%,纯度为95.07%。程璐等[53]对絮凝法处理苯乳酸发酵液进行了研究,比较了不同絮凝剂对苯乳酸发酵液的处理效果。实验中探索了硫酸锌、氯化铝和尿素等不同絮凝剂的影响,其中硫酸铝的絮凝率最高,效果最好。以硫酸铝作絮凝剂,其最佳絮凝条件为:pH为3.0,温度为30℃,絮凝剂用量为8g/L,以100r/min的转速振荡35min。最终发酵液脱色率达到60.88%,其中苯乳酸回收率可达88.13%。
由以上众多分离手段来看,从发酵液中通过多种分离方式分离纯化苯乳酸是可行的,并且能够有效保留苯乳酸的抑菌效果,说明苯乳酸理化性质较为稳定。
2007年,GU等[54]用体积比为1∶6∶1.5∶1.5∶8的乙烷-乙酸乙酯-甲醇-乙酸-水体系作为溶剂,通过高速逆流层析色谱从丹参素中分离出了二羟苯基乳酸。2008年徐佳妮[55]使用离子层析色谱法层析分离了发酵液中的乳酸。使用三元交联共聚物作为固定相作为层析介质,研究了乳酸的色谱分离工艺,实验发现乳酸的分离度会随着固定相中羧酸基含量的增加先上升后下降,当羧酸基含量小于30%时,分离度大于1.5,实现了完全分离。在实验中采用纯水作为层析流动相,研究柱温对苯乳酸分离度相对偏差的影响,最后选择30℃作为最适温度。虽然在这些实验中分离的目标物为二羟苯基乳酸和乳酸,但分离目标物性质与苯乳酸有所类似,可作为分离手段的参考。
但是,总的来看,苯乳酸在发酵液和转化液中的浓度不高,一些菌株在发酵过程中还常常形成了其他有机酸副产物,这就增加了苯乳酸分离的难度。现有的分离方法,主要针对的是实验室研究和分析分离,规模较小,尚没有适于规模化应用的苯乳酸分离纯化方法。因此,研究和探索苯乳酸的高效转化菌株、途径和分离技术,具有深远意义。
4 结 语
苯乳酸作为一种天然存在的防腐剂,有着良好的抑菌性能,同时因为安全无毒性,有广阔的应用前景,在食品、医药及材料等行业中有相当高的研究价值。由于化学方法合成苯乳酸有诸多副产物并且对环境不友好,所以通过生物的方法,把微生物进行基因改造或者其他处理手段,在一定条件下利用底物生物转化合成苯乳酸,是一种非常有效的苯乳酸生产工艺。在微生物菌种的筛选及选育方面,由于特定基因工程菌的制备过程复杂及多次传代后可能出现的不稳定性,从自然界中筛选来源安全、无危害的优良野生菌株还有着很大的探索空间。在利用微生物催化底物合成苯乳酸的过程中,对菌体进行预处理的过程尽量简单快捷、安全无害,这有利于之后的下游分离纯化过程。现有的苯乳酸分离方法主要适于分析分离和实验室研究,对于制备分离和规模化工业应用分离,目前的方法还不成熟。所以,探索适用于大规模工业化应用的分离纯化方法有着很高的应用价值。
因此,筛选优质野生菌株和利用基因工程方法进行菌株改造,获得具有工业应用潜力的高产菌株,以及探索和研究适于从发酵液或转化液中高效分离和纯化苯乳酸的新方法,是当前苯乳酸微生物合成与分离方面的重要发展方向。
[1] DIEULEVEUX V,VAN DER PYL D,CHATAUD J,et al. Purification and characterization of anti-Listeria compounds produced by Geotrichum candidum[J]. Applied and Environmental Microbiology,1998,64(2):800-803.
[2] DIEULEVEUX V,LEMARINIER S,GUÉGUEN M. Antimicrobial spectrum and target site of D-3-phenyllactic acid[J]. International Journal of Food Microbiology,1998,40:177-183.
[3] LAVERMICOCCA P,VALERIO F,EVIDENTE A,et al. Purification and characterization of novel antifungal compounds from the sourdough Lactobacillus plantarum Strain 21B[J]. Applied and Environmental Microbiology,2000,66(9):4084-4090.
[4] FUJITA T,NGUYEN H D,ITO T,et al. Microbial monomers custom-synthesized to build true bio-derived aromatic polymers[J]. Applied Microbiology and Biotechnology,2013,97:8887-8894.
[5] 邓喜玲,陈学敏,周淑芳,等. β-苯基乳酸的合成[J]. 西北药学杂志,2001,16(1):36-37.
[6] BUBL E C,BUTTS J S. A method of synthesis of phenyllactic acid and substituted phenyllactic acids[J]. Journal of the American Chemical Society,1951,73:4972.
[7] 森田光,森浩幸. 苯基乳酸衍生物的生产方法.:95109050.X[P]. 2002.
[8] MORITA H,MORI H. Process of production of phenyllactic acid and derivative:U S,5684186[P]. 1997.
[9] VAN DRAANEN N A,HENGST S. The conversion of L-phenylalanine to (S)-2-hydroxy-3-phenylpropanoic acid:a simple, visual example of a stereospecific SN2 reaction[J]. Journal of Chemical Education,2010,87(6):623-624.
[10] MAGNUSSON J,SCHNÜRER J. Lactobacillus coryniformis subsp. coryniformis strain Si3 produces a broad-spectrum proteinaceous antifungal compound[J]. Applied and Environmental Microbiology,2001,67(1):1-5.
[11] MAGNUSSON J,STRÖM K,ROOS S,et al. Broad and complex antifungal activity among environmental isolates of lactic acid bacteria[J]. FEMS Microbiology Letters,2003,219:129-135.
[12] STRÖM K,SJÖGREN J,BROBERG A,et al. Lactobacillus plantarum MiLAB 393 produces the antifungal cyclic dipeptides cyclo(L-Phe-L-Pro) and cyclo(L-Phe-trans-4-OH-L-Pro) and 3-phenyllactic acid[J]. Applied and Environmental Microbiology,2002,68(9):4322-4327.
[13] LAVERMICOCCA P,VALERIO F,VISCONTI A. Antifungal activity of phenyllactic acid against molds isolated from bakery products[J]. Applied and Environmental Microbiology,2003,69(1):634-640.
[14] LIND H,SJÖGREN J,GOHIL S,et al. Antifungal compounds from cultures of dairy propionibacteria type strains[J]. FEMS Microbiology Letters,2007,271:310-315.
[15] SCHWENNINGER S M,LACROIX C,TRUTTMANN S, et al. Characterization of low-molecular-weight antiyeast metabolites produced by a food-protective Lactobacillus-propionibacterium coculture[J]. Journal of Food Protection,2008,71(12):2481-2487.
[16] WANG H K,YAN Y H,WANG J M,et al. Production and characterization of antifungal compounds produced by Lactobacillus plantarum IMAU10014[J]. PLoS One,2012,7(1): e29452.
[17] ZAVALETA O C,MALO A L,MENDOZA A H,et al. Antifungal activity of lactobacilli and its relationship with 3-phenyllactic acid production[J]. International Journal of Food Microbiology,2014,173:30-35.
[18] VALERIO F,LAVERMICOCCA P,PASCALE M,et al. Production of phenyllactic acid by lactic acid bacteria: an approach to the selection of strains contributing to food quality and preservation[J]. FEMS Microbiology Letters,2004,233:289-295.
[19] LI X F,JIANG B,PAN B L. Biotransformation of phenylpyruvic acid to phenyllactic acid by growing and resting cells of a Lactobacillus sp.[J]. Biotechnology Letters,2007,29:593-597.
[20] MU W M,YU S H,JIANG B,et al. Characterization of D-lactate dehydrogenase from Pediococcus acidilactici that converts phenylpyruvic acid into phenyllactic acid[J]. Biotechnology Letters,2012,34:907-911.
[21] MU W M,YU S H,ZHU L J,et al. Recent research on 3-phenyllactic acid, a broad-spectrum antimicrobial compound[J]. Applied Microbiology and Biotechnology,2012,95:1155-1163.
[22] MU W M,YU S H,ZHU L J,et al. Production of 3-phenyllactic acid and 4-hydroxyphenyllactic acid by Pediococcus acidilactici DSM 20284 fermentation[J]. European Food Research and Technology,2012,235:581-585.
[23] KAWAGUCHI H,Uematsu K,Ogino C,et al. Simultaneous saccharification and fermentation of kraft pulp by recombinant Escherichia coli for phenyllactic acid production[J]. Biochemical Engineering Journal,2014,88:188-194.
[24] KAWAGUCHI H,KAWAGUCHI H,UEMATSU K,et al. Phenyllactic acid production by simultaneous saccharification andfermentation of pretreated sorghum bagasse[J]. Bioresource Technology,2015,182:169-178.
[25] 李兴峰,江波,潘蓓蕾,等. 苯丙氨酸及苯丙酮酸对Lactobacillus sp. SK007合成苯乳酸的影响[J]. 过程工程学报,2007,7(6):1202-1206.
[26] 李兴峰,江波,潘蓓蕾,等. 产苯乳酸的乳酸菌分离筛选及菌种鉴定[J]. 食品与发酵工业,2007,33(2):1-4.
[27] 李兴峰. 乳杆菌生物合成苯乳酸的研究[D]. 无锡:江南大学,2008:26-109.
[28] LI X F,JIANG B,PAN B L,et al. Purification and partial characterization of Lactobacillus species SK007 lactate dehydrogenase (LDH) catalyzing phenylpyruvic acid (PPA)conversion into phenyllactic acid (PLA)[J]. Journal of Agricultural and Food Chemistry,2008,56:2392-2399.
[29] 刘凤丽,沐万孟,江波,等. 静息细胞转化合成苯乳酸的条件优化[J]. 食品工业科技,2008,29(8):67-70.
[30] 刘凤丽. 乳酸菌SK007生物合成苯乳酸的研究[D]. 无锡:江南大学,2008:1-40.
[31] 沐万孟,刘凤丽,张涛,等. 渗透化细胞转化生成苯乳酸的研究[J].食品与发酵工业,2009,35(3):19-22.
[32] MU W M,LIU F L,JIA J H,et al. 3-phenyllactic acid production by substrate feeding and pH-control in fed-batch fermentation of Lactobacillus sp. SK007[J]. Bioresource Technology,2009,100(21):5226-5229.
[33] FUJII T,SHIMIZU M,DOI Y,et al. Novel fungal phenylpyruvate reductase belongs to d-isomer-specific 2-hydroxyacid dehydrogenase family[J]. Biochimica et Biophysica Acta,2011,1814:1669-1676.
[34] RODRÍGUEZ N,SALGADO J M,CORTÉS S,et al. Antimicrobial activity of D-3-phenyllactic acid produced by fed-batch process against Salmonella enterica[J]. Food Control,2012,25(1):274-284.
[35] RODRÍGUEZ N,SALGADO J M,CORTÉS S,et al. Biotechnological production of phenyllactic acid and biosurfactants from trimming vine shoot hydrolyzates by microbial coculture fermentation[J]. Applied Biochemistry and Biotechnology,2013,169(7):2175-2188.
[36] ZHENG Z J,MA C Q,GAO C,et al. Efficient conversion of phenylpyruvic acid to phenyllactic acid by using whole cells of Bacillus coagulans SDM[J]. PLoS One,2011,6(4):e19030.
[37] ZHENG Z J,ZHAO M Y,ZANG Y,et al. Production of optically pure L-phenyllactic acid by using engineered Escherichia coli coexpressing L-lactate dehydrogenase and formate dehydrogenase[J]. Journal of Biotechnology,2015,207:47-51.
[38] 朱银龙,贠军贤,沈绍传,等. 透化性干酪乳杆菌细胞转化苯丙酮酸合成苯乳酸[J]. 高校化学工程学报,2015,29(2):495-500.
[39] JOHANNINGSMEIER S D,FRANCO W,PEREZ I,et al. Influence of sodium chloride, pH, and lactic acid bacteria on anaerobic lactic acid utilization during fermented cucumber spoilage[J]. Journal of Food Science,2012,77(7):M397-M404.
[40] XU G C,ZHANG L L,NI Y. Enzymatic preparation of D-phenyllactic acid at high space-time yield with a novel phenylpyruvate reductase identified from Lactobacillus sp. CGMCC 9967[J]. Journal of Biotechnology,2016,222:29-37.
[41] AMIN M R,ONODERA R. Synthesis of phenylalanine and production of other related compounds from phenylpyruvic acid and phenylacetic acid by ruminal bacteria, protozoa, and their mixture in vitro[J]. Journal of General and Applied Microbiology,1997,43(1):9-15.
[42] SJÖGREN J. Bioassay-guided isolation and characterisation of antifungal metabolites[D]. Uppsala:Swedish University of Agricultural Sciences,2005:10-50.
[43] SCHNÜRER J,MAGNUSSON J. Antifungal lactic acid bacteria as biopreservatives[J]. Trends in Food Science and Technology,2005,16(S1- 3):70-78.
[44] JOHANNINGSMEIER S D,MCFEETERS R F. Metabolism of lactic acid in fermented cucumbers by Lactobacillus buchneri and related species,potential spoilage organisms in reduced salt fermentations[J]. Food Microbiology,2013,35(2):129-135.
[45] 芦夏霏,刘毕琴,柳陈坚,等. 乳酸菌苯乳酸的合成及其代谢调控机制研究进展[J]. 食品与发酵工业,2014,40(11):177-181.
[46] POOLMAN B. Energy transduction in lactic acid bacteria[J]. FEMS Microbiology Reviews,1993,12(1/2/3):125-148.
[47] VERMEULEN N,GÁNZLE M G,VOGEL R F. Influence of peptide supply and cosubstrates on phenylalanine metabolism of Lactobacillus sanfranciscensis DSM20451Tand Lactobacillus plantarum TMW1.468[J]. Journal of Agricultural and Food Chemistry,2006,54(11):3832-3839.
[48] LI X F,NING Y W,LIU D,et al. Metabolic mechanism of phenyllactic acid naturally occurring in Chinese pickles[J]. Food Chemistry,2015,186:265-270.
[49] JOHANNINGSMEIER S D,MCFEETERS R F. Metabolic footprinting of Lactobacillus buchneri strain LA1147 during anaerobic spoilage of fermented cucumbers[J]. International Journal of Food Microbiology,2015,215:40-48.
[50] 李德茂,李从发,刘四新,等. 3-苯基乳酸的手性毛细管电泳拆分[J]. 色谱,2004,22(3):281-283.
[51] 陈超. 乳酸菌产苯乳酸及分离提取的研究[D]. 无锡:江南大学,2008:7-43.
[52] THINH N Q. Using macroporous resin in phenyllactic acid separation and purification[D]. 上海:华东理工大学,2011:20-27.
[53] 程璐,杨青,缪铭,等. 絮凝法处理苯乳酸发酵液的研究[J]. 食品工业科技,2011(3):256-261.
[54] GU M,WANG X L,SU Z G,et al. One-step separation and purification of 3,4-dihydroxyphenyllactic acid,salvianolic acid B and protocatechualdehyde from Salvia miltiorrhiza Bunge by high-speed counter-current chromatography[J]. Journal of Chromatography A,2007,1140(1/2):107-111.
[55] 徐佳妮. 离子排斥色谱法分离提纯发酵液中的乳酸[D]. 无锡:江南大学,2008:4-52.
An overview of recent advances in microbial synthesis and separation of phenyllactic acid
NI Zheng,GUAN Jintao,SHEN Shaochuan,YUN Junxian
(State Key Laboratory Breeding Base of Green Chemistry Synthesis Technology,College of Chemical Engineering,Zhejiang University of Technology,Hangzhou 310032,Zhejiang,China)
3-Phenyllactic acid(PLA)is a high-value organic acid and also an important metabolite of some lactic acid bacteria with effective activities against a wide range species of gram-positive and gram-negative bacteria and some fungi. This interesting compound has potential applications in chemical and pharmaceutical industry,biotechnology,and material and food areas as either a potential alternative to the chemical preservatives or a promise key monomer for the preparation of new polymer materials of poly(phenyllactic acid)s by polymerization,which have enhanced properties compared with those of wide-used poly(lactic acid)s. The present review summarizes the advances in the antibacterial activities,the available microbial strains,the biotransformation and biosynthesis,the metabolic pathways within these microorganisms,and the downstream separation and purification methods of PLA. The bacteria strains are crucial to the bioconversion or biosynthesis production of PLA. Although the recombinant engineering strains always have high conversion efficiencies,the construction of these strains is complex. The screening of new,safe strains with satisfactory bioconversion properties from natural resources is of great importance and an interesting approach for the enhancement of the bioconversion efficiency and the final concentration of PLA in the biotransformationbroth. Moreover,the separation of PLA from the fermentation or biotransformation feedstocks is mostly focused on the laboratory scale,which cannot match industrial requests. Further investigations on the novel isolation and purification techniques are still needed.
phenyllactic acid;biosynthesis;fermentation;separation;microorganism strain
Q 939.97
A
1000-6613(2016)11-3627-07
10.16085/j.issn.1000-6613.2016.11.036
2016-04-26;修改稿日期:2016-05-20。
浙江省自然科学基金(LZ14B060001)、国家自然科学基金(21576240)项目。
倪正(1992—),男,硕士研究生。联系人:贠军贤,教授,博士生导师,主要研究方向为生物分离与转化、微化工及药物载体内的传递现象。E-mail yunjx@zjut.edu.cn。
